小分子肽电泳
- 格式:doc
- 大小:83.50 KB
- 文档页数:6

一、实验目的1. 学习活性多肽的提取方法。
2. 了解活性多肽的生物学活性及其作用。
3. 掌握活性多肽的鉴定与分析技术。
二、实验原理活性多肽是一类具有生物活性的小分子肽,由2个或2个以上氨基酸通过肽键相互连接而成。
它们在生物体内起着重要的生理调节作用,如免疫调节、细胞信号传导、生长调节等。
本实验通过提取活性多肽,对其生物学活性进行分析,探讨其在医学、食品、生物工程等领域的应用前景。
三、实验材料与仪器1. 实验材料:新鲜淡水鱼、生物酶、硫酸铵、盐酸、丙酮等。
2. 实验仪器:离心机、紫外可见分光光度计、pH计、电热恒温水浴锅、分析天平等。
四、实验方法1. 活性多肽的提取(1)取新鲜淡水鱼,去内脏、去皮,切成小块。
(2)将鱼块放入酶解液中,在50℃、pH 7.0条件下酶解4小时。
(3)酶解完成后,将混合液离心(3000 r/min,20 min)取上清液。
(4)用硫酸铵对上清液进行盐析,沉淀后用丙酮洗涤,去除杂质。
(5)将沉淀物溶于适量水中,调节pH至7.0,离心(3000 r/min,20 min)取上清液,即为活性多肽溶液。
2. 活性多肽的鉴定与分析(1)紫外可见分光光度法测定活性多肽浓度。
(2)采用SDS-PAGE电泳法对活性多肽进行分离鉴定。
(3)通过体外实验检测活性多肽的生物学活性,如免疫调节、细胞信号传导、生长调节等。
五、实验结果与分析1. 活性多肽的提取通过酶解、盐析、丙酮洗涤等步骤,成功提取出活性多肽溶液。
2. 活性多肽的鉴定与分析(1)紫外可见分光光度法测定活性多肽浓度为0.5 mg/mL。
(2)SDS-PAGE电泳结果显示,活性多肽分子量分布在500-3000 Da之间。
(3)体外实验结果表明,活性多肽具有免疫调节、细胞信号传导、生长调节等生物学活性。
六、实验结论1. 成功提取出淡水鱼活性多肽,并通过紫外可见分光光度法、SDS-PAGE电泳法对其进行了鉴定。
2. 活性多肽具有免疫调节、细胞信号传导、生长调节等生物学活性,为活性多肽在医学、食品、生物工程等领域的应用提供了理论依据。

生物电泳作用
生物电泳(Bioelectrophoresis)是一种生物分子的移动方式,它
是利用带有正或负电荷的分子在电场中排列形成电泳图或离子迁移图。
生物电泳可以用来分离和检测微量的生物分子,如蛋白质、多肽、核酸、抗体、抗原和病毒等。
生物电泳是一种快速、有效的技术,广泛应用于分子生物学、细
胞生物学和免疫学的研究,特别是用于以下实验:
1. 分析生物大分子的组成:通过电泳来提取非结构性的生物分子,如
蛋白质、多肽、核酸、抗体等,可以提供有关分子的准确结构信息。
2. 分析生物大分子的活性:生物电泳技术可以用于分析不同类型
的生物大分子,如蛋白质、多肽、核酸、抗体等,以及它们之间的相
互作用。
3. 用于药物研究:生物电泳可以用来研究药物对抗原蛋白质或抗
体的影响,例如药物识别结构、亲和力、抑制作用等。
4. 检测体内微量物质:生物电泳技术可以用于检测体内微量物质,如小分子抗原、抗体、抗毒素介质、脂肪酸和胆固醇等物质的浓度和
周期性的变化。
5. 病毒检测:生物电泳技术可以用于检测病毒,有助于我们了解
病毒的感染情况以及传播趋势。
生物电泳技术的基本原理是,当在受电场的影响下,表面带有电
荷的生物分子沿着电流线方向移动时,分子在具有负电荷区域和正电
荷区域之间重新分散,导致原来分散的分子发生不同程度的移动,最
终形成电泳图或离子迁移图。

高效毛细管电泳法(简称CE)是一种应用电泳原理的分离技术,适用于分离和测定小分子有机化合物和生物大分子,如氨基酸,肽,核酸和蛋白质等,因其操作简便,分离速度快,分辨率高,样品耗费小等优点而广泛应用于分析技术领域.
其原理主要是利用电荷作用力和电流作用力共同作用于被分离物质,在快速流动的毛细管内进行分离,不同的物质根据其理化性质差异,在电场力的作用下,快速分离并达到最终的分析结果.
具体分离过程可分为三步:1.预处理:通过对样品进行一些必要的化学或物理处理,如蛋白的
脱盐,核酸的降解等,使之达到最佳测定条件.2.分离和检测:样品被注入高压,在毛细管内被电场引导向阳极(或阴极)并被快速分离,经过检测器检测,得出分析结果.3.定量分析:基于标准品,定量分析被分离物质的浓度.
在实际应用中,高效毛细管电泳法可通过改变分离毛细管的材料、加入胶体、调整电场强度等方式,进一步提高分离效率和分辨率,并能够与其他分析技术结合使用,如质谱法、光谱法等.
综上,高效毛细管电泳法是一种快速、高效、准确的分离技术,具有广泛的实际应用价值,在
企业管理和生物学等领域都有着广泛的应用前景.。

肽含量的检测方法
以下是 7 条关于肽含量检测方法的内容:
1. 高效液相色谱法呀,这可是个很厉害的家伙呢!就像警察能精准识别坏人一样,它能准确地检测出肽的含量。
比如说,在检测蛋白质水解产物中的肽含量时,它就能大显身手啦!
2. 质谱法呢,也是一把检测肽含量的好手哟!想象一下它就像一个超级侦探,任何肽的蛛丝马迹都逃不过它的法眼。
像在分析复杂生物样本中的肽时,它可牛了呢!
3. 比色法呀,简单又好用哦!这就好像一个直观的指示灯,清楚地告诉你肽的含量情况。
举个例子,在检测一些特定的肽时,它能快速给出答案,多方便啊!
4. 酶联免疫吸附法,这可是个很神奇的方法呢!它就如同一个灵敏的小雷达,精准地捕捉肽的信号。
比如检测血清中的某些特定肽,它可厉害啦!
5. 毛细管电泳法也不错哦!可以把它想象成一条专门输送肽信息的通道,快速而准确。
就好像在检测一些小分子肽的时候,它能游刃有余地完成任务呢!
6. 免疫印迹法呢,厉害得很呐!它宛如一个忠诚的卫士,坚定地识别肽的存在。
比如在确定某些蛋白质中是否存在特定的肽片段时,它可太重要啦!
7. 荧光检测法呀,闪闪发亮很神奇哟!就像是在黑暗中为肽含量点亮一盏明灯。
比如说在研究某些具有荧光特性的肽时,用它就再合适不过啦!
我觉得这些肽含量检测方法都各有其优势和适用场景,我们应该根据具体需求来选择合适的方法呀!。


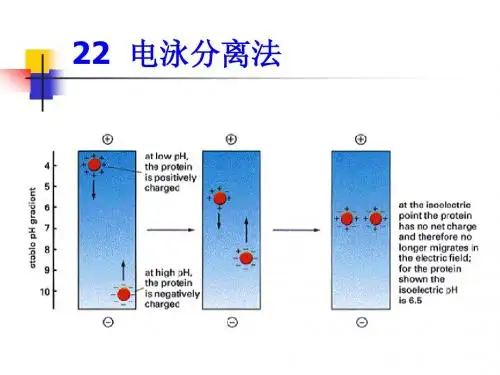
电泳的基本原理电泳是指带电颗粒在电场的作用下发生迁移的过程。
许多重要的生物分子,如氨基酸、多肽、蛋白质、核苷酸、核酸等都具有可电离基团,它们在某个特定的pH值下可以带正电或负电,在电场的作用下,这些带电分子会向着与其所带电荷极性相反的电极方向移动。
电泳技术就是利用在电场的作用下,由于待分离样品中各种分子带电性质以及分子本身大小、形状等性质的差异,使带电分子产生不同的迁移速度,从而对样品进行分离、鉴定或提纯的技术。
电泳过程必须在一种支持介质中进行。
Tiselius等在1937年进行的自由界面电泳没有固定支持介质,所以扩散和对流都比较强,影响分离效果。
于是出现了固定支持介质的电泳,样品在固定的介质中进行电泳过程,减少了扩散和对流等干扰作用。
最初的支持介质是滤纸和醋酸纤维素膜,目前这些介质在实验室已经应用得较少。
在很长一段时间里,小分子物质如氨基酸、多肽、糖等通常用滤纸或纤维素、硅胶薄层平板为介质的电泳进行分离、分析,但目前则一般使用更灵敏的技术如HPLC等来进行分析。
这些介质适合于分离小分子物质,操作简单、方便。
但对于复杂的生物大分子则分离效果较差。
凝胶作为支持介质的引入大大促进了电泳技术的发展,使电泳技术成为分析蛋白质、核酸等生物大分子的重要手段之一。
最初使用的凝胶是淀粉凝胶,但目前使用得最多的是琼脂糖凝胶和聚丙烯酰胺凝胶。
蛋白质电泳主要使用聚丙烯酰胺凝胶。
电泳装置主要包括两个部分:电源和电泳槽。
电源提供直流电,在电泳槽中产生电场,驱动带电分子的迁移。
电泳槽可以分为水平式和垂直式两类。
垂直板式电泳是较为常见的一种,常用于聚丙烯酰胺凝胶电泳中蛋白质的分离。
电泳槽中间是夹在一起的两块玻璃板,玻璃板两边由塑料条隔开,在玻璃平板中间制备电泳凝胶,凝胶的大小通常是12cm 14 cm,厚度为1mm~2 mm,近年来新研制的电泳槽,胶面更小、更薄,以节省试剂和缩短电泳时间。
制胶时在凝胶溶液中放一个塑料梳子,在胶聚合后移去,形成上样品的凹槽。

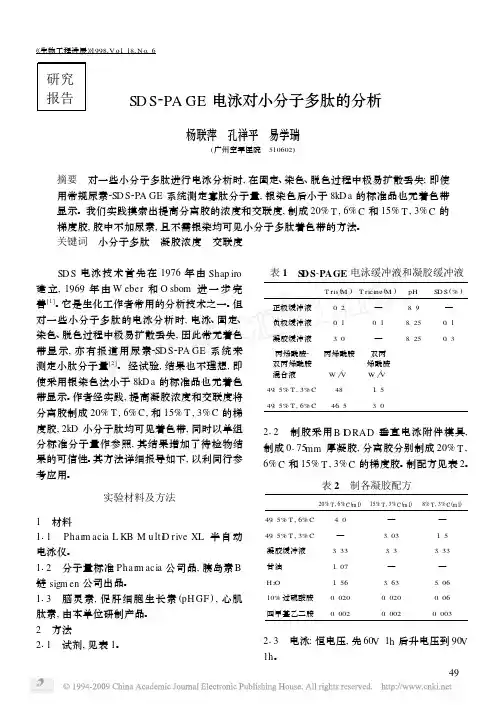
不同孵化时期鸡蛋蛋清小分子多肽的鉴定及功能分析朱方莉;孙浩浩;何钟瑜;陈璨;邱宁【摘要】通过聚丙烯酰胺凝胶电泳(SDS-PAGE)和基质辅助激光解吸电离飞行时间串联质谱(MALDI-TOF MS/MS)技术,比较不同孵化时期鸡胚蛋蛋清中产生的小分子多肽,研究肽段与鸡胚发育之间的联系结果显示在孵化第0、6、14、16 d分别得到837、879、872和842条肽段(共3430条).除丛生蛋白肽段外,大部分被鉴定到的肽段来源于蛋清中低丰度蛋白其中926条肽段来源于与鸡胚先天免疫有关的9种蛋白质,如防御素、白细胞介素6等;256条肽段来源于与鸡胚呼吸系统发育相关的3种蛋白质,cx9C基序蛋白、sprouty蛋白和碳酸酐酶.结果表明由蛋清蛋白质内源性酶降解形成的小分子多肽可能对鸡胚发育时形成的呼吸和免疫系统等发挥重要作用.【期刊名称】《食品工业科技》【年(卷),期】2019(040)010【总页数】6页(P62-67)【关键词】鸡胚发育;小分子多肽;基质辅助激光解吸电离飞行时间串联质谱;蛋清【作者】朱方莉;孙浩浩;何钟瑜;陈璨;邱宁【作者单位】国家蛋品加工技术研发分中心,湖北武汉430070;华中农业大学食品科技学院,湖北武汉430070;华中农业大学食品科技学院,湖北武汉430070;华中农业大学食品科技学院,湖北武汉430070;国家蛋品加工技术研发分中心,湖北武汉430070【正文语种】中文【中图分类】TS253鸡胚蛋是指受精蛋在适宜条件下进行孵化一段时间后,并未破壳且具有生命力、可食用的鸡蛋[1]。
受精蛋在孵化过程中只与外界进行气体及热量交换,鸡蛋本身提供胚胎生长所需的全部营养物质。
蛋清和蛋黄中的蛋白质以完整蛋白的形式或降解成肽段进入鸡胚,为其生长发育提供营养[2]。
目前研究表明,鸡胚蛋孵化早期粗蛋白含量逐渐增多,中期趋于平稳,在孵化第14 d时其含量达到最高值,后期蛋白质开始被鸡胚所吸收利用,故在此阶段呈降低趋势[3]。

【关键词】,聚丙烯酰胺凝胶电泳;蛋白质;分离摘要:目的建立一种灵敏易行分离分子量<10 000 Da低丰度蛋白质的电泳方法。
方法用Hitrap Blue层析柱去除血清中白蛋白,用U9对血清样品进行变性处理,采用改进后的方法(01%甲醇,05%三氯乙酸,01%考马斯亮蓝G250)进行染色。
结果经去除血清中的白蛋白、对样品进行变性处理及改进染色方法后,分辨率和灵敏度明显提高,可有效分离10 000 Da以下的小分子蛋白质。
结论改进后的电泳方法,不仅简便灵敏,而且还有利于蛋白质的洗脱回收。
关键词:聚丙烯酰胺凝胶电泳;蛋白质;分离Separation of micro molecular protein in human serum with improvedTricine-SDS-PAGE systemWEI Xiao,HE Min,NONG Bingjin,et al.Gangxi Center For Disease Control and Prevention(Nanning 530021,China)Abstract:Objective To separate less abundant proteins less than 10 000 Da with an effective Tricine-SDS-PAGE system.Methods The human serum albumin was removed by Hitrap Blue column,and serum was dealed with U9.Then gel was stained by the improved method(01% carbinol,05% TCA,01%Coomassie briliant blue G250).Results The discovery and detection of less abundant proteins less that 10 000 Da were improved obviously by removal of human serum albumin,serum treated with U9 and improvement of staining.Conclusion The improved Tricine-SDS-PAGE system is not only effective to resolve these less abundant proteins less than 10 000 Da,but also favourable to recover these proteins from gel.Key words:SDS-PAGE;protein;separation患者血清中某些小分子蛋白标志物可以用于疾病监测和快速诊断,但分离分子量<10000Da的小分子蛋白质面临很多问题。

尿素-SDS-PAGE测定小分子多肽相对分子质量方法的建立王丽荣,程福亮,陈雷,谷巍(山东宝来利来生物工程股份有限公司,山东泰安 271000)摘要:目的建立一种简易快速测定小分子多肽相对分子质量的SDS-PAGE电泳方法。
方法通过改进分离胶交联度为6%,丙烯酰胺总浓度为15%,并加入6%的尿素,对所测得的多肽相对分子质量进行线性回归分析。
结果得到的标准曲线线性相关系数r2达到0.9938,测得条带的相对分子质量分别为9.2129KD。
结论本研究建立的方法操作简单、耗时短,且小分子多肽成像清晰,是一种具有很高实用价值的测定方法。
关键字:SDS-PAGE;小分子多肽;尿素;相对分子质量;转移因子口服液Development of Urea-SDS-PAGE Method for the relative molecular mass of small molecular peptideWANG LI-Rong CHENG Fu-Liang CHEN Lei GU Wei(Shandong BaoLai-LeeLai bioengineering Co. Ltd, Tai an, Shandong, 271000)Abstract: Objective In order to establish a simple and rapid measuring method SDS-PAGE of the relative molecular mass of small molecular peptide. Method by improving the separation gel, the crosslinking degree was 6%, total acrylamide concentration was 15%, and 6% of urea was added, the relative molecular mass peptides was obtained by linear regression analysis. Results the linear correlation coefficient of the standard curve is 0.9938, and the relative molecular mass of the target protein bands was measured to be 9.2129 KD. Conclusions this study established the method of simple operation, short time consuming, and clear imaging, so, as a kind of measuring method of the relative molecular mass peptides of small molecular peptide, it has a high practical value.Key words: SDS-PAGE; small molecular peptide; relative molecular mass; urea 蛋白质的生化分析和基因表达产物的分离纯化中,难免会需要分离某种或某些小分子蛋白质成分。
对于小分子量的蛋白:可以考虑一下Tricine-SDS-PAGE,即用三羟甲基甘氨酸(tricine)代替甘氨酸作为终止离子。
Tricine-SDS-PAGE可以有效地分离1-100 kDa的蛋白样品:下面推荐两个Tricine-SDS-PAGE电泳的protocol,供参考。
推荐I首先是Nature Protocol上的一篇专门介绍Tricine-SDS-PAGE的文章,作者是该领域的专家——Schǎgger。
Nature Protocols 1, - 16 - 22 (2006)Published online: 12 May 2006 | Corrected online: 10 August 20 06 | doi:10.1038/nprot.2006.4Tricine-SDS-PAGE要与小蛋白打很多交道的同志们可以仔细研读一下这篇文章,总结整理出适合你的具体方案。
推荐II只是想看看Tricine胶的分离效果,偶尔一试,可以参考下面这个具体的protocol。
Tricine胶的配方阴极、阳极缓冲液的配方介绍:常规的Tris-SDS-PAGE电泳的只能分辨大分子物质的,而对了相对分子量小的,尤其是10kD以下的蛋白分辨率极低。
本人用Tris-SDS-PAGE做一个20KD以下的蛋白结果不是很理想,而且重现性差,因为在这种不连续的缓冲系统中,低分子量的常常堆积在浓缩胶中。
而Tricine-SDS-PAGE 可以很好的分离30KD以下的蛋白,而且本人还发现它同样对大蛋白也适用,我用它做过45KD,90KD,120KD左右的蛋白,而且每次上样3uL的Marker跑出来的10条带清清楚楚,几乎是平行的跑下来,常规的Tris-SDS-PAGE加了10uL的效果也没它好,有时越大下面越不清楚,也越窄。
如果,有战友做小蛋白的话不妨试试看,下面是实验配方和步骤。
一、缓冲液的配置:1.正极缓冲液anode buffer(2X):0.1M Tris(pH 8.9):12.114g加H20定容至500ml, 4℃保存。
【主题】凝胶电泳法大分子和小分子跑条带1. 引言在生物化学领域,凝胶电泳法是一种常用的手段,用于分离和测量不同大小分子的电泳运动速度,通过观察条带的位置和长度,可以对分子的大小和电荷进行初步的判断。
而针对大分子和小分子在凝胶电泳过程中跑条带的特点和方法也是我们研究的重点之一。
2. 凝胶电泳法概述凝胶电泳是一种分离和测量生物大分子(如DNA、RNA、蛋白质等)或小分子(如药物、代谢产物等)的常用技术手段。
根据分子的大小和电荷,选择不同类型的凝胶(如琼脂糖凝胶、聚丙烯酰胺凝胶等)和电场条件,将样品加载到凝胶槽中,通过电场的作用,分子在凝胶中进行电泳运动,最终形成不同位置的条带,根据条带的位置和长度进行分析和测量。
3. 大分子的凝胶电泳法(1)凝胶选择对于大分子的凝胶电泳,一般选择琼脂糖凝胶或琼脂糖琼脂糖凝胶,由于大分子的分子量较大、形状较长,选择较稀的凝胶可使其得到更好的展开和分离。
(2)电场条件在凝胶电泳中,要根据大分子的不同特点,如分子量、电荷等,确定合适的电场条件,一般采用较低的电场强度和较长的电泳时间,以保证大分子能够充分展开并在凝胶中进行分离。
4. 小分子的凝胶电泳法(1)凝胶选择对于小分子的凝胶电泳,一般选择聚丙烯酰胺凝胶,由于小分子的分子量较小、形状较短,选择较浓的凝胶可使其得到更好的聚集和分离。
(2)电场条件对于小分子的凝胶电泳,通常采用较高的电场强度和较短的电泳时间,以保证小分子能够在凝胶中快速地进行分离和测量。
5. 个人观点和理解在实践中,我们发现在进行大分子和小分子的凝胶电泳实验时,需要根据其特点和要求进行合适的凝胶选择和电场条件确定,尤其要注意大分子的展开和分离、小分子的快速迁移。
只有在实验操作过程中严格把控这些因素,才能准确、可靠地获得实验结果。
6. 总结凝胶电泳法是一种重要的生物化学分析技术,对于大分子和小分子的分离和测量具有广泛的应用。
在实际操作中,根据大分子和小分子的特点,选择适合的凝胶和电场条件,能够得到更好的实验结果。
Tricine SDS-PAGE实用方案Tricine-SDS-PAGE是用于分离分子量在1-10kD的肽类用的。
一、试剂配配制:1.Low Bis acrylamide(49.5% T, 3% C)Acylamide 48.0gBis 1.5gWater make up to 100ml2. High Bis acrylamide (49.5% T, 6% C)Acrylamide 46.5gBis 3.0gWater make up to100ml3. Gel Buffer (3M Tris/cl, PH8.45, 0.3% SDS)SDS 0.3gTris 36.4gWater make up to 100mlPH to 8.45 with HCL注: 3M Tris 配制时不容易溶解,因此配制时我配制了2M Tris,配方如下:Tris 36.4gSDS 0.3gWater make up to 150ml4. Anode (Lower) buffer 阳极缓冲液(0.2M Tris/cl, PH8.9)Tris 12.11gWater make up to 500mlPH to 8.9 with HCL5. Cathode (Upper) buffer 阴极缓冲液(0.1M Tris/cl, 0.1M Tricine, 0.1% SDS, PH 8.25) Tris6.06gTricine 8.96gSDS 0.5gWater make up to 500ml注:不用调PH值6. 4×Tricine SDS Sample buffer 4×上样缓冲液(Final concentration: 0.05M Tris/cl, 4% SDS, 12% glycerol, 200mM DTT, 0.01% Commasie G 250)8×Tris.cl/SDS PH 6.8 2mlGlycerol 4.8mlSDS 1.6gCommasie Blue G 250 4mgWater make up to 10ml注:8×Tris.cl/SDS PH 6.8配方Tris 6.05gSDS 0.4gWater make up to 100mlPH to 6.8 with HCL二、胶的配制1. 16.5% T 6% C separating gel 30ml49.5% T 6% C 10mlGel buffer 15mlGlycerol 3.2mlWater 1.8ml2. 10% T 3% C spacer gel 30ml49.5% T 3% C 6.1mlGel buffer 15mlWater 8.9ml3. 4% T 3% C stacking gel 12.5ml49.5% T 3% C 1mlGel buffer 4.65mlWater 6.85ml注: 用Bio-Rad系统, 0.75mm的胶,separating gel 配3ml, 加2.5ml; Spacer gel 配1ml,加0.7ml; Stacking gel 配1.25ml. 灌胶前临时加10%AP(过硫酸铵)和TEMED.胶配制的通用配方:三、电泳参数及染色脱色1. 用Bio-Rad mini 电泳装置进行电泳. 30V 电泳1hr, 100V至电泳结束2. 固定, 染色及脱色: 小分子量肽类在SDS-PAGE胶中容易扩散,因此电泳结束后, 有时需要固定20min (固定液: 0.5% 戊二醛, 30% 乙醇), 再进行染色20-30min (染色液: 50% 甲醇, 10% 乙醇, 0.2% G-250), 在脱色液(45% 甲醇, 10% 冰醋酸)脱色20-30min; 脱色完毕,把胶放在水中或10%甘油中.四、电泳示例照片小分子该选择用tricine-SDS-PAGE.protocol上写着the common role of glycerol in SDS gels is to increase the density ofsolutions and tofacilitate gel casting; it has no obious effect on protein separationI tried 25% Tricine gel for 3KD peptide, looks good. Good Luck!哦,我自己经常做2x多的分子,用的是15%的gel,效果很好的。
对于小分子量的蛋白:可以考虑一下Tricine-SDS-PAGE,即用三羟甲基甘氨酸(tricine)代替甘氨酸作为终止离子。
Tricine-SDS-PAGE可以有效地分离1-100 kDa的蛋白样品:下面推荐两个Tricine-SDS-PAGE电泳的protocol,供参考。
推荐I首先是Nature Protocol上的一篇专门介绍Tricine-SDS-PAGE的文章,作者是该领域的专家——Schǎgger。
Nature Protocols 1, - 16 - 22 (2006)Published online: 12 May 2006 | Corrected online: 10 August 20 06 | doi:10.1038/nprot.2006.4Tricine-SDS-PAGE要与小蛋白打很多交道的同志们可以仔细研读一下这篇文章,总结整理出适合你的具体方案。
推荐II只是想看看Tricine胶的分离效果,偶尔一试,可以参考下面这个具体的protocol。
Tricine胶的配方阴极、阳极缓冲液的配方介绍:常规的Tris-SDS-PAGE电泳的只能分辨大分子物质的,而对了相对分子量小的,尤其是10kD以下的蛋白分辨率极低。
本人用Tris-SDS-PAGE做一个20KD以下的蛋白结果不是很理想,而且重现性差,因为在这种不连续的缓冲系统中,低分子量的常常堆积在浓缩胶中。
而Tricine-SDS-PAGE 可以很好的分离30KD以下的蛋白,而且本人还发现它同样对大蛋白也适用,我用它做过45KD,90KD,120KD左右的蛋白,而且每次上样3uL的Marker跑出来的10条带清清楚楚,几乎是平行的跑下来,常规的Tris-SDS-PAGE加了10uL的效果也没它好,有时越大下面越不清楚,也越窄。
如果,有战友做小蛋白的话不妨试试看,下面是实验配方和步骤。
一、缓冲液的配置:1.正极缓冲液anode buffer(2X):0.1M Tris(pH 8.9):12.114g加H20定容至500ml, 4℃保存。
SDS-聚丙烯酰胺凝胶电泳分析小分子多肽[日期:2007-02-13] 来源:[字体:大中小]SDS-聚丙烯酰胺凝胶电泳分析小分子多肽第四军医大学学报2000年第21卷第6期石继红赵永同王俊楼韩苇颜真张英起摘要:目的研究SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)显示小分子多肽的方法.方法观察不同方法处理的样品,上样量对电泳结果的影响及对分子量标准(M r2512~16949)进行直线回归分析.结果样品的不同处理条件未见有差异;在该实验系统条件下上样样品为每孔5~10μg较佳;分子量标准直线回归系数r=-0.962.结论样品处理方便;上样量少;在160 g·L-1 T,60 g·kg-1 C较低的丙烯酰胺含6 mol·L-1脲的分离胶中能够显示M r为2512的多肽,是一种显示小分子多肽的较好方法.关键词:SDS-聚丙烯酰胺凝胶电泳;肽;蛋白质0引言20世纪60年代Shapiro建立了SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)方法之后,Weber,Glossmann和Douglas等人进行了多次改进,已显示出了在分离、鉴定和纯化蛋白质方面的优越性,但对于M r小于10000的蛋白质来说是无能为力的[1]. 20世纪80年代初Schägger等[2]应用脲分离蛋白质复合体亚单位的11种蛋白质,但分离效果不甚理想且重复性较差.之后他们又进行了系统地研究和摸索,能够分离较大M r范围内的蛋白质.随着生物技术的飞速发展和基因工程药物的大量涌现,具有高生物活性的小分子多肽的分离、纯化和鉴定已显得尤为突出.我们在进行基因工程药物的开发研制中,对SDS-PAGE方法进行了多次改进,在较低的丙烯酰胺浓度下取得了理想的结果.此法所需仪器简单,操作方便,重现性好,时间短,只需微克量的多肽便可显带且能迅速估计出其M r,值得进一步推广和利用.1材料和方法1.1试剂和仪器SDS、脲、甘油、过硫酸铵均为分析纯,西安化学试剂厂出品;丙烯酰胺(分析纯)为汕头市光华化学厂产品;N,N′-甲叉双丙烯酰胺(分析纯)为浙江黄岩人民化工厂生产;tris(分析纯)为成都试剂厂出品;TEMED为BIO-RAD产品;Tricine(Ultra pure Grade)为Solon Ind产品. BIO-RAD小型垂直式电泳附件模具;FD-201稳压稳流电泳仪(上海医用分析仪器厂).1.2肽分子质量标准肽分子质量标准的M r范围2512~16949为Pharmacia lKB 公司产品. 胸腺肽α1是美国加州圣马刁市赛生药品公司产品(商品名“ZADAXIN”),是一乙酰化的多肽,M r为3108,pI 3.8. 经Sephadex G-25柱去除所含的甘露醇,然后冷冻干燥,用样品缓冲液配成所需样品.1.3方法1.3.1电泳贮存液的配制阳极缓冲液中Tris为0.2 mol·L-1用HCl调pH值至8.9.阴极缓冲液为0.1 mol·L-1的Tris,0.1 mol·L-1的Tricine和0.01 g·L-1的SDS溶液,其pH 值约为8.25. 胶缓冲液为3.0 mol·L-1的Tris和0.03 g·L-1的SDS,用HCl调pH值至8.4.称取48 g丙烯酰胺和1.5 g N,N′-甲叉双丙烯酰胺溶于100 mL纯水中,溶解混匀后经4号滤纸过滤即得到495 g·L-1 T,30 g·kg-1 C的贮存液;称取46.5 g丙烯酰胺和3.0 g N,N′-甲叉双丙烯酰胺溶于100 mL纯水中,同样得到495 g·L-1 T,60 g·kg-1 C的贮存液(T代表丙烯酰胺的总浓度,C代表交联度).1.3.2胶的制备与一般SDS-PAGE电泳相似[3],按Tab1给出的数据分别配制分离胶、间隙胶和浓缩胶,依次灌胶.表1分离胶、间隙胶和浓缩胶的组成tab 1Composition of separating, spacer and stacking gelsa:495 g·L-1T,30 g·kg-1C;B:495 g·L-1 T,60 g·kg-1C. T: the total percentage concentration of both monomers;C: the percentage concentration of the corosslinkage.1.3.3样品缓冲液的制备及样品的处理蛋白质样品与上样缓冲液(4 g·L-1 SDS,120 g·L-1甘油,50 mol·L-1 tris,20 mL·L-1巯基乙醇含0.1 g·L-1溴酚蓝,pH6.8)混合均匀,分别按40 ℃孵育30 min;60 ℃孵育10 min和煮沸2 min处理.1.3.4电泳条件内槽装阴极缓冲液、外槽用阳极缓冲液恒压电泳,先40 v约1 h,当样品进入分离胶时,电压升至60 V约2 h.1.3.5染色、脱色和胶的保存电泳完毕时胶置于染色液[2.5 g·L-1考马斯亮蓝R-250的乙醇(V)∶冰乙酸(V)∶水(V)为9∶2∶9]中振荡染色1.5~2 h,转至脱色液(400 mL·L-1的乙醇,40 mL·L-1的冰乙酸)中扩散脱色,直到背景清晰.胶的保存与一般SDS-PAGE类同[3].2结果2.1不同处理的样品对SDS-PAGE的影响多肽样品经上述3种不同处理,经SDS-PAGE后,分子质量蛋白标准(M r2512~16949)没有电泳差异,均能较清晰地显示6条带(Fig 1).分子质量蛋白标准分别在每孔上不同量的蛋白质(Fig 2),当上样量为1μg 时,分子质量蛋白标准仅能显示其中的5条带.当上样量达到5~10 μg时,M r 2512的肽带明显可见.2.2分子量标准蛋白回归方程及对低分子量标准品的分析应用160 g·L-1T,60 g·kg-1C含6 mol·L-1脲的丙烯酰胺凝胶能够较好地显示标准蛋白的6条带(Fig1). 对其M r对数(lgM r)和在分离胶中迁移的距离(μ)进行直线回归分析,回归方程为=-0.0378x + 4.5512,相关系数r = -0.962,从曲线查及胸腺肽α1单体的M r为3135(其理论M r为3108).图1样品的不同处理fig 1Treated samples with different conditionlane 1, 4: 40℃30 min; Lane 2, 5: 60℃10 min; Lane3,6:100℃2 min图2样品量的不同对电泳的影响fig 2Quantity's effect on electrophrosisfrom lane 1 to 6 the protein quantity is 4, 8, 12, 16, 20, 24 μg respectively.3讨论SDS-PAGE的有效分离范围取决于聚丙烯酰胺的浓度和交联度,其孔径随着双丙烯酰胺:丙烯酰胺比率的增加而减小,比率接近于1∶20时,孔径达到最小值[3]. m r低于10 000的小分子肽,即使用较高浓度的聚丙烯酰胺凝胶的SDS-PAGE也不能完全分离[2].杨联萍等[4]指出用含脲的SDS-PAGE,即使用银染方法M r小于8000的蛋白标准品也无着色.而我们用含6 mol·L-1脲160 g·L-1 t,60 g·kg-1 C的SDS-PAGE方法,不需银染而直接用2.5 g·L-1的考马斯亮蓝R-250染色1.5~2 h,即可把标准品中的6条带显示得非常清楚,且简单方便,上样量小,重复性好.实验范围内(蛋白标准M r为2512~16 949)肽M r的对数与迁移率呈良好的线性关系,相关系数r= -0.962. 我们以低M r胸腺素α1作参照,其结果3153与实际M r3108标准相符,从而证明该方法的准确性和待测样品结果的可信性,该方法是一种显示小分子多肽和估测其M r的较好方法.在含SDS缓冲液的样品中,小分子多肽的浓缩是较困难的,这是因为小分子多肽与SDS形成的复合体具有和SDS本身类似的电荷和大小,因此浓缩对于小分子多肽的SDS-PAGE来说就成了一个突出的问题[5].上述方法中Tricine以阳离子形式存在可以作为拖尾离子,使小分子多肽能够在浓缩胶中形成尽可能窄的带.此外,快速的固定、染色和脱色对于小分子多肽电泳是必要的.这主要是由于小分子多肽对染料的结合力较弱,易扩散冲洗掉而着色较差.随着生物活性多肽物质的发现和多肽类药物的研制,小分子多肽电泳变得越来越重要,已成为生物活性物质纯化分析过程中不可缺少、经常使用的快速鉴定方法.作者简介:石继红(1963-),男(汉族),河北省枣强县人.讲师. Tel.(029)3374774石继红(第四军医大学生物技术中心,陕西西安710033)赵永同(第四军医大学生物技术中心,陕西西安710033)王俊楼(第四军医大学生物技术中心,陕西西安710033)韩苇(第四军医大学生物技术中心,陕西西安710033)颜真(第四军医大学生物技术中心,陕西西安710033)张英起(第四军医大学生物技术中心,陕西西安710033)参考文献:[1]Cleveland DW, Fischer SG, Kirschner MW et al. Peptide mapping by limited proteolysis in sodiun dodecyl sulfate and analysis by gel electrophoresis[J]. J Bio Chem,1977;252(3):1102-1106.[2]Schgger H, Jagow G. Tricine-sodium dodecyl sulfate-polyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 KDa[J]. analBiochem, 1987; 166(2): 368-397.[3]金冬雁,黎孟枫译. 分子克隆实验指南[M],第2版.北京:科学出版社,1992:880-887.[4]杨联萍,孔祥平,易学瑞. SDS-PAGE电泳对小分子多肽的分析[J].生物工程进展,1998;18(6):49-51.[5]Fish WW, Reynolds JA, Tanford C. Gel chromatography of proteins indenaturing solvents[J]. J Bio Chem, 1977; 245(19): 5166-5168。