实验五、GUS染色检测基因瞬时表达
- 格式:ppt
- 大小:422.00 KB
- 文档页数:6

gus染色原理Gus染色原理Gus染色原理是一种常用的分子生物学实验技术,用于检测和观察基因的表达情况。
它基于酶反应原理,通过染色剂Gus的添加和酶反应的发生,使得目标基因在组织或细胞中显示出特定颜色,从而可以直观地观察基因的表达水平和组织分布情况。
Gus染色原理的基本步骤如下:1. 样品处理:首先需要获取待检测的组织样品或细胞,可以是植物组织、动物组织或细菌等。
样品需要经过一系列处理步骤,如固定、脱水、透明化等,以保证染色的准确性和可靠性。
2. Gus染色液制备:Gus染色液通常由染色底物、缓冲液和酶反应辅助物质组成。
常用的染色底物有X-β-Glucuronide,它是一种无色底物,在酶反应中会被酶催化分解为产生特定颜色的产物。
缓冲液的选择要根据实验的需要,可以是酸性缓冲液或碱性缓冲液。
3. Gus染色反应:将处理好的样品与Gus染色液进行充分混合,使得染色底物与目标基因的酶发生反应。
在反应过程中,底物被酶催化分解,产生特定颜色的产物。
染色的时间和温度需要根据实验要求进行控制,以保证染色效果的准确性和可靠性。
4. 观察结果:染色反应完成后,观察样品的颜色变化。
正常情况下,目标基因的表达区域会显示出特定颜色,可以是蓝色、紫色等,而未表达的区域则没有颜色变化。
观察结果可以使用显微镜或肉眼进行观察和记录。
Gus染色原理的优点在于其操作简单、成本低廉,可以在大量样品中快速进行检测。
同时,由于染色结果直观明了,可以用肉眼观察和记录,无需复杂的仪器设备。
因此,Gus染色在基因表达研究、遗传工程和植物学等领域得到广泛应用。
然而,Gus染色原理也存在一些限制和注意事项。
首先,染色结果的可视化程度受样品的固定和处理等步骤的影响,不同的样品处理方法可能导致染色结果的差异。
其次,染色结果只能显示目标基因的表达水平和组织分布情况,无法提供更详细的信息,如基因的调控机制和表达动力学等。
此外,由于染色底物的选择和反应条件的不同,染色结果可能存在一定的差异性,需要在实验设计和数据分析中进行合理控制。

GUS报告基因范文GUS报告基因是一种用于筛选转基因植物的报告基因。
它在植物细胞内表达的酵素β-葡萄糖苷酶(β-Glucuronidase,GUS),能够将葡萄糖醛酸(X-Gluc)转化为蓝色产物。
通过观察和分析植物组织的GUS活性,可以判断是否发生了基因转化。
下面将详细介绍GUS报告基因的特点、应用以及实验方法。
1.GUS报告基因的特点(1)GUS基因来自于大肠杆菌,它很少在真核生物中表达,因此不会对植物正常生长发育产生影响。
(2)GUS基因编码的酵素活性能够方便、快速地用染色剂标记出来,实验结果直观可见。
(3)转GUS基因的步骤相对简单,转化率较高,且不需要使用昂贵的设备。
2.GUS报告基因的应用(1)植物转基因筛选:通过观察和分析转基因植物的GUS活性,可以确定哪些植株成功地转化了外源基因。
(2)基因调控研究:GUS报告基因可以用来研究目的基因的表达调控机制,例如在转基因植物中瞬时表达GUS基因,观察其在各种组织和发育阶段的表达情况,可以推测目的基因的启动子活性。
(3)信号传导途径研究:通过构建GUS基因的操纵,可以研究植物信号传导途径中特定基因的表达情况,进而了解信号传导途径的效率和调节机制。
3.实验方法以下是GUS报告基因实验的一般步骤:(1)构建GUS载体:将GUS基因与适合的植物表达载体进行连接,形成GUS转化载体。
(2)遗传转化:将GUS转化载体导入要进行转基因植物研究的植物细胞中,使用适当的生物技术方法(如冲击法、农杆菌介导法)实现遗传转化。
(3)植物筛选:选择经过转化的植株进行分析,通常可以通过PCR、Southern blot、Western blot等技术检测GUS基因的存在。
(4)组织切片染色:收集不同部位的植物组织,例如叶片、根、花等,制作切片。
使用X-Gluc作为底物加入切片中,观察蓝色染色产物的形成。
(5)定量分析:通过测定GUS活性,使用亲合素、含有底物的液体培养基等方法,可以 quantitatively 地测定GUS酶活性。

GUS基因瞬时表达检测小麦1Ay基因启动子功能马建华;王玉国;张瑾华;胡变芳;杨艳君【摘要】本试验以pAyGUS为转化质粒,该质粒为小麦高分子量麦谷蛋白亚基基因1Ay的启动子和β—葡糖苷酸酶(GUS)基因的重组质粒,利用基因枪法将该质粒导入小麦胚乳及胚中,检测其表达活性.通过X-gluc染色检测表明,GUS基因在该启动子的驱动下能在小麦种子中特异表达,可见小麦1Ay基因的启动子具有在小麦胚乳中特异表达的活性,这为小麦品种改良及转基因研究奠定了基础.【期刊名称】《山西农业大学学报(自然科学版)》【年(卷),期】2014(034)006【总页数】4页(P499-502)【关键词】小麦;1Ay基因;启动子;GUS基因;瞬时表达【作者】马建华;王玉国;张瑾华;胡变芳;杨艳君【作者单位】晋中学院生物科学与技术学院,山西晋中030600;山西农业大学农学院,山西太谷030801;晋中学院生物科学与技术学院,山西晋中030600;晋中学院生物科学与技术学院,山西晋中030600;晋中学院生物科学与技术学院,山西晋中030600【正文语种】中文【中图分类】S512.103.53;Q78小麦在世界上种植面积最大,是我国人民的主要粮食作物之一,其种植面积在我国位居第二[1]。
当前,优质小麦已经成为小麦育种研究者的主要目标之一。
研究显示,小麦加工品质受其高分子量麦谷蛋白亚基(HMW-GS)的数量、类型、结构和含量的影响[2]。
近年来许多改善小麦品质的高分子量麦谷蛋白亚基基因被克隆和转化,白建荣应用分子克隆技术获得了乌拉尔图小麦表达型和不表达型1Ay麦谷蛋白亚基基因[3]。
研究认为,通过转基因将表达型1Ay基因导入到栽培小麦品种中,将可能提高小麦的烘烤品质[4]。
而要实现这一目标,就必须获得高效且在种子中专一表达的启动子,驱动1Ay麦谷蛋白亚基基因在小麦种子中高效专一表达。
本试验以含标记基因GUS和胚乳特异性启动子1Aypromoter的质粒pAyGUS(6009bp)为转化质粒,对小麦胚乳及胚进行转化,以验证1Ay麦谷蛋白亚基基因的启动子的胚乳特异性启动功能,从而为小麦转基因及品质改良研究奠定基础。


gus报告基因GUS报告基因。
GUS报告基因是一种用于植物基因表达研究的重要工具。
它是由β-葡萄糖苷酶(β-glucuronidase)基因构建而成,可以被广泛地应用于植物遗传转化和表达分析中。
GUS报告基因的研究对于理解植物基因表达及其调控机制具有重要意义。
首先,GUS报告基因可以用于植物遗传转化的研究。
通过将GUS报告基因导入植物细胞,可以观察到该基因在植物体内的表达情况。
这对于研究外源基因在植物中的表达特点以及转基因植物的遗传稳定性具有重要意义。
通过对GUS报告基因的研究,可以更好地了解植物转基因技术的应用前景及其潜在风险。
其次,GUS报告基因也可以用于植物基因表达分析。
通过将GUS报告基因与目标基因进行融合,可以观察到目标基因在植物体内的表达情况。
这对于研究目标基因在不同组织和发育阶段的表达模式,以及其受到外界环境因素影响的调控机制具有重要意义。
通过对GUS报告基因的研究,可以更好地了解植物基因表达调控的分子机制及其在植物生长发育过程中的作用。
此外,GUS报告基因还可以用于植物转基因技术的研究与应用。
通过对GUS报告基因的表达情况进行定量和定位分析,可以更好地评估转基因植物的表达效率和稳定性。
这对于改良转基因植物的遗传背景和表达性能具有重要意义。
通过对GUS报告基因的研究,可以更好地指导植物转基因技术的开发和应用,为农业生产和生物技术研究提供有力支持。
综上所述,GUS报告基因在植物基因表达研究中具有重要的应用价值。
通过对GUS报告基因的研究,可以更好地理解植物基因表达及其调控机制,促进植物遗传转化和基因功能研究的进展,为植物生物技术的发展和应用提供重要支持。
因此,对GUS报告基因的深入研究具有重要的理论和实际意义,值得进一步深入探讨和应用。

一种基于农杆菌介导的拟南芥瞬时转化技术优化郭勇;王玉成;王智博【摘要】利用根癌农杆菌(Agrobacterium tumefaciens)介导的拟南芥瞬时转化体系影响因素来确定最佳转化条件.以生长15日龄的拟南芥幼苗为试验材料,以转化pCAMBIA1301空载体的根癌农杆菌EHA105为目的菌株进行瞬时转化.研究了吐温20、菌液OD值、乙酰丁香酮(AS)及转化时间等对拟南芥瞬时转化效率的影响.结果表明:以体积分数为0.05%的吐温、菌液OD600值为1.0和120 μmol/L 的AS侵染拟南芥2.5 h后,再共培养72 h,能够得到高瞬时转化效果.【期刊名称】《东北林业大学学报》【年(卷),期】2016(044)006【总页数】5页(P41-44,83)【关键词】拟南芥;GUS基因;瞬时表达;实时定量;农杆菌介导转化【作者】郭勇;王玉成;王智博【作者单位】林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040;林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040;林木遗传育种国家重点实验室(东北林业大学),哈尔滨,150040【正文语种】中文【中图分类】Q786拟南芥是重要的模式植物,很多植物基因的功能都是通过基因转入拟南芥中进行研究,而转基因又分稳定表达与瞬时表达两种方式[1],稳定表达需要的培养、鉴定时间较长,而与之相比,瞬时表达具有简单、快捷、周期短、准确等优点[2],并且表达效率较稳定,转化率高。
当需要在短时间内进行基因功能的分析或者蛋白间的互作以及蛋白与基因间互作等的研究时,瞬时表达的方法可作为一种高效的手段[3]。
基于瞬时转化技术使基因在宿主体内瞬时表达,是一种快速的研究基因表达、蛋白质亚细胞定位及基因间互作的一种重要手段,与传统的转基因相比,瞬时表达不需要整合到染色体上,而且瞬时表达还不受基因的位置效应和基因沉默的影响,也不会产生可遗传的子代,生物安全性高[4]。

gus染色技术在遗传学实验教学中的应用Gus染色技术是一种常用的植物细胞组织活性染色技术,它可以用来
观察植物细胞中酵素表达的变化情况。
在遗传学实验教学中,Gus染色技
术被广泛应用,它可以帮助学生更好地了解植物基因表达的过程,同时也
可以培养他们的实验操作能力和科学思维能力。
以下是Gus染色技术在遗传学实验教学中的几个应用场景:
1.观察基因表达的时空特点。
Gus染色是一种靶向不同时间和组织区域检测基因表达的方法,可以
在植物发育早期就对各种组织部位的基因表达进行检测。
学生可以通过观
察Gus染色结果来探索基因表达的时空特点,并分析影响基因表达的因素。
2.研究转基因植物的表达情况。
Gus染色技术是一种便捷而又经济的评价转基因植物表达情况的方法。
学生可以借助Gus染色法观察转基因植物中Gus基因的表达情况,从而研
究转基因植物在不同条件下的表达情况和转基因效率。
3.分析基因调控。
Gus染色技术还可以用于研究基因调控,尤其是在探讨转录因子对基
因表达的影响时。
学生可以将GUS基因与某些特定基因的启动子结合,以
便对基因表达的调节进行详细的观察和研究。
4.探究物种间的基因表达差异。
Gus染色技术可以用于探究不同物种之间基因表达的差异。
学生可以
通过比较不同物种的Gus染色结果,了解它们的遗传差异和进化关系,并
深入探究这些差异引起的生物学功能变化。
总之,Gus染色技术在遗传学实验教学中具有重要的应用和意义,它可以帮助学生深入了解植物基因表达的机制,掌握实验操作技能,并启发他们的科学思维和能力。
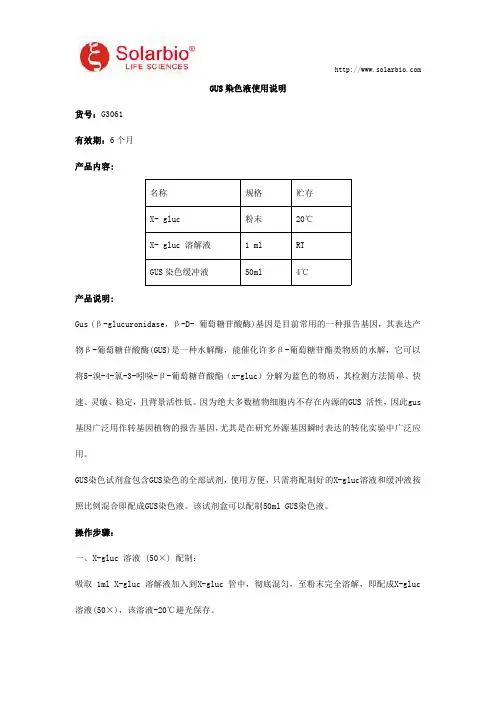
GUS染色液使用说明货号:G3061有效期:6个月产品内容:名称规格贮存X-gluc粉末20℃X-gluc溶解液1ml RTGUS染色缓冲液50ml4℃产品说明:Gus(β-glucuronidase,β-D-葡萄糖苷酸酶)基因是目前常用的一种报告基因,其表达产物β-葡萄糖苷酸酶(GUS)是一种水解酶,能催化许多β-葡萄糖苷酯类物质的水解,它可以将5-溴-4-氯-3-吲哚-β-葡萄糖苷酸酯(x-gluc)分解为蓝色的物质,其检测方法简单、快速、灵敏、稳定,且背景活性低。
因为绝大多数植物细胞内不存在内源的GUS活性,因此gus 基因广泛用作转基因植物的报告基因,尤其是在研究外源基因瞬时表达的转化实验中广泛应用。
GUS染色试剂盒包含GUS染色的全部试剂,使用方便,只需将配制好的X-gluc溶液和缓冲液按照比例混合即配成GUS染色液。
该试剂盒可以配制50ml GUS染色液。
操作步骤:一、X-gluc溶液(50×)配制:吸取1ml X-gluc溶解液加入到X-gluc管中,彻底混匀,至粉末完全溶解,即配成X-gluc 溶液(50×),该溶液-20℃避光保存。
注:正常的X-gluc溶液颜色为无色,如果溶液变为红色或棕色,表明溶液失效。
二、GUS染色工作液配制:GUS染色工作液配制量1ml5ml10mlX-gluc溶液(50×)20μl100μl200μlGUS染色缓冲液1ml5ml10ml注:GUS染色工作液最好现用现配,短期贮存可以-20℃保存2-3天。
三、GUS染色步骤:1.预处理:将叶片、花瓣、根茎等组织剪成小片,放于1.5ml离心管中,加入预冷的90%丙酮完全覆盖材料,常温处理20-30分钟。
此步骤可以预固定组织并且可以去除部分叶绿素。
注:用于染色的植物材料的制备方法要因涉及的特定组织和器官的不同而异。
例如,拟南芥的根、花和叶片以及烟草幼苗的根就可以不作任何预处理而直接染色。


农杆菌介导的马铃薯块茎GUS基因瞬时表达研究作者:舒锐等来源:《天津农业科学》2013年第11期摘要:采用根癌农杆菌介导的瞬时表达方法,以马铃薯块茎为主要的研究材料,分别采用浸染法和注射法将外源基因导入马铃薯块茎细胞中,然后进行GUS组织化学染色。
试验结果表明,导入马铃薯块茎细胞里的外源基因获得了表达;浸染法的表达区域更加均匀,优于注射法。
关键词:马铃薯;块茎;根癌农杆菌;瞬时表达;GUS中图分类号:S532 文献标识码:A DOI编码:10.3969/j.issn.1006-6500.2013.11.001马铃薯(Solanum tuberosum L.)俗称“土豆”,是茄科茄属多年生草本块茎植物,原产于安第斯山区和智利沿海山地,是仅次于水稻、玉米、小麦的世界第四大重要粮食作物,具有分布广泛、高产稳定、适应性强、营养丰富等特点,是一种兼具粮食、蔬菜、饲料以及工业原料等具有多种用途的经济作物[1]。
目前,农杆菌介导的瞬时表达方法已经在烟草、拟南芥、莴苣、番茄、草莓、梨等多种植物中得到应用。
利用此方法在叶片和果实中进行的研究比较常见,但是没有发现利用农杆菌介导法对马铃薯块茎进行瞬时表达的研究报道。
传统的稳定转化方法是目前研究马铃薯块茎最常用的方法,但是其具有试验周期长、耗资大、表达效率低下等缺点,因此,农杆菌介导的瞬时表达方法在马铃薯块茎上可以得到应用,将使得对马铃薯块茎特异启动子的研究变得更加方便快捷。
刘敏等[2]和孟楠等[3]采用注射法对草莓果实进行瞬时表达均获得成功,但是相对于草莓果实而言,马铃薯块茎结构更加致密,给试验带来了困难。
本研究分别采用浸染法和注射法侵染马铃薯块茎,以马铃薯叶片及烟草叶片为对照,通过GUS组织化学染色分析证明本研究的可行性。
1 材料和方法1.1 试验材料本研究采用鄂马铃薯(Solanum tuberosum L.)3号品种(E3)的叶片、块茎和烟草的叶片,作为转化受体材料。
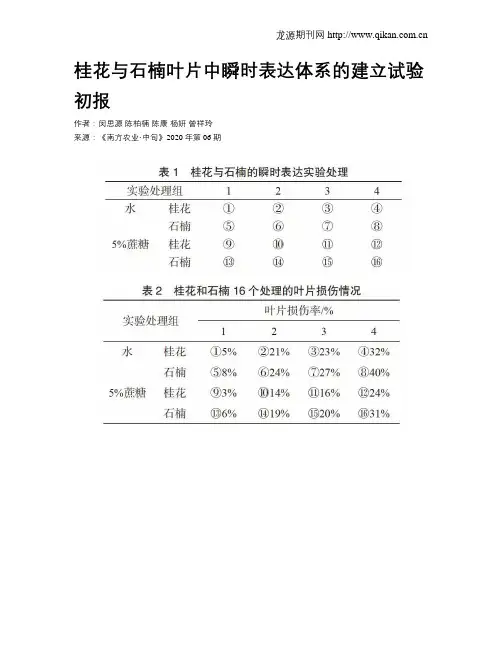
桂花与石楠叶片中瞬时表达体系的建立试验初报作者:闵思源陈柏楠陈康杨妍曾祥玲来源:《南方农业·中旬》2020年第06期摘要木本植物的稳定遗传转化难以建立或所需时间长,而在这些木本植物中建立瞬时遗传转化可大大提高基因功能分析的效率。
因此,使用根癌农杆菌介导的瞬时侵染技术,以桂花和石楠叶片为材料,以β-葡糖醛酸酶基因(β-glucuronidase,GUS)作为实验结果检测的报告基因,建立瞬时表达体系。
结果发现,侵染过程中,农杆菌对于桂花和石楠叶片有一定的毒性,可加速叶片衰败;蔗糖溶液相对于水可减缓叶片衰败;GUS基因表达的蛋白质可能因为叶片木质化程度太高或叶片脱色后褐化而无法检测或者没有表达。
本实验为进一步改进桂花和石楠的瞬时表达实验体系提供了借鉴。
关键词桂花;石楠;瞬时表达;遗传转化桂花是我国的十大传统名花之一,自古享有“独占三秋压众芳”的美誉。
随着大量基因测序工作的完成,我国对于植物基因作用的研究也进入了更加深入的阶段。
目前,对植物基因功能与作用的研究主要通过转基因技术、基因敲除、基因沉默等方法。
瞬时表达是最近几十年来发展的一种高速、高效率的检测蛋白质表达的办法,随着相关研究不断深入,逐渐被广泛应用到生物科学各方面的发展研究中。
植物基因瞬时表达体系的构建为简洁、快速研究启动子活性、基因功能和蛋白质定位等开辟了新的途径[1-3]。
园林木本植物中的瞬时表达是基因功能检测鉴定的有效方法,相较于稳定的遗传转化系统而言,瞬时表达具有一定优势:1)简洁高效,可操作性强,不需要经过漫长的组织培养过程,能够一周甚至几天内转化基因;2)基因表达的水平较高;3)安全,因为被转移的基因没有被整合到基因组中,不会产生能够遗传的下一代,不会有基因飘移的生态风险[4-5]。
基因瞬时表达技术是在比较短的时间跨度范围内将植物需要表达的目的基因转化到靶细胞中,在靶细胞内建立一种暂时能够高效表达的体系。
其中,β-葡糖醛酸酶基因(β-glucuronidase,GUS)被作为报告检测基因广泛应用在瞬时表达系统中[6]。
水稻转基因实验操作(谢越、赵建宁、艾鹏慧、孙淑斌整理)(2006.7)一、水稻(日本晴)愈伤组织的诱导(以水稻成熟胚为试材诱导愈伤组织)1.消毒:取水稻成熟种子,人工或者机械脱壳,挑选饱满光洁无菌斑的种子,按以下步骤消毒:1)将种子放入100ml无菌烧杯中,倒入70%酒精消毒1分钟;2)倒去酒精,加入100ml 30%次氯酸钠(NaClO)溶液(5.2%次氯酸钠),浸泡30分钟;3) 倒去次氯酸钠溶液,用无菌蒸馏水清洗种子4-5遍,最后一遍浸泡30分钟。
2.诱导与继代培养:(以下步骤需无菌操作)1)种子放在无菌滤纸上吸干,置成熟胚于诱导培养基中,每皿12-14颗;2)操作完毕用封口膜(Micropore TM Surgical Tape)封好培养皿,在30℃光照培养箱,培养4周;3)在超净工作台上打开培养皿,用镊子挑取自然散落的胚性愈伤组织(淡黄色,致密呈球状),在30℃光照培养箱,继代培养1-2周。
(没有脱落的可在原培养基上继续培养7天,次数多了效果会减弱)二、农杆菌(工程菌)培养挑取农杆菌单克隆或吸取所保藏的农杆菌(EHA105)菌液100µl于4ml YEP(含50mg/LSpec和50mg/L Str)培养液中,28℃,250rpm振荡培养20-36h至菌液OD600为0.8-1.0。
三、感菌与共培养1)取培养好的工程菌液1ml于1.5ml离心管中,4℃,5000rmp,离心1min,去上清。
用含200µmol/LAs的30ml AAM感菌液制成悬浮液。
2)将长到一定大小的水稻愈伤组织挑出,放入农杆菌悬浮液侵染5分钟(愈伤量没过50ml离心管锥形部位即可)。
3)将愈伤组织取出,置于无菌的滤纸上沥干30-40分钟;4)将愈伤组织置于共培养基上(共培养基上面垫上一层9cm无菌滤纸)。
28℃(组培室)暗培养2.5天。
四、愈伤组织的抗生素筛选将愈伤组织取出,用无菌水清洗6次,其间需不停的振荡(组培室震荡机最大速率)。
2. 染色步骤(1)染色:加入适量配制好的GUS 染液于24孔板的孔中,将待测样品浸到GUS染液中,将24孔板置于37℃保温箱中放置6 h。
(2)漂洗:先后用50%,70%,100%的乙醇漂洗样品,每次浸泡5分钟。
(3)脱色:加入100%乙醇浸泡直至完全脱色。
(4)记录:在体视显微镜下拍照记录。
二、GUS报导基因的定量检测GUS 能与底物MUG(分子量352.3,4-甲基伞型酮-β-葡萄糖醛酸苷,4-methylumbelliferylβ-D-glucuronide)反应产生荧光物质MU(分子量198.2,4-甲基伞型酮,4-methylumbelliferone)。
MU的激发波长为365 nm,发射波长为456 nm,其含量可由荧光分光光度计测出。
因此,我们可以根据单位质量的植物总蛋白在单位时间内产生的荧光物质的多少来定量的检测GUS含量。
1.试剂配制(1)1 mol/L Na2HPO4溶液:35.814 g Na2HPO4溶于100 ml水。
(2)1 mol/L NaH2PO4溶液:15.601 g NaH2PO4溶于100 ml水。
(3)0.1 M 磷酸缓冲液(pH7.0):1 mol/L Na2HPO4取5.77 ml,1 mol/L NaH2PO4取4.23 ml,定容至100 ml。
(4)10%SDS溶液:将90 ml 水稍微加热,加10 g SDS,搅拌溶解,加入几滴浓盐酸调节pH至7.2,然后加水定容至100 ml。
(5)0.5 M EDTA (pH8.0):在80 ml 水中加入18.61 g Na2EDTA•2H2O,用NaOH调pH至8.0(约需2 g 左右的固体NaOH),溶解后定容至100 ml。
(6)GUS酶提取液:0.1 M 磷酸缓冲液(pH7.0)取50 ml;10% SDS取1 ml;0.5 M EDTA(pH8.0)取2 ml;Triton X-100取100 ul;β-巯基乙醇100 ul;用水定容至100 ml。
亚细胞定位准备(用烟草ck)MS无抗培养基倒平皿,铺二层滤纸于培养基上;吸水纸(卫生纸一卷),小滤纸,用10ml 离心管代替打孔器,50ml离心管;小三角瓶(均需要灭菌,115℃,30min)1.将保存的农杆菌划线(kan+rif),第三天中午挑菌于(kan+rif)LB培养基中28-30℃,摇床20h至第四天早上;2.以1:25比例(1ml接种于25ml)接菌液于25mlLB(含kan+rif,50nmAS)28-30℃,摇床培养至OD=0.6-0.8,约5h。
3.用50mL离心管收集菌体,常温,5000rpm,离心5min,弃上清;4.用以下溶液重悬菌体等体积25ml(10mM MgCL2,10mM MES, 150nM AS)放入小三角瓶,室温下静置活化2h,(铺滤纸于已凝的无抗MS培养基);5.将叶片打孔,圆状的叶片浸泡在菌液中,真空渗透30min-1h(0.85Mpa)。
6.用灭菌的吸水纸吸干表面的菌液,平铺放置于MS培养基上,光照培养48h。
7.观察。
GUS定量分析所用试剂:1、0.1M磷酸缓冲液)(pH7.0)1M Na2PO4 11.54ml1M NaH2PO4 8.46mlAdd ddH2O TO 200ml2、GUS 蛋白提取液 (现用现配)0.1M磷酸缓冲液(pH7.0) 100ml10% SDS 2ml0.5M EDTA(Ph8.0) 4mlTritonx-100 200ulβ-巯基乙醇 200uladd ddH2O TO 200ml121℃灭菌室温保存3、gus蛋白分析buffer每100ml的蛋白提取液加入4-MUG 70.46mg,-20℃保存,现配现用。
4、0.2M Na2CO3 buffer。
Gus蛋白提取方法(全过程于冰上操作)•取适量烟草叶片,加入适量PVP,加液氮研磨成粉末,取约0.6g装入15ml离心管中•预先加入500ml蛋白提取液,摇匀,在冰上放置置沉淀•4℃,13000prm离心15min.•吸取上清到另一管中进行下一步实验,(未及时做放-20℃)Gus活性测定•取20ul蛋白加入37℃预热的180ulgus 蛋白分析buffer中,37℃温浴。