苯酚和酚类
- 格式:ppt
- 大小:529.50 KB
- 文档页数:20



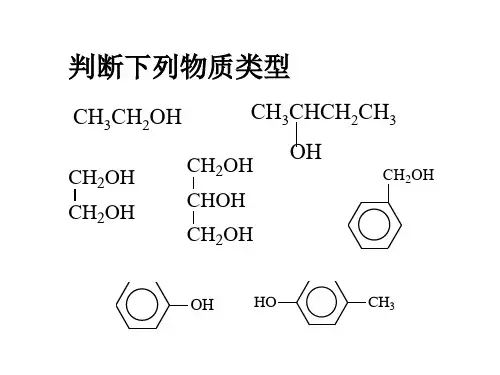
苯酚及酚类的性质练习题1.下列有关苯酚的说法错误的是A.易溶于乙醇等有机溶剂B.含有的官能团为酚羟基C.常温下苯酚能与水互溶D.苯酚的空间填充模型为2.苯酚具有弱酸性的原因是A.苯环使羟基中的O-H极性变强B.羟基使苯环活化C.苯酚能与NaOH溶液反应D.苯酚与溴水反应3.下列有关苯酚的叙述正确的是()A.苯酚呈弱酸性,能使紫色石蕊溶液显浅红色B.苯酚分子中的13个原子不可能处于同一平面上C.苯酚有腐蚀性,不慎沾在皮肤上应立即用酒精冲洗,再用水冲洗D.苯酚较稳定,在空气中不易被氧化4.苯酚有毒,如不慎沾到皮肤上,正确的处理措施是KMnO溶液冲洗A.用小苏打溶液冲洗B.用酸性4C.用冷水冲洗D.先用酒精冲洗,再用水冲洗5.下列各组物质,一定互为同系物的是( )A.C2H4与C3H6B.CH4O与C3H8OC.C4H10与C8H18D.与6.下列五种物质既能使高锰酸钾酸性溶液褪色又能与溴水反应使之褪色的是( )①甲烷②苯③聚乙烯④邻二甲苯⑤苯酚A.②③B.③⑤C.⑤D.④⑤7.下列有机物与苯酚互为同系物的是A.B.C.D.8.已知酸性强弱顺序为H2CO3>C6H5OH>HCO-3,下列化学方程式正确的是() A.2C6H5ONa+H2O+CO2―→2C6H5OH+Na2CO3B.C6H5OH+NaHCO3―→C6H5ONa+H2O+CO2↑C.2C6H5OH+Na2CO3―→2C6H5ONa+H2O+CO2↑D.C6H5OH+Na2CO3―→C6H5ONa+NaHCO39.向下列溶液中滴入FeCl3溶液,颜色无明显变化的是()10.实验室回收废水中苯酚的过程如图所示。
下列分析错误的是A.该过程中苯作萃取剂B .操作Ⅰ、Ⅱ、Ⅲ均涉及分液C .该过程中苯可循环使用D .操作Ⅰ、Ⅱ均需要分液漏斗,操作Ⅲ需要漏斗11.芥子醇的结构简式如图所示,下列有关芥子醇的说法正确的是A .属于芳香烃B .分子式为11164C H OC .遇3FeCl 溶液不能显色D .能发生氧化反应、取代反应、加成反应12.(2021·北京八中乌兰察布分校高二期末)已知有抗癌作用的有机物白藜芦醇的结构简式为,1mol 该有机物分别与2Br (浓溴水)和2H 反应,消耗2Br 和2H 的物质的量最多为A .1mol 、1molB .3.5mol 、7molC .6mol 、6molD .6mol 、7mol13.按照要求填空: ① ② ③ ④ ⑤ ⑥(1)各物质中互为同系物的是_______(填物质序号,下同)。

第2课时酚1.认识苯酚及酚类物质的组成和结构特点。
2.掌握苯酚的重要化学性质。
3.理解有机物分子中各基团间的影响。
4.了解苯酚的用途及对环境和人体健康的影响,关注有机化合物的安全使用问题。
苯酚一、苯酚的结构1.分子中羟基与苯环(或其他芳环)碳原子直接相连而形成的有机化合物称为酚,最简单的酚是苯酚。
2.苯酚的分子式为C6H6O,结构简式为,可简写为C6H5OH。
二、苯酚的物理性质和化学性质1.苯酚的物理性质(1)颜色:无色,露置在空气中会部分氧化而略带红色。
(2)状态:晶体;熔点:40.9 ℃。
(3)溶解性:常温下,苯酚能溶于水并能相互形成溶液(苯酚与水形成的浊液静置后会分层,上层是溶有苯酚的水层,下层是溶有水的苯酚层),当温度高于65 ℃时,苯酚能与水以任意比互溶。
(4)毒性:苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心,如果不慎沾到皮肤上,应立即用酒精洗涤,再用水冲洗。
2.苯酚的化学性质(1)与NaOH溶液反应苯酚是一种酸性比碳酸还弱的酸,它能与氢氧化钠溶液反应生成苯酚钠和水,苯酚钠易溶于水,所以向苯酚的浊液中加入NaOH溶液后,溶液变澄清。
反应如下:向苯酚钠溶液中通入CO2或加入稀盐酸,又会生成苯酚。
反应如下:(2)与浓溴水反应苯酚与浓溴水反应生成白色不溶于水的2,4,6三溴苯酚。
反应如下:该反应能够定量完成,常用于对溶液中的苯酚进行定性和定量测定。
(3)苯酚的显色反应向含有苯酚的溶液中加入三氯化铁溶液,溶液呈现紫色,这是苯酚的显色反应。
1.判断正误(正确的打“√”,错误的打“×”)。
(1)苯酚沾在皮肤上,可以用酒精或氢氧化钠溶液清洗。
()(2)苯酚的酸性很弱,不能使酸碱指示剂变色。
()(3)向苯酚钠溶液中通入少量CO2时生成Na2CO3,通入过量CO2时生成NaHCO3。
()(4)苯中少量的苯酚可先加适量的浓溴水,使苯酚生成三溴苯酚,再过滤除去。
()(5)苯酚分子中的13个原子可能处于同一平面上。


酚类化合物分子结构
酚类化合物是一类含有羟基(-OH)官能团的有机化合物。
它们以
其独特的分子结构而闻名,其中羟基固定在芳香环上。
这些化合物的分子结构通常呈现环状结构,由苯环或其衍生物连接而成。
酚类化合物可以根据官能团的位置和数量进行分类。
例如,苯酚或氢氧化苯是最简单的酚类化合物,它们的分子结构中只有一个羟基固定在苯环上。
另一方面,苯二酚或苯酚醛是复杂的化合物,它们具有两个或更多的羟基和其他官能团,如醛基或酮基。
酚类化合物的分子结构对其物理性质和化学性质起着至关重要的作用,因此对于研究和应用这些化合物非常重要。
- 1 -。

酚类污染与防治摘要:在我国现阶段,随着经济的发展,资源浪费、环境污染等一系列问题日益严重,水污染问题尤为突出。
国家对水污染控制的力度不断加大,一些大江大河的水环境问题已有所改善,但就总体而言水污染问题却仍旧严重。
本文着重介绍了水体中酚类污染的现状与治理。
关键词:水污染;酚类污染Phenolic Pollution and ControlAbstractIn our country, along with economic development, resource waste and environmental pollution problems and a series of increasingly serious water pollution problem is particularly prominent. State water pollution control has intensified, some environmental problems of water of large rivers has improved, but on the whole issue of water pollution is still serious. This paper introduces the phenols in water pollution and its treatment.Key words: water pollution; phenolic pollution酚类污染是指酚类对环境造成的污染。
酚类主要包括苯酚、甲酚、氨基酚、二硝基邻甲酚、荼酸和五氯酚等。
酚主要来源于炼焦、炼油、制造煤气、酚、绝缘材料、药、造纸等生产过程中排出的废气和废水中。
酚类是恶臭物质,可经消化道、呼吸道和皮肤侵入人体,与细胞原生质中的蛋白结合,使细胞失去活力。
同时,酚还对神经、泌尿、消化系统有毒害作用。

苯酚苯酚(C6H6O,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
有腐蚀性,常温下微溶于水,易溶于有机溶液;当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
中文名:苯酚外文名:p henol 别名:石炭酸分子式:C6H6O 相对分子质量:94.11化学品类别:有机物--苯的衍生物管制类型:不管制储存:密封保存理化性质物理性质外观与性状:白色结晶,有特殊气味。
熔点(℃):40.6相对密度(水=1):1.07沸点(℃):181.9相对蒸气密度(空气=1):3.24折射率1.5418闪点79.5℃分子式:C6H6O化学式:C6H5OH,PhOH分子量:94.11饱和蒸气压(kPa):0.13(40.1℃)燃烧热(kJ/mol):3050.6临界温度(℃):419.2临界压力(MPa):6.13辛醇/水分配系数的对数值:1.46闪点(℃):79爆炸上限%(V/V):8.6引燃温度(℃):715爆炸下限%(V/V):1.7溶解性:可混溶于、醚、氯仿、甘油、二硫化碳、凡土林、挥发油、强碱水溶液。
室温时稍溶于水,与大约8%水混合可液化,65℃以上能与水混溶,几乎不溶于石油醚。
化学性质可吸收空气中水分并液化。
有特殊臭味,极稀的溶液有甜味。
腐蚀性极强。
化学反应能力强。
与醛、酮反应生成酚醛树脂、双酚A,与醋酐;水杨酸反应生成醋酸苯酯、水杨酸酯。
还可进行卤代、加氢、氧化、烷基化、羧基化、酯化、醚化等反应。
[2]苯酚在通常温度下是固体,与钠不难顺利发生反应,如果采用加热熔化苯酚,再加入金属钠的方法进行实验,苯酚易被氧化,在加热时苯酚颜色发生变化而影响实验效果。
本人在教学中采取下面的方法实验,操作简单,取得了满意的实验效果。
在一支试管中加入2-3毫升无水乙醚,取黄豆粒大小的一块金属钠,用滤纸吸干表面的煤油,放入乙醚中,可以看到钠不与乙醚发生反应。

多酚类化合物和酚类化合物
多酚类化合物和酚类化合物有区别,具体分析如下:
酚类化合物是一类含苯环的有机化合物,其特点是具有酸性的有机物,其酸性比碳酸的酸性小,但比醋酸的酸性大。
酚类化合物通常以苯酚为基础,包括苯酚本身以及以苯酚为基础的化合物,如苯酚钠、苯酚丙酮等。
多酚类化合物是一类更为复杂的有机化合物,它们通常具有多个酚性羟基,并因此具有更强的抗氧化活性。
多酚类化合物包括黄酮类、单宁类、酚酸类以及花色苷类等。
这些化合物在植物性食物中普遍存在,具有潜在的促进健康作用。
总的来说,多酚类化合物和酚类化合物在结构和性质上存在差异。
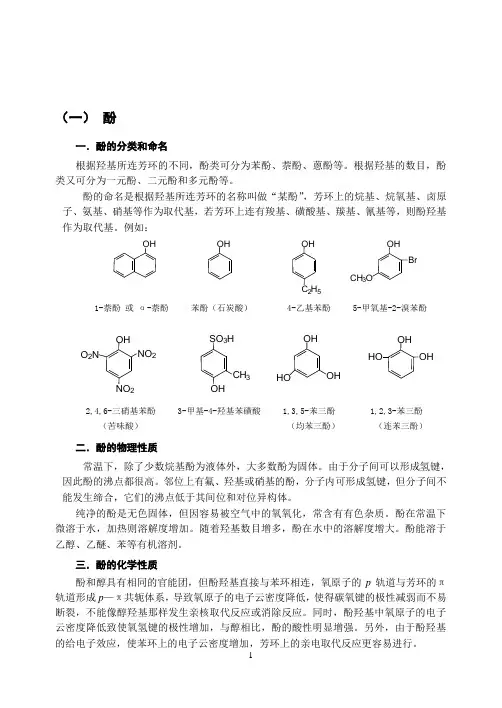
(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。
苯酚酚类第三章第⼀节《苯酚酚类》⼀、苯酚的结构、组成和性质1、苯酚的组成和结构分⼦式:C 6H 6O ,俗名:⽯炭酸OH ,官能团:—OH , 2.酚类的结构特点:羟基与苯环直接相连。
羟基与氢氧根的区别⼆、苯酚物理性质1、纯净的苯酚是⽆⾊的晶体,具有特殊的⽓味,长时间露置空⽓中呈粉红⾊。
2、熔点是43℃。
3、室温下,苯酚在⽔中溶解度不⼤,当温度⾼于65℃时,能跟⽔混溶。
苯酚易溶于⼄醇,⼄醚等有机溶剂。
4、苯酚有毒,其浓溶液对⽪肤有强烈的腐蚀性,使⽤时要⼩⼼!(如不慎沾到⽪肤上,应⽴即⽤酒精洗涤。
依据在教材52页最下⾯⼀⾃然段)三、苯酚化学性质 1、氧化反应:①可以燃烧:C 6H 6O +7O 26CO 2+3H 2O ②在空⽓中易被氧化⽽呈粉红⾊。
2、(1)弱酸性 A .与NaOH 溶液的反应由于苯环对羟基的影响,使苯酚中的羟基能发⽣微弱电离所以苯酚能够与NaOH +NaOH所以向苯酚的浊液中加⼊NaOH 溶液后,溶液变澄清苯酚的酸性极弱,它的酸性⽐碳酸还要弱,以致于苯酚不能使紫⾊⽯蕊试剂变红,++ NaCl点燃OH+H 2OONa OH + H +O -ONa OH+ H 2O +CO 2+ NaHCO 3注意:产物是苯酚和碳酸氢钠这是由于酸性:H 2CO 3 > 苯酚 > HCO 3-所以苯酚与碳酸钠反应不会放出CO 2+Na 2CO 3(2)苯酚的取代反应A .能与⾦属Na 反应置换出氢⽓2 2 Na + H 2↑B .苯酚与浓溴⽔在常温2,4,6-三溴苯酚 Br Br +3Br 2 ↓+3HBr 2,4,6-三溴苯酚该反应可以⽤来定性检验苯酚也可以⽤来定性测定溶液中苯酚的含量(3)显⾊反应:酚类化合物与Fe 3+显紫⾊,该反应可以⽤来检验酚类化合物。
(4)加成反应苯酚可在苯环上发⽣加成反应OH+3H 2OH(环⼰醇)苯酚与苯取代反应的⽐较OH +ONa ONa OH+ NaHCO 3ONa OH(1)苯酚、⼄醇均有羟基,为什么苯酚能与NaOH 溶液反应,⽽⼄醇不能呢?(2)苯酚能与浓溴⽔发⽣取代反应,⽽甲苯不能反应,为什么?【⼩结】①在苯酚的分⼦中,苯基影响了与其相连的羟基上的氢原⼦,促使其较易电离,显⽰了⽐醇中羟基上的氢原⼦有较明显的酸性;②⽽羟基则反过来能影响与其相连的苯基上的氢原⼦更活泼、更容易发⽣取代反应。
苯酚百科名片苯酚苯酚(C6H6O,PhOH),又名石炭酸、羟基苯,是最简单的酚类有机物,一种弱酸。
常温下为一种无色晶体。
有毒。
有腐蚀性,常温下微溶于水,易溶于有机溶液;当温度高于65℃时,能跟水以任意比例互溶,其溶液沾到皮肤上用酒精洗涤。
暴露在空气中呈粉红色。
目录[隐藏]基本介绍化学特性工业生产世界苯酚生产与消费现状物化性质储存注意事项毒理学简介应急处理苯酚的鉴别基本介绍化学特性工业生产世界苯酚生产与消费现状物化性质储存注意事项毒理学简介应急处理苯酚的鉴别[编辑本段]基本介绍苯酚是一种常见的化学品,是生产某些树脂、杀菌剂、防腐剂以及药物(如阿司匹林)的重要原料。
【中文名称】苯酚;石炭酸【英文名称】phenol【结构或分子式】所有C原子均以sp2杂化轨道形成σ键,O原子均以sp3杂化轨道形成σ键。
【相对分子量或原子量】94.11【密度】1.071【熔点(℃)】42~43【沸点(℃)】182【折射率】1.5425(41)【毒性LD50(mg/kg)】大鼠经口530。
【性状】无色或白色晶体,有特殊气味。
【溶解情况】溶于乙醇、乙醚、氯仿、甘油、二硫化碳等。
易溶于有机溶液,常温下微溶于水,当温度高于70℃时,能跟水以任意比例互溶。
【用途】用于制染料合成树脂、塑料、合成纤维和农药、水杨酸等。
作外科消毒剂消毒能力大小的标准(石炭酸系数)。
【制备或来源】由煤焦油经分馏,由苯磺酸经碱熔。
由氯苯经水解,由异丙苯经氧化重排。
【其他】加热至70℃时能溶于水(在室温下,在水中的溶解度是9.3g,当温度高于70℃时能与水混溶),有毒,具有腐蚀性如不慎滴落到皮肤上应马上用酒精(乙醇)清洗,在空气中易被氧化而变粉红色。
在民间有土方用石炭酸来治皮肤顽疾,以毒攻毒,如用来治脚底起泡。
[编辑本段]化学特性三维结构一种重要的苯系中间体[1]。
又称石炭酸。
低熔点(43℃)无色晶体,在空气中放置及光照下变粉红,有特殊气味,沸点181.84℃。
有机化学基础知识点整理酚的结构与性质酚是一类具有羟基(-OH)官能团的有机化合物,其结构与性质在有机化学中占据重要的地位。
本文将对酚的结构与性质进行整理,以帮助读者更好地理解有机化学的基础知识。
第一部分:酚的结构酚的结构可以通过羟基的位置以及芳香环的个数来描述。
最简单的酚是苯酚,也称为苯酚,其结构为一个苯环上连接着一个羟基。
苯酚的化学式为C6H6O,结构式为C6H5OH。
在苯酚的基础上,我们可以通过取代基的连接方式来得到更复杂的酚类化合物。
例如,苯环上存在一个或多个其他基团的酚称为取代酚。
常见的取代酚有对羟基苯甲酸(对酚)和邻羟基苯甲酸(邻酚)等。
第二部分:酚的性质1. 理化性质酚一般为无色液体或结晶体,具有特殊的芳香气味。
酚的熔点和沸点随着分子结构的改变而有所不同。
苯酚的熔点为42.15℃,沸点为182.2℃。
2. 溶解性酚具有较好的溶解性,在水中可以发生氢键形成溶液。
然而,随着分子结构的增大,溶解性会下降。
对于更复杂的酚类化合物,其溶解性主要受到分子间作用力的影响。
3. 酸碱性酚具有一定的酸性,可以与碱反应生成酚酸盐。
酚的酸性来自于羟基上的氢离子,可以通过在羟基上连接电子亲密基团来增强其酸性。
例如,在苯酚的羟基上连接一个硝基基团可以形成硝基酚,其酸性比苯酚强。
第三部分:酚的反应性1. 取代反应酚可以进行取代反应,在芳香环上引入其他基团。
常见的酚取代反应包括硝化反应、氨基化反应、烷基化反应等。
这些反应可通过在反应中加入适当的试剂和条件来控制。
2. 氧化反应酚可以进行氧化反应,通过与氧气或氧化剂反应生成酚醛、醛酮等化合物。
这些氧化反应在有机合成中有着重要的应用,可用于合成其他有机化合物。
第四部分:酚的应用由于酚具有羟基官能团的特性,使得其可以用于合成许多有机化合物。
酚及其衍生物在医药、染料、香料等领域有广泛的应用。
例如,对羟基苯甲酸可以用于合成阿司匹林等药物,对羟基苯甲醛可用于合成香料。
结语:本文对酚的结构与性质进行了整理,通过了解酚的结构以及其在有机化学中的应用,读者可以更好地理解酚的重要性。
酚编稿:宋杰审稿:张灿丽【学习目标】1、了解酚类的结构特点、一般特性和用途;2、掌握苯酚的化学性质。
【要点梳理】要点一、苯酚的结构和物理性质【高清课堂:酚#苯酚的结构和物理性质】分子中羟基与苯环(或其他芳香环)上的碳原子直接相连的有机化合物称为酚。
最简单的酚是苯酚。
1.苯酚的结构。
苯酚的分子式为C6H6O,结构简式为、或C6H5OH。
苯酚中至少有12个原子处于同一平面上,是极性分子。
2.苯酚的物理性质。
纯净的苯酚是无色晶体,暴露在空气中会因部分氧化而呈粉红色。
苯酚具有特殊气味,熔点43℃。
苯酚易溶于乙醇等有机溶剂。
常温下,苯酚在水中的溶解度不大(9.3 g),当温度高于65℃时,能与水混溶。
苯酚有毒,其浓溶液对皮肤有强烈的腐蚀性,使用时要小心,如果不慎沾到皮肤上,应立即用酒精清洗。
要点二、酚的化学性质及用途【高清课堂:酚#苯酚的性质】1.苯酚具有弱酸性,俗称石炭酸,能与NaOH溶液发生中和反应。
注意:苯酚、H2CO3、HCO3-的酸性强弱顺序为:H2CO3>>HCO3-因此苯酚能与Na2CO3发生反应,且苯酚钠与CO2、H2O反应时,无论CO2是否过量,均生成NaHCO3,而不会生成Na2CO3。
2.苯酚与金属钠的反应。
苯酚与钠反应比醇与钠反应要容易,表明苯环对酚羟基上氢原子的影响大于乙基对醇羟基上氢原子的影响,使酚羟基上氢原子比醇羟基上的氢原子更活泼。
3.取代反应。
苯酚可与卤素单质、硝酸、硫酸等发生取代反应。
苯酚能与浓溴水反应生成不溶于水的白色沉淀(2,4,6-三溴苯酚),此反应很灵敏,常用于苯酚的定性检验和定量测定。
4.显色反应。
苯酚的稀溶液遇FeCl3溶液时立即变成紫色。
本反应也可用于鉴定酚的存在。
5.缩聚反应。
酚醛树脂俗称“电木”,它不易燃烧,具有良好的电绝缘性,被广泛地用来生产电闸、电灯开关、灯口、电话机等电器用品。
6.苯酚的用途。
苯酚是重要的化工原料。
广泛用于制造酚醛树脂、染料、医药、农药等,也可用于制备食品防腐剂和消毒剂。
苯酚酚类说课稿选修5 第三章第一节醇酚第二课时贵州省安顺市一中雷宇各位老师大家好,我今天说课的内容是新课程高中化学选修5(人教版)第三章《烃的含氧衍生物》第一节《醇和酚》的第二课时一、教材与学情分析1、教材的地位和作用:酚类物质是采用具体代表物的方式进行学习。
授课安排为1课时。
酚与醇结构相似,都含有羟基,本节内容是学生初次运用所学规律预测一类物质可能发生的反应,并通过各自代表物的性质的对比,理解醇羟基与酚羟基的区别,体会官能团与取代基之间相互影响的重要思想,为后续的有机化学的学习提供方法打下基础。
2、学情分析从知识层面看,在必修阶段已经具备有机化学基本的类别概念,知道一些典型有机物的性质。
在前面的学习过程中对官能团决定有机物的化学性质、基团的相互影响都有了一定的认识,但有待完善。
从能力层面看,具备了一定的分析、解决问题的能力;设计分析简单实验的能力;对“结构决定性质”这一普遍规律比较熟悉,因此具有性质预测的知识基础,知道研究有机化合物的一般方法和流程,具备进行探究活动的能力。
本节课授课对象是普通班学生,他们基础较差,自主探究的意识、合作创新的精神还有一定程度欠缺,需要老师引导和支持。
二、教学目标与重点难点通过对教材、课程标准的要求以及学生的分析,我制订出本节课要完成的教学目标,1、教学目标(1)知识与技能方面a、认识酚类物质,能够识别酚和醇b、掌握苯酚的结构、性质及用途c、理解苯环和羟基的相互影响(2)过程与方法方面a、通过以问题为驱动的自主实验探究过程,培养学生类比推测、分析解决问题和观察的能力以及实验综合能力b、在苯酚结构与性质的理论探讨过程中,培养思维的全面性、深刻性,提升思维品质。
(3)情感态度与价值观方面a、通过对苯环和羟基的相互影响理解,让学生体会事物之间相互联系、相互影响b、通过苯酚的用途与毒性引导学生从化学的视角认识生活、认识社会,学会辩证的看待化学物质c、训练学生在获得知识的过程中与人沟通、争辩、交流的勇气2、教学重点和难点(1)重点:苯酚的化学性质(酸性、苯环上的三元取代)(2)难点:建立官能团之间相互影响的基本观念。
酚类化合物有哪些?产生的途径是什么?酚,通式为ArOH,是芳香烃环上的氢被羟基(—OH)取代的一类芳香族化合物。
最简单的酚为苯酚。
酚类化合物是芳烃的含羟基衍生物,根据其挥发性分挥发性酚和不挥发性酚。
酚类化合物都具有特殊的芳香气味,均呈弱酸性,在环境中易被氧化。
含酚废水中以苯酚和甲酚的含量最高,因此,环境监测常以苯酚和甲酚等挥发性酚作为污染指标。
酚类化合物的危害酚是一种中等强度的化学毒物,与细胞原浆中的蛋白质发生化学反应。
低浓度时使细胞变性,高浓度时使蛋白质凝固。
酚类化合物可经皮肤粘膜、呼吸道及消化道进入体内。
低浓度可引起蓄积性慢性中毒,高浓度可引起急性中毒以致昏迷死亡。
一般来讲,酚进入人体后机体通过自身的解毒功能使之转化为无毒物质而排出体外。
只有当摄入量超过解毒功能时才有蓄积而导致慢性中毒,表现为头晕、头痛、精神不安、食欲不振、呕吐腹泻等症状。
酚类化合物的用途酚类是煤焦油中提取的主要产品之一,在焦油中的含量约为3-4%,是加工苯酚、邻位甲酚、间位甲酚等产品的原料。
随着苯酚下游产品的发展,对苯酚的需求量正逐年增加,国内已供不应求,每年都需进口。
其中间甲酚是合成农药、染料、橡胶塑料抗氧剂、医药感光材料、维生素E及香料等产品的重要精细化工中间体。
引起酚污染的原因环境中的酚污染主要指酚类化合物对水体的污染,含酚废水是当今世界上危害大、污染范围广的工业废水之一,是环境中水污染的重要来源。
在许多工业领域诸如煤气、焦化、炼油、冶金、机械制造、玻璃、石油化工、木材纤维、化学有机合成工业、塑料、医药、农药、油漆等工业排出的废水中均含有酚。
这些废水若不经过处理,直接排放、灌溉农田则可污染大气、水、土壤和食品。
酚类废气的排放与监测由于酚的用途极为广泛,预防其污染的工作也很困难。
在生产和使用酚的工厂必须建立严格的操作制度,谨防酚的外泻。
同时要搞好废水的回收利用和生物氧化处理,严禁含酚废水排入渗井、渗坑,以免污染地下水。