压缩空气系统验证方案(最终)(DOC)
- 格式:doc
- 大小:2.03 MB
- 文档页数:21

XXXX有限公司1.验证目的通过对压缩空气净化的验证,保障进入洁净区空气得到有效净化,防止进入洁净室(区)的压缩空气对产品造成污染。
2.验证职责设备工程师负责验证方案的起草,并负责预确认、安装确认、运行确认的组织3.验证目的通过对压缩空气净化的验证,保障进入洁净区空气得到有效净化,防止进入洁净室(区)的压缩空气对产品造成污染。
4.验证职责设备工程师负责验证方案的起草,并负责预确认、安装确认、运行确认的组织实施。
生产部负责性能确认组织实施。
品管部负责完成设备验证中的相关检验任务,确保检验结论正确可靠。
负责报告的整理。
品管部经理负责验证方案及报告的审核。
管理者代表负责验证方案的批准。
5.验证范围适用于我公司压缩空气系统的验证。
6.方案说明6.1.在报告中尽详细地填写本方案中的所列表格。
用墨水笔填写。
完成表格的人员应在底部“复核人”一栏签上姓名和日期。
如果由一个以上的人填写,那么每一个人都应签上姓名和日期。
6.2.方案执行时可能会发现偏差。
一旦这种情况发生,应将一份“异常情况报告”送交验证领导小组进行处理。
7.背景资料5.1空气压缩机:生产厂家:泉州市华德机电设备有限公司压缩空气系统为公司公共设施。
主要设备喷油螺杆式空气压缩机、两个1.0m3储气罐、冷冻式压缩空气干燥机、压缩空气精密过滤器等组成洁净压缩空气系统的装置。
该系统按车间工艺布置图安装于空压机室内。
为口罩车间全自动平面口罩机提供洁净压缩空气。
设备制造商及零件供应商资料:设备名称:螺杆式空气压缩机型号:LGPM-75排气量:10.5m3/min排气压力:0.8Mpa8.验证目的通过对压缩空气净化的验证,保障进入洁净区空气得到有效净化,防止进入洁净室(区)的压缩空气对产品造成污染。
9.验证职责设备工程师负责验证方案的起草,并负责预确认、安装确认、运行确认的组织实施。
生产部负责性能确认组织实施。
品管部负责完成设备验证中的相关检验任务,确保检验结论正确可靠。

压缩空气系统验证方案适用范围本方案适用于LU710-22A螺杆空压机+JAD75N冷干机+后级精过滤器系统的验证。
职责设备动力科:负责设备及公用工程系统验证方案的起草,并负责预确认、安装确认、运行确认的组织实施。
生产车间:负责性能确认的组织实施,并协助性能确认方案的起草。
质量部QC:负责按计划完成设备及公用工程系统验证中的相关检验任务,确保检验结论正确可靠。
QA验证管理员:负责验证工作的管理,协助设备及公用工程系统验证方案的起草,组织协调验证工作,并总结验证结果,起草验证报告。
质量部经理:负责验证方案及报告的审核。
质量总监:负责验证方案及报告的批准。
内容3.1. 概述本系统采用螺杆式空压机+风冷式冷冻干燥机+四级空气过滤器得到洁净的符合医用标准的压缩空气。
系统流程图如下:LU710-22A螺杆式空压机为喷油式机型,具有优良的可靠性能,机组重量轻、振动小、噪声低、操作方便、易损件少、运行效率高是其最大优点。
其基本结构由压缩机、电动机、传动机构、冷却系统、控制系统及防护箱体等部件组成。
该机采用皮带传动,带动主机转动进行空气压缩,通过喷油对主机内的压缩空气进行冷却,主机排出的空气+油混合气体经过粗、精两道分离,将压缩空气中的油分离出来,最后得到洁净的压缩空气。
冷冻式压缩空气干燥机主要功能是除去压缩空气所含之水份,是藉着一只空气对冷媒的热交换器,将压缩空气温度降至露点温度2℃,可凝结压缩空气中所含水份,再经由分离器,分离空气及水滴,而水滴经由自动排水器排出系统外,即完成干燥过程。
经干燥的压缩空气经后级精过滤器除油、除尘、除臭得到符合药品生产要求的空气。
验证依据《验证管理程序》、《设备及公用工程系统验证规程》、《设备说明书》。
3.2空压机系统的预确认3.2.1. 目的根据公司生产要求,选择与公司生产能力,相适应的设备,确保所选设备能满足生产要求和GMP要求。
3.2.2. 技术适用性及供货要求3.2.2.1. 要选择适合本公司厂房空间(12×2.5×4m3)及生产用压缩空气最大量(6m3/min)的机型。

压缩空气系统验证方案起草人:起草日期:审核人:审核日期:批准人:批准日期:医药有限公司目录1.引言1.1.验证小组人员及责任1.2.概述1.3.主要技术参数1.4.验证目的1.5.验证依据及采用文件2.预确认3.安装确认4.运行确认5.性能确认6 异常情况的处理7.结果分析与评价8.设备验证评定报告9.验证合格后批准的正式文件10 再验证周期1.引言按照GMP的要求,设备在正式生产使用前,需要经过验证来证实所使用的设备能够达到设计要求及规定的技术指标,符合生产工艺要求,以便使所生产的产品符合预定的质量标准,从设备方面为产品的质量提供保证,因此需要对压缩空气系统进行设备验证。
1.1.验证小组人员及责任小组职务岗位责任组长质保部部长审定验证方案,组织实施组员车间主任会审验证方案,参与本方案的实施组员生产技术部长编制验证方案,负责实施组员设备管理员编制验证方案,组织实施组员计量员参与本方案的实施组员质量管理员参与本方案的实施组员化验员参与本方案的实施组员车间维修工安装并根据本方案及说明书实施维修操作组员空压机操作员参与安装并负责根据本方案及说明书实施操作1.2.概述本系统由一台螺杆式空压机,冷冻式干燥器、高压储气罐和空气过滤器(初级过滤、一级过滤及二级过滤)三级构成。
使用时压缩空气经进气过滤器滤去尘埃、杂质后,最后通过高效空气过滤器滤掉尘、油等杂质后供用户气动系统使用。
本系统产品严格按ISO1217,ISO7183,ISO8573.1标准设计制造,具有气量足,压缩空气洁净,为全封闭结构,低噪音,振动小,重量轻,占地面积小,操作方便,易损件少,运行效率高,无需安装基础,空车过久自动停机, 需要时自动启动,节约电力,实现24小时无人看守连续运转等特点。
压缩排出的气体进入贮气罐,然后气体分别经过离心式油水分离器,冷冻式干燥机、主管路过滤器、微油雾过滤器对压缩空气进行干燥、除油、净化,使其达到干燥、无油、清洁、洁净度达到10万级的要求,净化后的压缩空气通过不锈钢分配管道输送到车间各用气点。

压缩空⽓系统验证⽅案压缩空⽓系统验证⽅案设备名称:压缩空⽓系统设备型号:ZT22-7.5 设备编号: JD-0204-004 制造⼚商:安装位置:验证⽅案编号:⽬录⼀、概述 4⼆、⽬的 4三、范围 4四、压缩空⽓的组成及流程 4五、验证依据和⽂件 5六、⼈员职责及⼈员培训 5七、风险评估 6⼋、验证计量确认 9九、性能确认 9⼗、偏差处理 11⼗⼀、变更控制 11⼗⼆、验证结论 12⼗三、再确认周期 12⼗四、验证结论 12验证⽅案起草审批⽅案起草⽅案审核⽅案批准验证⼩组名单及职责1.概述本压缩空⽓系统是按照 GMP 要求设计、安装的压缩空⽓⽓源,由两台阿特拉斯· 科普柯 ZT22-7.5 型固定式螺杆压缩机、⼀台冷冻式空⽓⼲燥机、⼀级 P 级精密过滤器、⼆级 S 级精密过滤器、⼀个 1.5m 3的缓冲罐和⽆缝钢管输⽓管道组成。
其基本流程是:将⾃然空⽓经固定式螺杆空⽓压缩机压缩,经缓冲罐、⼀级 P 级精密过滤器,再使⽤冷冻式⼲燥机将其除湿⼲燥,然后通过⼆级 S 级精过滤器得到⽆油、⽆⽔、⽆尘的压缩空⽓,经过⽆缝钢管输⽓管道,输送⾄车间各⽤⽓点,与药品直接接触各⽤⽓点再经0.01 µ m 过滤器过滤,压缩空⽓符合药品⽣产要求。
2、⽬的确认系统⽣产的压缩空⽓性能达到使⽤标准3. 范围对本⼚区内接触药品内包材的压缩空⽓⽤⽓点进⾏性能确认。
4. 压缩空⽓组成及流程 4.1 压缩空⽓系统设备⼀览表4.2 净化区压缩空⽓⽤⽓点⼀览表:5、验证依据及⽂件5.1药品⽣产质量管理规范(2010 年修订)5.2空⽓压缩机标准操作规程5.3药品⽣产验证指南6.⼈员培训确认6.1⼈员培训6.2.1确认⽬的:确认所有参与本次验证的⼈员是否接受了本次验证⽅案的培训6.2.2合格标准:所有参与本次验证的⼈员均已接受了本次验证⽅案的培训。
6.2.3确认记录:详见附件1,“验证⽅案培训记录”。
验证⽅案培训记录附件17、风险评估7.1 风险初步识别初步分析有以下原因造成压缩空⽓质量风险点:1、压缩空⽓湿度偏⾼。
压缩空气系统验证方案一、验证方案审批1验证方案的起草。
2验证方案批准批准人:日期:年月日二、验证方案1引言压缩空气系统产生的压缩空气是为水系统、自动控制系统提供动力。
压缩空气的质量,对于工艺用水、药液、药物的洁净至关重要,因此,压缩空气系统是影响产品质量的重要环节。
该系统于年月日安装、调试,投入使用,根据药品GMP要求,结合实际情况,决定于年月日~ 年月日对压缩空气系统进行验证。
2 验证目的:该系统安装后,检查并确认本系统是否仍符合设计要求和生产要求。
3 验证对象:本公司压缩空气系统该系统主要由两台空气压缩机、两个贮气罐、一个缓冲罐、一套英国公司生产的压缩空气处理器、压缩空气管道及直接接触药品使用点的压缩空气过滤罐组成。
4 验证准备:1)有关操作规程A ZW3-10系列无油润滑空气压缩机操作规程B 压缩空气过滤罐清洁标准操作程序2)有关资料3)有关仪表5 安装确认6 运行确认:6.1 管道系统的完整性试验:启动空气压缩机,达正常工作压力后,打开各使用点阀门,检查并记录各使用点能否达到需要压力。
检查人:检查日期:6.2 使用点净化压缩空气质量:应根据使用点洁净室的净化级别确定净化压缩空气尘埃粒子数的检测标准,净化压缩空气对物料及洁净室环境不应造成污染。
所以采用相应洁净室的净化标准。
终端尘埃粒子数测定方法:制作或购买聚乙烯塑料一个,要求体积大于1立方米,袋口直径小于30cm,形状不限,洗净后,置验证合格的百级层流罩下吹干、压平、叠齐,移至净化压缩空气使用点。
在压缩空气系统正常工作情况下,将尘埃粒子计数器的采样管插入袋内后,收集使用点的净化压缩空气,至塑料袋胀满,袋口有气排出时移开并封闭袋口,按《尘埃粒子计数器标准操作规程》检测袋内空气的尘埃粒子数。
重复取样三次,每次计取样数两次,记录结果。
使用点:测定人:测定日期:7 结果分析和评价:根据上述试验数据和有关检查情况由验证小组成员出具验证报告(含验证评定)。

压缩空气系统验证方案压缩空气系统验证方案如下:1. 确定验证目标:明确需要验证的压缩空气系统的特定功能、性能要求和安全标准。
2. 设计验证方案:根据验证目标,制定验证方案,包括验证方法、测试设备、测试环境、测试工具和相关人员。
3. 压力测试:利用压力传感器和数据记录仪对压缩空气系统进行压力测试,验证是否能够达到指定的压力要求,并检测是否存在泄漏、漏气等问题。
4. 温度测试:利用温度传感器和数据记录仪对压缩空气系统进行温度测试,验证系统是否能够稳定控制温度,并排除过热、过冷等问题。
5. 噪声测试:利用噪声测试仪器对压缩空气系统进行噪声测试,验证系统是否符合环境噪声限制要求。
6. 能耗测试:通过测量压缩空气系统的能耗,验证系统是否能够达到预期的节能要求。
7. 安全性测试:测试压缩空气系统的安全装置和防护措施是否有效,是否能够及时发现和处理可能存在的安全隐患。
8. 故障恢复测试:模拟压缩空气系统部分故障情况,验证系统的自动检测和恢复能力是否正常工作。
9. 持续性测试:对压缩空气系统进行持续性测试,验证系统是否能够长时间运行,并确保其稳定性和可靠性。
10. 数据分析和评估:对验证过程中收集的数据进行分析,评估压缩空气系统是否通过验证,并根据分析结果提出改进建议。
11. 编写验证报告:根据验证结果编写验证报告,详细记录验证过程、结果和评估,并提供建议和改进方案。
12. 验证结果复核:组织相关专业人员对验证报告进行复核,确保验证结果的准确性和可靠性。
13. 验证结果审查:将验证报告提交给相关部门领导或专家,进行审查和批准,确认压缩空气系统的验证合格性。
14. 反馈和改进:根据验证结果和审查意见,进行必要的反馈和改进,以确保压缩空气系统的质量和性能达到预期要求。

压缩空气系统验证方案目录1、概述2、验证目的3、验证范围4、职责5、验证5.1 安装确认5.2 运行确认5.3 性能验证5.4 异常情况处理程序6、验证结果与结论7、再验证周期1 概述:本厂压缩空气系统由两台螺杆空气压缩机、前置过滤器、压缩空气冷冻干燥机、中置过滤器、贮气罐、后置过滤器、连接管路等部分组成,用于生产符合药品生产工艺要求的压缩空气。
压缩空气系统流程如下:阿特拉斯科普柯压缩机→贮气罐→前置过滤器→ 空气冷冻干燥机→ 中置过滤器→ 后置过滤器复盛压缩机→贮气罐→前置过滤器→ 空气冷冻干燥机→ 中置过滤器→ 后置过滤器→ 后置过滤器两台压缩机后置过滤器出来的气体进入压缩空气主管道我厂使用的两台空气压缩机,阿特拉斯科普柯压缩机有限公司生产的GA30C-7.5螺杆空气压缩机,排汽压力为0.75Mpa,排汽量为4.53M3/分钟,压缩排出的气体进入贮气罐,然后气体经过前置过滤器(1μm)后除去空气中的杂质及碳粒,残余油雾含量为1ppm,再经冷冻干燥机入口进入冷冻干燥机,经冷冻干燥机冷却、离心分离、除去空气中水分,干燥的压缩空气经中置过滤器(0.01μm)过滤,残余油雾量为0.01ppm,最后经过后置过滤器(0.01μm),残余油雾含量为0.003ppm。
中山复盛机电有限公司生产的SA230A螺杆空气压缩机,排气压力为0.8 Mpa,排气量为3.4 M3/分钟,压缩排出的气体进入贮气罐,然后气体经过前置过滤器(c级,3μm)后除去空气中的杂质及碳粒,残余油雾含量为5ppm,再经冷冻干燥机入口进入冷冻干燥机,经冷冻干燥机冷却、离心分离、除去空气中水分,干燥的压缩空气经中置过滤器(T级,1μm)过滤,残余油雾量为1ppm,然后经过后置过滤器(A级,0.01μm),残余油雾含量为0.01ppm,最后再经过后置过滤器(H级,0.01μm),残余油雾含量为0.003ppm。
2 验证目的:检查并确认本公司压缩空气系统安装符合要求并能提供符合药品生产质量的压缩系统。

压缩空气系统验证方案目录1 引言1.1 验证小组成员及责任1.2 概述1.3 工作原理1.4 验证目的2 验证内容1.5 相关文件2.1 预确认2.1.1 预确认目的2.1.2 预确认内容2.2 安装确认2.2.1 安装确认目的2.2.2 安装确认所需的文件资料2.2.3 安装确认内容2.3 运行确认2.3.1 运行确认目的2.3.2 运行确认所需的文件资料2.3.3 运行确认内容2.4 性能确认2.4.1 性能确认目的2.4.2 性能确认内容3 异常情况处理程序4 验证结果评定与结论5 附件6 再验证1 引言1.1 验证小组成员及责任1.1.1 验证小组成员1.1.2 责任验证小组组长:负责验证方案起草,验证方案实施全过程的组织、由副组长写出验证报告。
验证小组组员:负责验证方案实施过程中安装确认、运行确认、性能确认部分的具体工作。
1.2 概述BOSHIHANDLE螺杆式空气压缩机为单级螺杆喷油式机型,主要给挤注车间和吹瓶车间提供洁净气源,具有良好的可靠性。
机组重量轻、振动小、噪音低、操作方便、易损件少、运行效率高等优点。
其系统由主机、油分离器、冷却器、风扇、电动机及启动装置、安全及调节装置、仪表板、精密过滤器、储气罐、组成。
可提供0.8~0.9Mpa以下的压缩空气。
生产厂家:成都博士汉压缩机机械有限公司型号:BS-60A排气压力:0.8~0.9Mpa容积容量:7.0m3/min电机功率:45KW生产日期:2008年4月编号:BS060082011.3 工作原理室内空气经过滤器进入压缩机,电动机通过皮带传动,使压缩机主机转动通过减荷阀吸入外部空气。
空气首先经过过滤板进行预过滤,再经减荷阀上的进气过滤器过滤,在主机内,空气+油混合气一起被压缩机送到分离油罐,大部分油份在此被从空气离出来,然后压缩空气进入精油分离器进行分离,使油在空气中的含量最小,至此,油与空气被送到各自冷却器进行冷却,冷却器通过冷却风扇冷却,油进入下一个循环,而空气被送到用户用气系统。

目录1.0 方案审核及授权2.0 人员3.0 范围及概述4.0 职责5.0 方案/计划描述6.0 验证目的7.0验证程序8.0 验证实施 8.1安装确认 8.2运行确认 8.3性能确认9.0 验证原始记录 10.0 再验证周期 附表1偏差表格 1.0方案授权2.0人员所有负责执行此方案的人员必须按如下签字表格中进行签字。
签字内容包括:姓名、职务、日期等。
姓名 职务 签字 日期 李学成质量部经理授 权起草人 审核人 批准人 生效日期 姓名: 职务: 签字: 日期: 姓名 职务: 签字: 日期:姓名: 职务: 签字: 日期:景晓卫车间主任叶素芳QA主管工艺员QC人员QA人员马月芳操作工孙月平操作工3.0范围。
3.1此方案适用于小容量注射剂车间压缩空气系统的验证。
按照GMP要求,确定验证系统的验证方法及文件编号,保证被验证系统能以正确的方法验证并使系统运行满足使用要求。
压缩空气系统是按照GMP要求设计安装的压缩空气气源。
使用固定式螺杆压缩机将空气压缩,使用压缩空气冷冻式干燥机、过滤器将压缩空气进行净化,使之达到无油、无水、无菌,通过不锈钢管道,输送至车间各用气点。
本系统由空气压缩机、压缩空气过滤器、压缩空气高效除油器、储气罐、吸附干燥机和不锈钢管道系统组成。
3.2 有足够的文件系统证明压缩空气系统能达到检测要求。
3.3 所有的必须适用性文件将表明验证在这个方案中将被确认和证明其有效性。
3.4 在方案的执行过程中遇到任何短缺的数据或异常情况应被作为偏差记录下来并审核确认。
异常情况将被调查并终止引起该情况的行动。
在执行的同时所有数据应及时记录,该方案中应包括最终的总结。
3.5验证时间:年月日---- 年月日3.6制备:空气经空气压缩机制得,再经四级过滤、终端除菌过滤。
3.6.1工艺流程空气空气压缩机储灌C级压缩空气过滤器吸附干燥机储气罐压缩空气高效除油器3.6.2 设备生产厂家: 柳州富达机械有限公司。
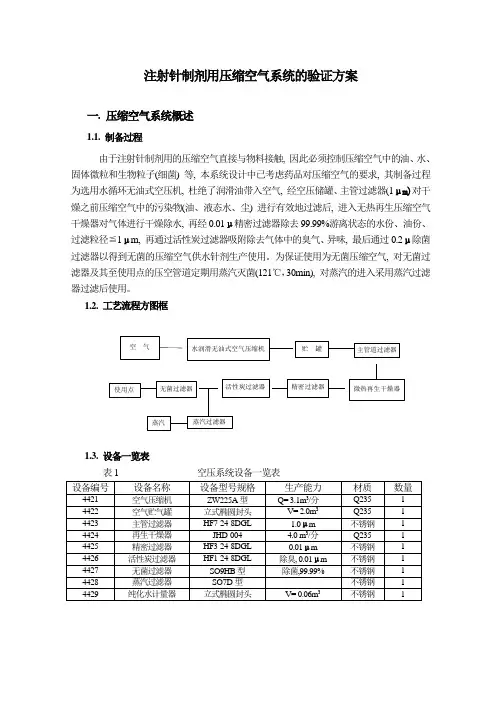
注射针制剂用压缩空气系统的验证方案一. 压缩空气系统概述1.1. 制备过程由于注射针制剂用的压缩空气直接与物料接触, 因此必须控制压缩空气中的油、水、固体微粒和生物粒子(细菌) 等, 本系统设计中已考虑药品对压缩空气的要求, 其制备过程为选用水循环无油式空压机, 杜绝了润滑油带入空气, 经空压储罐、主管过滤器(1μm)对干燥之前压缩空气中的污染物(油、液态水、尘) 进行有效地过滤后, 进入无热再生压缩空气干燥器对气体进行干燥除水, 再经0.01μ精密过滤器除去99.99%游离状态的水份、油份、过滤粒径≦1μm, 再通过活性炭过滤器吸附除去气体中的臭气、异味, 最后通过0.2μ除菌过滤器以得到无菌的压缩空气供水针剂生产使用。
为保证使用为无菌压缩空气, 对无菌过滤器及其至使用点的压空管道定期用蒸汽灭菌(121℃,30min), 对蒸汽的进入采用蒸汽过滤器过滤后使用。
1.2. 工艺流程方图框1.3. 设备一览表表1 空压系统设备一览表二. 压缩空气系统的验证方案1. 验证目的通过对水循环无油式空压机为主的空压系统的验证, 从而确认其生产能力及其性能在任何条件下始终满足设计能力和无菌生产工艺的要求。
2. 安装确认2.1.准备工作在设备到位开箱后, 设备管理人员或验证检查人员必须检查设备厂家提供的设备图纸、手册、备件清单、操作说明书、维修、保养指南等技术资料。
在熟悉这些资料的基础上进行质量检查。
2.2. 空气压缩机及其系统(含管道)安装质量检查在设备按工艺流程要求安装后, 对照设计图纸及供货商提供的技术参数, 检查设备及其管道安装是否符合设计和《规范》。
具体检查技术要求见表2表2 空压系统设备及其管道安装质量检查表2.3. 空气无菌过滤器完整性试验检查空气过滤系统,包括无菌或非无菌的各种气体过滤器, 在使用前或使用后均应做完整性试验, 以此来证明安装是否正确, 膜是否破损、密封是否良好, 孔洞率是否正确。
技术标准验证方案制订验证方案审核验证方案批准目录概述1.验证目的2.验证范围3.人员和职责4、验证内容5.偏差和漏项6.验证周期7.验证方案审批表概述压缩空气系统是按照GMP要求设计安装的压缩空气气源。
使用空气压缩机将空气压缩,使用无热再生式干燥、过滤器将压缩空气进行净化,使之达到无油、无水、无尘、无菌,通过不透钢管道,输送至车间各用气地点。
本系统由空气压缩机、0.6m3贮罐、1.8 m3贮罐,主管路过滤器、冷冻干燥机、冷冻干燥机、油雾过滤器、微油雾过滤器、除臭过滤器和不锈钢管道系统组成。
原有系统为已经经过的系统,本次新增加了管道回路,主要对新增回路部分进行验证。
主要技术参数压缩空气产量:2.02m3/min/0.7MPa。
四级过滤孔径分别为:3μm、1μm、0.01μm、0.01μm。
产品压缩空气含水量低。
贮气罐容量为1.8 m3,0.6m31.验证目的1.1 检查并确认该系统设计、所用材质、安装符合GMP要求。
1.2 检查该系统设备的文件资料齐全且符合GMP要求。
1.3 检查并确认设备的安装符合生产要求、公用工程系统配套齐全且符合设计要求。
1.4 确认设备的各种仪表经过校正合格。
1.5 确认该系统的各种控制功能符合设计要求,SOP符合要求。
1.6 确认该设备在稳定的操作范围内能稳定地运行且能达到设计标准。
压缩空气性能指标1.7 确认系统生产的压缩空气能达到设定的质量标准。
压缩空气质量指标本验证方案适用于压缩空气的发生及输送系统的验证。
相关文件验证小组人员:1.2.1、验证小组组长:负责验证方案起草,组织实施验证的全过程,验证结束写出验证报告。
1.2.2、验证小组组员:分别负责本方案中具体工作。
1.2.3、实验室、实验员:QC理化室及必须的检测仪器为本项目验证实验室4.验证内容:4.1.仪器、仪表的校正目的:检查压缩空气系统中的仪器、仪表是否经过校验,是否在有效期内。
检查内容及结果如下表:检查人:复核人:日期:4.2.设计确认确认该系统设计方案通过审查,待定购的设备及管道对生产工艺适用性符合GMP 要求。
压缩空气系统验证方案验证方案编号:设备(系统)名称:压缩空气系统设备(系统)编号:******制药证小组成员名单项目主管:小组成员:目录1 概述2 目的3 范围4 职责4.1 验证领导小组4.2 验证工作小组4.3 生产部4.4 质监部5 验证实施的步骤和要求5.1 验证依据及标准5.2 预确认5.3 安装确认所需文件资料确认及仪器仪表确认5.4 安装确认5.5 运行确认5.6 性能确认6 结果分析与评价7 验证记录、验证项目有关记录表格l 概述洁净压缩空气系统为制剂车间公共设施。
主要设备有FHOG75A型蜗杆式空气压缩机、气水分离器、2.5m3空气储罐、SAD冷冻式干燥机、LY 型高效除油器、A级过滤器等组成洁净压缩空气系统的装置。
该系统按车间工艺布置图安装于车间二楼空压机室内。
为固体制剂车间湿法混合制粒机、沸腾制粒干燥器、高效沸腾干燥机、高效包衣机、铝塑包装机等设备提供洁净压缩空气。
FHOG75A型蜗杆式空气压缩机系统流程将空气经过空气滤清器滤去尘埃、杂质,由减荷阀控制进入压缩机工作腔,随着蜗杆与两侧星轮片的合运动,空气被压缩,并在压缩过程开始时与喷入的润滑油混合,经压缩后的混合气体进入油气分离器,利用旋风分离法和上返分离法粗分离油气后,经精分离器滤芯进行精分离、通过最小压力阀排出的气体是比较纯净压缩空气;然后经过板翘式冷却器,将压缩空气冷却,空气中水蒸汽饱和析出,与压缩空气一起排出。
空气压缩机排出的压缩空气还含有一些的水分、油气和杂质,所以增加了一套后处理设备,包括:气水分离器(除水)、冷冻干燥机(进一步处除水)、高效除油器(除油)、A级精密过滤器(除尘、进一步除油)等。
经过处理后的压缩空气常压露点≤-23℃;含油量≤0.01ppm;固体尘≤0.01µm。
本系统采用自动控制系统,操作方便。
FHOG75A型蜗杆式空气压缩机:容积流量(排气量):10m3/min排气压力(表压):0.55~0.7MPa电机转速:2970r/min电机功率:55KW空压机气体出口含油:<3PPm高效除油过滤器:出口气体含油量<0.01PPm;固体尘为0.01µmA级精滤器:出口气体含油量<0.01PPm;固体尘≤0.01µm2 目的为确认压缩空气系统能够正常运行,设备各项性能指标符合设计要求,保证生产出质量合格、符合工艺要求的压缩空气,特制订本验证方案,对压缩空气系统进行验证。
压缩空气系统验证方案目录1、引言1.1验证小组成员及责任1.2概述1.3验证目的1.4验证采用文件及标准1.5验证范围2.验证项目、评价方法及标准2.1验证用仪器仪表校验2.2压缩空气系统性能确认2.2.1测试目的2.2.2测试范围2.2.3测试方法2.2.4可接受标准3.验证周期4.验证结果评价与结论5.附件(验证记录空白样张)1引言1.1 验证小组人员责任1.1.1验证小组人员1.1.2 验证小组责任验证小组组长-负责验证方案起草、验证方案实施及验证全过程的组织和验证报告的完成。
验证小组组员-分别负责方案实施的具体工作。
1.1.3 验证工作中各部门责任验证领导小组-负责验证方案的批准;负责验证数据及结果的审核;负责验证报告的审批;负责验证项目合格单的发放。
质量部-负责组织验证方案、验证报告、验证结果的会审会签;负责对验证全过程实施监控。
负责验证的直接工作,以保证本验证方案规定项目的顺利实施;负责建立验证档案,及时将批准实施的验证资料收存归档。
生产技术部-参加会签验证方案、验证报告;负责设备仪器仪表的校正,并做好相应记录;负责收集各项验证记录,报验证领导小组;负责建立设备档案。
供应部-为验证过程提供物支持。
生产车间-配合好验证的各项工作。
1.2概述在生产过程中,压缩空气是公用工程中重要组成部分,而且在针剂生产洗瓶岗位直接接触安瓿,所以压缩空气质量直接影响药品质量,因此压缩空气系统的验证十分重要。
压缩空气系统由空压机、储罐、预过滤器、冷冻式压缩空气干燥器、除油过滤器、除菌过滤及终过滤器组成,压缩空气经除水、除油、除菌过滤后分配至各用气点使用。
1.3验证目的压缩空气系统的验证,在此以压缩空气终滤效果验证为核心,通过验证确认压缩空气过滤系统具有预定净化能力,确保我公司压缩空气系统能稳定的供应质量合格的洁净压缩空气。
在验证过程中,应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案变更申请及批准书(附件1)报验证委员会批准。
压缩空气系统验证方案1概述1.1压缩空气系统描述本压缩空气系统由预处理系统连接管路至车间各用气点构成。
预处理系统位于制剂大楼二楼空调机房内,主要有LS10-30H固定式螺杆空压机、储气罐、主管路过滤器、冷冻式压缩空气干燥机、压缩空气精密过滤器等设施;连接管路及阀门全部采用304L不锈钢材质,并且双面抛光。
系统为工艺生产气动设备及仪表的使用而提供无油无水的干燥空气,空压机排出的压缩空气,首先经过主管路过滤器,过滤粒径为1µm,然后经过冷冻式压缩空气干燥机除去水份,最后分别再经过二台0.01µm的压缩空气精密过滤器,保证了压缩空气质量满足GMP生产要求。
1.2设备基本情况寿力空气压缩机组中一个重要部件是一单级容积式,油润滑螺杆压缩机。
它提供稳定无脉动的压缩空气,并且无需保养和内部检查。
冷冻式压缩空气干燥机主要的功能是除去压缩空气所含的水份,是根据空气热交换原理,将压缩空气温度降至露点温度2℃~10℃,可凝结压缩空气所含的水份,再经油分离器分离空气和水滴,水滴经自动排水器排出系统外,即完成压缩空气干燥过程。
干燥的压缩空气经过压缩空气精密过滤器除油、除尘、除臭得到符合药品生产要求压缩空气。
压缩空气体系装备基本情形序号123456名称固定式螺杆压缩机储气罐冷冻式压缩空气干燥机主管路过滤器微油雾过滤器除油除臭超精过滤器规格型号LS16-75HR11A2187SLAD-10HTF SLAF-10HT SLAF-10HA SLAF-10HH编号01-008-0101-008-0201-008-0301-008-03-F101-008-03-F201-008-03-F3供应商XXX台州中威空压机制造有限公司XXX设备有限公司XXX装备有限公司XXX设备有限公司XXX设备有限公司主要技术参数:1.3压缩空气系统的流程示意图和各用气点分布图1.4各用气点的分布如下表:序号1234567用气点真空乳化搅拌机软管灌装封口机设备编号BPBP所在功能间名称(编号乳化(B-124)灌装间(B-126)备注栓剂高效湿法制粒机BP栓剂自动灌封间(B-131)混合制粒间(B210-1)烘干间(B-211)内包(1)(B-219)内包(3)(B-221)沸腾干燥平板式泡罩包装机平板式泡罩包装机BPBP2压缩空气法规要求2.1与药品直接接触的干燥用空气、压缩空气和惰性气体应经过净化处理,符合生产要求。
1 概述1.1本公司制剂车间压缩空气系统使用的空气压缩机是由上海康普艾压缩机有限公司制造的V15型喷油滑片式空气压缩机,进厂日期为2003年7月,固定资产编号为01304-02,系统排汽压力为0.8MPa,排汽量为2.25M3/分钟,压缩排出的气体进入贮气罐,然后气体分别经过离心式油水分离器,冷冻式干燥机、主管路过滤器、微油雾过滤器对压缩空气进行干燥、除油、净化,使其达到干燥、无油、清洁、洁净度达到10万级的要求,净化后的压缩空气通过不锈钢分配管道输送到车间各用气点。
2003年12月通过验证,符合生产工艺要求。
在使用过程中系统安装未发生变更,使用情况未发生飘移,系统设备正常进行维护及保养,未曾进行过大修及技术改造工作。
1.2 压缩空气系统工艺流程方框图1.3 压缩空气系统主要技术参数2 验证小组成员及职责3 验证目的3.1 明确压缩空气系统验证的内容与方法。
3.2 通过验证,确认该压缩空气系统安装、连接是否符合设计标准,操作、维护保养标 准操作程序是否符合生产实际操作要求,是否能够正常、稳定地运行,保证压缩 空气各项指标持续达到设计标准。
4 验证范围此次验证包括压缩空气系统的运行确认(OQ)、压缩空气系统的性能确认(PQ)。
5 验证类型前验证 □ 同步验证 □ 回顾性验证 □再验证 □ 6 验证条件确认6.1 验证小组成员培训确认在验证工作实施前,由验证小组组长对参加验证的人员进行本方案的培训。
6.2仪器仪表校验确认包括压缩空气系统的仪器仪表校验确认及检测使用的仪器仪表的校验确认。
6.3 验证前文件确认7运行确认7.1 经安装确认合格后才能进行。
进行运行确认是压缩空气系统的实际运行实验,运行确认的目的是证明设备、系统及其各项技术参数能够达到设计要求及生产要求。
7.2.验证所需的仪器仪表7.3检查系统每个设备的运行情况,包括喷油滑片空气压缩机、冷冻干燥机、储罐、过滤器等装置运行是否正常,检查指标包括电压、电流、压力、排水系统等;对照设备操作手册下的参数确定设备运行参数,检查设备运转情况是否正常;检查系统管路情况,管路、阀门、密封圈等是否有泄漏等缺陷。
压缩空气系统验证方案验证方案编号:设备(系统)名称:压缩空气系统设备(系统)编号:******制药证小组成员名单项目主管:小组成员:目录1 概述2 目的3 范围4 职责4.1 验证领导小组4.2 验证工作小组4.3 生产部4.4 质监部5 验证实施的步骤和要求5.1 验证依据及标准5.2 预确认5.3 安装确认所需文件资料确认及仪器仪表确认5.4 安装确认5.5 运行确认5.6 性能确认6 结果分析与评价7 验证记录、验证项目有关记录表格l 概述洁净压缩空气系统为制剂车间公共设施。
主要设备有FHOG75A型蜗杆式空气压缩机、气水分离器、2.5m3空气储罐、SAD冷冻式干燥机、LY型高效除油器、A级过滤器等组成洁净压缩空气系统的装置。
该系统按车间工艺布置图安装于车间二楼空压机室内。
为固体制剂车间湿法混合制粒机、沸腾制粒干燥器、高效沸腾干燥机、高效包衣机、铝塑包装机等设备提供洁净压缩空气。
FHOG75A型蜗杆式空气压缩机系统流程将空气经过空气滤清器滤去尘埃、杂质,由减荷阀控制进入压缩机工作腔,随着蜗杆与两侧星轮片的合运动,空气被压缩,并在压缩过程开始时与喷入的润滑油混合,经压缩后的混合气体进入油气分离器,利用旋风分离法和上返分离法粗分离油气后,经精分离器滤芯进行精分离、通过最小压力阀排出的气体是比较纯净压缩空气;然后经过板翘式冷却器,将压缩空气冷却,空气中水蒸汽饱和析出,与压缩空气一起排出。
空气压缩机排出的压缩空气还含有一些的水分、油气和杂质,所以增加了一套后处理设备,包括:气水分离器(除水)、冷冻干燥机(进一步处除水)、高效除油器(除油)、A级精密过滤器(除尘、进一步除油)等。
经过处理后的压缩空气常压露点≤-23℃;含油量≤0.01ppm;固体尘≤0.01µm。
本系统采用自动控制系统,操作方便。
FHOG75A型蜗杆式空气压缩机:容积流量(排气量):10m3/min排气压力(表压):0.55~0.7MPa电机转速: 2970r/min电机功率: 55KW空压机气体出口含油: <3PPm高效除油过滤器:出口气体含油量<0.01PPm;固体尘为0.01µmA级精滤器:出口气体含油量<0.01PPm;固体尘≤0.01µm2 目的为确认压缩空气系统能够正常运行,设备各项性能指标符合设计要求,保证生产出质量合格、符合工艺要求的压缩空气,特制订本验证方案,对压缩空气系统进行验证。
验证过程应严格按照本方案规定的内容进行,若因特殊原因确需变更时,应填写验证方案变更申请及批准书作为其附件,报验证工作领导小组批准。
3 范围本验证方案适用于洁净压缩空气系统的验证。
4 职责4.1 验证领导小组4.1.1 组织编写验证方案4.1.2 领导协调验证的实施4.1.3 验证方案的审核和批准4.1.4 批准验证报告4.2 验证工作小组4.2.1 编写验证方案4.2.2 实施验证方案4.2.3 编制验证报告4.2.4 收集验证数据、记录、信息4.3 生产部4.3.1 协助验证工作小组实施验证方案4.3.2 协助编写验证方案、验证报告4.3.3 收集验证资料、数据并记录4.4 质监部4.4.1 负责验证实施过程中的取样、检验、测试、监控及结果报告4.4.2 协助编制验证方案、验证报告、验证结果5 验证实施的步骤及要求5.1 验证依据及标准5.1.1 《药品生产质量管理规范》(1998年修订)5.1.2 《中国药典》(2000年版)5.1.3 《产品使用与维修说明书》5.2 预确认--选择设备供应商根据确定的设备的技术指标要求,从技术和经济两个方面选择设备供应商,应考虑的主要因素包括:5.2.1 供应此类设备的经验;5.2.2 供应商的信誉和财政稳定性;5.2.3 供应商的技术水平及生产条件;5.2.4 能否保证安装、培训和试车方面给予全面的支持;5.2.5 能否在供应商处进行试车;5.2.6 试车资料是否齐全;5.2.7 到其主要客户处了解同类设备的运行及售后服务情况:5.2.8 能否保证执行交货期:5.2.9 对供应商成本进行分析,确认价格优势:5.2.10 供应商是否熟悉或理解GMP。
根据分析结果确认供应商,选择的供应商应作为设备项目小组的成员,共同参与设备评价及验证工作。
供应商应按照预确认方案和辅助试验标准操作要求,对设备的技术指标设计要求逐项检查,并证实设计合理,设备能够正常运行。
5.3 安装确认所需文件资料及仪器仪表的检定确认安装确认所需资料文件及存放处见下表按上表所列文件进行确认并将确认结果填入“文件验证记录”5.4 安装确认5.4.1 安装区域及要求5.4.1.1 安装区域压缩空气系统安装按设备平面布局图安装于“空压机房”位置。
5.4.1.2 安装要求压缩空气系统按设计图所示进行安装连接,导气管道用无缝钢管;压缩空气的流向与过滤器、设备所标的方向路径一致。
其中:1 FHOG75A型蜗杆式空气压缩机 2 气水分离器 3 2.5m3储气罐4 SAD冷冻式干燥机5 高效除油过滤器6 A级精密过滤器5.4.2 设备附件确认5.4.2.1 储气罐附件名称制造厂家体积确认方法储气罐上海申江压力容器厂 2.5M3检索5.4.2.2过滤器列出本正常运行所需的过滤器清单过滤器制造厂家过滤精度5.4.2.3 管路连接5.4.3 公用工程连接5.4.4 仪器仪表的检定5.5运行确认目的:保证压缩空气系统在运转时符合设计要求。
接受范围:按照制造厂商的操作说明书,每步操作均运转正常。
测试步骤:确认机器已经为性能测试做好一切准备。
5.6 性能确认目的:保证压缩空气符合设计要求。
接受范围:按照设计要求,达到净化空气的指标。
测试步骤:系统运行测试三次。
5.6.按说明书操作启动空气压缩系统,在运行条件下进行测试,测试内容包括洁净压缩空气的温湿度、空气尘埃粒子数、微生物限度等项目。
5.6.1.1压缩空气的温湿度测定方法:其中:1. 被测气体 2. 调节阀 3. 10000ml抽滤瓶4. 胶塞5. 温湿度计探头6. 温湿度计A测试条件:温度:18~26℃;相对湿度:45~65%。
B测试方法按图2装置与被测气体连接,连续通入气体30分钟后,按图2所示插入WS一508B温湿度计探头,并计时,每间隔10分钟记录一次温湿度计数字显示屏上温度和相对温度,共连续检测60分钟,检测所得结果按“温湿度测试记录”的要求填写。
C技术要求和判断标准相对湿度(RH)≤45%5.6.1.2 压缩空气的尘埃粒子数测定。
其中:1. 被测气体 2. 进气调节阀 3. 出气调节阀4. 500ml抽滤瓶5. 集气斗6. 采样管7. 尘埃粒子计数器A测试条件:温度:18~26℃;相对湿度:45~65%。
B测试方法按图3装置与被测气体连接,连续通入气体30分钟后,按图3所示用尘埃粒子计数器测定压缩空气中的悬浮粒子(≥0.5μm、≥5μm),共采样18次并分别记录;检测结果按“尘埃粒子数测定记录”的要求进行填写。
C技术要求和判断标准不低于三十万级洁净区空气的洁净要求(≥0.5μm,≤10500000;≥5μm,≤60000)。
(液体制剂车间为十万级,但洁净区没有使用压缩空气)5.6.1.3 洁净压缩空气系统的微生物限度检查方法。
A测试条件:温度:18~26℃;相对湿度:45~65%。
B测试方法按图4所示,所用的抽滤瓶、无菌过滤器等装置经过121℃热压灭菌30分钟及用75%乙醇溶液浸泡12小时灭菌的连接软管及胶塞经烘干后组装成其中:1. 被测气体 2 进气调节阀 3. 过滤膜 4. 胶塞5. 出气口(关闭) 6 250ml抽滤瓶 7 灭菌生理盐水套。
在抽滤瓶内加入100mL生理盐水,在系统运行30分钟后,接通压缩空气让压缩空气通灭菌生理盐水搅动10分钟,停止通气,按《微生物限度检测标准操作程序》立即送样检测抽滤瓶内生理盐水中微生物含量;并以使用的灭菌生理盐水作检测对照,检测结果按附表过“做生物检测记录”的要求填写。
C技术要求与标准:压缩空气微生物菌落数<10个/ml。
6 结果分析与评价系统各项验证工作完成后.由验证实施人员负责整理原始记录,对验证结果进行分析与评价,并编写验证报告,交由验证领导小组审阅。
并最终批准。
7验证记录、验证项目有关记录表格。
附件1文件确认记录结论:确认人:复核人:日期:日期:附件2仪器仪表检定确认记录结论:确认人:复核人:日期:日期:附件3设备安装确认记录结论:确认人:复核人:日期:日期:附件4公共介质安装确认记录结论:确认人:复核人:日期:日期:附件5设备运行确认记录结论:确认人:复核人:日期:日期:附件6压缩空气温湿度记录测试单位测试依据测试状态仪器及型号测试日期报告日期测试人:复核人:日期:日期:附件7压缩空气尘埃粒子测试记录测试单位测试依据测试状态测试温度相对湿度采样量仪器及型号测试日期报告日期.测试人:复核人:日期:日期:【本文档内容可以自由复制内容或自由编辑修改内容期待你的好评和关注,我们将会做得更好】感谢您的支持与配合,我们会努力把内容做得更好!精品word文档。