第8章 胶体分散体系稳定性
- 格式:ppt
- 大小:433.50 KB
- 文档页数:50






胶体的稳定性
答案:
胶体(Colloid)又称胶状分散体,是一种分散质粒子直径介于粗分散体系和溶液之间的一类分散体系[1]。
胶体不一定都是胶状物,也不一定是液体,常见的胶体有有色玻璃、果冻、鸡蛋清、血液等。
介稳性:
胶体的稳定性介于溶液和浊液之间,在一定条件下能稳定存在,属于介稳体系。
胶体具有介稳性的两个原因:
原因一:胶体粒子可以通过吸附而带有电荷,同种胶粒带同种电荷,而同种电荷会相互排斥(要使胶体聚沉,就要克服排斥力,消除胶粒所带电荷)。
原因二:胶体粒子在不停地做布朗运动,与重力作用相同时便形成沉降平衡的状态。
结构:
根据法扬斯规则(能与晶体的组成离子形成不溶物的离子将优先被吸附.优先吸附具有相同成分的离子),胶体粒子是胶粒,胶粒与扩散层在一起组成了胶团,而胶粒又包括胶核与吸附层。
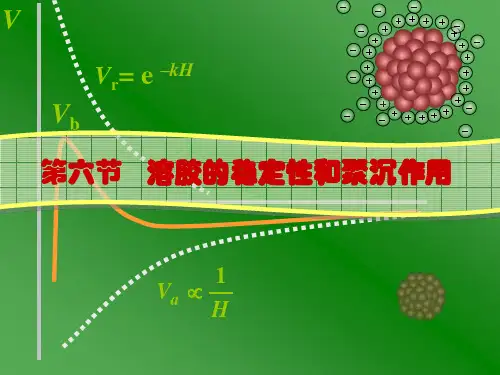

第八章胶体思考题1. 何为纳米材料?纳米材料有何特性?有哪些应用?【答】纳米材料是指纳米粒子组成的材料,分类有纳米粉体、纳米膜材料、纳米晶体和纳米块等等。
纳米材料的主要特性有:(1)小尺寸效应;(2)表面效应;(3)量子尺寸效应;(4)宏观量子隧道效应。
2. 胶粒发生Brown 运动的本质是什么?这对溶胶的稳定性有何影响?【答】Brown 运动是分子热运动的宏观体现。
Brown 运动使系统浓度分布均匀,对抗聚沉,有利于系统的稳定。
3. 有A、B 两种透明液体,其中一种是真溶液,另一种是溶胶,问可用哪些方法鉴别?【答】观察Tyndall 效应。
4. 燃料油中常需要加入少量油溶性的电解质,为什么?【答】消除电动现象产生的电动势,防止隐患发生。
5. 试解释:(1)做豆腐时“点浆”的原理是什么?哪几种盐溶液可作为卤水?哪种盐溶液聚沉能力最强?(2)江河入海处,为什么常形成三角洲?(3)明矾为何能使混浊的水澄清?【答】(1)点浆是使蛋白质聚沉。
常用的盐溶液有CaSO4和MgCl2。
(2)海水中富含电解质,使水中的胶质聚沉。
(3)明矾中Al3+水解形成Al(OH)3溶胶带正电,可以中和水中负电性胶质,从而使水质澄清。
6. 什么情况下大分子化合物对溶胶具有保护作用和絮凝作用,为什么?【答】少量絮凝作用,足量保护作用。
7. 电渗现象表明()(1)胶粒粒子是电中性的;(2)分散介质是电中性的;(3)胶体的分散介质也是带电的;(4)胶粒粒子是带电的。
【答】(3)。
8. 在胶体分散体系中,ζ电势为何值时称为等电状态?(1)大于零;(2)等于零;(3)小于零;(4)等于外加电势差。
【答】(2)。
9. 若溶胶粒子的表面上吸附了负离子,则其ζ电势()(1)一定大于零;(2)一定等于零;(3)一定小于零;(4)还不能确定其正负。
【答】(4)。
10. 溶胶与大分子溶液的相同点是()(1)热力学稳定体系;(2)热力学不稳定体系;(3)动力学稳定体系;(4)动力学不稳定体系。

胶体分散体系的粒径范围摘要:一、胶体分散体系的定义与特点二、胶体分散体系的粒径范围三、胶体分散体系的分类四、胶体分散体系的应用正文:一、胶体分散体系的定义与特点胶体分散体系是一种由两种不同状态的物质组成的均匀混合物,其中一种物质以微小的粒子或液滴的形式存在,另一种物质则作为连续相。
胶体分散体系具有以下特点:1.粒径范围:胶体分散体系的粒径范围在1 纳米至100 纳米之间。
2.分散质:胶体分散体系中的分散质是由微小的粒子或液滴组成。
3.连续相:胶体分散体系中的连续相可以是液体、气体或固体。
4.稳定性:胶体分散体系具有一定的稳定性,可以在一定条件下长时间保持均匀状态。
二、胶体分散体系的粒径范围胶体分散体系的粒径范围在1 纳米至100 纳米之间。
根据分散质粒子直径大小,可以将分散系划分为溶液(小于1 纳米)、胶体(1 纳米至100 纳米)和浊液(大于100 纳米)。
三、胶体分散体系的分类根据分散剂的类型,胶体分散体系可以分为以下几类:1.气溶胶:以气体作为分散剂的分散体系,其分散质可以是液态或固态(如烟、雾等)。
2.液溶胶:以液体作为分散剂的分散体系,其分散质可以是气态、液态或固态(如Fe(OH) 胶体)。
3.固溶胶:以固体作为分散剂的分散体系,其分散质可以是气态、液态或固态(如有色玻璃、烟水晶)。
四、胶体分散体系的应用胶体分散体系在许多领域都有广泛的应用,如水处理、医药、化妆品、食品等。
例如,胶体净水技术利用胶体粒子具有较大的表面积和吸附力,在水中吸附悬浮固体或毒素形成沉淀,从而达到净化水的目的。
总之,胶体分散体系是由两种不同状态的物质组成的均匀混合物,具有特定的粒径范围和稳定性。
根据分散剂的类型,胶体分散体系可以分为气溶胶、液溶胶和固溶胶。


胶体稳定性名词解释胶体稳定性(胶体稳定性)指胶体不能聚集,形成较大颗粒,呈现为不均一的分散体系。
胶体不仅能在液态和固态之间转变,而且还能从液态转变为气态。
这就是说胶体具有“触变性”和“不稳定性”,即当它与其他物质接触时,如果发生化学作用或物理作用,都会失去稳定性。
只有当改变其外部条件(如温度、 pH值、离子强度、溶剂等)后才恢复其稳定性。
这种因外界条件变化引起的不稳定称为“触变性”,又称“水化作用”;若胶粒间发生碰撞,使其失去稳定性,则称为“动力稳定性”或“凝聚稳定性”。
电镜下可以看到,蛋白质溶液表面存在着空间网状结构,其中许多氢键的线性排列有利于保持胶粒的稳定。
正是由于这些疏水基团在蛋白质溶液表面,以及在蛋白质溶液与周围环境之间,建立了牢固的氢键,所以蛋白质溶液稳定地悬浮在水中。
由此可见,对蛋白质溶液稳定性影响最大的因素是蛋白质溶液中蛋白质的分子量,一般来讲蛋白质分子量越大,其溶液的稳定性也就越差。
大分子蛋白质胶体一般不能单独存在,必须溶解于某种溶剂,才能稳定地存在于溶液中。
由于大多数胶体溶液并不稳定,因此各种蛋白质都应该能够溶解在水中,或者能被水抽提出来,否则不能稳定地保存于溶液中。
如果蛋白质溶液的稳定性受到破坏,那么胶体在形成后很快就会出现不均匀性,导致物质间发生聚沉作用。
相互间反应而产生沉淀,胶体的稳定性也就遭到破坏,所以测定蛋白质的分子量就显得尤为重要。
生物相容性:通常包括无毒、无刺激性和无过敏反应三项内容。
如果不满足这些条件,则蛋白质胶体对人体是有害的。
例如链霉素的热稳定性不好,易受光照破坏,就是因为其含有杂链结构,它对人体有毒害作用。
这是一个专业问题,你应该问问研究生物胶体稳定性的教授,或查阅相关资料。
胶体的稳定性是指溶液中的胶体粒子,在外加的机械力或热、光、电等条件改变时,其在溶液中的存在状态或分布的规律不被破坏的特性。
胶体的稳定性主要决定于它的溶解性和粘度。
在一定条件下,胶粒带同号电荷,它们之间的排斥力远大于吸引力,这样就能保持胶粒稳定。