元素周期律第二课时
- 格式:ppt
- 大小:2.07 MB
- 文档页数:20



第二课时元素周期律教学目标:1. 知识与技能(1)使学生初步掌握原子核外电子排布、原子半径和元素主要化合价的周期性变化;(2)认识元素性质的周期性变化是元素原子的核外电子周期性排布的结果,从而理解元素周期律的实质。
2. 过程与方法:通过元素周期律的推出及运用,初步培养学生抽象归纳以及演绎推理能力;在学习中提高自学能力和阅读能力。
3.情感态度与价值观:(1)培养学生学习自然科学的兴趣以及探求知识、不断进取的优良品质。
(2)使学生树立由量变到质变以及“客观事物本来是相互联系的和具有内部规律的”辩证唯物主义观点。
教学重点:元素周期律的推导及实质教学难点:元素的金属性、非金属性的变化规律教学方法:学生讨论,性质比较,实验探究,总结归纳教学过程:[复习]1、回忆有关元素原子核外电子的排布规律;2、填写课本P14 1——18号元素符号以及它们的原子结构示意图。
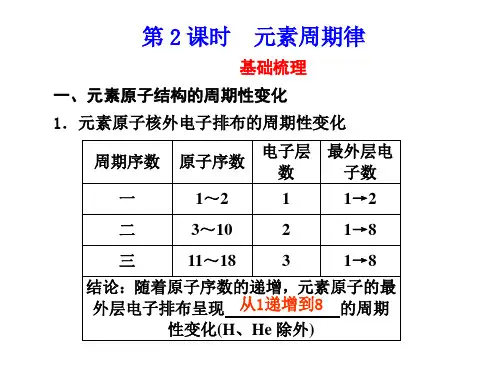
[提问]参照课本上所填内容,请大家总结一下,随着原子序数的递增,原子核外电子层排布、元素的原子半径和元素的化合价有何规律性变化?[板书]二、元素周期律[讲述] 随着原子序数的递增,原子核外电子层排布变化的规律性原子序数电子层数最外层电子数1~2 1 1~23~10 2 1~811~18 3 1~8[讲述]从上表可以看出:随着原子序数的递增,每隔一定数目的元素,会重复出现原子最外层电子从1个递增到8个的情况(H、He除外),这种周而复始的重现(但并不是简单的重复)的现象,我们称之为周期性。
这就如同我们一年一年的四季更替及学生活中的每天都是24小时一样。
因此,原子核外电子层排布的这种规律性变化,我们便称之为周期性变化。
由此,可得出如下结论:[板书]1、原子核外电子排布的规律性随着原子序数的递增,元素原子最外层电子排布呈现周期性变化。
原子序数原子半径3~9 (0.152nm) (0.071nm) 大小10~17 (0.186nm) (0.099nm) 大小[过渡] 除了元素原子最外层电子排布呈现周期性变化外,我们再来看下元素原子的半径有何变化。






化学学案5 第一章物质结构元素周期律第二节元素周期律(第二课时)姓名:【学习目标】1.掌握元素的金属性和非金属性随原子序数的递增而呈现周期性变化规律。
2.掌握元素周期表和元素周期律的应用。
【学习重难点】元素金属性非金属性判断【复习】1、元素的金属性:元素的原子电子的能力。
电子能力越强,元素的金属性越强。
2、碱金属元素:从上到下,失电子能力逐渐,金属性逐渐。
卤族元素:从上到下,得电子能力逐渐,非金属性逐渐。
一、元素金属性和非金属性的递变【探究一】同周期元素金属性是否随着原子序数的递增呈现周期性的递变规律?【实验1】镁与冷水和沸水的反应。
【实验2】镁带、铝条分别与盐酸反应。
【探究二】同周期元素非金属性是否随着原子序数的递增呈现周期性的递变规律?【结论】同周期元素,随着原子序数的递增,元素非金属性逐渐增强。
【小结】同周期元素性质递变规律:同周期从左到右,金属性逐渐,非金属性逐渐。
二、元素周期律(1)定义:元素性质随原子序数的递增而呈现出周期性变化的规律。
1.原子的最外层电子排布呈周期性变化。
个→个(除H,He)随着原子序数2.原子半径呈周期性变化。
从左到右,原子半径逐渐。
的递增3.元素化合价呈周期性变化。
正价:→(除O、F)负价:→主族元素:最高正化合价最外层电子数主族序数。
非金属:最高正化合价+∣最低负化合价∣=。
4.元素金属性和非金属性呈现周期性变化。
从左到右,金属性逐渐,非金属性逐渐。
三、元素周期律、元素周期表的应用1、元素的金属性、非金属性与元素在周期表中位置的关系位构性【练习1】X、Y是元素周期表中的两种元素。
下列叙述中能说明X的非金属性比Y强的是A、X原子的电子层比Y原子的电子层数多B、X的氢化物的沸点比Y的氢化物的沸点低C、X的气态氢化物比Y的气态氢化物稳定D、Y的单质能将X从NaX的溶液中置2、预测未知物的位置与性质【练习2】Ra(镭)是原子序数最大的第ⅡA族元素,下列说法不正确的是()A、原子半径是第ⅡA族中最大的B、遇冷水能剧烈反应C、位于第七周期D、Ra(OH)2是两性氢氧化物3、寻找所需物质在能找到制造半导体材料,如;在能找到制造农药的材料,如;在能找到作催化剂,耐高温,耐腐蚀的合金材料。