氨气物性参数
- 格式:docx
- 大小:22.04 KB
- 文档页数:7


氨气理化特性分析氨气(化学式:NH3)是一种无色、有刺激性气味的气体,具有一些独特的理化特性。
以下是对氨气的几个主要理化特性进行分析。
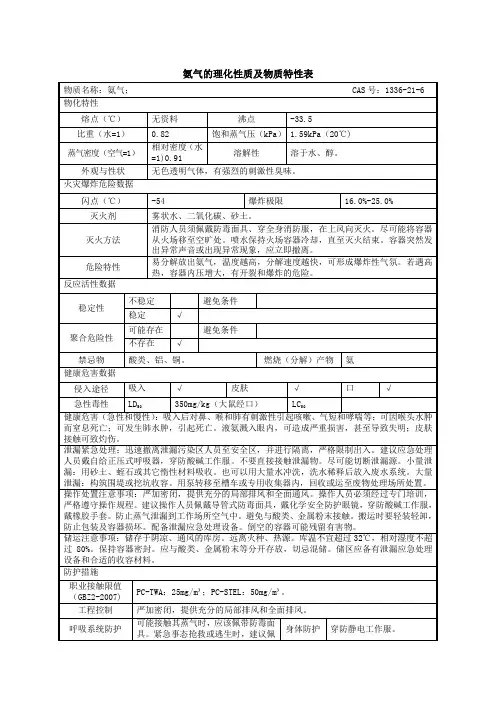
1.氨气的物理性质:-熔点和沸点:氨气的熔点为-77.73℃,沸点为-33.34℃。
这显示氨气在常温下为气体,不易液化。
-密度:氨气比空气轻,其密度为0.7713g/L。
这使得氨气能够在空气中上升,很容易扩散。
- 溶解性和溶解热:氨气在水中具有良好的溶解性,溶解度随温度的升高而增加。
在常温下,氨气的溶解度约为700 mL/L。
氨气与水反应会形成氨水,同时产生大约9.33 kJ/mol的溶解热。
2.氨气的化学性质:-角溶液性:氨气在水溶液中呈碱性,可形成氨水。
这是因为氨气与水反应生成氨氢离子(NH4+)和氢氧根离子(OH-),表现出碱性反应。
-结构反应:氨气是一种强还原剂,可与许多氧化剂反应,如与氯气反应生成氯化胺离子(NH4Cl)。
-与金属的反应:氨气也与许多金属发生反应,形成相应的金属氨合物。
例如,氨气与银离子反应会生成暗色的银氨合物。
-氧化性:尽管氨气通常表现出还原性,但在一些特殊条件下,如与氯气反应或在高温下,它也可以表现出氧化性。
3.氨气的毒性:-氨气是一种有毒气体,对呼吸系统和眼睛有刺激性。
高浓度的氨气会导致眼睛刺痛、咳嗽、呼吸困难等症状,严重时可导致肺水肿和窒息。
-氨气也是一种燃烧性气体,与空气中的氧气能够发生燃烧。
氨气的燃烧产物主要是氮气和水蒸气。
4.氨气的应用:-氨气广泛应用于农业,作为植物的氮源。
氨气可以直接用作氮肥或制成其他氮肥,如尿素。
-氨气也用作工业上的重要原料,例如用于制造硝酸、硫酸和合成纤维等化学品。
-另外,氨气还被用作制冷剂和氨气喷雾剂。
总之,氨气具有一系列独特的理化特性,包括适中的溶解度、角溶液性、还原性和气味刺激性等。
了解氨气的这些特性对于安全处理和使用氨气至关重要。


氨的物理化学性质氨气,Ammonia,NH3,无色气体。
有强烈的刺激气味。
你知道它的物理化学性质吗?接下来店铺为你整理了氨的物理化学性质,一起来看看吧。
氨的物理性质相对分子质量 17.031[1]氨气在标准状况下的密度为0.771g/L临界点132.4℃蒸汽压506.62kPa(4.7℃)熔点-77.7℃;沸点-33.5℃溶解性:极易溶于水(1:700)相对密度(水)0.82(-79℃)相对密度(空气)0.5971自燃点651.1℃临界压力11.2mPa临界体积72.47cm3/mol临界密度0.235g/cm3临界压缩系数0.242液体热膨胀系数,25℃时0.0025 1/℃表面张力,25℃时19.75×10-3 N/m,19.75dyn/cm汽化热,沸点下 1336.97kj/kg,574.9BTU/1b熔化热,熔点下 332.16kj/kg,142.83BTU/1b气体定压比热容cp,25℃时 2.112kj/(kg* k),0.505BTU/(1b·R)气体定容比热容cp,25℃时 1.624kj/(kg* k),0.388BTU/(1b·R)气体比热容比,cp/cv 1.301气体摩尔熵,25℃时 192.67j/(mol*k )气体摩尔生成焓,25℃时 -45.9kj/mol气体黏度,25℃时101.15×10-7Pa *s,101.15μP液体黏度,25℃时 0.135mPa *s,0.082cp燃烧热,25℃(77oF)气态时 18603.1kj/kg,7999.3BTU/1b空气中爆炸低限含量16.1%( φ )空气中爆炸高限含量25%( φ )氨的化学性质(1)跟水反应氨在水中的反应可表示为:NH3+H2O=NH3·H2O[2]一水合氨不稳定受热分解生成氨和水氨水在中学化学实验中三应用①用蘸有浓氨水的玻璃棒检验HCl等气体的存在②实验室用它与铝盐溶液反应制氢氧化铝③配制银氨溶液检验有机物分子中醛基的存在。

氨气的性质知识点总结一、物理性质1. 氨气的化学式为NH3,相对分子质量为17.03。
它是一种无色气体,在常温下呈压缩状态,放出时呈蒸气状。
氨气有刺激性气味,可溶于水,在水中呈弱碱性。
2. 氨气的沸点为-33.34℃,是一种易液化的气体,在低温和高压下可以液化成为氨液。
3. 氨气的密度为0.73克/升,比空气轻,能上升到高处。
所以在一定空气流通情况下,如果泄漏,氨气会迅速上升,易散去。
4. 氨气具有很强的促燃性,能和氧气或氧化剂发生激烈的反应,因此在储存和使用氨气时要十分小心。
二、化学性质1. 氨气是一种具有强还原性的气体,能与氧化剂或氧气发生搏斗反应,放出大量热量。
例如,氨气与氧气反应可生成氮气和水,其中氮气是稳定的氧化物,而水是一种无害的产物。
这种还原性很强的性质使氨气被广泛用作还原剂。
2. 氨气与酸反应时呈现出明显的中和反应,生成盐和水。
由于氨气具有很强的碱性,所以在实验室中,我们通常会用氨气来中和酸性溶液。
3. 氨气具有很强的亲电性,在充分供氧的条件下,它会与许多金属和非金属元素发生化学反应,产生各类氨合物。
4. 氨气能够与醛和酮反应,形成胺醇。
这样的反应通常发生在一些有机化合物的合成中,氨气在有机合成中有着重要的应用价值。
三、毒性和危害性1. 氨气是一种具有强烈刺激性气味的气体,当浓度达到一定程度时,会对眼睛、鼻腔和呼吸道产生刺激作用,引起头晕、恶心、呕吐等症状。
2. 高浓度的氨气对人体呼吸道和粘膜会产生腐蚀作用,引起化学性肺炎,严重时可导致呼吸困难和窒息,甚至会对人体的神经系统和心血管系统产生危害。
3. 氨气对一些金属和材料也具有腐蚀性作用,因此在使用和储存氨气时要严格遵守相关的安全操作规程,做好防护工作,以免造成人员和设施的损害。
综上所述,氨气是一种具有很强化学活性和毒性的气体,但在工业生产和实验室中具有重要的应用价值。
在使用氨气时,需要严格遵守安全操作规程,做好相关的防护措施,以免对人体和环境造成不利影响。

氨⽓的物理化学性质及主要应⽤虽然氨⽓对⼈体有害,但在医药、化肥、国防、轻⼯业⽅⾯均⽤途⼴泛,那么我们就来了解⼀下它的物理化学性质,为什么会有如此⼴泛的应⽤?⼀、氨⽓的物理性质:1、氨⽓是⼀种有刺激性⽓味的⽓体,对⼈体的眼、⿐、喉等有刺激作⽤。
如果不慎接触过多的氨⽓⽽出现病症,要及时吸⼊新鲜空⽓和⽔蒸⽓,并⽤⼤量⽔冲洗眼睛。
2、氨⽓的密度为0.771g/L(标准状况下)。
3、氨⽓很容易液化,在常压下冷却⾄-33.5℃或在常温下加压⾄700KPa⾄800KPa,⽓态氨就液化成⽆⾊液体,同时放出⼤量的热。
液态氨汽化时要吸收⼤量的热,使周围物质的温度急剧下降,所以氨常作为制冷剂。
以前⼀些⽼式冰棍就是利⽤氨⽓制作的4、氨⽓极易溶于⽔,在常温、常压下,1体积⽔能溶解约700体积的氨⽓。
⼆、氨⽓(NH₃)的化学性质:1、NH₃(挥发性)遇HCl(挥发性)⽓体有⽩烟产⽣,可与氯⽓反应。
2、氨⽔(⼀⽔合氨,NH3·H2O)可腐蚀许多⾦属,⼀般若⽤铁桶装氨⽔,铁桶应内涂沥青。
3、NH₃的催化氧化是放热反应,产物是NO,是⼯业制硝酸的重要反应,NH₃也可以被氧化成N₂。
4、在⽔中产⽣少量氢氧根离⼦,呈弱碱性。
5、氨与酸反应⽣成铵盐:NH₃+HCI=NH₄CI6、氨⽓溶于⽔得到氨⽔,氨⽔的主要成分是⼀⽔合氨,但是不能认为⼀⽔合氨就是氨⽔。
⽽且氨⽔成碱性的原因就是⼀⽔合氨在⽔中电离出氢氧根离⼦。
市售氨⽔浓度为25%-28%。
其性质和氨⽓完全不⼀样。
三、氨⽓的主要⽤途包括NH⽤于制氨⽔、液氨、氮肥(尿素、碳铵等)、HNO、铵盐、纯碱,⼴泛应⽤于化⼯、轻⼯、化肥、制药、合成纤维、塑料、染料、制冷剂等,是近现代化⼯的基础原料。
⼤家是否更加了解氨⽓了呢?但你如果有可能接触到氨⽓,千万要注意防护措施。

氨气的知识点总结一、氨气的性质1. 物理性质(1)氨气是一种无色的气体,在室温下呈碱性,有强烈的刺激性气味。
(2)氨气具有较大的相对分子质量(17.03),比空气要轻,因此氨气会向上升。
(3)氨气的密度大约为0.86克/升。
它比空气轻,可在空气中上升,故氨气比空气有向下扩散的倾向。
2. 化学性质(1)氨气是一种碱性气体,它能够和酸反应生成盐和水。
比如,氨气和盐酸反应产生氯化铵。
NH3 + HCl → NH4Cl(2)氨气和氧气反应能够生成氮化合物,比如氧化氮和亚氮化合物。
(3)氨气可作为还原剂,与燃烧在空气中生成氮气和水。
2NH3 + 3O2 → N2 + 3H2O(4)氨气和一些金属盐类反应,生成沉淀或络合物。
二、氨气的制备1. 广义制备方法(1)氨气可以通过尿素热分解反应制备。
尿素经过加热分解,生成氨气和二氧化碳。
(2)氨气可以通过氨水电解法制备。
这是一种工业上常用的制备氨气的方法。
(3)氨气还可以通过氨碱法、氨盐法等方法制备。
2. 工业制备方法(1)氨气的工业制备方法主要是哈伯-玻斯赫过程,该过程是由德国化学家哈伯和玻斯赫于1913年发明。
该方法是将氮气和氢气通过催化剂的作用反应生成氨气。
N2 + 3H2 → 2NH3三、氨气的应用1. 制造化肥氨气被广泛用于制造化肥。
通过氨气的氮元素与氢原子的结合,能够形成含氮的化合物,从而制造氮肥。
氮肥是农业生产中必不可少的一种肥料,可以提高作物的产量和质量。
2. 合成纤维氨气还被用于合成纤维。
利用氨气和其他化学原料进行聚合反应,可以制备出尼龙、涤纶等合成纤维,这些合成纤维具有很好的特性,被广泛用于服装、汽车内饰、工业材料等各个领域。
3. 合成塑料氨气在制造塑料中也扮演着重要的角色。
通过氨气与其他原料进行反应,可以合成出聚丙烯、聚苯乙烯等各种塑料制品,这些塑料制品在日常生活和工业中都有着广泛的应用。
4. 制造药品氨气还可以用于制造一些药品。
比如,氨气可以用于合成氨基酸、氨基酮和氨基糖等有机化合物,这些有机化合物是制造药品的重要原料。


氨水在中学化学实验中三应用
①用蘸有浓氨水的玻璃棒检验HCl等气体的存在
②实验室用它与铝盐溶液反应制氢氧化铝
③配制银氨溶液检验有机物分子中醛基的存在。
2、与酸反应
2NH3+H2SO4===(NH4)2SO4
NH3+HCl===NH4Cl
3NH3+H3PO4===(NH4)3PO4
NH3+CO2+H2O===NH4HCO3
(反应实质是氨分子中氮原子的孤对电子跟溶液里具有空轨道的氢离子通过配位键而结合成离子晶体。
若在水溶液中反应,离子方程式为:
8NH3+3Cl2===N2+6NH4Cl
(黄绿色褪去,产生白烟)
反应实质:2NH3+3Cl2===N2+6HCl
NH3+HCl===NH4Cl
总反应式:8NH3+3Cl2===N2+6NH4Cl
3、与氧气反应
4NH3+3O2==点燃==2N2+6H2O
4、与碳反应
NH3+C=加热=HCN+H2↑(剧毒氰化氢)
5、液氨的自偶电离
液氨的自偶电离为:
2NH3==(可逆)NH2- + NH4+ K=1.9×10^-30(223K)
6、取代反应
取代反应的一种形式是氨分子中的氢被其他原子或基团所取代,生成一系列氨的衍生物。
另一种形式是氨以它的氨基或亚氨基取代其他化合物中的原子或基团,例如;
COCl2+4NH3==CO(NH2)2+2NH4Cl
HgCl2+2NH3==Hg(NH2)Cl+NH4Cl
这种反应与水解反应相类似,实际上是氨参与的复分解反应,故称为氨解反应。
7、与水、二氧化碳。
氨气的物理和用途氨气是一种无色、有刺激性气味的气体,化学式为NH3。
它是一种重要的化学物质,在工业生产和日常生活中有着广泛的应用。
下面将详细介绍氨气的物理性质和用途。
1. 物理性质:氨气的分子量为17.03g/mol,密度为0.771g/L(0,1 atm),熔点为-77.7,沸点为-33.34。
氨气具有较好的溶解性,可溶于水,溶解度随温度的升高而增加。
在水中形成氨水(氨气溶液),氨水呈碱性,能与酸反应生成盐。
2. 用途:2.1. 化肥生产:氨气是制造化肥的重要原料。
通过哈伯-博士过程,将氮气与氢气在催化剂的作用下反应生成氨气。
氨气可以与二氧化碳反应生成尿素,尿素是一种重要的氮肥,广泛应用于农业生产中。
2.2. 冷冻和制冷:由于氨气的低沸点和良好的热传导性能,它被广泛用于冷冻和制冷领域。
氨气可以作为制冷剂在制冷设备中使用,如冰箱、冷库、空调等。
与氟利昂等氯氟烃制冷剂相比,氨气具有环境友好性,不会对臭氧层造成破坏。
2.3. 金属表面处理:氨气可以用于金属表面处理,如氨气渗氮。
在高温下,氨气可以与金属表面反应,使金属表面形成氮化物层,提高金属的硬度、耐磨性和耐腐蚀性。
2.4. 化学合成:氨气在化学合成中起着重要的作用。
它可以用作氨基化合物的合成原料,如合成氨基酸、合成胺类化合物等。
此外,氨气还可以用于合成染料、合成塑料等化学反应中。
2.5. 水处理:氨气可以用于水处理过程中的氯消毒。
在水中加入氯气时,会产生有害的氯化物,而加入氨气可以中和氯气,减少氯化物的生成,提高水的安全性。
2.6. 医药和医疗:氨气在医药和医疗领域也有一定的应用。
例如,氨气可以用于制备药物,如合成抗生素、合成药物中的氨基酸等。
此外,氨气还可以用于医疗设备中,如呼吸机、麻醉机等。
2.7. 环保应用:氨气在环保领域有着重要的应用。
例如,氨气可以用于脱硫过程中,通过与烟气中的二氧化硫反应生成硫酸铵,从而减少大气污染物的排放。
此外,氨气还可以用于废水处理中,通过与废水中的重金属离子反应形成沉淀物,从而净化废水。
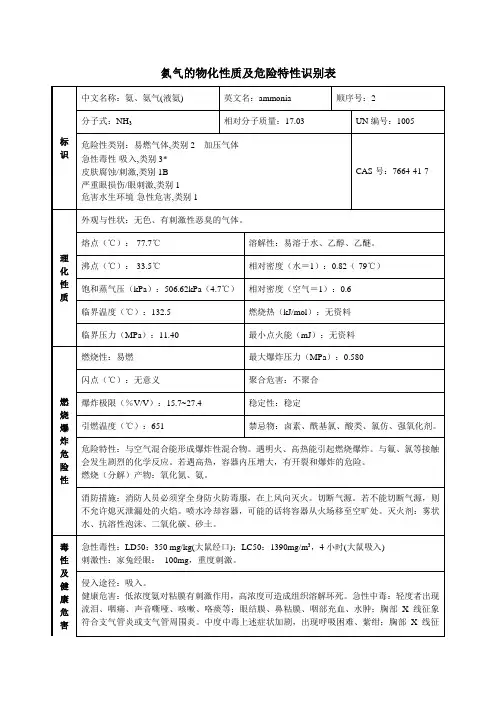
氨的职业危害与预防及氨使用注意事项一、氨气性质氨气,无色气体,有刺激性恶臭味。
分子式NH3。
分子量17.03。
相对密度0.7714g/l。
熔点-77.7℃。
沸点-33.35℃。
自燃点651.11℃。
蒸气密度0.6。
蒸气压1013.08kPa(25.7℃)。
蒸气与空气混合物爆炸极限16~25%(最易引燃浓度17%)。
氨在20℃水中溶解度34%,25℃时,在无水乙醇中溶解度10%,在甲醇中溶解度16%,溶于氯仿、乙醚,它是许多元素和化合物的良好溶剂。
水溶液呈碱性,0.1N水溶液PH值为11.1。
液态氨将侵蚀某些塑料制品,橡胶和涂层。
遇热、明火,难以点燃而危险性较低; 但氨和空气混合物达到上述浓度范围遇明火会燃烧和爆炸,如有油类或其它可燃性物质存在,则危险性更高。
与硫酸或其它强无机酸反应放热,混合物可达到沸腾。
不能与下列物质共存:乙醛、丙烯醛、硼、卤素、环氧乙烷、次氯酸、硝酸、汞、氯化银、硫、锑、双氧水等。
二、氨的职业危害与预防1 氨气危害表现(1)吸入的危害表现。
氨的刺激性是可靠的有害浓度报警信号。
但由于嗅觉疲劳,长期接触后对低浓度的氨会难以察觉。
吸入是接触的主要途径,吸入氨气后的中毒表现主要有以下几个方面。
轻度吸入氨中毒表现有鼻炎、咽炎、喉痛、发音嘶哑。
氨进入气管、支气管会引起咳嗽、咯痰、痰内有血。
严重时可咯血及肺水肿,呼吸困难、咯白色或血性泡沫痰,双肺布满大、中水泡音。
患者有咽灼痛、咳嗽、咳痰或咯血、胸闷和胸骨后疼痛等。
急性吸入氨中毒的发生多由意外事故如管道破裂、阀门爆裂等造成。
急性氨中毒主要表现为呼吸道粘膜刺激和灼伤。
其症状根据氨的浓度、吸入时间以及个人感受性等而轻重不同。
急性轻度中毒:咽干、咽痛、声音嘶哑、咳嗽、咳痰,胸闷及轻度头痛,头晕、乏力,支气管炎和支气管周围炎。
急性中度中毒上述症状加重,呼吸困难,有时痰中带血丝,轻度发绀,眼结膜充血明显,喉水肿,肺部有干湿性哕音。
急性重度中毒:剧咳,咯大量粉红色泡沫样痰,气急、心悸、呼吸困难,喉水肿进一步加重,明显发绀,或出现急性呼吸窘迫综合症、较重的气胸和纵隔气肿等。
氨气物性参数1.别名·xx液氨;Ammonia、Liquid amlllorlia.2.用途氮肥、铵盐、硝酸、尿素、丙烯腈、三聚氰酰胺、丙烯酰胺、氢氰酸、无机试剂、药品、染料、酸性中和剂、橡胶氧化剂、金属表面氮化、制冷剂、半导体用气体、氧化、氮化膜、化学气相淀积、标准气、校正气、在线仪表标准气。
3.制法氢和氮在高温高压时在催化剂的作用下合成而得氨。
4.理化性质分子量:17.031熔点(101.325kPa):-77.7℃沸点(101.325kPa):-33.4℃液体密度(-73.15℃,8.666kPa):729kg/m3气体密度(0℃,101.325kPa):0.7708kg/m3相对密度(气体,空气=1.25℃,101.325kPa):0.597比容(21.1℃,101.325kPa):1.4109m3/kg气液容积比:(15℃,100kPa):947L/L 临界温度:132.4℃临界压力:11277kPa临界密度:235kg/m3 压缩系数:压缩系数压力kPa300K380K420K580K101.330.99060.99660.99780.9997506.630.94630.97850.985l0.99541013.250.88600.95730.97030.9911熔化热(-77.74℃,6.677kPa):331.59kJ/kg气化热(-33.41℃,101.325kPa):1371.18kJ/kg比热容(101.33kPa,300K):Cp=2159.97J/(kg·K)比热比(气体,46.8℃,101.325kPa):CP/Cv=1.307蒸气压(-20℃):186.4kPa(0℃):410.4kPa(20℃):829,9kPa粘度(气体,20℃,101.325kPa):0.00982mPa·s(液体,-33.5℃):0.255mPa·s 表面张力(20℃):21.2mN/m导热系数(100kPa,300K):0.02470 W/(m·K)(液体,10℃):0.501 w/(m·K)折射率(气体,0℃,101.325kPa):1.000383(气体,25℃,101.325kPa):1.空气中可燃范围(20℃,101.325kPa):15%~27%空气中最低自燃点(101.325kPa):690℃氧气中可燃范围(20℃,101.325kPa):14%~79%氧气中化学当量燃烧热:17354 kJ/m3(高) 14361 kJ/m3(低)毒性级别:2(液氨:3级)易燃性级别:1易爆性级别:0火灾危险:中等度氨在常温常压下为具有特殊刺激性恶臭的无色有毒气体,比空气轻。