届高考化学二轮专题复习学案之水的电离和溶液的PH.
- 格式:docx
- 大小:68.06 KB
- 文档页数:9
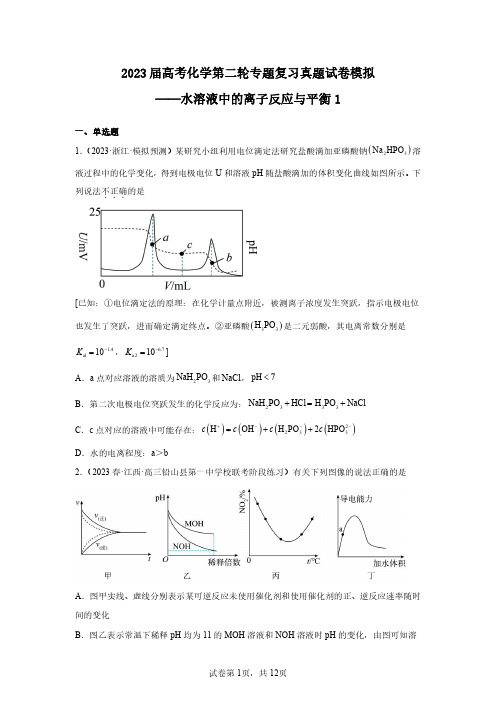
2023届高考化学第二轮专题复习真题试卷模拟——水溶液中的离子反应与平衡1一、单选题[已知:①电位滴定法的原理:在化学计量点附近,被测离子浓度发生突跃,指示电极电位也发生了突跃,进而确定滴定终点。
②亚磷酸(H 1.4al 10K -=, 6.7a 210K -=]A .a 点对应溶液的溶质为32NaH PO 和NaCl ,pHB .第二次电极电位突跃发生的化学反应为:NaHC .c 点对应的溶液中可能存在:()()H OH c c +-=D .水的电离程度:a >b2.(2023春·江西·高三铅山县第一中学校联考阶段练习)有关下列图像的说法正确的是A .图甲实线、虚线分别表示某可逆反应未使用催化剂和使用催化剂的正、逆反应速率随时间的变化B .图乙表示常温下稀释pH 均为11的MOH 溶液和NOH 溶液时pH 的变化,由图可知溶A .()-2.3b K ROH =10B .P 、Q 点对应溶液中()()++c R c H 的值:P Q>C .若将溶液无限稀释,溶液中()(+2-4c R 2c SO ≈D .相同条件下,若改为()124c R SO =0.2mol L -⋅4.(2023秋·浙江宁波·高三统考期末)下列溶液因盐的水解而呈酸性的是A .K SO 溶液B .NaHCO 溶液CA .完全沉淀废液中的2Pb +,I -的效果不如B .z 点,()()(2-2+3sp Q=c CO c Pb <K PbCO ⋅C .()sp 2K PbI 的数量级为1410-A .A -是HA 的共轭碱C .增大pH 过程中,()()A HA c c -的值减小()()HA A 1.0δδ-+=9.(2023·辽宁·模拟预测)难溶物2SrF 可溶于盐酸。
常温下,用A .1L 代表()2+-lgc Sr 与()()+c HF lg c H ⎡⎤⎢⎥⎢⎥⎣⎦的变化曲线B .a 、c 两点的溶液中均存在(2c Sr C .()a K HF 的数量级为710-D .c 点的溶液中存在()(2+-c Sr>c Cl 10.(2023·全国·模拟预测)某元素M(OH)3(s)M 3+(aq)+3OH -(aq)、A .曲线①代表lgc(M 3+)与pH 的关系B .M(OH)3的K sp 为1×10-33.5C .4.5≤pH≤9.3时,体系中元素M 主要以D .M(OH)4-与M 3+在溶液中可以大量共存11.(2023·山东·模拟预测)室温下,向柠檬酸A .C 6H 8O 7的K a1为10−3.13B .曲线b 表示δ(677C H O -)随pH 的变化C .在C 6H 6Na 2O 7溶液中,(677C H O -)>(66C H OD .pH 大于6时,发生的反应主要为2667C H O -12.(2023·辽宁·模拟预测)25℃时,用同一NaOH 溶液,pM[p 表示负对数,M 表示()()-c A c HA 、(c CuA .HA 为一元弱酸,25℃时7.4a K =10-B .线①代表滴定4CuSO 溶液时pM 与溶液C .滴定HA 溶液至x 点时,溶液中()()()()()-++-c HA >c A >c Na >c H >c OH D .滴定4CuSO 溶液至x 点时,改为滴加HA 溶液,沉淀逐渐完全溶解二、多选题A .25℃时,BOH 的电离平衡常数的数量级为10-4B .t=0.5,2c(H +)+c(B +)=2c(OH -)+c(BOH)C .P 1所示溶液:c(Cl -)>0.05mol·L -1D .P 2所示溶液:c(B +)>100c(BOH)14.(2023春·山东滨州·高三统考开学考试)25℃时,用HCl 气体调节0.1mol 体系中微粒浓度的对数值(lgc)与pH 的关系如图1所示(a 、b 、c 、d 线分别对应体系中除下列说法错误的是A .4NH Cl 水解平衡常数的数量级为1010-B .3P 对应溶液;()-1c Cl 0.05mol L-<⋅C .水的电离程度:123P P P <<D .4P 对应溶液:()()()-+4323c Cl =2c NH +2c NH H O⋅三、工业流程题常温下,有关金属离子开始沉淀和沉淀完全的pH 见下表:金属离子3Fe +3Al +2Mg +2Ca +(1)萃取塔中经过______(填写操作名称)可将含酚有机层分离出来。


水的电离溶液的酸碱性与pH 编号28班级组别姓名【学习目标】1、掌握影响水的电离、水的离子积常数的因素。
了解溶液pH的定义及测定方法,2、小组合作讨论,探究关于pH计算的基本方法。
3、以极度的热情,全力以赴投入学习,体验学习的快乐。
【使用说明】利用一节课,认真阅读课本完成学案,下课收齐。
下节课修改10 分钟后结合错题统计讨论10分钟,师生探究、学生展示20分钟,巩固落实5分钟。
标有★★的B层可不做,标有★或★★的C层可不做。
【课前导学】一、水的电离和水的离子积常数Kw1、水是一种极弱的电解质:电离方程式为,△H 0,平衡常数表达式为________________________25℃(常温)的纯水中:c(H+)= _____ ,c(OH-)= ,pH = ,Kw =2、Kw不仅适用于纯水,还适用于任何稀的水溶液。
即不论酸、碱、盐的水溶-,且[H+][OH-]=Kw,常温下Kw = 液中均存在...H.+ 和.OH..___________,室温下(20℃)Kw一般也取这个数值。
[练习1]、(1)某温度下,纯水的c(H+)=2.0×10-7mol/L,则此时的c(OH-)=_______________;若温度不变,滴入稀硫酸使c(H+)=5.0×10-7mol/L, 则c(OH-)=_______________(2)若100℃时纯水电离出的H+浓度为 1.0×10-6mol/L,此时Kw = ,pH= ;pH=2的硫酸溶液温度由25℃升高到100℃,pH = ______ ;pH=12的氢氧化钠溶液由25℃升高到100℃,pH = ______3、影响水的电离、Kw的因素:[练习2]、25℃时,水的电离达到平衡:H 2O H+ + OH-△H >0,下列叙述正确的是()A、向水中加入稀氨水,平衡逆向移动,c(OH-)降低B、向水中加入少量硫酸氢钠固体,c(H+)增大,K W不变C、向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)不变D、将水加热,K W增大,pH 不变★[练习3]、25℃时pH=3的盐酸和氯化铁溶液中由水电离出的H+浓度之比是,pH=10的烧碱溶液和纯碱溶液中由水电离出的OH-浓度之比是【小结】(1)影响水的电离的因素:(2)影响Kw的因素:二、溶液的酸碱性与pH值1、溶液的酸碱性取决于的相对大小2、溶液的pH 数学表达式:3、溶液酸碱性与pH判断① c(H+)越大,c(OH-)越,pH越,溶液酸性越,碱性越;pH相同的酸(或碱),酸(或碱)性越弱,其物质的量浓度越②pH相同的强酸和弱酸溶液,加水稀释相同倍数,则溶液pH变化大,碱也如此。

2021届高考化学二轮优选题:水的电离和溶液的酸碱性及答案专题:水的电离和溶液的酸碱性一、选择题1、准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.100 0 mol·L-1 NaOH 溶液滴定。
下列说法正确的是()A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小2、喷墨打印机的墨汁的pH为7.5~9.0。
当墨汁喷在纸上时,与酸性物质作用生成不溶于水的固体。
由此可知()。
①墨汁偏碱性②墨汁偏酸性③纸张偏酸性④纸张偏碱性A.①③B.②④C.①④D.②③3、313 K时,水的K W=3.0×10-14,则在313 K时,c(H+)=10-7 mol·L-1的溶液()A.呈酸性B.呈中性C.呈碱性D.无法判断4、准确移取20.00 mL某待测HCl溶液于锥形瓶中,用0.1000 mol·L-1 NaOH溶液滴定,下列说法正确的是()A.滴定管用蒸馏水洗涤后,装入NaOH溶液进行滴定B.随着NaOH溶液滴入,锥形瓶中溶液pH由小变大C.用酚酞作指示剂,当锥形瓶中溶液由红色变无色时停止滴定D.滴定达终点时,发现滴定管尖嘴部分有悬滴,则测定结果偏小5、以下离子①H+、②Cl-、③Al3+、④K+、⑤SO2-4、⑥OH-、⑦NO-3、⑧NH+4中,基本上不影响水的电离平衡的是()A.①③⑤⑦⑧B.②④⑥⑦C.②④⑤⑦D.②④⑥⑧6、已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO2-4。
某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。
对于该溶液,下列叙述中不正确的是()A.该温度下加入等体积pH=12的NaOH溶液可使反应后的溶液恰好呈中性B.水电离出来的c(H+)=1×10-10 mol·L-1C.c(H+)=c(OH-)+c(SO2-4)D.该温度高于25 ℃7、一定温度下,下列溶液的离子浓度关系式正确的是()。

水的电离和溶液的pH【考点透视】一、考纲指要1.了解水的电离和水的离子积2.影响水的电离平衡的因素3.溶液的酸碱性和pH的关系4.掌握pH的有关计算二、命题落点本节的命题落点:水的电离和影响水电离的因素。
溶液的pH及pH的测量方法。
判断和表示溶液的酸碱。
有关溶液及混合溶液的pH的有关计算。
酸碱指示剂的变色范围。
近几年出现了反应后有关溶液的pH的计算及以字母表示溶液的pH值的计算,在此类计算中突出了运用数学工具解决化学问题的能力。
【典例精析】例1:有人曾建议用AG表示溶液的酸度(acidity grade),AG的定义为AG=lg[C (H+)/C(OH-)]。
下列表述正确的是()A.在25℃时,若溶液呈中性,则pH=7,AG=1B.在25℃时,若溶液呈酸性,则pH<7,AG<0C.在25℃时,若溶液呈碱性,则pH>7,AG>0D.在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH)解析:本题考查接收和同化新信息能力。
A项,溶液呈中性,表明c(H+)=c(OH-)=1×10-7mol/L,pH=7,因为c(H+)/c(OH-)=1,AG=0,A项错误;B项,溶液呈酸性,c(H+)>c(OH-),pH<7,因为c(H+)/c(OH-)>1,所以AG>0,B项不正确;C项,溶液呈碱性,c(H+)/c(OH-)<0,pH>7,AG<0,C项错误;D项,pH=-lg[c(H+)]=-lg[Kw/c(OH-)]=14+lg[c(OH-)],lg[c(OH-)]=pH-14,AG=lg[c(H+)/c(OH-)]=lg[c(H+)]-lg[c(OH-)]=14-2pH=2(7-pH).答案:D例2:已知液氨的性质与水相似,25℃时,NH3 + NH3 NH4+ + NH2-,NH4+离子的平衡浓度为1×10-15mol/L,则下列说法中正确的是()A.在液氨中加入NaNH2可使液氨的离子积变大B.在液氨中加入NH4Cl可使液氨的离子积减小C.在此温度下液氨的离子积为1×10-30D.在液氨中放入金属钠,可有生成NaNH2解析:本题考查对水的离子积理解与迁移能力。

水溶液中的离子平衡1.数形结合思想应用——分布系数曲线真题研究1.(2017·全国卷Ⅱ,12)常温下,改变0.1 mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数δ(X)随pH的变化如图所示[已知δ(X)=c(X)c(H2A)+c(HA-)+c(A2-)]。
下列叙述错误的是()A.pH=1.2时,c(H2A)=c(HA-)B.lg[K2(H2A)]=-4.2C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)D.pH=4.2时,c(HA-)>c(A2-)>c(H+)2.(2022·辽宁,15)甘氨酸(NH2CH2COOH)是人体必需氨基酸之一。
在25 ℃时,NH+3CH2COOH、NH+3CH2COO-和NH2CH2COO-的分布分数[如δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]与溶液pH关系如图。
下列说法错误的是()A.甘氨酸具有两性B.曲线c代表NH2CH2COO-C.NH+3CH2COO-+H2O NH+3CH2COOH+OH-的平衡常数K=10-11.65D.c2(NH+3CH2COO-)<c(NH+3CH2COOH)·c(NH2CH2COO-)3.(2020·全国卷Ⅰ,13)以酚酞为指示剂,用0.100 0 mol·L-1的NaOH溶液滴定20.00 mL未知浓度的二元酸H2A溶液。
溶液中,pH、分布系数δ随滴加NaOH溶液体积V NaOH的变化关系如下图所示。
[比如A2-的分布系数:δ(A2-)=c(A2-)c(H2A)+c(HA-)+c(A2-)]下列叙述正确的是()A.曲线①代表δ(H2A),曲线②代表δ(HA-)B.H2A溶液的浓度为0.200 0 mol·L-1C.HA-的电离常数K a=1.0×10-2D.滴定终点时,溶液中c(Na+)<2c(A2-)+c(HA-)模拟演练1.(2022·福建漳州一模)边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液,水溶液中H2SO3、HSO-3、SO2-3的分布系数δ随pH的变化关系如图所示。
水的电离和溶液的PH考纲要求1.水的离子积及水电离平衡的影响因素;2.溶液的酸碱性及溶液的pH;3.pH的相关计算.重难点学习内容知识要点:一、水的电离1.水的电离平衡及平衡常数:水是一种极弱的电解质,能能弱的电: ,25℃时,c(H+)=c(OH-)= ,水的离子积KW= ,理解KW时要注意几点:2.影响水电离平衡的因素:【例1】当温度为95℃时,纯水中H+的物质的量浓度为10-6mol/L。
若将0.01mol的NaOH固体溶解在95℃的水中配成1L的溶液,则溶液中由水电离出的H+的浓度为()A.10-6mol/L B.10-10mol/L C.10-8mol/LD.10-12mol/L二、溶液的酸碱性和pH1、溶液的酸碱性:取决于溶液中c(OH-)与c(H+)的相对大小。
2、溶液的pH:溶液中c(H+)的负对数,适用于稀溶液。
(1)pH的测定方法:pH试纸、酸碱指示剂、pH计等。
(2)常用酸碱指示剂及其变化范围:【例2】下列溶液肯定是酸性的是()A.含H+的溶液 B.能使酚酞显色的溶液C.pH<7的溶液 D.c(OH-)<c(H+)的溶液三、溶液pH的相关计算(各类情况分析运用)【例3】将pH为5的硫酸溶液稀释500倍后,溶液中c(SO42-)和c(H+)的比值约为()A.1:1 B.1:2 C.1:10 D.10:1【例4】常温时,向pH为2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是()A.pH为12的Ba(OH)2溶液 B. pH为12的氨水C.0.005mol/L的NaOH溶液 D.0.05mol/L的BaCl2溶液随堂练习:1.常温下,某溶液中由水电离产生的c(H+)、c(OH-)满足c(OH-)×c(H+)=1×10-24,则下列各组离子在该溶液中一定可以大量共存的是()A.K+、Na+、AlO2-、Cl- B.Na+、Cl-、SO42-、HCO3-C.NH4+、Na+、NO3-、SO42-D.Ba2+、Na+、NO3-、Cl-2.已知水分子间会通过分子间作用力形成“缔合分子”,如nH2O(H2O)n,下列关于水的说法中错误的是()A.25℃时,纯水中c(H+)=10-7mol/LB.温度升高时,水分子间的缔合作用会减弱C.加入CaO,平衡向左移动,水分子数目增加D.水是一种难电离的弱电解质3.已知弱电解质的电离度(α)等于溶液中已电离的弱电解质分子数与弱电解质分子总数之比。
2020届高考化学二轮复习专项测试专题十 考点一 水的电离和水的离子积常数(1)1、下列操作中,能使电离平衡H 2O H ++OH -正向移动且溶液呈酸性的是( )A.向水中加入NaHSO 4溶液B.向水中加入Al 2(SO 4)3溶液C.向水中加入Na 2CO 3溶液D.将水加热到100℃,使水的pH=62、向水中分别加入下列溶液,对水的电离平衡不产生影响的是( ) A. 4KHSO 溶液 B. 3KHCO 溶液 C. KHS 溶液 D. KI 溶液3、将① +H 、② Cl -、③ 3Al +、④ K +、⑤ 2S -、⑥ OH -、⑦ 3NO -、⑧ 4NH +分别加入2H O 中,基本上不影响水的电离平衡的是( ) A.① ③ ⑤ ⑦ ⑧B.② ④ ⑦C.① ⑥D.② ④ ⑥ ⑧4、水的电离过程为H 2O H ++OH -,在不同温度下其离子积常数为1414W W (25) 1.010,(35) 2.110o o K C K C --=⨯=⨯。
则下列关于纯水的叙述正确的是( )A. ()c H +随着温度升高而降低 B.在35℃时, ()()c H c OH +->C.25℃时水的电离程度大于35℃时水的电离程度D.水的电离是吸热的5、25C ︒时,水的电离达到平衡:2H OH OH +-+;ΔH>0,下列叙述正确的是( )A .向水中加入稀氨水,平衡逆向移动,c(OH )-降低B .向水中加入少量固体硫酸氢钠,c(H )+增大,W K 不变C .向水中通入HCl 气体,平衡逆向移动,溶液导电能力减弱D .将水加热,pH 不变,W K 增大6、水的电离平衡曲线如下图所示。
下列说法正确的是( )A .图中对应点的温度关系为:a >bB .水的电离常数K W 大小关系为:b >dC .温度不变,加入少量NaOH 可使溶液从c 点变到a 点D .b 点对应温度下,将pH=2的H 2SO 4与pH=10的NaOH 溶液等体积混合后,溶液显酸性 7、如图表示水中+(H )c 和-(OH )c 的关系。
2010届高考化学二轮专题复习精品学案之水的电离和溶液的PH专题目标:1 •通过对水的电离、离子积、pH定义等重要知识和方法迁移应用的练习,提高认知能力;2 •灵活解答水的电离平衡的相关问题;3 •掌握混合溶液pH计算的方法,并能运用数学工具解决一些有关pH计算的综合问题4 •培养学习过程中探究、总结的习惯。
知识点一:水的电离【例1】(1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 ——NH4++NH2-据此判断以下叙述中错误的是( )A •液氨中含有NH3、NH4+、NH2-等微粒+ -B .一定温度下液氨中C(NH 4 ) • C(NH 2 )是一个常数—C.液氨的电离达到平衡时C(NH 3)= C(NH 4 ) = C(NH 2 )+ -D .只要不加入其他物质,液氨中C(NH 4 ) = C(NH 2 )(2)完成下列反应方程式①在液氨中投入一小块金属钠,放出气体②NaNH 2溶于水的反应_____________________________________________③类似于"H+OH =H2。
"的反应---------------------------------------解析:此题要求掌握水自偶的实质(水分子电离产生的日+与H2O结合形成H30+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生『和NH2 ,H+与NH3 结合生成NH4+,液氨电离产生等量的NH2 —与NH4+,—定温度下离子浓度乘积为一常数;NH4+类似于H +, NH2—类似于OH —。
具备上述知识后,就可顺利完成解题。
答案:(1) C(2)① 2Na+2NH3=H2f +2NNH2②NaNH2+H2O=NaOH+NH 3 M NH2—+H2O=OH —+NH3 f③NH2—+NH4+ =2NH3 1或NH4Cl+NaNH 2=2NH 3? +NaCl练习:(1)纯硫酸、乙醇中也存在微弱的电离,写出其电离方程式硫酸----------------------------------------------乙醇-----------------------------------------------(2)乙醇钠中加水的反应------------------------------------------------乙醇钠和NH 4CI的反应-------------------------------------知识点二:水的离子积【例2】某温度下纯水中C(H+) = 2 X 10-7 mol/L,则此时溶液中的C(OH-) = _______________ 。
丄6若温度不变,滴入稀盐酸使C(H ) = 5 X 10- mol/L,则此时溶液中的C(OH-)=解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。
根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH -)。
- + - 7答案:纯水中C(OH ) = C(H ) = 2 X 10 mol/L+ - -7 -7 -14Kw = C(H )• C(OH ) = 2 X 10 X 2 X 10 = 4 X 10-+ -14 - 6 - 9稀盐酸中C(OH ) = Kw / C(H ) = (4 X 10 ) / (5 X 10 ) = 8 X 10 mol/L【例3】.难溶化合物的饱和溶液存在着溶解平衡,例如:+ —+ 2—AgCl(s) -一Ag +Cl ,Ag2CrO4(s) ——2Ag +CrO4,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
, + - -10已知:Ksp(AgCI)=[Ag ][Cl ]=1.8 X 10+ 2 2- -12Ksp(Ag 2CrO4)=[Ag ] [CrO4 ]=1.9 X 10现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:(1) Cl-和CrO42-中哪种先沉淀?(2) 当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)解析:(1 )当溶液中某物质离子浓度的乘积大于Ksp时,会形成沉淀。
几种离子共同沉淀某种离子时,根据各离子积计算出所需的离子浓度越小越容易沉淀。
(2)由Ag2CrO4沉淀时所需Ag+浓度求出此时溶液中Cl—的浓度可判断是否达到有效分离。
解答:(1) AgCl 饱和所需Ag+浓度[Ag+]1=1.8 X 10-7摩/升h 9 x10」2Ag 2CrO4 饱和所需Ag +浓度[Ag +]2= =4.36 X 10-5摩/升0.001[Ag+]1<[Ag+]2, Cl-先沉淀。
_J018 X 10 6 5(2) Ag2CrO4开始沉淀时[Cl-]= 一----------- =4.13 X 10 <10,所以能有效地分离。
4.36 00知识点三:水的电离平衡的移动—12【例4】:某溶液中由水电离出来的C(OH )=10- mol/L ,则该溶液中的溶质不可能是()A、HClB、NaOHC、NH4CID、H2SO4解析:由水电离反应式知:此溶液水电离产生的C(H +)=C(OH —) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。
NH4CI不可能电离产生+H。
解答:C下列两题为上题的变式,分析一下变在何处?解题方法、思路与上题是否一样?差异何在?(1)室温下,在纯水中加入某物质后,测得溶液中由水电离产生的C(H+)=10-12mol/L , 则加入的物质可能是(假设常温下碳酸、氢硫酸的第一步电离度为0.1% )()A、通入CO2B、通入H2SC、通入NH3D、加入NaHSO4(2)某溶液中水电离产生的C(H+)=10-3mol/L ,,该溶液中溶质可能是( )①Al2(SO4)3 ②NaOH ③ NH4CI ④ NaHSO4A、①②B、①③C、②③D、①④【例5】能促进水的电离,并使溶液中C(H +)>C(OH —)的操作是( )(1)将水加热煮沸 (2)向水中投入一小块金属钠(3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矶晶体 (6)向水中加入NaHCO 3固体(7)向水中加NaHSO q固体A 、( 1)( 3)( 6)( 7)B 、( 1)( 3)( 6)C 、( 5)( 7)D 、( 5)解析:本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何 (C(H +)与C(OH —)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。
解答:D规律小结: 酸、碱:抑制水的电离 1.酸碱盐对水的电离平衡的影响- 一电离后显酸性的:抑制水的电离。
如:HSO 4 (只电离)、出卩04—(电离强于 ] 水解)盐:•一电离后水解的:促进水的电离电离后显中性、不水解的:无影响2.知识点四:pH 的定义方法【例6】、下列溶液,一定呈中性的是()A. 由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液B. [H +]=1 >10-7mol L -1 的溶液C. pH=14-pOH 的溶液D. pH=pOH 的溶液(2000年化学试测题)解析:此题要求将教材中定义 pH 方法迁移应用于表示 pOH 以及pH 与pOH 的关系,根据 pH 的定义 方法,可定义 pOH= — lgC(OH —),将室温下水的离子积的表达式 C(H +) >C(OH —)=10—14两边取负对数,一lgC(H +) —|gC(OH —)= — lg10—14,整理得 pH+pOH=14。
应用所得关系式分析可得答案。
解答:D点评:pOH= — lgC(OH )、pH+pOH=14两个关系式及其应用均不在教学大纲和考纲范围内, 我们不一定要掌握,但将教材中的知识、方法加以迁移应用,进行探究发现是教学大 纲和考纲提出的能力要求。
此题作为全国高考化学测试题具有重要的指导意义,值得大家认真去领悟,在随后的2001年上海高考题以及 2002年全国理科综合高考题中又 出现了类似的题目。
则下列叙述正确的是A 中性溶液的AG = 0B 酸性溶液的AG V 0为更好地表示溶液的酸碱性,科学家提出了酸度(AG )的概念,AG = lgcH cOH 一,C 常温下0」mol/L 氢氧化钠溶液的 AG = 12D 常温下0.lmol/L 盐酸溶液的 AG = 12( 2001年上海) 有人曾建议用AG 表示溶液的酸度下列表述正确的是 在25C 时, 在25C 时, 在25C 时, 在25C 时, A B C D (acidity arede ), AG 的定义为 AG = Ig ([H j/[OH _])。
若溶液呈中性,则 若溶液呈酸性,则 若溶液呈碱性,则 溶液的pH 与AG 的换算公式为 AG = 2(7 — pH) (2002理科综合) pH = 7, AG = 1 pH V 7, AG V 0 pH > 7, AG > 0 知识点五:溶液pH 的计算 【例7】室温下将n 体积pH=10和m 体积pH=13两种NaOH 溶液混合得pH=12的NaOH 溶液,贝U n : m= --------------------------------解析:此题是关于两种不反应的溶液混合后溶液 列式求解C(H +)=1O -10mol/L +-13C(H )=10 mol/L + -12 C(H )=10 mol/L-110 m = (n+m) W n : m = 100 : 11有关混合溶液的pH 计算,题设条件可千变万化,正向、逆向思维,数字与字母 交替出现,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。
对于溶液 的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH 应介于两种溶液的 pH 之间,因而酸、碱溶液无论加多少水稀释, 其最终pH 均不 可能等于纯水的pH (即常温不可能为 7)。
混合溶液pH 的计算方法也很简单,即设法求出混合溶液的 碱性,则必须先求出溶液的 C(OH —),然后再换算为C(H +)或按 :此题若按照 H +守恒求解,是什么结果?【例8】25(C ,若10体积的某强碱溶液与 1体积的某强酸溶液混合后, 合之前,该碱的pH 与强酸的pH 之间该满足的关系是 ____________ 分析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中 n(H +)与 碱中n(OH -)相等,故有C(H +)酸 V 酸==C(OH -)碱V 碱,由此关系列式可求得结果。