电解池的计算专题
- 格式:pdf
- 大小:55.82 KB
- 文档页数:2



微专题4 电化学中多池装置及电解的相关计算一、多池装置 1.判断电池类型(1)有外接电源时,各电池均为电解池。
(2)无外接电源,如燃料电池、铅酸蓄电池在电池中作电源,其他均为电解池。
(3)无外接电源,有活泼性不同的电极的为原电池,活泼性相同或均为惰性电极的为电解池。
(4)根据电极反应现象判断。
2.常用解题步骤↓↓二、电解的相关计算 1.计算的原则(1)阳极失去的电子数等于阴极得到的电子数。
(2)串联电路中通过各电解池的电子总数相等。
(3)电源输出的电子总数和电解池中转移的电子总数相等。
2.计算的方法(1)得失电子守恒法计算:用于串联电路、通过阴、阳两极的电量相同等类型的计算,其依据是电路上转移的电子数相等。
(2)总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。
(3)关系式计算:借得失电子守恒关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。
如电路中通过4 mol e -可构建如下关系式:4e -~2Cl 2(Br 2、I 2)~O 2~4H +~4OH -~2H 2~2Cu ~4Ag ~4n M阳极产物 阴极产物 (式中M 为金属,n 为其离子的化合价数值)3.计算的步骤(1)正确书写电极反应式(要注意阳极材料)。
(2)当溶液中有多种离子共存时,要确定放电离子的先后顺序。
(3)最后根据得失电子守恒进行相关的计算。
例1以惰性电极电解CuSO4溶液,若阳极上生成的气体的物质的量为0.010 mol,则阴极上析出Cu的质量为()A.0.64 g B.1.28 gC.2.56 g D.5.12 g答案 B解析以惰性电极电解CuSO4溶液,在阳极上氢氧根离子放电生成氧气,阳极电极反应式为4OH--4e-===2H2O+O2↑;在阴极上铜离子得到电子析出金属铜,电极反应式为2Cu2++4e-===2Cu。
根据得失电子守恒得到:O2~4e-~2Cu0.010 mol0.020 mol所以阴极析出铜的质量m(Cu)=0.020 mol×64 g·mol-1=1.28 g,B项正确。
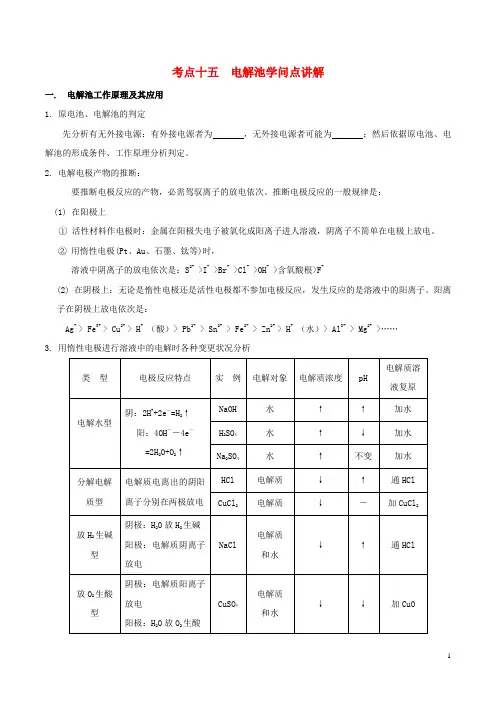
考点十五电解池学问点讲解一. 电解池工作原理及其应用1. 原电池、电解池的判定先分析有无外接电源:有外接电源者为,无外接电源者可能为;然后依据原电池、电解池的形成条件、工作原理分析判定。
2. 电解电极产物的推断:要推断电极反应的产物,必需驾驭离子的放电依次。
推断电极反应的一般规律是:(1) 在阳极上①活性材料作电极时:金属在阳极失电子被氧化成阳离子进人溶液,阴离子不简单在电极上放电。
②用惰性电极(Pt、Au、石墨、钛等)时,溶液中阴离子的放电依次是:S2- >I- >Br- >Cl- >OH- >含氧酸根>F-(2) 在阴极上:无论是惰性电极还是活性电极都不参加电极反应,发生反应的是溶液中的阳离子。
阳离子在阴极上放电依次是:Ag+ > Fe3+ > Cu2+ > H+(酸)> Pb2+ > Sn2+ > Fe2+ > Zn2+ > H+(水)> Al3+ > Mg2+>……3. 用惰性电极进行溶液中的电解时各种变更状况分析典例1(2025届内蒙古赤峰二中高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O 2Al(OH)3+3H2D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D典例2(2025届内蒙古自治区赤峰其次中学高三上学期其次次月考)某化学课外活动小组拟用铅蓄电池进行电絮凝净水的试验探究,设计的试验装置如图所示,下列叙述正确的是A. Y 的电极反应: Pb-2e- = Pb2+B.铅蓄电池工作时SO42-向 Y 极移动C.电解池的反应仅有2Al+6H2O2Al(OH)3+3H2↑D.每消耗 103.5 gPb ,理论上电解池阴极上有0.5 molH2生成【答案】D二. 电解原理在工业生产中的应用1.电解精炼反应原理(电解精炼铜)阳极(粗铜,含Fe、Zn、C等):Cu-2e—=Cu2+,阴极(纯铜):Cu2++2e—=Cu工作一段时间后,溶液中电解质的成分CuSO4、ZnSO4、FeSO4,Cu2+的浓度减小。

电解池的构成和电解过程的计算在化学实验和工业生产中,电解是一种重要的化学过程。
而电解过程中所使用的电解池的构成和计算是我们需要详细了解和学习的内容。
本文将介绍电解池的构成以及针对电解过程的计算方法。
一、电解池的构成电解池是由两个电极和一个电解质溶液组成的。
电极分为阳极和阴极,电解质溶液则是通过电解质质量进入电解池,同时要保持电解质离子的平衡。
1. 阳极阳极是电解池中氧化反应发生的地方,通常由活泼的金属或金属氧化物构成。
阳极上的离子接受电子,发生氧化反应。
例如,在氯化钠的溶液中,阳极可以是铂或铂涂层的钛。
2. 阴极阴极是电解池中还原反应发生的地方,通常由惰性金属或还原性金属构成。
阴极上的离子释放电子,发生还原反应。
以氯化钠溶液为例,阴极可以是银或铜。
3. 电解质溶液电解质溶液由可导电性的盐酸、硫酸、氯化钠等物质组成。
电解质溶液中的离子在电解过程中起到承载电流的作用。
水也可以用作电解质,但通常需要在水中加入少量的酸或碱来增加导电性。
二、电解过程的计算在电解过程中,我们常常需要计算一些重要参数,如电解时间、电解量、理论产物等。
下面将详细介绍这些计算方法。
1. 电解时间电解时间可以通过下式计算得出:电解时间 = 电解物的物质的量 / 电流强度其中,电解物的物质的量可以通过摩尔质量和质量计算得出,电流强度可以通过电流表测量得出。
2. 电解量电解量是指在电解过程中氧化或还原的物质的量。
电解量可以通过下式计算得出:电解量 = 电流强度 * 时间要注意,电流强度必须用安培表示,时间必须用秒表示。
3. 理论产物在电解过程中,根据电解质和电流的不同,产生的理论产物也不同。
可以根据产生离子的标准电极电位来预测产物。
例如,在氯化钠溶液中,当电流通过电解池时,氯离子在阳极上被氧化成气体,而钠离子在阴极上被还原成金属钠。
需要注意的是,实际电解过程中可能会存在其他的反应发生,使得产物与理论产物有所不同。
这取决于溶液中存在的杂质以及氧化还原反应的特性。

关于电解计算的基本方法解题思路及题型归纳1根据电子守恒法计算:依据是电路中转移的电子数目相等。
用于串联电路、阴阳两极产物、正负极产物、电荷量等类型的计算。
2根据总反应式计算:先写出电极反应在写出总反应式,根据总反应式比例计算。
3根据关系式计算:由电子守恒关系建立已知量与未知量之间的比例关系。
常见微粒间的计量关系式为:4e -~4H +~4OH -~4Cl -~4Ag +~2Cu 2+~2H 2~O 2~2Cl 2~4Ag~2Cu~2H 2O四、串联电路的电解例7.把两个电解槽串联起来如图示,电解一段时间后,铜阴极的质量增加了0.192g,金属X 阴极质量增加了0.195g,已知X 的相对原子质量为65,求X 离子所带电荷数?练习1.有两只串联的电解池,甲池盛有CuSO 4溶液,乙池盛有某硝酸盐溶液,用惰性电极电解,当甲池的阴极上析出1.6gCu 时,乙池的阴极上析出0.6g 固体,则乙池的溶质可能是 ( )A .NH 4NO 3B .Al(NO 3)3C .Cu(NO 3)2D .Mg(NO 3)22.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1molCu(OH)2后恰好恢复到电解前的浓度和pH。
则电解过程中转移的电子数为()A.0.1mol B.0.2molC.0.3mol D.0.4mol3.[2013·兰州模拟]用铂作电极电解500mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成11.2L标准状况下的气体,原溶液中Cu2+的物质的量浓度为()A.0.5mol/L B.1mol/LC.2mol/L D.无法确定4、用铂电极电解CuSO4溶液,当阴极端发现有气体产生时,继续再通电一会,则加入下面哪种物质可能使电解后的溶液恢复成原来浓度和体积的是A.无水CuSO4 B.CuOC.Cu(OH)2 D.CuCO35、用Pt电极电解VmL某二价金属硫酸盐溶液,当阴极有mmg金属析出时,溶液pH值由6.5变为A6、将7轴表示在电极上通过的电子的量,则Y轴不可能表示ABCD8、(9分用图所示的装置进行电解。





2020届届届届届届届届届——届届届届届届届届届一、单选题(本大题共23小题,共46分)1.如图是一种可充电锂电池,反应原理是4Li+FeS2⇌Fe+2Li2S,LiPF6是电解质,SO(CH3)2是溶剂。
下列说法正确的是()A. 放电时,a 极被还原B. 放电时,电解质溶液中PF6−向b极区迁移C. 充电时,b 极反应式为Fe+2Li2S−4e−=FeS2+4Li+D. 充电时,a 极连接电源正极【答案】C【解析】解:该原电池中,Li易失电子作负极,所以a是负极、b是正极,负极反应式为Li−e−=Li+,LiPF6是电解质,则正极反应式为FeS2+4Li++4e−=Fe+2Li2S,充电时是电解池反应原理,与原电池刚好相反,A、装置图分析可知放电时是原电池反应原理,a极为原电池负极,发生氧化反应,Li 被氧化,故A错误;B、放电时是原电池反应原理,原电池中阴离子向负极移动,原电池中a为负极,所以PF6−向a极区迁移,故B错误;C、充电时是电解原理,b电极为阳极,阳极上发生失电子的氧化反应,电极反应式为Fe+2Li2S−4e−=FeS2+4Li+,故C正确;D、充电时是电解原理,a极为电解池的阴极,连接电源负极,故D错误。
故选:C。
本题考查化学电源新型电池,为高频考点,侧重考查原电池原理,把握正负极判断、电子移动方向、电极反应式的书写是解本题关键,难点是电极反应式的书写,题目难度不大。
2.下列所示物质的制备方法合理的是()A. 实验室从海帶中提取单质碘取样→灼烧→溶解→过滤→萃取→蒸馏B. 金红石(主要成分TiO2)为原料生产金属Ti:金红石、焦炭C. 从卤水中(溶质主要是MgCl 2)提取Mg 卤水→Ca(OH)2Mg(OH)2→盐酸MgCl 2(aq) →加热蒸干MgCl 2(s) →熔融电解MgD. 由食盐制取漂粉精NaCl(ag) →电解Cl2→澄清石灰水漂粉精【答案】B 【解析】解:A.海带中碘以离子存在,需要氧化为单质,则需要氧化后萃取,故A 错误;B.TiO 2、C 、Cl 2反应生成TiCl 4,稀有气体保护下Mg 还原TiCl 4生成Ti ,可实现转化,故B 正确;C.加热促进氯化镁的水解,且生成盐酸易挥发,则MgCl 2(aq)→加热蒸干MgCl 2(s)不能实现,故C 错误;D.石灰水的浓度太低,应选氯气与石灰乳制备漂粉精,故D 错误;故选:B 。
常考点高考题——电解计算电解始终贯穿着电量的守恒关系,即外电路上电子流动数目 = 电极被氧化所失去的电子数=阴、阳离子在电极上放电的失去或得到的电子数。
因此,利用电子得失总数相等关系(或宏观上的总价数相等关系)来计算是一般的方法。
当然,有些题则可用一些公式或电解规律来技巧解题。
25.用两支惰性电极插入500 mL AgNO 3溶液中,通电电解。
当电解液的pH 从6.0变为3.0时(设电解时阴极没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是(MCE91) ( D )A. 27 mgB. 54 mgC. 108 mgD. 216 mg解析:由规律4知,AgNO 3溶液电解后溶液产生酸,产生的浓度可由pH 差来计算,n e =n (H +)=10-3 mol / L ×0.5 L =5×10-4 mol ,m (Ag)=1e n ×M =5×10-4 mol ×108 g / mol =0.054 g =54 mg 。
D 正确。
22.将质量分数为0.052(5.2%)的NaOH 溶液1 L(密度为1.06 g · cm -3)用铂电极电解,当溶液中NaOH 的质量分数改变了0.010(1.0%)时停止电解,则此时溶液中应符合的关系是 (98MCE ) ( B )解析:用惰性电极电解NaOH 溶液,阳极上析出O 2,阴极上析出H 2,二者的体积比为1∶2,质量比为8∶1。
溶液中NaOH 的质量分数会减小。
结合这两点,即可找出答案。
因此,本题是一个看似要算而不需算的巧解题。
例2:如图所示的A 、B 两个电解池中的电极均为铂,在A 池中加入0.05 mol / L 的CuCl 2溶液,B 池中加入0.1 mol / L 的AgNO 3溶液,进行电解。
a 、b 、c 、d 四个电极上所析出的物质的物质的量之比是(88上海高考五、3) ( A ) A . 2∶2∶4∶1 B . 1∶1∶2∶1 C . 2∶1∶1∶1 D . 2∶1∶2∶1解析:由电解规律可知:a 、c 为阴极,b 、d 为阳极。
电解池计算试题及解析答案一、选择题1. 在电解池中,阳极上发生的是氧化反应,阴极上发生的是还原反应。
这种说法是否正确?A. 正确B. 错误答案:A2. 电解液中离子的定向移动方向是?A. 阳离子向阴极移动,阴离子向阳极移动B. 阳离子向阳极移动,阴离子向阴极移动答案:B二、填空题1. 电解池中,当电流通过时,阳极失去电子的金属离子进入溶液,阴极则发生______反应。
答案:还原2. 电解过程中,电解液中的离子向电极移动,阳离子向______极移动,阴离子向______极移动。
答案:阴;阳三、计算题1. 已知电解池中电解铜的电流为2A,电解时间为0.5小时,求电解出的铜的质量。
已知铜的摩尔质量为63.5g/mol,法拉第常数为96500C/mol。
答案:首先计算通过的电荷量Q=It=2A×0.5h×3600s/h=3600C。
然后计算电解出的铜的摩尔数n=Q/F=3600C/96500C/mol=0.0372mol。
最后计算质量m=nM=0.0372mol×63.5g/mo l=2.36g。
2. 电解池中电解水,已知电解电流为5A,电解时间为1小时,求电解出的氢气和氧气的体积比。
已知在标准状况下,1mol气体的体积为22.4L。
答案:通过的电荷量Q=It=5A×1h×3600s/h=18000C。
电解水的电极反应为2H2O → 2H2↑+O2↑,每4个电子产生1mol氢气和0.5mol氧气。
因此,电解出的氢气摩尔数n(H2)=Q/(2F)=18000C/(2×96500C/mol)=0.0927mol,氧气摩尔数n(O2)=0.0463mol。
氢气和氧气的体积比为V(H2):V(O2)=n(H2):n(O2)=0.0927mol:0.0463mol=2:1。
四、简答题1. 简述电解池中阳极和阴极的工作原理。
答案:在电解池中,阳极是连接电源正极的电极,阳极上发生氧化反应,即阳极失去电子,金属离子进入溶液。
有关电解的计算问题山西大学附中常守信一、应知应会1.必须明确该电解池的电解质溶液中存在的离子,电解池的阴、阳极的电极材料,是惰性(Pt、石墨)电极还是金属活性电极(尤其是阳极材料)。
2.能根据电解规律,推断阳极和阴极上所发生的电极反应。
产物是什么?有何现象?必要时能熟练地写出电极反应式和电解总的化学方程式,常见的电极反应有:隋性阴极:2Cl--2e=Cl2↑4OH--4e=2H2O+O2↑金属阳极:Zn-2e=Zn2+Cu-2e=Cu2+阴极:Cu2++2e=CuAg++e=Ag2H++2e=H2↑3.同一电解池或串联的几个电解池中,同一时间在各阴极、阳极转移电子的物质的量相等,因此各电极析出的物质的量有如下关系:O2~2Cl2~2Cu~4Ag~2H2这是电化学简单计算中重要的基本关系。
4.在电解某物质水溶液过程中,由于存在的电离平衡,若阴极上析出1molH2,表示有2molH+离子放电,则溶液中增加2molOH-离子,若阳极上析出1molO2,表示溶液中有4molOH-离子放电,则溶液中4molH+离子,这是定理计算电解后溶液pH值的关键。
二、范例解析[例1]将分别盛有熔融的氯化钾、氯化镁、氧化铝的3个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的理之比为A.1∶2∶3 B.3∶2∶1 C.6∶3∶1 D.6∶3∶2[分析]要清楚地认识到,不管有多少个电解槽联在一起,在相同的时间内,各个电极通过的电量是相同的。
Na++1e=NaMg2++2e=MgAl3++3e=Al所以,每通过1mol电子,分别析出Na、镁、铝为1mol,1/2mol,1/3mol。
即6∶3∶2[例2]将质量分数为0.052(5.2%)的NaOH溶液1L(密度为1.06g/cm3),用铂电极电解,当溶液中NaOH的质量分数改变了0.01(1.0%)时停止电解,则此时溶液中应符合的关系是:[分析]铂是惰性电极,根据离子放电规律,电解NaOH溶液篁电解水,水不断减少,使NaOH溶液的浓度增大,由此可将选项C与D排除。
关于电解计算的基本方法解题思路及题型归纳
1根据电子守恒法计算:依据是电路中转移的电子数目相等。
用于串联电路、阴阳两极产物、正负极产物、电荷量等类型的计算。
2根据总反应式计算:先写出电极反应在写出总反应式,根据总反应式比例计算。
3根据关系式计算:由电子守恒关系建立已知量与未知量之间的比例关系。
常见微粒间的计量关系式为:
4e -~4H +~4OH -~4Cl -~4Ag +~2Cu 2+~2H 2~O 2~2Cl 2~4Ag~2Cu~2H 2O
一、单一溶液的电解
例1.用两个惰性电极插入500mL AgNO
3溶液中,通电电解。
当电解液的pH 从变为时(设电解时阴极
没有氢气逸出,且电解液体积变化可以忽略),电极上析出的质量是A. 27mg B. 54mg C. 108mg D. 216mg
例2. 25℃,用惰性电极电解一定量的硫酸钠饱和溶液。
一段时间后,阴极析出
a 摩尔气体,同
时有m 克晶体析出 .若温度不变,此时溶液中溶质的质量分数是多少?
×100%×100% % % 二、混合溶液的电解
例3 在100mL H 2SO 4和CuSO 4的混合液中用石墨做电极电解,两极均收集到气体(标况),则原混合
液中
Cu2+的物质的量浓度为
A .1moL/L B. 2moL/L C. 3moL/L D. 4moL/L
例4.在1L K2SO4和CuSO4的混合液中,c( SO42-)= 2moL/L,用石墨做电极电解,两极均收集到气体
(标况),则原混合液中K+的物质的量浓度为?
例5. 将 AgNO3 、(NO3)2、溶于水,配成100mL 的溶液,用石墨做电极电解一段时间后,在一极析出,此时在另一极收集到气体体积为(标况)
A . B. C. D.
三、非惰性电极做阳极的电解
例6. 用质量均为100g 的铜做电极,电解AgNO3 溶液,一段时间后,两电极质量相差28g,此时两电极质量分别为:
A. 阳极阴极
B.阳极100g 阴极128g
C.阳极阴极
D.阳极阴极
四、串联电路的电解
例7.把两个电解槽串联起来如图示,电解一段时间后,铜阴极的质量
增加了,金属X 阴极质量增加了,已知X 的相对原子质量为65,求X 离子所带电荷数?
练习
1. 有两只串联的电解池,甲池盛有CuSO 4溶液,乙池盛有某硝酸盐溶液,用惰性电极电解,当甲池的阴极上析出g Cu 时,乙池的阴极上析出g 固体,则乙池的溶质可能是
()
A .NH 4NO 3
B .Al(NO 3)3
C .Cu(NO 3)2
D .Mg(NO 3)2
X X
Cu Cu
2.用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入mol Cu(OH)2后恰好恢复到电解前的浓度和pH。
则电解过程中转移的电子数为()
A.mol B.mol
C.mol D.mol
3.[2013·兰州模拟]用铂作电极电解500 mL含KNO3和Cu(NO3)2的混合溶液一段时间后,在两极均生成L标准状况下的气体,原溶液中Cu2+的物质的量浓度为()
A.mol/L B.1 mol/L
C.2 mol/L D.无法确定
4、用铂电极电解CuSO4溶液,当阴极端发现有气体产生时,继续再通电一会,则加入下面哪种物质可
能使电解后的溶液恢复成原来浓度和体积的是
A.无水CuSO4 B.CuO (OH)2 D.CuCO3
5、用Pt电极电解V mL某二价金属硫酸盐溶液,当阴极有m mg金属析出时,溶液pH值由变为(电解
前后溶液的的体积变化可以忽略不计)。
析出的金属的相对原子质量是
A.100m/V B.200m/V C.1×105m/V D.2×105m/V
6、将L含有CuSO4和的水溶液用惰性电极电解。
电解一段时间后,一个电极上得到mol Cu,另一电
极析出的气体
A.只有Cl2B.只有O2C.既有Cl2又有O2D.只有H2
7、按装置右图进行实验,若图的X轴表示在电极上通过的电子的量,则Y轴不可能表示
A.Ag+物质的量浓度
B.NO3-物质的量浓度
C.溶液的pH
D.银棒的质量
8、(9分)用图所示的装置进行电解。
通电一会儿,发现湿润的淀
粉KI试纸的C端变为蓝色。
(1)左杯中发生反应的化学方程式为_____________。
(2)在右杯中观察到的现象是____________________
___________________________________。
(3)室温下,若从电解开始到时间t s,A、B装置中共收集到气体标况下L,若电解过程中无其他副反
应发生,经测定电解后A中溶液加水稀释为1000 mL,则A溶液的pH为______。
9.(2009·全国卷Ⅰ)下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g %的NaOH溶液、足量的CuSO4溶液和100g %的K2SO4溶液,电极均为石墨电极。
(1)接通电源,经过一段时间后,测得丙中K2SO4浓度为%,乙中c电极质
量增加。
据此回答问题:
①电源的N端为__________极;
②电极b上发生的电极反应为__________________;
③列式计算电极b上生成的气体在标准状况下的体积:__________________________________________;
④电极c的质量变化是__________g;
⑤电解前后各溶液的酸、碱性大小是否发生变化,简述其原因是:
甲溶液:__________________________________________________________________
;
;
乙溶液:__________________________________________________________________
丙溶液:__________________________________________________________________
;
(2)如果电解过程中铜全部析出,此时电解能否继续进行,为什么?
________________________________________________________________________。