北京化工大学《基础化学》2010期末考试试卷
- 格式:doc
- 大小:99.00 KB
- 文档页数:6
《基础化学》试卷答题纸适用专业:一、选择题(每小题1分,共40分)二、判断题(每小题1分,共20分)三、综合题(共40分)1.写出下列有机物的结构简式(每题2分,共8分)(1)(2)(3)(4)2.指出下列化合物中所含主要官能团的名称。
(共5分)(1)和(2)、和3.指出下列反应各属于何种反应类型?(每题2分,共10分)(1)(2)(3)(4)(5)4.简答题(前两题每题5分,后一题8分,共18分) (1)(2)(3)《基础化学》考试试卷一、单项选择题(每题1分,共40分)1.下列元素原子电负性最大的是A .OB .ClC .FD .S 2.下列物质或微粒哪一组互为同位素A .H 与DB .石墨与金刚石C .14C 与14ND . Cl 与Br 3.下列不同分子间能形成氢键的为A .NH 3和H 2OB .NH 3和CH 4C .HBr 和H 2OD .C 6H 6和H 2O4.已知下列反应H 2(g)+S(s)H 2S(g)的平衡常数为K ө,则反应 H 2S(g) H 2(g)+S(s)的平衡常数为 A .K ө B .-K ө C .1/ K ө D .(K ө)2 5.0.02mol·L -1 MgCl 2溶液的渗透浓度是 A .50 mmol·L -1 B .20 mmol·L -1 C .30 mmol·L -1 D .60 mmol·L -1 6.pH 为1和3的强碱溶液等体积混合,它的pH 值范围为A .1~2B .2~3C .12~13D .13~14 7.将少量NaAc 晶体加入0.001mol·L -1 HAc 溶液中,将使 A .θa K 值增大 B .θa K 减小C .溶液的pH 减小D .溶液的pH 增大 8.HPO 42-的共轭碱是 A .H 2PO 4- B .H 3PO 4 C .PO 43- D .OH -9.向0.1 mol/L HAc 溶液中加入0.1 mol/L HCl ,下列叙述正确的是 A .HAc 解离度增大 B .HAc 解离度减小 C .K a θ(HAc )增大 D .K a θ(HAc )减小10.已知H 3PO 4的θ1p a K =2.72,θ2p a K =7.21,θ3p a K =12.67,HAc 的θa K p =4.75,欲配制pH=12.0的缓冲溶液,应选择的缓冲对为A .HAc —AcˉB .H 3PO 4—-42PO H C .-42PO H —-24HPO D .-24HPO —-34PO 11.密度为1.19g·cm -3、质量分数为37%的浓盐酸的物质的量浓度约为 A .1.84mol·L -1 B .12mol·L -1 C .6mol·L -1 D .18.4mol·L -1 12.反应MnO 2(s)+4H +(aq)+2Clˉ(aq) 2+(aq)+Cl 2(g)+2H 2O(l)的标准平衡常数θK 的表示式为( )A . 2422)](Cl [)](H [)(Cl )(Mn -++=c c p c K θB .2422])/(Cl [])/c (H [])/(Cl ][)/c (Mn [θθθθθc c c p p c K -++=C .24222)](Cl [)](H )[(MnO )(Cl )(Mn -++=c c c p c K θD . ])/(Cl [])/(H [])/(Cl ][)/(Mn [222θθθθθc c c c p p c c K -++=13.根据酸碱电子理论,下列物质中不可以作为质子碱的是A .Cl -B .NH 3C .Fe 3+D .PO 43-14.判断下列盐类水解的叙述中正确的是( )A .溶液呈中性的盐一定是强酸强碱盐。
北京化工大学2008——2009学年第一学期《基础化学》期末考试试卷班级:姓名:学号:分数:一、判断下列叙述是否正确,正确的在括号中画√,错误的画 (本大题分14小题,每小题1分,共14分)1.( )由极性共价键组成的分子一定是极性分子。
2.( )Cl—与K+核外均有三个电子层,其核外电子排布相同。
3.( )CCl4,H2S,CO2分子的偶极矩都为零。
4.( )溶液的pH值越大,EDTA的lgαY(H)值越小,M-EDTA配合物的条件稳定常数越大。
5.( )对于微溶性强电解质,可根据其大小判断其溶解度大小。
6.( )Na2S2O3·5H2O俗称海波或大苏打,是无色透明的晶体,常被用作强氧化剂。
7.( )PH3与金属离子形成配合物的能力比NH3强。
8.( )极性分子中的化学键一定是极性键,非极性分子中的化学建一定是非极性键。
9.( )在多电子原子中,核外电子的能级只与主量子数n有关,n越大能级越高。
10.( )电极电势较小的电对的还原态物质可以还原电极电势较大的电对的氧化态物质。
11.( )HgCl2和Hg2Cl2都是直线型分子,其中的Hg原子都是采取的sp杂化。
12.( )配合物的几何构型取决于中心离子所采用的杂化轨道类型。
13.( )对氢原子来说,其原子轨道能级顺序为1s<2s<2p<3s<3p<4s<3d。
14.( )NH3和H2O分子的中心原子都是以sp3杂化成键的,但氧原子的2对孤对电子占据2个杂化轨道而产生更大的斥力,使H2O中H-O-H键角小于NH3中H-N-H键角。
二、在下列各题中,选择出符合题意的答案,将其代号填入下表内(本大题分10小题,每小题2分,共20分)1.下列电极的电极电势与介质的酸碱度无关的是( )。
A、O2/H2OB、MnO4-/Mn2+C、Cr(OH)3/CrD、AgCl/Ag2.对于下面两个反应方程式,说法完全正确的是( )。
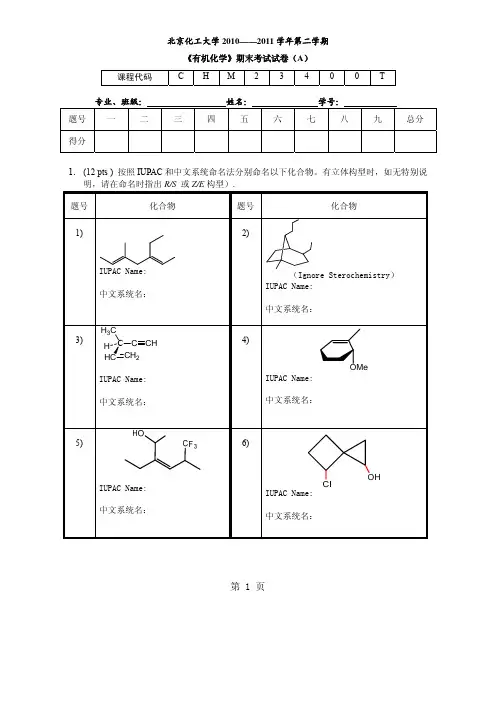
北京化工大学2011——2012学年第一学期《有机化学》(II)期末考试试卷(A)专业、班级:姓名:学号:一、用系统命名法命名化合物,必要时标明构型(R/S,顺/反或Z/E)。
每题1分,共12分。
二、选择题(每题只有一个答案,每题1分,共15分。
适用于应化、化工、高材专业重修生)1. 下列化合物中,不能发生Friedel-Crafts烷基化反应的是()A. 苯甲醚B. 硝基苯C. 乙苯D. 苯酚2. 芳香族伯胺发生重氮化反应是在()溶液中进行。
A、强酸性B、中性C、碱性D、强碱性3. 下列化合物中能与土伦试剂发生反应的是()A. 葡萄糖B. 果糖C. 苯乙酮D. 丙酮4. 下列化合物哪一个是酸酐()A. B. C. D.5.下列化合物烯醇式含量最多的是:()A、B、C、D、6. 下列化合物碱性最强的是()A. 苯胺B. 三乙胺C. 乙酰苯胺D. 氨气7. 下列化合物酸性最大的是()A. 邻硝基苯酚;B. 间硝基苯酚;C. 对硝基苯酚;D. 苯酚8. 不能与饱和亚硫酸氢钠反应产生沉淀的是()A、甲醛B、苯乙酮C、2-丁酮D、环己酮9. 下列负离子亲核性性最大的是( )A、B、C、D、10. 下列化合物不能发生碘仿反应的是()A. CH3CHOB. CH3COOHC. CH3CH(OH)CH3D. CH3COCH2CH311. 下列化合物发生醇解反应活性最小的是()A. 乙酰氯B. 乙酸酐C. 乙酰胺D. 乙酸乙酯12. 下列化合物与卢卡斯试剂发生反应,速率最快的是()A、叔丁醇B、1-丙醇C、2-丙醇;D、苄醇13.能使三氯化铁溶液变成蓝紫色的是()A、乙酰丙酮B、甲醇C、丙酮;D、苯甲醇14.根据休克尔规则,下列结构中不具有芳香性的是()A. B. C. D.15. 发生亲核加成反应活性最高的是()A、苯甲醛B、丙烯醛C、丙醛D、丙酮三、完成下列反应(每空1分。
应化学生答第1-14小题,共30分;高材、化工重修生答第1-8及第15-22小题,共36分)四.写出下列反应的反应机理(本大题两个小题都适用于应化专业,总分6分;第2小题适用于高材专业重修生,总分3分。

《基础化学》期末考试试卷附答案一、选择题(共10小题,每小题4分,共40分)1、某反应的ΔrHmΘ<0 ,当温度升高时,其平衡常数的数值将()。
A、增大B、不变C、减小D、先增大后减小2、当主量子数n=3时,则角量子数l的取值为()。
A、1、2、B、0、1、2C、0、1D、0、±1、3、某温度下,反应2NO(g)+O2(g)=2NO2(g)达到平衡,是因为()。
A、反应已停止B、反应物中的一种已消耗完C、正逆反应的速率相等D、反应物均已消耗完毕4、下列化合物晶体中,既存在离子键又存在共价键的是()。
A、H2OB、NaBrC、CH3OHD、Na2O25、蔗糖的凝固点为()。
A、0℃B、高于0℃C、低于0℃D、无法判断6、已知某元素核外电子排布式为1s22s22p2,该元素在周期表中所属的分区为()。
A、s区B、d区C、f区D、p区7、质量作用定律只适用于()。
A、实际上能进行的反应B、一步完成的简单反应C、化学反应方程式中反应物和产物的化学式系数均为1的反应D、已进行完的反应8、对于反应Cr2O72-+ 6Fe2+ + 14H+ = 2Cr3+ + 6Fe3+ + 7H2O,其ΔrGm= –nFE,式中n等于()。
A、1B、6C、3D、129、下列物质中熔点最高的是()。
A、SiB、CO2C、ZnSD、Fe3C10、下列叙述中错误的是()。
A、原电池的反应是氧化还原反应B、原电池的能量变化是由化学能变为电能C、原电池的能量变化是由电能变为化学能D、原电池的负极发生氧化反应二、填空题(共15空,每空2分,共30分)1、原电池(-)Pt |Fe2+(C1),Fe3+(C2)|| Fe2+(C3),Fe3+(C4)| Pt(+)负极上发生的电极反应式:____________________;正极上发生的电极:______________________________________。

一、填空题(共20分)1、主量子数n为4时,其轨道总数为,电子层电子的最大容量为。
2、根据共价键形成时原子轨道重叠方式不同,共价键可分为和两种.3、在等温等压条件下,系统的焓变ΔH=。
4、质量作用定律适用的范围是。
5、用有效数字表示下列计算结果:(3.202+0.01301)×12。
9= ;158.7÷2 - 5。
11×10-3 = 。
6、已知NaHCO3注射液的质量浓度为50g/L,则其物质的量浓度为mol/L。
(NaHCO3的摩尔质量为84 g/ mol)。
7、医学上的等渗溶液的渗透浓度范围是。
8、在NH4Cl—NH3&#8226;H2O的体系中,抗酸成分是 .9、用0.1 mol/L的NaOH溶液滴定0.1 mol/L的HC1溶液20 ml,选用的指示剂是。
10、[Ag(NH3) 2]OH的名称是。
二、选择题(共20分)1、下列各组量子数中不合理的是( )。
A、n=2,l=1,m=0B、n=3,l=2,m=1C、n=2,l=2,m=lD、n =3,l=2,m=22、原子序数为7的氮元素,原子核外电子排布式为( )。
A、1S22S22P1B、1S22S22P2C、1S22S22P3D、1S22S22P43、已知PC13分子中,中心原子采用不等性SP3杂化,则分子的空间构型为()。
A、直线型B、平面三角型C、三角锥形D、正四面体4、在水分子之间存在的主要作用力是()A、氢键B、取向力C、色散力D、诱导力5、下列各种函数中,不属于状态函数的是( )。
A、恒压反应热B、反应的焓变C、系统的内能D、物质的标准生成自由能6、今有反应:A+B=C,其速率方程式为:u=kCACB,下列说法正确的是( )。
A、这反应一定是基元反应B、这反应一定是复杂反应C、这是个一级反应D、这是个二级反应7、用万分之一的天平称取的质量为2.3801g一级标准物质K2Cr2O7,则其相对误差是()。

北京化工大学2011——2012学年第一学期《基础化学》期末考试试卷所有题目全部答在试卷上一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画×)(本大题分10小题,每小题1分,共10分)()1.1.0 ⨯10- 8 mol⋅L-1的HCl溶液,其pH为8.00;()2.任何一对共轭酸碱对均可以组成缓冲溶液;( ) 3. 对零级反应来说,反应速率与反应物浓度无关;()4.某物质的Kɵsp越大,其溶解度也越大;()5. 原电池中负极发生氧化反应,正极发生还原反应;()6.电极电势不具有加和性;()7.EDTA是很多金属离子的螯合剂,在水溶液中是四元弱酸;()8.元素的标准电极电势图: A—B—C—D中,若EɵB/C< EɵA/B, 则B不可能发生歧化反应;()9.某一元弱酸,其浓度越小,其解离度就越大;()10. 由于生成配离子,Ag(Ⅰ)的氧化性增强;二、单项选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)(本大题分10小题,每小题2分,共20分)1.下列有关氧化还原反应的表述中,正确的是:(A) 强氧化剂参与的氧化还原反应是不可逆反应,因此无法写出其平衡常数;(B)氧化还原反应也是可逆反应,其平衡常数Kɵ可由公式∆r Gɵm = RT ln Kɵ求得;(C) 氧化还原反应中氧化剂得到的电子数等于还原剂失去的电子数;(D) 原电池中的氧化还原反应在同一处发生。
2.下列物质不是一元酸的是: (A) H 3BO 3(B) H 3PO 2(C) HClO 4(D) H 3PO 33.浓差电池:(-)Zn |Zn 2+(c 1 mol .L -1) || Zn 2+(c 2 mol .L -1) | Zn(+) , 已知V E 76.0/Zn)Zn (2θ-=+,则下列说法正确的是:(A) 为提高电池电动势,可在负极处通入HCl 气体 (B) 为提高电池电动势,可在正极处加入氨水 (C) 若c 1/c 2=104,则电池电动势为0.24V (D) 若c 2/c 1 =104,则电池电动势为0.12V 4.下列关于周期表各族元素论述正确的是: (A) 非金属都是主族元素,金属都是副族元素 (B) VIIA 族元素都是非金属(C) IV A 族与IVB 族元素最外层都只有4个价电子 (D) IA 族与IB 族元素的最高价态为+15.在EDTA 滴定金属离子时,副反应系数α Y 与酸效应系数αY(H)、干扰离子效应系数αY(N)的关系为:(A) αY = αY(H)αY(N) (B) αY = αY(H) + αY(N) (C) αY = αY(H) + αY(N) -1 (D) αY = αY(H)αY(N) -16.下列关于物质中酸性强弱顺序正确的是:(A) HF > HCl > HBr > HI (B) H 4SiO 4 < H 3PO 4 < H 2SO 4 < HClO 4 (C) H 5P 3O 10 < H 4P 2O 7 < H 3PO 4 (D) HClO > HClO 2 > HClO 3 > HClO 47.在H 3PO 4溶液中加入一定量的NaOH 后,其溶液pH 为9.78,则此溶液中下列物种浓度最大的是(已知H 3PO 4的p K ɵa,1=2.15,p K ɵa,2= 7.20, p K ɵa,3= 12.35): (A) H 2PO 4-(B) H 3PO 4(C) PO 43-(D) HPO 42-8.向Mg(OH)2的饱和溶液中加入MgCl 2,使[Mg 2+] 为0.0010mol ⋅L -1,则该溶液的pH 为(已知K ɵsp(Mg(OH)2)=1.8⨯10-11): (A) 8.63 (B) 10.13(C) 3.87 (D) 5.379. 下列物质中能组成碱性缓冲溶液的是:(A) 0.1mol ⋅L -1HOAc 与0.05 mol ⋅L -1NaOH 溶液等体积混合 (B) 0.1 mol ⋅L -1 H 2C 2O 4与0.05 mol ⋅L -1NaOH 溶液等体积混合 (C) 0.1 mol ⋅L -1H 3PO 4与0.05 mol ⋅L -1NaOH 溶液等体积混合 (D) 0.1 mol ⋅L -1H 3PO 4与0.25 mol ⋅L -1NaOH 溶液等体积混合10. 已知K ɵb (NH 3⋅H 2O)=1.8×10-5,欲配制1.0 L pH=10.00、c (NH 3⋅H 2O)=0.10mol ⋅L -1的缓冲溶液,需用(NH 4)2SO 4的物质的量为:(A) 9.0×10-3mol (B)1.8×10-2mol (C) 0.050mol (D) 9.0×10-2mol三、填充题(根据题意,在下列各题的横线处,填上正确的文字,符号或数值)(本大题分10小题,每空1分,共20分)1.NH4HCO3的质子条件式为。

《基础化学》期终考试试卷适用专业:一、单项选择题(将正确答案填入题后括号内, 每小题2分,共32分)1.下列各组溶液中,不能作为缓冲溶液的是( ) A .0.1mol/LHAc 和0.2mol/LNaOH 等体积混合的溶液 B .0.1mol/LHAc 和0.1mol/LNaAc 等体积混合的溶液 C .0.1mol/LNH 3·H 2O 和0.1mol/LNH 4Cl 等体积混合的溶液 D .0.2mol/LNH 3·H 2O 和0.1mol/LHCl 等体积混合的溶液 2.下列盐的水溶液显酸性的是( )A .BaCl 2B . NaAcC .FeCl 3D . Na 2CO 3 3.下列有机物中含有芳伯胺氨基的是( ) A .CH 3CH 2NH 2B.C .NH CH 3D .4.向10mL 0.1mol·L -1NaOH 溶液中,先加甲基橙指示剂1d ,再缓慢逐滴加入过量的0.1mol·L -1HCl 溶液,边加边振荡,溶液颜色的变化为( ) A .无→黄→红 B .无→橙→红 C .黄→红 D .无→黄→橙→红 5.配制FeCl 3溶液时,常加入少量盐酸,其目的是( ) A .防止Fe 2+被氧化 B. 防止Fe 2+水解 C. 防止Fe 3+被氧化 D. 防止Fe 3+水解6.向稀苯酚水溶液中滴加少许饱和溴水,观察到的现象是( ) A .有黄色晶体 B .有白色浑浊 C .呈现紫色 D .有气体H 2NCOOCH 2CH 2N(C 2H 5)2HClH 2NCOOCH 2CH 2NH(C 2H 5)2+CH 2NH 27.氢化可的松是肾上腺皮质激素类药物,有影响糖代谢和抗炎、抗过敏等作用。
其结构式如右图,其中所含的碳原子数是( )A .19B .20C .21D .228.《中国药典》中碘量法测定维生素C 注射液含量时,常加丙酮作掩蔽剂,以消除加在维生素C 中的抗氧剂NaHSO 3的干扰,其原理是利用丙酮与NaHSO 3发生了( )A .加成反应B .取代反应C .消去反应D .酯化反应 9.斐林试剂的主要成分是( )A .[Ag(NH 3)2]OHB .Cu(OH)2C .CuSO 4D .AgNO 3 10.下列物质不具有酸性的是( )A .乙醇B .苯酚C .乙酸D .苯胺 11.某同学用天平称了5.3g 无水碳酸钠,然后加水配成了250mL 溶液(M (Na2CO3)=106g/mol),则该溶液的物质的量浓度为( ) A .0.2 mol/L B .0.4 mol/L C .0.02mol/L D .0.04mol/L 12.配制医用消毒酒精溶液500mL ,需95%酒精约( ) A .105mL B .395mL C .210mL D .290mL 13.配0.1mol·L -1的氢氧化钠溶液250mL (M (NaOH)=40g/mol ),需用固体氢氧化钠( )A .1gB .2gC .4gD .10g 14.下列物质不能使酸性高锰酸钾的紫红色褪去的是 ( ) A .甲酸 B .乙酸 C .草酸 D .乙烯 15.配制碘水或碘酒时常加适量碘化钾,其目的是( ) A .防止水解 B .防止氧化 C .增加碘在其中的溶解度 D . 防止还原 16.下列化合物中既能水解又具有还原性的是( )A .淀粉B .蔗糖C .麦芽糖D .葡萄糖二、判断题(将正确答案填入题后括号内, 对的打“√”,错的打“ⅹ”,每小题1分,共15分)HOOC OHCH 2OHO1.重铬酸钾只有在酸性条件下才能发挥其氧化作用,其还原产物为绿色的Cr 3+。

基础化学试卷及答案(一)一、填空题(3分/空,共10空,30分)1及物质之间相互转化的科学。
23、溶液是由至少两种物质组成的均一、稳定的混合物。
4、系统的性质按是否有加和性分为容量性质和强度性质两类。
5、化学反应速率是指在一定条件下,某化学反应的反应物转变成生成物的速率。
6、滴定分析中能发生颜色改变而指示终点的试剂称为指示剂。
7、酸碱质子理论认为,凡是能给出质子(H+)的物质(包括分子、正离子、负离子)都是酸,凡是能接受质子物质(包括分子、正离子、负离子)都是碱。
8、在一定条件下,难溶电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各生离子的浓度保持不变的状态,称为沉淀-溶解平衡。
9、有机化合物最基本的共同结构特征是原子之间都以共价键结合。
10、水污染可根据污染杂质的不同主要分为化学性污染、物理性污染、生活性污染三大类。
二、单项选择题(3分/题,共10题,30分)1、地面附近有一正在上升的空气团,它与外界的热交热忽略不计。
已知大气压强随高度增加而降低,则该气团在此上升过程中(不计气团内分子间的势能)(C)A体积减小,温度降低 B体积减小,温度不变C体积增大,温度降低 D体积增大,温度不变2、酚酞指示剂的变色范围是PH等于( C )。
A 、 10~12B 、 7~9 C、8~10 D、5~103、当被称量物高于室温时,应( C )A、立即称量B、讯速称量C、冷至室温称量D、冷至35℃称量4、碳原数低于12的饱和一元醇常温下是( A )A、无色液体B、腊状固体C、黏稠状液体D、无色气体5、下列叙述正确的一项是( C )A、配合物由正、负离子组成B、配合物由中心离子(或原子)与配位体以配位键结合而成C、配合物由内界与外界组成D、配合物中的配位体是含有未成键的离子6、下列关于螯合物的叙述正确的一项是()A、有两个以上配位原子的配体均生成螯合物B、螯合物和具有相同配位原子的非螯合物稳定性相差不大C、螯合物的稳定性与环境的大小有关,现环境的多少无关D、起螯合作用的配体多为多齿配体,称为螯合济。

北京化工大学2010——2011学年第一学期《高分子材料基础理论》期末考试试卷班级:姓名:学号:分数:一、选择题(多选题,每题2分,共20分)1 按主链结构分类,下列高分子中属于杂链高分子的有()。
A、聚氨酯,B、聚苯乙烯,C、聚丙烯,D、聚酰胺,E、聚甲基丙烯酸甲酯2 属于聚合度变大的高分子化学反应有()。
A、加聚反应,B、交联,C、自由基聚合,D、接枝,E、扩链反应3 ,高分子链柔顺性最差的是()。
A、聚氯乙烯,B、聚乙烯,C、聚丙烯,D、聚二甲基硅氧烷4 高聚物结晶结构的特点是()。
A、成周期性排列的质点是链段;B、成周期性排列的质点是整个分子;C、成周期性排列的质点是结构单元;D、存在晶格缺陷。
5从结构观点分析,下列高聚物中结晶能力最弱的是()A、聚甲醛B、聚酰胺C、聚碳酸酯D、等规聚丙烯6 结晶度对聚合物性能的影响,错误的描述为()。
A、随结晶度的提高,拉伸强度增加,而伸长率及冲击强度趋于降低;B、随结晶度的提高,相对密度、熔点、硬度等物理性能也有提高。
C、球晶尺寸大,材料的冲击强度要高一些。
D、结晶聚合物通常呈乳白色,不透明,如聚乙烯、尼龙。
7 下列关于聚氯乙烯拉伸取向的描述,正确的有:()。
A、取向温度设定在其Tg以下;B、取向单元可以为链段和整个高分子链;C、取向后聚集态结构为伸直链晶体;D、取向后沿取向方向力学性能提高;E、取向温度越高越好。
8 降低聚氯乙烯玻璃化转变温度的方法有:()。
A、交联,B、加入增塑剂;C添加碳酸钙;D、提高加工温度9 从分子运动观点分析,下列高聚物中抗蠕变能力最强的是( )。
A、聚苯醚,B、高密度聚乙烯,C、聚氯乙烯,D、聚四氟乙烯10 高聚物熔体弹性效应的主要表现现象有()A、韦森堡效应,B、剪切变稀,C、挤出胀大,D、熔体破裂二、填空题(每空1分,共30分)1 高分子,也称高分子化合物,是指分子量很高并由(1)连接的一类化合物,高分子的分子量范围通常为(2),英文缩写(3)。
基础化学考试题+答案一、判断题(共100题,每题1分,共100分)1.任何原子的摩尔质量在数值上等于该原子的相对原子质量。
A、正确B、错误正确答案:A2.配位滴定指示剂称为金属指示剂,它本身是一种金属离子。
A、正确B、错误正确答案:B3.生理盐水的浓度为0.9%,是指每100mL溶液中含0.9g的氯化钠。
A、正确B、错误正确答案:A4.乙烷、乙烯和乙炔分别通入溴水中,能使溴水褪色的一定是乙烯。
A、正确B、错误正确答案:B5.用NaOH标准溶液标定HCl溶液浓度时,以酚酞作指示剂,若NaOH溶液因贮存不当吸收了CO2,则测定结果偏高。
A、正确B、错误正确答案:A6.乙酸不溶于水,易溶于有机溶剂。
A、正确B、错误正确答案:B7.变色范围必须全部在滴定突跃范围内的酸碱指示剂才可用来指示滴定终点。
A、正确B、错误正确答案:B8.提高反应溶液的温度能提高氧化还原反应的速度,因此在酸性溶液中用KMnO4滴定时,必须加热至沸腾才能保证正常滴定。
A、正确B、错误正确答案:B9.滴定突跃范围的宽窄,与酸碱的浓度无关,只与酸碱的性质有关。
A、正确B、错误正确答案:B10.烯烃的化学性质比较稳定,原因是双键比单键牢固。
A、正确B、错误正确答案:B11.烯烃很容易被氧化,冷的稀高锰酸钾碱性溶液就能把烯烃氧化。
A、正确B、错误正确答案:A12.缓冲溶液中,其他条件相同时,缓冲对的pKa越接近缓冲溶液的pH时,该缓冲溶液的缓冲容量就一定越大。
A、正确B、错误正确答案:A13.配合滴定中,一般情况下,对主反应影响最大的是EDTA的浓度。
A、正确B、错误正确答案:B14.乙酸乙酯是易挥发,并有水果香味的液体。
A、正确B、错误正确答案:A15.同一溶液,其组成的表示方法不同,所含溶质的质量也不同。
A、正确B、错误正确答案:B16.溶液稀释前后溶质的物质的量不变,但物质的质量发生了变化。
A、正确B、错误正确答案:B17.有效数字当中不包括最后一位可疑数字。
基础化学课程期末考试试卷答案本试卷共五道大题,满分100 分。
一、填空题(本大题20分,每小空1分)1.ΔU=q v的应用条件是封闭系统,不做非体积功,定容过程。
2.含有0.1 mol⋅dm-3HAc与0.1 mol⋅dm-3NaAc的缓冲溶液的pH值为4.75 。
[K a=1.76×10-5]3.理想气体在向真空膨胀时,吉布斯函数(G)减小。
(填“增大”,“减小”或“不变”)4.基元反应是指一步完成的反应。
5.对于反应N2(g)+3H2(g) 2NH3(g)的Δr Hθm(298.15K)=-92.2kJ⋅mol-1,若升高温度约100K,则(1)Δr Hθm 基本不变,(2)Δr Gθm增大,(3)Kθ减小(4)υ(正)增大,(5)υ(逆)增大(填“不变,基本不变,增大”或“减小”)6.电极极化使得阳极电极电势值升高,阴极电极电势值降低。
7.铅蓄电池放电做功25kJ,吸热5kJ。
该过程的体积功为0 kJ,非体积功为-25 kJ,ΔU = -20 kJ,ΔH = -20 kJ。
8.在BaSO4和AgCl的饱和溶液中加入KNO3,则其BaSO4的溶解度会增大,AgCl的溶解度会增大,这种现象称为盐效应。
9.某离子最外层电子排布为2s22p6,若该离子为-1价离子,则其为F-。
二、单项选择题(本大题30分,每小题2分)1.绝对零度时,任何纯物质的完美晶体的标准熵值为( A )。
A.0 B.4.871 kJ⋅mol-1⋅K-1C.4.871J⋅mol-1⋅K-1D.1 J⋅mol-1⋅K-12.通常反应热的精确的实验数据是通过测定反应或过程的哪个物理量而获得的( D )。
A.△H B.p△V C.q p D.q v3.下列函数值为零的是( B )。
A.△f Hθm(Br2, g, 298.15K ) B.△f Hθm(H+,aq, 298.15K)C.△f Hθm(O3, g, 298.15K) D.Sθm(Br2, g, 298.15K )4.影响平衡常数最主要的因素是( A )。
北京化工大学2006——2007学年第二学期《有机化学》期末考试试卷(A)专业、班级:姓名:学号:分数:一、用系统命名法命名下列化合物,必要时标明构型(R/S,顺/反或Z/E),每题1分,共10分。
二、根据下列化合物名称写出正确的结构,只能一个答案。
每题1分,共5分。
三、选择题(每题只有一个答案,每题1分,共15分)1、下列化合物沸点由大到小的顺序正确的是:(B)a. 乙醇;b. 正丙醇;c. 甲乙醚;d. 丙酸A、d>a>c>b;B、d>b>a>c;C、b>a>d>c;D、b>c>d>a2、下列有机化合物在水中溶解度由大到小的顺序正确的是:(B)a. 正丁烷b. 1,3丙二醇c. 1-丁醇d. 乙醚A、a>d>c>b;B、b>c>d>a;C、b>d>c>a;D、c>b>a>d3、下列化合物酸性由大到小的顺序正确的是:(A)a. 苯磺酸;b. 对硝基苯甲酸;c. 苯甲酸;d. 苯酚A、a>b>c>d;B、c>a>d>b;C、d>b>c>a;D、a>c>d>b4、下列化合物碱性由大到小的顺序正确的是:(B)a. 苯胺b. 乙胺c. 乙酰苯胺d. 氨A、a>b>d>c;B、b>d>a>c;C、b>a>c>d;D、c>a>d>b5、下列化合物进行硝化反应时,反应速率从大到小顺序正确的是:(C)a. 甲苯b. 硝基苯c. 苯d. 氯苯A、b>d>a>c;B、c>a>d>b;C、a>c>d>b;D、b>d>c>a6、下列化合物与HCN加成,反应速率从大到小顺序正确的是:(B)a. 苯乙酮b. 苯甲醛c. 一氯乙醛d. 三氯乙醛A 、d>c>a>b ;B 、d>c>b>a ;C 、a>b>c>d ;D 、c>d>a>b 7、下列碳正离子稳定性从大到小顺序正确的是:( B ) a.CH 3CH 2+;b.CH 3+;c.2+d.H 3C C CH 3CH 3A 、a>b>c>d ;B 、c>d>a>b ;C 、c>b>d>a ;D 、b>a>d>c 8、反-1-甲基-4-叔丁基环己烷的优势构像是:( A )A.B.C.D.9、根据休克尔规则,下列结构中不具有芳香性的是( B )A.B.C.D.10、与溴发生加成反应,活性从大到小顺序正确的是: ( C )a 、乙烯;b 、丙烯;c 、氯乙烯;d 、溴乙烯A 、d>c>a>b ;B 、b>c>d>a ;C 、b>a>c>d ;D 、a>c>d>b11、按照亲核性从强到弱顺序正确的是:( B )a. C 2H 5O -b. HO -c. C 6H 5O -d. CH 3COO -A 、d>c>a>b ;B 、a>b>c>d ;C 、c>d>b>a ;D 、a>b>d>c12、下列化合物在NaI 的丙酮溶液中发生S N 2反应,其快慢顺序正确的是:( B )a. 3-溴-1-丙烯b. 溴乙烯c. 1-溴丁烷d. 2-溴丁烷 A 、b>c>d>a ; B 、a>d>c>b ; C 、d>a>b>c ; D 、a>b>c>d 1A 、c>b>d>a ; B 、b>c>a>d ; C 、d>b>a>c ; D 、d>a>b>c 14、 15、下列自由基稳定性从大到小顺序正确的是:( C )a.CH 3CH 2CHCH 2CH 2CH 2CH 3b. CH 3CH 2CHCHCH 3CH 2CH 3c.CH 3CH 2CCH 2CH 3CH 2CH 3d.CH 3CH 2CCHCH 3CHCH 3A 、a>b>c>d ;B 、c>d>b>a ;C 、d>c>b>a ;D 、c>b>a>d四、完成下列反应(每空1分,共27分)五、写出下列反应的反应机理,任选两题(6分)1、H3CCOH+H3CCOH+H3OH18H3C COHOHO182CH3H H3C COHO2CH3H3C COHO18CH2CH3H+H3C C O18CH2CH32、(有机过氧化物可用R-O-O-R表示)①引发阶段:R O O R R O2R O+HBr R OH+Br1).2).②增长阶段:+BrCH3CH CH2CH3CH CH2BrCH3CH CH2Br+HBr+BrCH3CH2CH2Br3).4).重复3)、4),直到链终止。
班级学号姓名※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※※装订线基础化学模拟试题1题号一二三四五总分得分一、填空题(共20分,每空1分)1.用邻苯二甲酸氢钾(KHP)测定NaOH溶液的浓度,这种确定浓度的操作,称为。
而邻苯二甲酸氢钾称为物质。
2.在滴定分析中,根据指示剂变色时停止滴定的这一点称为,而该点与化学计量点不一致而引起的误差称为。
3.在混合溶液中加入某种沉淀剂时,离子发生先后沉淀的现象,称为。
4.莫尔法是以作指示剂,在介质中用标准滴定溶液测定卤素混合物含量的方法。
5.某元素基态原子的核外电子分布的原子实表示式为〔Ar〕3d104s24p5,则该原子的价电子构型为,原子序数为,元素符号为。
6.NH3分子构型为三角锥形,中心原子N采取杂化,键角∠HNH 109°28′(提示:填写>,=或<)。
7.已知φɵ(Fe3+/Fe2+)=0.771V,φɵ(Fe2+/Fe)=—0.447V,根据铁元素的标准电势图可知,Fe2+在水中发生岐化反应(能或不能),在配制其盐溶液时,常常放入适量的铁粉防止Fe2+被。
8.[]36K Fe(CN)命名为,其中心离子为配位体为,配位原子为,配位数为。
二、选择题(共20分,每题2分)()1.某反应在一定条件下达到化学平衡,且平衡转化率为65%,若其他条件不变,加入催化剂,则平衡转化率将A.大于65% B.等于65% C.小于65% D.等于100%()2.已知25℃时,反应Fe2 + (aq) + Ag + (aq) Fe3 + (aq) + Ag(s)的平衡常数Kθ=2.98,当Fe2 + 、Ag + 、Fe3 + 的浓度均为0. 010mol/L时,则该反应将A.自发向右进行B.处于化学平衡状态C.自发向左进行D.不能判定()3.已知下列反应的平衡常数:H2(g) + S(s) H2S(g)1KθS(s) + O2(g) SO2(g)2Kθ则反应H2(g) + SO2(g) O2(g) + H2S(g)的平衡常数003Kθ为A.12K Kθθ+B.12K Kθθ-C.12/K KθθD.12K Kθθ⋅()4.欲配制pH=3的缓冲溶液,选择下列那种物质与其共轭酸(或共轭碱)的混合溶液比较合适A.HCOOH(θaK=1.77×10-4)B.HAc(θaK=1.75×10-5)C.NH3(θbK=1.8×10-5)D.HCN(θaK=6.2×10-10)()5.若c(12H2SO4)=0.2000 mol/L,则c(H2SO4)为A. 0.5000mol/LB. 0.2000mol/LC. 0.4000mol/LD. 0.1000mol/L()6.在BaSO4的饱和溶液中,加入稀硫酸,使其溶解度减小的现象称为A.盐效应B.缓冲作用C.同离子效应D.配位效应()7.精制食盐时,用BaCl2 除去粗食盐中的SO42-,若使SO42-离子沉淀完全[已知θspK(BaSO4)=1.1×10-10],需控制Ba2+离子浓度为A.>1×10-5 mol/L B.>1.1×10-5mol/LC.<1.1×10-5 mol/L D.>1.1×10-6mol/L()8.已知,θϕ(MnO4-/Mn2+)=1.507V,θϕ(Cr2O72-/Cr3+)=1.232V,则在25℃,标准状态下,下列物质的氧化性由强到弱的顺序,正确的是A.Cr2O72->MnO4-B.Mn2+>Cr3+C.MnO4->Cr2O72-D.Cr3+>Mn2+()9.下列各组物质沸点比较正确的是A.F2>Cl2B.NH3<PH3C.CCl4<CH4D.CH3OH<CH3CH2OH()10.已知φɵ(Fe3+/Fe2+)= 0.771V,φɵ(Cu2+/Cu)= 0.3419V,φɵ(Fe2+/Fe)= -0.447V,则在水溶液中能够共存的物质是A.Cu2+ ,Fe2+B.Cu ,Fe3+C.Fe,Fe3+D.Cu2+, Fe三、判断题(共10分,每题1分)()1.一般化学反应,在一定的温度范围内,温度每升高10℃,反应速率增加到原来的2~4倍。
北京化工大学2018——2019学年第一学期《基础化学》期末考试试卷样卷课程代码CHM17T班级: 姓名: 学号: 分数:题号 一 二 三 四 五 总分 得分一、判断下列叙述是否正确,正确的在括号中画√,错误的画⨯(本大题分12小题,每小题1分,共12分)1. ( × ) 由极性共价键组成的分子一定是极性分子。
P3032. ( × ) 在多电子原子中,核外电子的能级只与主量子数n 有关,n 越大,能级越高。
3. ( √ ) Fe (Ⅲ)、Co (Ⅲ)、Ni(Ⅲ)的氧化性强弱的次序为:Fe (Ⅲ) < Co (Ⅲ) < Ni (Ⅲ)4. ( × ) B 2H 6为平面形分子。
5. ( × ) 18电子构型阳离子元素在周期表中的位置主要为ds 区。
6. ( √ ) 配合物的几何构型取决于中心离子所采用的杂化类型。
7. ( × ) 乙炔分子中C-C 叁键能是C-C 单键键能的三倍。
8. ( × ) 所有气体单质的摩尔生成焓都是零。
9. ( × ) SO 2分子和H 2O 分子的空间构型均为V 型,他们的中心原子采取相同方式的杂化轨道成键。
10. ( √ ) 反应熵J 既可以大于平衡常数K θ,也可以小于平衡常数K θ。
11. ( × ) 对氢原子来说,其原子轨道能级顺序为1s <2s <2p <3s <3p <4s <3d 。
P241 12. ( √ ) H 2O 中H-O-H 键角小于NH 3中H-N-H 键角。
P289二、在下列各题中,选择出符合题意的答案,将其代号填入下表内(本大题分10小题,每小题2分,共20分)1、 CH 4、NH 3、H 2O 、HF 等氢化物的还原性递减顺序是( A )。
(A) CH 4 > NH 3 > H 2O> HF (B) HF > NH 3 > H 2O > CH 4 (C) CH 4 > H 2O > NH 3 > HF (D) HF > H 2O > NH 3> CH 4 2、从离子极化的角度考率,下列各物质中熔点最低的是( D ) A .MgCl 2 B . AlCl 3 C.SiO 2 D.PCl 5 3、=⨯=-=-+)(,106.1)(,126.0)(2522Pb PbCl E PbCl K V Pb Pb E sp θθθ则( C )A 、0.268VB 、-0.41VC 、-0.268VD 、0.41V 4、下列原子核外电子排布错误的是( C ) A 、26223221s p s s B 、15626224333221s d p s p s s C 、27223221s p s s D 、162622333221d p s p s s5、已知=0.68V;=1.36V ,则反应Cl 2+H 2O 22Cl -+O 2+2H +的标准平衡常数为( B )。
北京化工大学2009——2010学年第一学期
《基础化学》期末考试试卷
班级:姓名:学号:分数:
注意:所有试题均需直接答在试卷上
一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画 )
(本大题分10小题,每小题1分,共10分)
()1、由于β6([Co(NH3)6]3+)>β6([Co(NH3)6]2+),所以电对Co(NH3)6]3+/[Co(NH3)6]2+的标准电极电势小于电对Co3+/Co2+的标准电极电势。
()2、磁量子数m=0的轨道都是球形的轨道。
()3、酸碱完全中和后,pH等于7.0。
()4、氢键和共价键的特点相似,都具有方向性和饱和性。
()5、薛定鄂方程可以描述原子核外电子的运动,解薛定鄂方程得到的所有波函数均对应一个原子轨道。
()6. 非极性分子中可以存在极性键。
()7、H2O分子中O原子采用的是sp3杂化,NH3分子中N原子也采用了sp3杂化。
()8、一个C=C双键键能等于2个C-C单键键能之和。
()9、NO2分子,由于N原子采用了不等性sp2杂化,因此使得N-O键之间的夹角大于120O。
()10、取向力存在于所有分子之间。
二、单项选择题(在下列各题中,选择出符合题意的答案,并将其填入下方表格
内)(本大题分15小题,每小题1分,共15分)
1、下列离子的半径按由大到小顺序排列正确的是()。
(A) S2-、K+、Na+、Mg2+(B) Mg2+、S2-、K+、Na+
(C) Mg2+、Na+、K+、S2-(D) Mg2+、K+、Na+、S2-
2、下列各组分子中,化学键均有极性,但分子偶极矩均为零的是()。
(A) NO2、PCl3、CH4;(B) CS2、BCl3、CO2;
(C) N2、CS2、PH3;(D) SO2、BCl3、PCl3;
3、电池反应为:2Fe2+(1mol·L-1)+I2(s)=2Fe3+(0.0001mol·L-1)+2I— (0.0001mol·L-1),原电池符
号正确的是()。
(A) (-)Fe│Fe2+(1mol·L-1),Fe3+(0.0001mol·L-1)‖I-(0.0001mol·L-1),I2│Pt(+)
(B) (-)Pt│Fe2+(1mol·L-1),Fe3+(0.0001mol·L-1)‖I-(0.0001mol·L-1)│I2(s)(+)
(C) (-)Pt│Fe2+(1mol·L-1),Fe3+(0.0001mol·L-1)‖I-(0.0001mol·L-1)│I2(s), Pt(+)
(D) (-)Pt│I2,I-(0.0001mol·L-1)‖Fe2+(1mol·L-1),Fe3+(0.0001mol·L-1)│Pt(+)
4、下列量子数中,合理的一组是()。
(A) 3,0,1,-1/2 (B) 2,2,0,+1/2
(C) 4,3,-4,-1/2 (D) 5,2,2,+1/2
5、下列原子中,第一电离能最小的是()。
(A) B (B) C (C) Al (D) Si
6、在标准状况下,下列各对物质可以共存于同一溶液中的是()。
(A)Br2和Hg22+(B) Br2和Fe2+(C)Sn2+和Fe2+(D)Hg2+和Fe2+
7、下列各组物质分子间只存在色散力的是()。
(A) 氖气和四氯化碳;(B) 碘化氢和水;
(C)二氧化碳和二硫化碳;(D) 甲醇和水
8、下列各对元素中,电负性非常接近的是()
(A)Be和Al;(B)Be和Mg;(C)Be和B;(D)Be和K
9、下列酸中,酸性最弱的是()。
(A)H3BO3;(B)H3PO4;(C)HClO4;(D)HClO3。
10、从离子极化的角度考虑,下列物质中熔点最低的是()。
(A)MgCl2;(B)AlCl3;(C)SiO2;(D)PCl5。
11.下列离子形成的配合物一定具有顺磁性的是()。
(A) Cu2+(B) Ni2+(C) Fe2+(D) Co3+
12、下列化合物中,既存在离子键和共价键,又存在配位键的是()。
(A) NH4F (B) NaOH (C) H2S (D) BaCl2
13、描述一确定的原子轨道(即一个空间运动状态),需用以下量子数()。
(A) n.l (B) n.l.m (C) n.l.m.m s(D) 只需n
14、下列碳酸的盐中,分解温度最低的是()。
(A)MgCO3;(B)NH4HCO3;(C)Na2CO3;(D)CuCO3。
15、都能形成氢键的一组分子是()。
(A) NH3,HNO3,H2S (B) H2O,C2H2,CF2H2
(C) H2BO3,HNO3,HF (D) HCl,H2O,CH4
三、填充题(根据题意,在下列各题的横线处填上正确的文字,符号或数值) (本大题每空1分,共26分)
1、XeF 2分子的空间构形是_____ ___,Xe 的原子轨道采用的杂化形式为________,分子________(有或无)极性。
2、在下列物质中,存在大π键的分子为⎽⎽⎽⎽⎽⎽⎽⎽⎽,分子中存在缺电子共价键的是⎽⎽⎽⎽⎽⎽⎽⎽⎽,分子中含有p-dπ键的是⎽⎽⎽⎽⎽⎽⎽⎽(B 2H 6、H 2SO 4、HNO
3、H 2CO 3,每空填一种物质)。
3、在同一周期元素中,原子的共价半径一般随原子序数的增大而________,这是因为同一周期的元素_____________________________________ ___________。
4、已知: E Sn 2+ / Sn =-0.15V E H +/H 2 =0.000V E SO 42-/SO 2=+0.17V E
Mg 2+/Mg =-2.375V
E
Al 3+/Al =-1.66V
E S/H 2S =+0.141V
根据以上E θ值,把氧化型按照氧化能力由小到大排列: 5、如果指示剂与金属离子结合形成的配合物比金属离子与EDTA 结合的稳定性大,EDTA 不能将指示剂置换出来,滴定到化学计量点时也不能发生颜色变化,这种现象称为___________________________;而由于金属离子与指示剂形成的配合物形成胶体或沉淀,使终点拖长的现象称为____________________________。
6、某元素原子的最外层有2个电子,其主量子数等于4,在次外层l =2的原子轨道电子数为0。
则该元素的原子序数为______________________________;用原子实表示的原子核外电子排布式是________________________________________________。
7、 [Fe(CN)6]3-的未成对电子数为1, 磁距 B.M.,属于 (填外轨型、内轨
型); [Ni(H 2O)6]2+的未成对电子数为2, 所以是 (填高自旋、低自旋)。
8、在元素周期表的同一主族中,自上而下元素的电负性依次____ _,主族元素同
一周期中自左向右电负性逐渐____________。
9、配位化合物[Co(NH 3)4(H 2O)2]2(SO 4)3的中心离子是 ,配位体
是 ,配位原子是________,配位数为_____ ____,该配位化合物的名称 。
10、基态原子中的电子在排布时应遵循________________________, ________________________,
________________________三个规则
四、填表(本大题15分,每题5分,每空0.5分) 1、
2、
3、
五、配平题(完成并配平下列反应方程式) (本大题分5小题,每小题2分,共10分)
1、 Mn 2+ + NaBiO 3→(酸性介质)
2、 I 2 + S 2O 32-→
3、 Ni 2O 3 + H + + Cl - →
4、 Hg 2(NO 3)2+ NH 3+ H 2O
5、 重铬酸铵受热分解。
六、计算题(24分)
1、(8分)已知E
(Fe 3+/Fe 2+)=0.771V ,
K sp(Fe(OH)3)=2.80×10-39,K sp(Fe(OH)2)=4.86×10-17,在Fe 3+
和 Fe 2+ 组成的半电池中加入NaOH ,达到平衡时保持[OH -]=1.00mol/L ,计算 E
(Fe(OH)3/Fe(OH)2)。
2、(8分)通过计算说明在pH=10.00的NH3-NH4Cl缓冲溶液中(c(NH
+)=0.20mol/L),能
3+NH4
否用0.0200mol/LEDTA溶液准确滴定0.020mol/L Zn2+?已知:lg K ZnY=16.50,lgαY(H)=0.45,lgαZn(OH)=2.40,Zn(NH3)的lgβ1=2.27,lgβ2=4.61,lgβ3=7.01,lgβ4=9.06。
3、(8分)已知下列电对的标准电极电势:
(1)[Cu(CN)2]- + e Cu+2CN-,E=-0.903V
(2)[Co(NH3)6]3+ + e[Co(NH3)6]2+,E=0.169V。
(已知[Co(NH3)6]2+的K f= 1.3 105)
试分别计算配合物[Cu(CN)2]-及[Co(NH3)6]3+的标准稳定常数K f。