卤素单质及化合物的颜色
- 格式:doc
- 大小:15.00 KB
- 文档页数:1

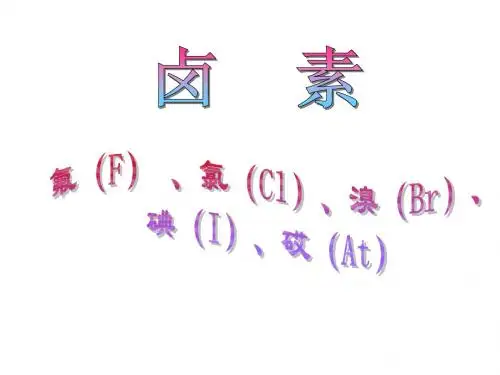
卤族元素一、卤族元素包括:氟(F)、氯(Cl)、溴(Br)、碘(I)、砹(At)。
1、原子结构特征:最外层电子数相同,均为7个电子,从外界获得电子的能力依次减弱,单质的氧化性减弱。
2、卤素元素单质的物理性质:从F2 Cl2、Br2、到I2,颜色由浅到深(浅绿色、黄绿色、红棕色、紫色),状态由气到液到固,熔沸点和密度都逐渐增大,水溶性逐渐减小。
3、卤素单质化学性质比较相似性:均能与H2发生反应生成相应卤化氢,卤化氢均能溶于水,形成无氧酸。
H2+F2===2HF (黑暗中反应)H2+Cl22HCl (点燃或加热)H2+Br22HBr(加热)H2+I2(持续加热)均能与水反应生成相应的氢卤酸和次卤酸(氟除外)2F2+2H2O==4HF+O2X2+H2O======HX+HXO (X表示Cl Br I)4、萃取和分液的概念①在溴水中加入四氯碳振荡静置有何现象?(分层,下层橙红色上层无色)②在碘水中加入煤油振荡静置有何现象?(分层,上层紫红色,下层色)5、卤离子的鉴别:加入HNO3酸化的硝酸银溶液,Cl-:得白色沉淀Ag++ Cl-====AgCl↓Br-:得淡黄色沉淀Ag++ Br-====AgBr↓I-:得黄色沉淀Ag++ I-====Ag I↓6、卤素特性①F元素无正价,只有-1价,AgF可以溶于水,CaF2不溶于水。
②I2可以升华(常用于分离),且能使淀粉变蓝(常用于检验碘或淀粉)7、单质氧化性从F2到I2在减弱Cl2+2KBr=2KCl+Br2Br2+2KI=2KBr+I2Cl2+2KI=2KCl+I2二、拟卤素和卤素互化物拟卤素:⒈概念:拟卤素是指由二个或二个以上非金属元素原子组成的原子团,这些原子团在自由状态时,与卤素单质的性质相似。
有剧毒。
重要的拟卤素有氰(qíng)(CN)2、硫氰(SCN)2等。
⒉拟卤素的化学性质①与水发生歧化反应Cl2+ H2O = HCl + HClO(SCN)2+ H2O = HSCN + HSCNO①与碱反应Cl2+ 2NaOH = NaCl + NaClO + H2O(CN)2+2OH-=CN-+CNO-;Cl2+2OH-=Cl-+ClO-卤素互化物⒈概念:不同卤素原子之间可通过共用电子对形成物质叫卤素互化物。


卤素单质水溶液的颜色和有机溶剂的颜色随着化学知识的普及和深入,我们对于化学元素的性质和特点有了越来越多的了解。
其中,卤素单质作为化学元素中的一种,其水溶液和有机溶剂中的颜色表现引起了我们的广泛关注。
在本文中,将深入探讨卤素单质在水溶液和有机溶剂中的颜色表现,带领读者全面了解这一化学现象。
1. 氯素单质水溶液的颜色首先让我们来探讨氯素单质在水溶液中的颜色表现。
一般情况下,氯素单质溶解于水中会生成氯离子,而氯离子在水中呈现淡黄绿色的颜色。
这种颜色对于氯素单质在水溶液中的特征有着重要的指示作用,也是我们在实验室中常见的化学现象之一。
2. 氟素单质水溶液的颜色我们来探讨氟素单质在水溶液中的颜色表现。
与氯素单质不同,氟素单质在水中溶解后并不会显现出明显的颜色。
这是由于氟离子在水中呈现无色的特点所决定的。
在实验操作中,我们往往需要通过其他检测方法来确认氟素单质在水溶液中的存在。
3. 溴素单质有机溶剂的颜色除了在水溶液中的颜色表现,我们还需要了解溴素单质在有机溶剂中的颜色变化。
一般情况下,溴素单质在有机溶剂中会呈现出深红色或红棕色的颜色。
这种颜色的呈现是由于溴素单质分子间的相互作用导致的,也是我们在化学实验中常见的观察结果之一。
4. 碘素单质有机溶剂的颜色让我们来探讨碘素单质在有机溶剂中的颜色表现。
一般来说,碘素单质在有机溶剂中会呈现出紫色或紫黑色的颜色。
这种颜色的呈现也是由于碘素单质分子间的相互作用所导致的,同时也是我们在化学实验中观察到的有机溶剂中的颜色现象之一。
从以上对于卤素单质在水溶液和有机溶剂中的颜色表现的探讨中,我们可以看到不同卤素单质在不同溶剂中呈现出的独特颜色,这为我们对于这一化学现象的理解提供了重要的参考。
对于这一现象的深入探讨也有助于我们在实验操作中准确把握颜色指示的特点,从而更好地完成化学实验。
个人观点和理解作为化学领域的一部分,我对于卤素单质在水溶液和有机溶剂中的颜色表现十分感兴趣。
这一化学现象不仅反映了卤素单质分子间的相互作用特点,也为化学实验操作提供了重要的参考依据。


象对市爱好阳光实验学校高一化学卤素【同步信息】一. 本周教学内容:卤素二. 教学目标:1. 卤素结构的相似点和递变性。
2. 卤素单质的物理性质。
3. 卤素单质的化学性质及递变性。
4. 卤化银和含碘化合物的主要性质。
5. 了解可逆反的含义。
三. 教学、难点::卤素性质变化规律。
难点:可逆反的涵义。
四. 知识分析:〔一〕卤素原子结构及性质推测:相同点⎪⎩⎪⎨⎧-+1)(717,负价为除外最高正价均为具有较强的氧化性个电子达到稳定结构,容易得个最外层电子都为F不同点:F Cl Br I−−−−→−核电荷数增大 −−−−→−电子层数增多 −−−−→−原子半径增大−−−−→−得电子能力减弱−−−−→−单质氧化性减弱 −−−−−→−阴离子还原性增强〔二〕卤素单质的物理性质:状态〔熔沸点〕气 气 液 固 熔沸点升高颜色 浅黄绿色 黄绿色 深红棕色 紫黑色 颜色加深 密度 密度增大水中溶解度 反 溶解 溶解 微溶 在水中溶解度减小说明:1. 卤素单质在不同溶剂的颜色:2. 液溴的保存:由于液溴极易挥发,具有强腐蚀性,因而室通常将液溴装入磨砂玻璃塞的试剂瓶,并参加一量水。
3. 碘的升华:固态物质不经液态而直接变成气态的现象。
四. 卤素单质的化学性质:1. 卤素都能与金属反生成金属卤化物。
说明:〔1〕这些反均是卤素单质得电子,表现氧化性。
〔2〕2I 的氧化性最弱,只能将Fe 氧化为2+价。
〔3〕自然界里,也存在着许多的金属跟卤素的化合物,如氟化钙、氯化钠、氯化镁、溴化钾、碘化钾卤化物。
2. 卤素都能跟氢气起反生成卤化氢。
HFF H 222=+冷暗处,爆炸HBr Br H 222∆+C ︒500较慢进行可逆反:在同一条件下,既能向正反方向进行,同时又能向逆反方向进行的反。
注意:〔1〕2F 、2Cl 、2Br 、2I 都能与2H 反生成卤化氢。
〔2〕2F 、2Cl 、2Br 、2I 与2H 反条件越来越严格,剧烈程度越来越差。

知识点8——氯、溴、碘单质活泼性比较一、知识疏理1、卤素单质在物理性质上的主要差异和递变规律F2Cl2Br2I2颜 色:淡黄绿色 黄绿色 深棕红色 紫黑色 (颜色逐渐加深)水中溶解性: 反应 溶解(少量反应)微溶 难溶 (溶解度减小)熔 沸 点: (气态) (气态) (液态) (固态) (由低到高)2、卤素化学性质的相似性和递变性(1)相似性① 卤素单质与氯气相似,都能跟金属、非金属(如P、H2等)、水、碱等物质反应:Zn+I2ZnI2(水作催化剂)(特殊反应,反应过程中能看到紫色蒸气,这说明了什么问题?)Fe+I2 → FeI2(不能生成FeI3)(表明I2的活泼性比Cl2、Br2、F2弱)(所以,盛碘的试剂瓶不能用铁盖。
)Br2+2NaOH→NaBr+NaBrO+H2O② 化合价相似:均有-1价,除氟外,均有+1、+3、+5、+7价。
如:HF、HBrO(次溴酸)、NaIO3(碘酸钠)、HClO4(高氯酸)。
(就知道各种价态,会写不同价态的物质的化学式。
)③ 形成气态氢化物的化学式相似,可表示为HX。
HX均易溶于水,形成氢卤酸,HX在空气中均形成白雾。
(2)递变性按氟、氯、溴、碘顺序单质氧化性:逐渐减弱。
(除氟外,其它的卤素单质也有弱还原性)卤离子(X-)还原性:逐渐增强。
(F-不能被常见的氧化剂氧化。
)气态氢化物(HX)稳定性:逐渐减弱。
(会从键长解释吗?)气态氢化物(HX)还原性:逐渐增强。
(HBr、HI能被常见的氧化剂氧化)氢卤酸酸性:增强。
(只有氢氟酸是弱酸)最高价氧化物水化物(HXO4)酸性:减弱。
(氟没有含氧酸,高氯酸为无机酸中酸性最强的酸)(3)卤素间的置换反应(略)注意:F2能从熔融状态下的卤化物中置换出其他卤素,而在水溶液中F2更易与水发生反应。
3、氟的特殊性① F原子半径小,获得电子能力强,无正价,无含氧酸。
F2是氧化性最强的非金属单质。
② F2与H2反应剧烈,低温、黑暗处妈会发生爆炸。



卤族(英VIIA):固体:I2 紫黑;ICl 暗红;IBr 暗灰;IF3 黄色;ICl3 橙;I2O5 白;I2O4黄(离子晶体);I4O9 黄(离子晶体).液体:Br2 红棕;BrF3 浅黄绿;IBr3 棕;Cl2O6暗红;Cl2O7 无色油状;HClO4 无色粘稠状;(SCN)2 黄色油状.气体:F2 浅黄;(CN)2无色;Cl2 黄绿;I2(g) 紫;BrF 红棕;BrCl 红;Cl2O 黄红;ClO2 黄色;Br2O 深棕;(SCN)n 砖红色固体.氧族(英VIA):固体:S 淡黄;Se 灰,褐;Te 无色金属光泽;Na2S,(NH4)2S,K2S,BaS 白,可溶;ZnS 白↓;MnS 肉红↓;FeS 黑↓;PbS 黑↓;CdS 黄↓;Ag2S 黑↓;CuS 黑↓;Na2S2O3 白;Na2S2O4 白;SeO2 白,易挥发;SeBr2 红;SeBr4 黄;TeO2 白(加热变黄);H2TeO3 白;TeBr2 棕;TeBr4 橙;TeI4 灰黑;PoO2 低温黄(面心立方),高温红(四方);SO3 无色;SeO3 无色易潮解;TeO3 橙色;H6TeO6 无色.液体:H2O 无色;纯H2O2 淡蓝色粘稠;CrO(O2)2(aq) 蓝;纯H2SO4 无色油状;SO32-(aq) 无色;SO42-(aq) 无色;SeO2(l) 橙;TeO2(l) 深红.气体:O2 无色;O3 低浓度无色,高浓度淡蓝(鱼腥味);S2(g) 黄,上浅下深;H2S 无色;SO2 无色;H2Se 无色;H2Te 无色.卤化硫(未注明者均为无色):液体:SF6,S2F10,SCl4 淡黄;SCl2 红;S2Cl2 无色;S2Br2 红.气体:SF4 ;SF2 ;S2F2 .液体:SOCl2 白色透明;SO2Cl2 无色发烟. 氮族(英V A):固体:铵盐无色晶体;氮化金属白;N2O3 蓝色(低温);N2O5 白;P 白,红,黑;P2O3 白;P2O5 白;PBr3 黄;PI3 红;PCl5 无色;P4Sx 黄;P2S3 灰黄;P2S5 淡黄;H4P2O7 无色玻璃状;H3PO2 白;As 灰;As2O3 白;As2O5 白;As2S5 淡黄;Sb 银白;Sb(OH)3 白↓;Sb2O3 白(锑白,颜料);Sb2O5 淡黄;SbX3(X≠I) 白;SbI3 红;Sb2S3 橘红↓;Sb2S5 橙黄;Bi 银白略显红;Bi2O3 淡黄;Bi2O5 红棕;BiF3 灰白;BiCl3 白;BiBr3 黄;BiI3 黑↓;Bi2S3 棕黑.液体:N2H4 无色;HN3 无色;NH2OH 无色;发烟硝酸红棕;NO3-(l)无色;王水浅黄,氯气味;硝基苯黄色油状;PX3 无色;纯H3PO4 无色粘稠状;AsX3(X≠I) 无色;.气体:N2 无色;NH3 无色;N2O 无色甜味;NO 无色;NO2 红棕;PH3 无色;P2H6 无色;AsH3 无色;SbH3 无色;BiH3 无色.卤化氮(未注明者均为无色):固体:NBr3•(NH3)6 紫,爆炸性;NI3•(NH3)6 黑,爆炸性;液体:NCl3;无色气体:NF3;无色碳族(英IV A):Solid:C(金刚石) 无色透明;C(石墨) 黑色金属光泽;Si 灰黑色金属光泽;Ge 灰白;Sn 银白;Pb 暗灰;SiO2 无色透明;H2SiO3 无色透明胶状↓;Na2SiF6 白晶;GeO 黑;GeO2 白;SnO 黑;SnO2 白;Sn(OH)2 白↓;PbO黄或黄红;Pb2O3 橙;Pb3O4 红;PbO2 棕;CBr4 淡黄;CI4 淡红;GeI2 橙;GeBr2 黄;GeF4 白;GeBr4 灰白;GeI4 黄;SnF2 白;SnCl2 白;SnBr2 淡黄;SnI2 橙;SnF4 白;SnBr4 无色;SnI4 红;PbF2 无色↓;PbCl2 白↓;PbF4 无色;GeS 红;GeS2 白;PbS 黑↓;PbS2 红褐;Pb(NO3)2 无色;Pb(Ac)2•3H2O 无色晶体;PbSO4 白↓;PbCO3 白↓;Liquid:CCl4 无色;CS2 无色;GeCl4 无色;SnCl4 无色;PbCl4 无色.Gas:CO CO2 CH4 CF4 SiF4 SiH4 均为无色. 硼族(英IIIA):Solid:B(无定型) 棕色粉末;B(晶体) 黑灰;Al 银白;Ga 银白(易液化);In 银灰;Tl 银灰;B2O3 玻璃状;H3BO3 无色片状;BN 白;NaBO2•4H2O 无色晶体;无水NaBO2 黄晶;Al2O3 白晶;AlF3 无色;AlCl3 白;AlBr3 白;AlI3 棕;Al(OH)3 白↓;Ga2O3 白↓;Ga(OH)3 白↓;GaBr3 白;GaI3 黄;In2O3 黄;InBr3 白;InI3 黄;TlOH 黄;Tl2O 黑;Tl2O3 棕黑;TlCl 白↓;TlBr 浅黄↓;TlI 黄↓(与银相似);TlBr3 黄;TlI3 黑.Liquid:BCl3 无色发烟.Gas:硼烷无色;BF3 无色(有窒息气味).碱土金属(英IIA):单质:银白氧化物:均为白色固体.氢氧化物:白色固体Be(OH)2↓,Mg(OH)2↓. 盐:多为无色或白色晶体;BeCl2 浅黄;BaCrO4 黄↓;CaF2 白↓.碱金属(英IA):单质:银白焰色:Li 红;Na 黄;K 紫;Rb 紫红;Cs 紫红. 氧化物、过氧化物、超氧化物、臭氧化物:Li2O 白;Na2O 白;K2O 淡黄;Rb2O 亮黄;Cs2O 橙红;Na2O2 淡黄;KO2橙黄;RbO2深棕;CsO2 深黄;KO3 橘红.氢氧化物:白色,LiOH白↓.盐:多为无色或白色晶体且易溶于水.不溶盐↓(未注明者皆为白色晶体):LiF Li2CO3 Li3PO4LiKFeIO6 Na[Sb(OH)6]NaZn(UO2)3(Ac)9•6H2O 黄绿;M3[Co(NO2)6] 亮黄;MBPh4 MClO4 M2PtCl6 淡黄;(M=K,Rb,Cs)CsAuCl4.铜副族(英IB):单质:Cu 紫红或暗红;Ag 银白;Au 金黄.铜化合物:焰色绿;CuF 红;CuCl 白↓;CuBr黄↓;CuI 棕黄↓;CuCN 白↓;Cu2O 暗红;Cu2S 黑;CuF2 白;CuCl2 棕黄(溶液黄绿);CuBr2 棕;Cu(CN)2 棕黄;CuO 黑↓;CuS黑↓;CuSO4 无色;CuSO4•5H2O 蓝;[Cu(H2O)4]2+ 蓝;[Cu(OH)4]2- 蓝紫;深蓝;炔铜红↓.银化合物:AgOH 白(常温分解);Ag2O 黑;新制AgOH 棕黄(混有Ag2O);蛋白银(AgNO3滴手上) 黑↓;AgF 白;AgCl 白↓;AgBr 淡黄↓;AgI 黄↓(胶体);Ag2S 黑↓;Ag4[Fe(CN)6] 白↓; Ag3[Fe(CN)6] 白↓; Ag+ ,[Ag(NH3)2]+ ,无色[Ag(S2O3)2]3- ,[Ag(CN)2]- 无色.金化合物:HAuCl4•3H2O 亮黄晶体;KAuCl4•1.5H2O 无色片状晶体; Au2O3 黑;H[Au(NO3)4]•3H2O 黄色晶体; AuBr 灰黄↓; AuI 柠檬黄↓.锌副族(I 英IB):单质:均为银白,Hg 在水溶液中的沉淀为黑色.ZnI2 无色; ZnS 白↓;ZnCl2 白色晶体(溶解度极大,水溶液酸性);K3Zn3[Fe(CN)6] 白; Zn3[Fe(CN)6]2 黄褐.镉化合物:CdO 棕灰↓;汞化合物:HgO 红(大晶粒)或黄(小晶粒)↓;HgI2 红或黄(微溶);(奈斯勒试剂产物)Hg2(NO3)2 无色晶体.ZnS 荧光粉:Ag 蓝;Cu 黄绿;Mn 橙.钛副族(英IVB):钛化合物:Ti3+ 紫红;[TiO(H2O2)2]2+ 橘黄;(NH4)2TiCl6 黄色晶体; [Ti(H2O)6]Cl3 紫色晶体;[Ti(H2O)5Cl]Cl2•H2O 绿色晶体; TiCl4 无色发烟液体.锆、铪:MO2,MCl4 白.钒副族(英VB):钒化合物:V2+ 紫;V3+ 绿; VO2+ 蓝; V(OH)4- 黄; VO43- 黄; VO 黑;V2O3 灰黑; V2S3 棕黑; VO2 蓝色固体; VF4 绿色固体; VCl4 暗棕色液体; VBr4 洋红色液体; V2O5 黄或砖红; 水合V2O5 棕红;饱和V2O5溶液(微溶) 淡黄; [VO2(O2)2]3- 黄; [V(O2)3]3- 红棕.铬副族(英VIB):[CrO(O2)2]OEt2 蓝; CrO2Cl2 深红色液体; Na2Cr2O7,K2CrO7 橙红;Ag2CrO4 砖红↓; BaCrO4 黄↓; PbCrO4 黄↓.紫红Cr2(SO4)3•18H2O ; 绿色Cr2(SO4)3•6H2O ; 桃红Cr2(SO4)3;暗绿[Cr(H2O)4Cl2]Cl ; 紫色[Cr(H2O)6]Cl3; 淡绿[Cr(H2O)5Cl]Cl2; [Cr(H2O)6]3+ 紫;[Cr(H2O)4(NH3)2]3+ 紫红; [Cr(H2O)3(NH3)3]3+ 浅红; [Cr(H2O)2(NH3)4]3+ 橙红; [Cr(NH3)5H2O]3+ 橙黄; [Cr(NH3)6]3+ 黄.钼、钨:MoO3 白;棕色MoCl3; 绿色MoCl5; MoS3 棕色↓;•6H2O 黄色晶状↓;H2WO4•xH2O 白色胶体.锰副族(英VIIB):无水锰盐(MnSO4) 白色晶体;六水合锰盐(MnX2•6H2O, X=卤素,NO3,ClO4) 粉红;MnCO3 白↓; Mn3(PO4)2 白↓; KMnO4 紫红;铁系(第四周期VIII 族):黄;FeO 黑; Fe2O3 暗红; Fe(OH)2 白↓; Fe(OH)3 棕红↓; FeCl3 棕红晶体; 无水FeSO4 白; FeSO4•7H2O 绿;K4[Fe(CN)6](黄血盐) 黄色晶体; K3[Fe(CN)6](赤血盐) 红色晶体; Fe4[Fe(CN)6] 普鲁士蓝↓;M2Fe6(SO4)4(OH)12(黄铁矾,M=NH4,Na,K) 浅黄色晶体;CoO 灰绿; Co3O4 黑; Co(OH)3 棕↓; Co(OH)2 粉红↓; Co(CN)2 红;K4[Co(CN)6] 紫色晶体; Co2(CO)8 黄色晶体; [Co(SCN)6]4- 紫;氯化钴脱水变色:粉红CoCl2•6H2O(325K) ;紫红CoCl2•2H2O(3l3K) ; 蓝紫CoCl2•H2O(393K) ; 蓝CoCl2.[Ni(NH3)6]2+ 紫; Ni(OH)2 绿↓; Ni(OH)3 黑↓; 无水Ni(II)盐 黄; Na2[Ni(CN)4] 黄;K2[Ni(CN)4] 橙;Ni(CO)4 无色液体.铂系元素(第五、六周期VIII族):Os 蓝灰色易挥发固体;Pd↓(aq) 黑;Na2PtCl6 橙黄色晶体;M2PtCl6(M=K,Rb,Cs,NH4) 黄色↓.。

卤素单质及化合物的颜色
1.卤族元素它们自身的颜色
f2,淡黄绿色气体,没有水溶液,因为与水迅速反应,2f2+2h2o=4hf+o2。
cl2,黄绿
色气体,氯水淡黄绿色,因为在水中的溶解度不大。
br2,浅红棕色液体,蒸气红棕色,溴在水中溶解度并不大,所以溴水橙色,溴在有
机溶剂中的溶解度很大,所以溴的苯溶液、溴的ccl4溶液都就是橙红色。
i2,紫黑色液态,蒸气紫红色,碘在水中的溶解度不大,所以碘水棕黄色,碘在有机溶剂中的溶解度很大,所以碘的苯溶液、碘的ccl4溶液都就是紫红色,但碘的酒精溶液就是棕黄色的。
【注】溶液的颜色与浓稀有关,浓溶液颜色深,稀溶液颜色浅,如饱和溴水为红棕色,而很稀的溴水则为浅黄色。
2.常用化合物的颜色
它们的离子都是无色的,所以它们的化合物多数是无色,或白色固体。
agf就是可以溶水的,无色溶液,agcl就是白色结晶,agbr就是淡黄色结晶,agi就
是黄色结晶。
3.他们之间鉴别的方法
cl-、br-、i-的辨别可以用agno3溶液,根据产生的结晶的颜色相同展开辨别,白色
结晶cl-,淡黄色结晶br-,黄色结晶i-。
第17章卤素17-1卤素单质17-2卤化氢和氢卤酸17-3卤化物与拟卤素17-4卤素的含氧化合物卤素(VIIA族):氟F,氯Cl,溴Br,碘I,砹At 。
它们都易形成盐,统称为卤素。
价电子构型:n s2n p5氧化态:除氟外(–1),其余均可呈现–1,0,+1,+3,+5,+7卤素的存在形式:氟:萤石CaF 2,冰晶石Na 3AlF 6,氟磷灰石Ca 5F(PO 4)3 ;氯:以NaCl 的形式存在于海水、盐湖、盐井中,矿物中以KCl 、光卤石KCl ·MgCl 2 ·6H 2O ;溴:以溴化物的形式存在于海水和地壳中;碘:碘在海水中存在的更少,主要被海藻所吸收。
通常以碘化物形式存在,南美洲智利硝石含有少许的碘酸钠。
砹:放射性元素,仅以微量而短暂地存在于镭、锕和钍的蜕变产物中。
17 -1卤素单质17 -1 -1物理性质F2Cl2 Br2 I2聚集状态g g l s分子间力小大解离能先上升再下降b.p./℃–188 –34 59 185 m.p. /℃–220 –102 –7 114颜色浅黄黄绿红蓝黑随着原子序数的增加,这种轨道之间的能量差逐渐减少,所需要外界提供的能量随之减少,即所吸收的光的波长逐渐增加,透过或反射的光的波长也呈现规律性变化。
卤素单质在水中的溶解度F2 氧化能力极强,与水剧烈反应。
Cl2在水中溶解度较小。
Br2在水中溶解度是卤素单质中最大的一个,100 g 水中可溶解3.58 g 溴。
I2 在水中的溶解度最小,但在CCl4中的溶解度很大。
I2 在KI 或其他碘化物溶液中溶解度变大,而且随I-浓度增大而增大。
I-+ I2 = I3-17 -1 -2化学性质F 2 Cl 2 Br 2 I 2X 2 氧化性:强弱X –还原性:弱强E ( X 2 / X –)/V :2.87 1.36 1.07 0.54结论:氧化性最强的是F 2,还原性最强的是I –。
卤素单质是强氧化剂,其中F 2 的氧化性最强,随原子序数增大,氧化能力逐渐变弱。
卤素单质总结引言卤素是指化学元素周期表中第17族元素,包括氟(F)、氯(Cl)、溴(Br)和碘(I)等四种元素。
这些元素在自然界中以单质形式存在,并且具有许多重要的化学和生物学特性。
本文将对卤素单质的性质、用途和反应进行总结和介绍。
1. 卤素单质的性质1.1 物理性质•氟(F)是黄绿色气体,具有非常强的剧毒性。
•氯(Cl)是黄绿色气体,有刺激性气味,在常温下为常见的气态元素。
•溴(Br)是红棕色液体,在常温下为液态元素。
•碘(I)是紫黑色晶体,常用于消毒和性能检测等领域。
1.2 化学性质•卤素单质具有较强的氧化能力,可以与其他元素或化合物发生反应。
•卤素可以和许多金属反应形成相应的卤化物。
•卤素单质也可以和氢气反应生成相应的氢卤酸。
•卤素单质在光照下能够和非金属元素反应,形成有机卤化物。
2. 卤素单质的用途2.1 工业应用•氯广泛用作消毒剂和漂白剂,也是合成许多化学品的重要原料。
•溴的化合物常用于制作某些消防药剂和医药产品。
•碘在医疗领域广泛应用于皮肤消毒和消毒剂的制备。
2.2 生活应用•氯化钠(NaCl)是食盐的主要成分,用于调味和食品保存。
•氟化物广泛添加到饮用水中,以预防牙齿蛀牙。
•碘化钾(KI)是一种常用的营养补充剂,用于预防碘缺乏病。
3. 卤素单质的反应3.1 卤素与金属的反应卤素单质可以和金属反应,生成相应的卤化物。
例如,氯气与钠金属反应生成氯化钠,溴液与铝反应生成三溴化铝,碘与铁反应生成碘化铁等。
3.2 卤素与非金属的反应卤素单质可以和非金属元素反应,生成相应的有机卤化物。
例如,氯气与甲烷反应生成氯甲烷,溴液与乙烷反应生成溴乙烷,碘与丙烷反应生成碘丙烷等。
3.3 氢卤酸的生成卤素单质可以与氢气反应生成相应的氢卤酸。
例如,氯气与氢气反应生成盐酸,溴液与氢气反应生成溴化氢,碘与氢气反应生成碘化氢等。
结论卤素单质具有独特的性质和广泛的应用。
它们在工业生产、医药、日常生活等领域发挥着重要的作用。
1.卤族元素它们自身的颜色
F2,淡黄绿色气体,没有水溶液,因为与水迅速反应,2F2+2H2O=4HF+O2。
Cl2,黄绿色气体,氯水淡黄绿色,因为在水中的溶解度不大。
Br2,深红棕色液体,蒸气红棕色,溴在水中溶解度不大,所以溴水橙色,溴在有机溶剂中的溶解度较大,所以溴的苯溶液、溴的CCl4溶液都是橙红色。
I2,紫黑色固体,蒸气紫红色,碘在水中的溶解度很小,所以碘水棕黄色,碘在有机溶剂中的溶解度较大,所以碘的苯溶液、碘的CCl4溶液都是紫红色,但碘的酒精溶液是棕黄色的。
【注】溶液的颜色与浓稀有关,浓溶液颜色深,稀溶液颜色浅,如饱和溴水为红棕色,而很稀的溴水则为浅黄色。
2.常见化合物的颜色
它们的离子都是无色的,所以它们的化合物多数是无色,或白色固体。
AgF是可溶于水的,无色溶液,AgCl是白色沉淀,AgBr是淡黄色沉淀,AgI是黄色沉淀。
3.他们之间鉴别的方法
Cl-、Br-、I-的鉴别可以用AgNO3溶液,根据产生的沉淀的颜色不同进行鉴别,白色沉淀Cl-,淡黄色沉淀Br-,黄色沉淀I-。