Ras-Raf-MAPK, mTOR-PI3K-AKT信号通路详解
- 格式:pptx
- 大小:9.10 MB
- 文档页数:86

如何选择关键靶点PI3K、AKT和mTOR的抑制剂?针对癌症中的PI3K / AKT信号通路-07-23 订阅号APExBIOPI3K / AKT信号通路的异常激活会导致癌症的发展。
PI3K家族分为四类:I类,II类,III类和IV类。
I类可以进一步分为IA和IB类。
本文主要介绍IA类PI3K。
IA类PI3K是由调节性p85亚基和催化性p110亚基组成的异二聚体。
前者由PIK3R1(p85α,p55α和p50α)和PIK3R2(p85β)基因编码,后者由PIK3CA(p110α),PIK3CB(p110β)和PIK3CD (p110δ)编码。
PI3K的信号传导是在细胞表面受体激活时触发的。
p85与活化的受体酪氨酸激酶(RTK)或相关的衔接蛋白的结合激活催化亚基并使其更接近质膜。
在那里,p110磷酸化磷脂酰肌醇4,5-二磷酸(PIP2,质膜的次要组分)以产生磷脂酰肌醇3,4,5-三磷酸(PIP3),其作为激活各种效应蛋白(包括AKT)的第二信使。
AKT的活化是通过3-磷酸肌醇依赖性蛋白激酶-1(PDK1)和mTOR复合物2(TORC2)的磷酸化完成的。
反过来,AKT的激活导致TORC1的激活,AKT和TORC1均调节促进细胞的存活、生长和增殖等途径。
另外,p110α和p110δ可以被Ras(GTP酶转换蛋白)进一步激活,Ras不与p110β结合。
Rac和Cdc42蛋白有助于激活p110β以响应G蛋白偶联受体(GPCR)激活。
TORC1信号传导还充当负反馈调节机制以抑制来自RTK的信号传导。
最后,肿瘤抑制因子PTEN使PIP3去磷酸化并返回PIP2(图1)。
图1 PI3K(IA类) / AKT信号通路的激活(此图列出了多种抑制剂,不知如何选择抑制剂的可作为参考)图2 PI3K(IA 类) / AKT信号通路的药理学抑制。
PI3K通路可以在多个节点上被药理学抑制,包括pan-PI3K和同种型特异性抑制剂,只靶向TORC1或同时靶向TORC1和TORC2的mTOR抑制剂以及AKT抑制剂,这些抑制剂可以直接抑制PI3K活性。
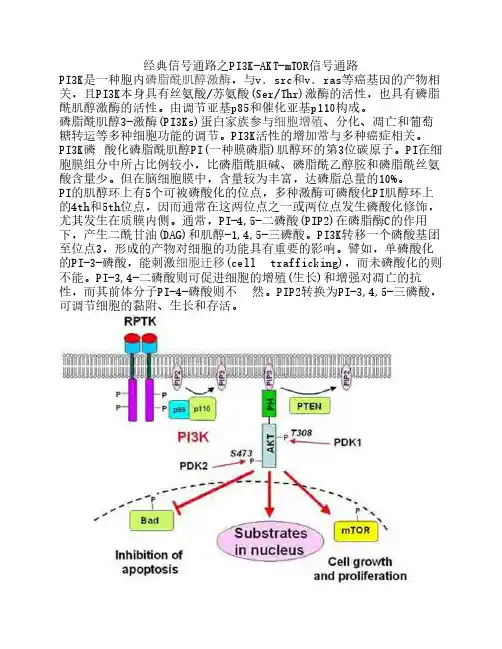
经典信号通路之PI3K-AKT-mTOR信号通路PI3K是一种胞内磷脂酰肌醇激酶,与v.src和v.ras等癌基因的产物相关,且PI3K本身具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。
由调节亚基p85和催化亚基p110构成。
磷脂酰肌醇3-激酶(PI3Ks)蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。
PI3K活性的增加常与多种癌症相关。
PI3K磷 酸化磷脂酰肌醇PI(一种膜磷脂)肌醇环的第3位碳原子。
PI在细胞膜组分中所占比例较小,比磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸含量少。
但在脑细胞膜中,含量较为丰富,达磷脂总量的10%。
PI的肌醇环上有5个可被磷酸化的位点,多种激酶可磷酸化PI肌醇环上的4th和5th位点,因而通常在这两位点之一或两位点发生磷酸化修饰,尤其发生在质膜内侧。
通常,PI-4,5-二磷酸(PIP2)在磷脂酶C的作用下,产生二酰甘油(DAG)和肌醇-1,4,5-三磷酸。
PI3K转移一个磷酸基团至位点3,形成的产物对细胞的功能具有重要的影响。
譬如,单磷酸化的PI-3-磷酸,能刺激细胞迁移(cell trafficking),而未磷酸化的则不能。
PI-3,4-二磷酸则可促进细胞的增殖(生长)和增强对凋亡的抗性,而其前体分子PI-4-磷酸则不 然。
PIP2转换为PI-3,4,5-三磷酸,可调节细胞的黏附、生长和存活。
PI3K的活化PI3K可分为3类,其结构与功能各异。
其中研究最广泛的为I类PI3K, 此类PI3K为异源二聚体,由一个调节亚基和一个催化亚基组成。
调节亚基含有SH2和SH3结构域,与含有相应结合位点的靶蛋白相作用。
该亚基通常称为p85, 参考于第一个被发现的亚型(isotype),然而目前已知的6种调节亚基,大小50至110kDa不等。
催化亚基有4种,即p110α,β,δ,γ,而δ仅限于白细胞,其余则广泛分布于各种细胞中。

肿瘤的细胞增殖信号通路肿瘤是一种导致细胞无限制增殖的疾病,其发展涉及复杂的信号通路调控网络。
了解肿瘤细胞增殖信号通路的机制,可以帮助我们更好地理解肿瘤的发生与发展,并为肿瘤治疗提供新的策略。
本文将重点介绍几个与肿瘤细胞增殖密切相关的信号通路。
一、PI3K-Akt信号通路PI3K-Akt信号通路是一条重要的细胞增殖信号通路,它在多种肿瘤中起到关键作用。
该通路的激活可以促进细胞增殖、增加细胞生存能力,同时抑制细胞凋亡过程。
在正常细胞中,该通路会受到严格的调控,以防止不受控制的细胞增殖。
而在肿瘤细胞中,PI3K-Akt信号通路常常被异常激活,导致细胞无限制增殖。
二、Ras-MAPK信号通路Ras-MAPK信号通路是另一个与肿瘤细胞增殖密切相关的信号通路。
该通路的激活可以促进细胞增殖、增强细胞迁移和侵袭能力。
在正常细胞中,该通路通常处于关闭状态,只有在特定刺激下才会被激活。
然而,在某些肿瘤中,Ras基因突变或过度表达会导致该通路的异常激活,从而推动肿瘤细胞的增殖。
三、Wnt/β-catenin信号通路Wnt/β-catenin信号通路在胚胎发育和成体组织的维持中发挥着重要作用。
研究表明,该通路在多种肿瘤中也起到关键作用。
在正常细胞中,Wnt信号通路处于关闭状态。
然而,在某些肿瘤中,该通路的异常激活导致β-catenin的稳定和核定位增加,从而促进肿瘤细胞的增殖和侵袭。
四、Notch信号通路Notch信号通路是一种高度保守的跨膜受体信号通路,在细胞分化和增殖中发挥着重要作用。
该通路的激活可以启动多种细胞命运的决定,包括细胞增殖和凋亡。
在某些肿瘤中,Notch信号通路的异常激活可以导致细胞增殖能力的提高,进而促进肿瘤的发展。
总结:肿瘤的细胞增殖信号通路涉及多个复杂的信号通路网络,其中包括PI3K-Akt、Ras-MAPK、Wnt/β-catenin和Notch等信号通路。
这些信号通路的异常激活可以导致肿瘤细胞的不受控制增殖,推动肿瘤的发展。

信号通路3 —PI3K/AKT/mTORAPExBIO一、PI3K/Akt/mTORPI3K/AKT/mTOR是调节细胞周期的重要细胞内信号通路。
PI3K/AKT/mTOR信号通路与细胞的休眠、增殖、癌变和寿命直接相关。
PI3K激活后磷酸化并激活AKT,将其定位在质膜中。
信号通过AKT传递到下游不同的靶点,如激活CREB,抑制p27,将FOXO定位于细胞质中,激活PtdIns-3ps,及激活mTOR(影响p70或4EBP1的转录)。
该通路的激活因子包括EGF、shh、IGF-1、胰岛素和CaM。
该信号通路的拮抗因子,包括PTEN、GSK3B、和HB9。
在多种癌症中,PI3K/AKT/mTOR通路是过度活化的,因此减少凋亡并促进增殖。
然而,该通路在成人干细胞尤其是神经干细胞的分化过程中促进细胞生长和增殖。
1. PI3KPhosphatidylinositide 3-kinases,是一种胞内磷脂酰肌醇激酶。
由调节亚基p85和催化亚基p110构成。
与v.sre和v.ras等癌基因的产物相关。
PI3K本身具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。
2. Akt又称PKB(protein kinase B)。
是一种丝氨酸/苏氨酸特异性蛋白激酶,在多种细胞生长过程中发挥关键作用,如葡萄糖代谢、凋亡、细胞增殖、转录和细胞迁移。
Akt的Ser473可以被PDK1磷酸化。
PKB与PKA和PKC均有很高的同源性,该激酶被证明是反转录病毒安基因v-akt 的编码产物,故又称Akt。
3. mTORMammalian target of rapamycin。
mTOR与其它蛋白质结合,形成两种不同蛋白质复合物,mTOR复合物1(mTORC1,)和mTOR复合物2(mTORC2),它们调节不同的细胞过程。
mTORC1由mTOR、mTOR调节相关蛋白Raptor、MLST8和非核心组分PRAS40、DEPTOR 组成。

PI3K—AKT—mTOR信号通路的研究进展PI3K-AKT-mTOR信号转导通路是哺乳动物肿瘤免疫中重要的信号通路,在多种恶性肿瘤的演变过程中发挥了极其重要的作用。
近几年来,随着肿瘤分子生物学的发展,恶性肿瘤的靶向治疗成为研究热点,通过研究探讨PI3K-AKT-mTOR信号通路在肿瘤发生、发展过程中的信号转导机制,联合多种抑制剂或者寻找作用于多种信号通路、多靶点的新药,对于肿瘤的靶向治疗有重要意义。
标签:PI3K-AKT-mTOR;信号转导;肿瘤;抑制剂恶性肿瘤严重危害人类健康,随着社会、经济的发展以及人口老龄化的加剧,我国大多数恶性肿瘤发病率、死亡率呈明显上升趋势。
与此同时,随着人们对恶性肿瘤的研究不断深入,越来越多肿瘤信号通路被发现,其中PI3K-AKT-mTOR 信号转导通路是哺乳动物肿瘤免疫中的重要信号通路,此信号通路对于调节细胞的生长、增殖、自噬以及凋亡有着重要的作用。
1 PI3K-AKT-mTOR 信号通路的组成在各种生物体中,细胞之间相互识别及相互作用,都是通过细胞信号的传导来实现,细胞信号转导指细胞通过细胞膜或者胞内相应受体感受信息分子刺激,通过细胞内信号转导系统进行转换,从而引发一系列生物化学反应及蛋白相互作用,直到细胞生理反应所需基因表达开始、各种生物学效应形成。
1.1 磷脂酰肌醇-3激酶(PI3K)PI3K存在于细胞质中,具有蛋白激酶及磷脂激酶的双重活性。
PI3K包括Ⅰ型、Ⅱ型、Ⅲ型,Ⅰ型的底物主要为磷脂酰肌醇(PI)、3-磷酸磷脂酰肌醇(PIP)及3,4-二磷酸磷脂酰肌醇(PIP2);Ⅱ型的底物主要为PI及PIP,Ⅲ型的底物主要为PI,但是只有Ⅰ型PI3K与肿瘤形成有着密切关联[1-2]。
Ⅰ型PI3K包括IA和IB亚型,它们从酪氨酸激酶连接受体、G蛋白连接受体进行信号传递,IA型PI3K由调节亚基(P58)和催化亚基(P110)组成,其中调节亚基(P58)包含SH2、SH3两个重要结构域,在正常情况下P58与P110结合导致PI3K失活。

PI3K-AKT-mTOR信号通路与前列腺癌PI3K / Akt / mTOR信号通路具有多种功能,包括调节细胞存活,分化和干细胞样特性,生长,增殖,代谢,迁移和血管生成。
成员:PI3K、AKT、mTOR、PTENPI3K,是磷脂酰肌醇-3-激酶的缩写,可分为3类,Ⅰ、Ⅱ、Ⅲ类。
其中研究最广泛的为Ⅰ类PI3K,Ⅰ类PI3K由酪氨酸激酶受体(RTK)、G蛋白偶联受体和一些致癌基因(如大鼠肉瘤癌基因RAS)激活。
Ⅰ类又可分ⅠA和ⅠB类,其中ⅠA类PI3K与癌症最相关。
p85α ( 由PIK3R1编码)β (由PIK3R2编码)γ ( 由PIK3R1编码)p110α( 由PIK3CA编码)p110β(由PIK3CB编码)p110δ(由PIK3CD编码)AKT(蛋白激酶B,PKB,又称为Akt)是PI3K重要的下游分子,被活化后,通过多种方式来影响其下游的相关分子,使细胞存活,是关键的抗凋亡调控分子mTOR(哺乳动物雷帕霉素靶蛋白)是一种丝氨酸-苏氨酸蛋白激酶,细胞内存在mTORC1和mTORC2两种不同的复合体。
其属于PI3K/Akt 下游的重要成分。
PTEN(磷酸酶和张力蛋白同源物))是一种肿瘤抑制蛋白。
可将PIP3去磷酸化生成PIP2。
当PTEN 下调时,可引起PI3K / Akt / mTOR 途径的激活。
PI3K-AKT-mTOR信号通路PI3K的激活导致4,5-二磷酸磷脂酰肌醇[PI(4,5)P2]磷酸化为3,4,5-三磷酸磷脂酰肌醇[PI(3,4,5)P3],随后将Akt募集到质膜上并激活。
(当配体与膜受体结合后,受体激活p85并招募p110,进而催化膜内表面的PIP2生成PI3P。
PI3P作为第二信使,进一步激活AKT和PDK1。
)Akt活化通过两个残基的磷酸化介导:T308通过磷酸肌醇依赖性蛋白激酶-1(PKD1)磷酸化;S473通过mTOR复合物2(TORC2)磷酸化。
Akt的完全激活是必需通过上述两者磷酸化。

RAS-RAF-MAPK信号通路与结直肠癌结直肠癌为结肠癌和直肠癌的总称,是指大肠(结肠、直肠)粘膜上皮在环境或遗传等多种致癌因素作用下发生的恶性病变。
它是消化道常见的恶性肿瘤,且预后不良,死亡率高,是全世界癌症死亡的主要原因。
近年各地资料显示随着人民生活水平的提高,饮食结构的改变,其发病率呈逐年上升趋势。
目前发现与结直肠癌有关的细胞信号转导通路主要有Wnt-β-catenin信号通路、Hedgehog信号通路、Notch信号通路、TGFβ-Smads信号通路、Jak-STAT信号通路、Ras-Raf-MAPK信号通路、PI3K-Akt-m TOR信号通路。
本文主要就MAPK信号通路及通路中常见突变与结直肠癌关系做简要介绍。
什么是MAPK信号通路?丝裂原活化蛋白激酶(mitogen-activatedproteinkinase,MAPK):是细胞内的一类丝氨酸/苏氨酸蛋白激酶。
从酵母到人类该信号通路非常保守,它能响应各种胞外和胞内刺激从而被激活,在多种细胞过程中发挥关键性作用,包括增殖、分化和凋亡等。
MAPK信号转导通路是多种膜受体传导的生长信号跨膜传递的交汇点或最后共同通路,参与细胞基质、生长因子、炎症反应等重要的信号途径,介导生长、发育、分裂、分化、凋亡以及细胞间相互作用等多种细胞过程。
通路途径主要由RAS→RAF→MEK→ERK等蛋白激酶组成,通过依次催化下级蛋白激酶发生磷酸化而激活整个信号通路,活化的ERK可以通过影响细胞周期MITF等因子促使细胞生长过度,导致正常细胞向肿瘤细胞转化。
MAPK信号通路包括:MAP激酶(MAPK)、MAPK激酶(MEK、MKK)和MEK激酶(MEKK、MKKK或MAPK激酶的激酶)。
MAPK通路信号的传送是通过MAPKKK,MAPKK和MAPK连续的磷酸化作用实现的。
苏氨酸和酪氨酸双重磷酸化的MAPK是其活性形式。
MAPK 去磷酸化是其非活化形式,抑制了其激酶活性。



细胞信号通路图解介绍之PI3KAkt信号通路丝/苏氨酸激酶Akt/PKB最初发现是作为一种原癌基因,现在已受到广泛的关注,因为其在很多的细胞活动中都起到关键性的作用,包括癌症的发展和胰岛素代谢。
Akt级联反应可以被许多机制激活,诸如受体酪氨酸激酶,整合素,B细胞和T细胞受体,细胞因子受体,G 蛋白偶联受体以及其他各种刺激,这些途径可以促使肌醇磷脂-3-激酶(PI3K )产生磷脂酰肌醇3,4,5 -三磷酸。
这些脂类物质为含有PH结构域(pleckstrin-homologydomain)的蛋白提供锚定位点,这些分子包括Akt和它的上游活化因子PDK1。
肿瘤抑制基因PTEN是一种公认的Akt的主要抑制剂,通常在人类肿瘤中会消失。
最近,越来越多的关注集中在磷酸酶(包括PHLIP)上,它能使Akt失活。
三种Akt的异构体(Akt1, Akt2,Akt3 )介导了许多PI3K 调控的下游通路。
Akt是胰岛素信号传递和葡萄糖代谢中主要的调节分子,小鼠的遗传学研究发现Akt2 在这些过程中起关键作用。
另外,现在已经发现癌症和胰岛素代谢在病理情况下会出现Akt的种系突变。
Akt作用于TSC1/TSC2复合物和mTOR信号通路来调控细胞生长;作用于CDK 的抑制分子P21和P27,并间接影响cyclinD1和p53的表达水平来调控细胞周期和细胞增殖。
Akt可以通过直接抑制促凋亡信号如促凋亡调节者Bad和Forkhead家族转录因子来促进细胞的存活。
T淋巴细胞转运到淋巴组织这个过程是由Akt下游的粘附因子的表达来控制的。
Akt还能调控神经元功能相关蛋白如GABA受体,ataxin-1 和huntingtin 分子。
最近,Akt又被发现能和Smad 分子结合调节TGF β信号传导。
最后,Akt对核纤层蛋白A抗原的磷酸化在核蛋白的结构组织中发挥作用。
这些发现使Akt/PKB成为在治疗癌症,糖尿病,中风和神经退行性疾病中的重要靶点。

PI3K/Akt/mTOR信号通路关键词:信号通路抑制剂细胞目的:通过特异性阻断PI3K和mTOR,观察HepG2和Hep3B细胞株PI3K/Akt/mTOR信号通路活性及生物学行为的改变,探讨相关的分子机制。
方法:在培养的HepG2、Hep3B人肝癌细胞株和人正常肝细胞株QSG-7701上,以免疫印迹方法(Western blot)检测各细胞株中PI3K(p110α亚单位)、PTEN、pAkt(S473,T308)和p-mTOR(S2448)的表达情况;分别用PI3K抑制剂LY294002(50μmol/ml)和mTOR抑制剂Rapamycin(RAPA,50 nmol/ml)孵育HepG2和Hep3B细胞,以MTT比色法检测细胞的增殖能力,以流式细胞术(Flow cytometry)检测细胞周期和凋亡情况,以Western blot法检测细胞中pAkt(S473,T308)和p-mTOR(S2448)的表达改变。
结果:PTEN在HepG2和Hep3B细胞中基本无表达,在QSG-7701细胞株中高表达,pAkt和p-mTOR在HepG2和Hep3B细胞中的表达较QSG-7701细胞均显著升高;LY294002和RAPA均呈剂量-时间依赖的抑制HepG2和Hep3B细胞生长。
饱和效应浓度的LY294002和RAPA作用24小时后,HepG2和Hep3B 细胞均呈现明显的G0/G1期阻滞,处于S期的细胞比例较对照组显著减少(P<0.01);两给药组中HepG2细胞和Hep3B细胞的凋亡率与对照组比较均显著增加(P<0.01);两给药组HepG2细胞的凋亡率显著高于Hep3B细胞(P<0.01或P<0.05),并且HepG2细胞的凋亡率在RAPA给药组显著高于LY294002给药组(P<0.01),但Hep3B细胞的凋亡率在两组间无显著差异。
饱和效应浓度的LY294002作用48小时后,HepG2和Hep3B细胞中pAkt(T308,S473)和p-mTOR(S2448)的表达水平较对照组均显著降低(P<0.01),饱和效应浓度的RAPA作用48小时后,HepG2和Hep3B细胞中P-mTOR(S2448)的表达水平较对照组均显著降低(P<0.01),而pAkt(T308,S473)的表达水平较对照组均显著升高(分别P<0.01)。
PI3KAktmTOR信号通路和靶向药物PI3K/AKT/mTOR信号通路的梳理着实不易,寄希望该贴梳理的知识帮助到患者和家属。
很多癌种都会涉及这个信号通路,很多患者都面对这个信号通路的药物问题。
经常读报告看到mTOR抑制剂的靶向药物推荐,而且很多基因突变都与该种类型的靶向药物相关,我印象中的基因有PIK3CA,PTEN、NF1等等。
当然也不是这些基因随便某个位点出现了改变就可以用mTOR抑制剂,某些变异只是良性多态性,没有影响到蛋白的结构和功能,对于肿瘤的增殖没有影响,相对应的靶向药物推荐也就没有意义。
一、PI3K信号通路的突变类型我们不从信号通路的科学去阐释,如此繁多的术语和英文字符看的我自己都头疼,我们先用尽量简单的语言去看PI3K信号通路的突变类型有哪些,该信号通路的激活经常是通过关键节点的直接突变,如PIK3CA和AKT1的激活突变或扩增,以及PTEN这个负调控基因的失活突变。
另外PI3K信号通路的激活也可能源于RAS基因,下面的图1是PI3K信号通路的组成部分、和相互之间的抑制和激活关系。
图1:PI3K/AKT信号通路。
图1突变的机制包含受体酪氨酸激酶和原癌基因(如ERBB2,KRAS)的基因扩增/突变,PIK3CA、AKT、TSC1/2、mTOR的突变。
抑癌基因如PTEN、INPP4B和LKB1的失活突变。
mTOR激酶包含两个核蛋白TORC1和TORC2,分别位于AKT基因的上游和下游。
粉红色背景框的是原癌基因,而蓝色背景框的是抑癌基因。
需要注意的是,MEK和ERK蛋白是涉及到PI3K信号通路中的。
所以有时要把两种信号通路的靶向药物联合起来开展临床试验的原因。
下面的图2是具体的某些基因的突变形式,以及它们出现的肿瘤类型。
图2:PI3K信号通路相关的基因突变二、针对mTOR的靶向药物mTOR是一个丝氨酸——苏氨酸激酶,属于PI3K相关的激酶家族,参与介导生长、营养、能量获取等来调控细胞增殖、凋亡等。
肿瘤的细胞信号通路与治疗靶点在现代医学领域中,肿瘤的产生和发展是一个复杂的过程,涉及到多个细胞信号通路的异常活化。
了解这些异常信号通路以及相关的治疗靶点对于肿瘤的治疗具有重要意义。
本文将介绍几个常见的肿瘤细胞信号通路,以及相关的治疗靶点。
一、PI3K/AKT/mTOR 通路PI3K/AKT/mTOR 通路是细胞命运决定的关键通路之一,它参与细胞生长、增殖、存活以及代谢等生理过程。
在肿瘤细胞中,这一通路常常被异常激活,导致肿瘤的增长和扩散。
因此,该通路成为肿瘤治疗的重要靶点之一。
目前已经有一些针对该通路的治疗药物问世,如白藜芦醇、雷帕霉素等,它们能够靶向抑制该通路,从而阻断肿瘤的生长和扩散。
二、RAS/MAPK 通路RAS/MAPK 通路是细胞增殖和分化的重要调节通路,它负责细胞对外界环境刺激的响应。
当这一通路发生异常激活时,会导致肿瘤的形成。
因此,该通路也是肿瘤治疗的重要靶点之一。
目前,一些靶向该通路的小分子抑制剂已经在临床上应用,如来那度胺、曲妥珠单抗等,它们能够抑制该通路中的关键蛋白激酶,从而阻断肿瘤细胞的增殖和扩散。
三、Wnt/β-catenin 通路Wnt/β-catenin 通路是细胞极性和细胞命运决定的重要调节通路之一,它对于细胞增殖和分化具有重要作用。
该通路在肿瘤中常常出现异常激活,促进肿瘤的生长和转移。
因此,该通路也成为肿瘤治疗的重要靶点之一。
目前已经有一些靶向该通路的治疗药物问世,如力扑平、以色列方程式等,它们能够抑制该通路的异常活化,从而阻止肿瘤的发展。
四、VEGF/VEGFR 通路VEGF/VEGFR 通路是血管生成的主要调控通路,也是肿瘤的血供来源。
该通路在肿瘤细胞中常常过度表达,导致肿瘤的血管生成和转移。
因此,该通路是肿瘤治疗的重要靶点之一。
一些VEGF或VEGFR的抑制剂已经应用于肿瘤的治疗,如贝伐珠单抗、舒尼替尼等,它们能够抑制该通路的异常活化,从而抑制肿瘤的血管生成和生长。
经典信号通路之PI3K-AKT-mTOR信号通路PI3K是一种胞内磷脂酰肌醇激酶,与v.src和v.ras等癌基因的产物相关,且PI3K本身具有丝氨酸/苏氨酸(Ser/Thr)激酶的活性,也具有磷脂酰肌醇激酶的活性。
由调节亚基p85和催化亚基p110构成。
磷脂酰肌醇3-激酶(PI3Ks)蛋白家族参与细胞增殖、分化、凋亡和葡萄糖转运等多种细胞功能的调节。
PI3K活性的增加常与多种癌症相关。
PI3K磷 酸化磷脂酰肌醇PI(一种膜磷脂)肌醇环的第3位碳原子。
PI在细胞膜组分中所占比例较小,比磷脂酰胆碱、磷脂酰乙醇胺和磷脂酰丝氨酸含量少。
但在脑细胞膜中,含量较为丰富,达磷脂总量的10%。
PI的肌醇环上有5个可被磷酸化的位点,多种激酶可磷酸化PI肌醇环上的4th和5th位点,因而通常在这两位点之一或两位点发生磷酸化修饰,尤其发生在质膜内侧。
通常,PI-4,5-二磷酸(PIP2)在磷脂酶C的作用下,产生二酰甘油(DAG)和肌醇-1,4,5-三磷酸。
PI3K转移一个磷酸基团至位点3,形成的产物对细胞的功能具有重要的影响。
譬如,单磷酸化的PI-3-磷酸,能刺激细胞迁移(cell trafficking),而未磷酸化的则不能。
PI-3,4-二磷酸则可促进细胞的增殖(生长)和增强对凋亡的抗性,而其前体分子PI-4-磷酸则不 然。
PIP2转换为PI-3,4,5-三磷酸,可调节细胞的黏附、生长和存活。
PI3K的活化PI3K可分为3类,其结构与功能各异。
其中研究最广泛的为I类PI3K, 此类PI3K为异源二聚体,由一个调节亚基和一个催化亚基组成。
调节亚基含有SH2和SH3结构域,与含有相应结合位点的靶蛋白相作用。
该亚基通常称为p85, 参考于第一个被发现的亚型(isotype),然而目前已知的6种调节亚基,大小50至110kDa不等。
催化亚基有4种,即p110α,β,δ,γ,而δ仅限于白细胞,其余则广泛分布于各种细胞中。