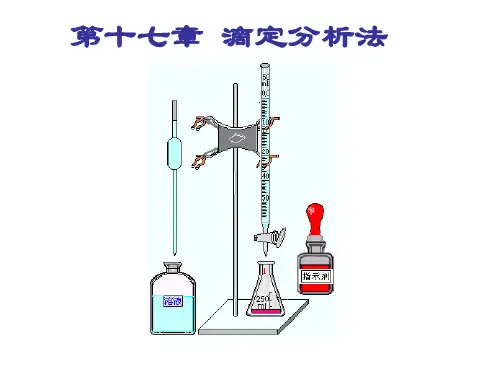
滴定分析法
- 格式:doc
- 大小:50.00 KB
- 文档页数:7


滴定分析法3.2滴定分析法3.2.1 滴定分析法的特点与分类滴定分析法是将一种已知准确浓度的试剂溶液,通过滴定管滴加到被测物质的溶液中,获奖被测物质的溶液滴加到已知准确浓度的溶液中,直到所加的试剂溶液与被测物质按化学计量关系完全反应为止,根据所用试剂溶液的浓度和消耗的体积,计算被测物质含量的方法。
这种分析方法的操作手段主要是滴定,因此称为滴定分析法。
又因这一类分析方法是以测量容积为基础的分析方法,所以又称容量分析法。
已知准确浓度的试剂融液称为标准溶液(又称为滴定剂或滴定液)。
将标准溶液从滴定管中滴加到被测物质溶液中的操作过程称为滴定。
当加入的标准溶液中物质的量与被测组分物质的量恰好符合化学反应时所表示的化学计量关系时,称为反应达到化学计量点,亦称等量点或等当点。
许多滴定反应在到达化学计量点时外观上没有明显的变化,为了确定化学计量点的到达,在实际滴定操作时,常在被测物质的溶液中加入一种辅助试剂,借助于其颜色变化作为化学计量点到达的标志,这种能通过颜色变化指示剂到达化学计量点的辅助试剂称为指示剂。
在滴定过程中,指示剂发生颜色变化的转变点成为滴定终点。
化学计量点是根据化学反应的计量关系求得的理论值,而滴定终点是实际滴定时的测量值,只有在理想情况下滴定终点才能完全一致。
在实际测定中,指示剂往往不是恰好在到达化学计量点的一瞬间变色,两者不一定完全符合,这种由滴定终点与化学计量点不一定恰好符合而造成的分析误差称为终点误差或滴定误差。
它的大小取决于化学反应的完全程度和指示剂的选择是否恰当。
因此,为了减小终点误差,应选择合适的指示剂,使滴定终点尽可能接近化学计量点。
滴定分析法通常适用于被测组分的含量在1%以上的常量组分的分析,具有操作简便、快速、所用仪器简单、准确、价格便宜的特点。
一般情况下相对平均偏差在0.2%以下。
各测量值及分析结果的有效数字位数为四位。
根据标准溶液与被测物质间所发生的化学反应类型不同,将滴定分析法分为酸碱滴定法(又称中和法)、沉淀滴定法、配位滴定法和氧化还原滴定法四大类。


滴定分析的分析方法滴定分析是一种常用的分析方法,它通过溶液中的酸碱反应进行定量分析。
滴定分析的基本原理是根据酸碱中和反应的化学方程式和定量关系,通过滴定液的加入,确定滴定点的位置,从而计算出待测溶液中溶质的浓度或化学计量数。
滴定分析的基本步骤包括:准确量取待测溶液,加入适当的指示剂,利用滴定管从滴定瓶中加入滴定液,当待测溶液中的溶质已与滴定液发生完全反应时,滴定反应到达终点,在滴定瓶中滴加过量的滴定液,直至指示剂颜色发生明显变化。
通过滴定液的用量(滴定体积)和滴定液的浓度,可以计算出待测溶液中溶质的浓度或化学计量数。
滴定分析可以分为酸碱滴定、氧化还原滴定、络合滴定和沉淀滴定等不同的类型。
下面将分别介绍这些类型的滴定分析方法。
1. 酸碱滴定:酸碱滴定是最常见的滴定分析方法,用于测定待测溶液中的酸或碱的浓度。
常用的滴定酸碱对有酸钠溶液对标准酸和碳酸钠溶液对标准碱。
滴定结束时,滴定液与待测溶液达到化学计量比例,pH值发生明显变化。
2. 氧化还原滴定:氧化还原滴定是利用氧化还原反应进行定量分析的方法。
常见的氧化还原滴定有碘量法、亚铁量法和过氧化氢量法等。
滴定过程中,滴定剂与待测溶液发生氧化还原反应,溶液颜色或电位发生明显变化。
3. 络合滴定:络合滴定是利用配位化学中金属离子与配体的配位反应进行定量分析的方法。
常见的络合滴定有硬络合滴定、铁计法和EDTA滴定等。
滴定时,滴定剂与待测溶液中的金属离子或配体形成稳定的络合物,滴定剂与待测溶液达到化学计量比例后,化学指示剂的颜色发生明显变化。
4. 沉淀滴定:沉淀滴定是利用沉淀反应进行定量分析的方法。
常见的沉淀滴定有氯化银沉淀滴定和氯化钡沉淀滴定等。
滴定时,滴定剂与待测溶液中的阳离子或阴离子发生反应,生成可见的沉淀物,从而判断滴定结束的标志。
在进行滴定分析时,有一些基本的实验技巧需要注意。
首先,需要准确量取待测溶液和滴定液,使用准确的量杯或容量瓶,并控制好温度和湿度。


分析化学四大滴定总结滴定分析法又称为容量分析法,是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
这其中又有重要的四大滴定方法。
以下是店铺整理的分析化学四大滴定总结,欢迎查看。
一、酸碱滴定原理:利用酸和碱在水中以质子转移反应为基础的滴定分析方法。
可用于测定酸、碱和两性物质。
其基本反应为H﹢+OH﹣=H2O也称中和法,是一种利用酸碱反应进行容量分析的方法。
用酸作滴定剂可以测定碱,用碱作滴定剂可以测定酸,这是一种用途极为广泛的分析方法。
最常用的酸标准溶液是盐酸,有时也用硝酸和硫酸。
标定它们的基准物质是碳酸钠Na2CO3。
方法简介:最常用的碱标准溶液是氢氧化钠,有时也用氢氧化钾或氢氧化钡,标定它们的基准物质是邻苯二甲酸氢钾KHC8H4O6或草酸H2C2O·2H2O:OH+HC8H4O6ˉ→C8H4O6ˉ+H2O如果酸、碱不太弱,就可以在水溶液中用酸、碱标准溶液滴定。
离解常数 A和Kb是酸和碱的强度标志。
当酸或碱的浓度为0.1M,而且A或Kb大于10-7时,就可以准确地滴定,一般可准确至0.2%。
多元酸或多元碱是分步离解的,如果相邻的离解常数相差较大,即大于104,就可以进行分步滴定,这种情况下准精确度不高,误差约为1%。
盐酸滴定碳酸钠分两步进行:﹢ˉCO32-+H→HCO3HCO3ˉ+H﹢→CO2↑+H2O相应的滴定曲线上有两个等当点,因此可用盐酸来测定混合物中碳酸钠和碳酸氢钠的含量,先以酚酞(最好用甲酚红-百里酚蓝混合指示剂)为指示剂,用盐酸滴定碳酸钠至碳酸氢钠,再加入甲基橙指示剂,继续用盐酸滴定碳酸氢钠为二氧化碳,由前后消耗的盐酸的体积差可计算出碳酸氢钠的含量。
某些有机酸或有机碱太弱,或者它们在水中的溶解度小,因而无法确定终点时,可选择有机溶剂为介质,情况就大为改善。
这就是在非水介质中进行的酸碱滴定。
有的非酸或非碱物质经过适当处理可以转化为酸或碱。
然后也可以用酸碱滴定法测定之。

滴定分析法名词解释
滴定分析法是一种常用于测定物质含量的分析手段。
它通过加入一种已知浓度的试剂(称为滴定剂)来与待测物质进行反应,从而确定待测物质的含量。
在滴定分析法中,试样通常以溶液的形式存在。
首先,需要取适量的试样加入反应容器中。
然后,使用滴定管将滴定剂滴入试样溶液中,滴定过程中需要进行颜色指示。
当滴定剂与试样中的物质反应完全时,颜色发生突变,这时需要统计记录滴定剂的用量,从而确定试样中物质的含量。
滴定分析法有多种类型,其中最常见的是酸碱滴定法。
在酸碱滴定中,酸溶液的酸度可以通过滴定一定浓度的碱溶液来测定;同样地,碱溶液的碱度也可以通过滴定一定浓度的酸溶液来测定。
此外,氧化还原滴定法和络合滴定法也是常用的滴定分析方法。
滴定分析法的精确度主要依赖于滴定剂的浓度和试样的准确配制。
因此,在实际操作中需要注意滴定剂和试样的溶解度、匀浆度和温度等因素,以提高滴定分析的准确性。
滴定分析法广泛应用于化学、生物、医药等领域。
它可以用于分析酸碱度、氧化还原性质以及配位络合等方面的问题。
例如,在药学领域中,滴定分析法可用于测定药物的含量;在环境监测领域中,滴定分析法可以测定水样中各种污染物的含量。
总之,滴定分析法是一种常用且有效的分析手段,通过滴定剂
与试样反应的完全性来测定物质的含量。
滴定分析法准确度高,广泛应用于各个领域。

滴定分析法,又叫容量分析法,将已知准确浓度的标准溶液,滴加到被测溶液中(或者将被测溶液滴加到标准溶液中),直到所加的标准溶液与被测物质按化学计量关系定量反应为止,然后测量标准溶液消耗的体积,根据标准溶液的浓度和所消耗的体积,算出待测物质的含量。
这种定量分析的方法称为滴定分析法,它是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
特点1. 加入标准溶液物质的量与被测物质的量恰好是化学计量关系;2. 此法适于组分含量在1%以上各种物质的测定;3. 该法快速、准确、仪器设备简单、操作简便;4.用途广泛。
根据标准溶液和待测组分间的反应类型的不同,分为四类1. 酸碱滴定法——以质子传递反应为基础的一种滴定分析方法2. 配位滴定法——以配位反应为基础的一种滴定分析方法3. 氧化还原滴定法——以氧化还原反应为基础的一种滴定分析方法5.非水溶液滴定法--愉滴定反应的介质分类原理滴定滴定分析法是将一种已知准确浓度的试剂溶液,滴加到被测物质的溶液中,直到所加的试剂与被测物质按化学计量定量反应为止,根据试剂溶液的浓度和消耗的体积,计算被测物质的含量。
这种已知准确浓度的试剂溶液称为滴定液。
将滴定液从滴定管中加到被测物质溶液中的过程叫做滴定。
当加入滴定液中物质的量与被测物质的量按化学计量定量反应完成时,反应达到了计量点。
在滴定过程中,指示剂发生颜色变化的转变点称为滴定终点。
滴定终点与计量点不一定恰恰符合,由此所造成分析的误差叫做滴定误差。
具备条件适合滴定分析的化学反应应该具备以下几个条件:(1)反应必须按方程式定量地完成,通常要求在99.9%以上,这是定量计算的基础。
(2)反应能够迅速地完成(有时可加热或用催化剂以加速反应)。
(3)共存物质不干扰主要反应,或用适当的方法消除其干扰。
(4)有比较简便的方法确定计量点(指示滴定终点)。
分析方式直接滴定法所谓直接滴定法,是用标准溶液直接滴定被测物质的一种方法。

滴定分析法一、特点和种类滴定分析法,是化学分析法的一种,将一种已知其准确浓度的试剂溶液(称为标准溶被)滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测组分的含量,这种方法称为滴定分析法(或称容量分析法)。
滴定分析法,又叫容量分析法,将已知准确浓度的标准溶液,滴加到被测溶液中(或者将被测溶液滴加到标准溶液中),直到所加的标准溶液与被测物质按化学计量关系定量反应为止,然后测量标准溶液消耗的体积,根据标准溶液的浓度和所消耗的体积,算出待测物质的含量。
这种定量分析的方法称为滴定分析法,它是一种简便、快速和应用广泛的定量分析方法,在常量分析中有较高的准确度。
(一)特点1. 加入标准溶液物质的量与被测物质的量恰好是化学计量关系;2. 此法适于组分含量在1%以上各种物质的测定;3. 该法快速、准确、仪器设备简单、操作简便;4.用途广泛。
(二)分类根据标准溶液和待测组分间的反应类型的不同,分为四类1. 酸碱滴定法——以质子传递反应为基础的一种滴定分析方法2. 配位滴定法——以配位反应为基础的一种滴定分析方法3. 氧化还原滴定法——以氧化还原反应为基础的一种滴定分析方法4. 沉淀滴定法——以沉淀反应为基础的一种滴定分析方法5. 非水溶液滴定法--愉滴定反应的介质分类(三)滴定滴定分析法是将一种已知准确浓度的试剂溶液,滴加到被测物质的溶液中,直到所加的试剂与被测物质按化学计量定量反应为止,根据试剂溶液的浓度和消耗的体积,计算被测物质的含量。
这种已知准确浓度的试剂溶液称为滴定液。
将滴定液从滴定管中加到被测物质溶液中的过程叫做滴定。
当加入滴定液中物质的量与被测物质的量按化学计量定量反应完成时,反应达到了计量点。
在滴定过程中,指示剂发生颜色变化的转变点称为滴定终点。
滴定终点与计量点不一定恰恰符合,由此所造成分析的误差叫做滴定误差。
(四)具备条件适合滴定分析的化学反应应该具备以下几个条件:(1)反应必须按方程式定量地完成,通常要求在99.9%以上,这是定量计算的基础。
(2)反应能够迅速地完成(有时可加热或用催化剂以加速反应)。
(3)共存物质不干扰主要反应,或用适当的方法消除其干扰。
(4)有比较简便的方法确定计量点(指示滴定终点)。
(四)分析方式1、直接滴定法所谓直接滴定法,是用标准溶液直接滴定被测物质的一种方法。
凡是能同时满足上述3个条件的化学反应,都可以采用直接滴定法。
直接滴定法是滴定分析法中最常用、最基本的滴定方法。
例如用HCl滴定NaOH,用K2Cr2O7滴定Fe2+等。
往往有些化学反应不能同时满足滴定分析的三点要求,这时可选用下列几种方法之一进行滴定。
2、返滴定法当遇到下列几种情况下,不能用直接滴定法。
第一,当试液中被测物质与滴定剂的反应慢,如Al3+与EDTA的反应,被测物质有水解作用时。
第二、用滴定剂直接滴定固体试样时,反应不能立即完成。
如HCl滴定固体CaCO3。
第三,某些反应没有合适的指示剂或被测物质对指示剂有封闭作用时,如在酸性溶液中用AgNO3滴定Cl–缺乏合适的指示剂。
对上述这些问题,通常都采用返滴定法。
返滴定法就是先准确地加入一定量过量的标准溶液,使其与试液中的被测物质或固体试样进行反应,待反应完成后,再用另一种标准溶液滴定剩余的标准溶液。
例如,对于上述Al3+的滴定,先加入已知过量的EDTA标准溶液,待Al3+与EDTA反应完成后,剩余的EDTA则利用标准Zn2+、Pb2+或Cu2+溶液返滴定;对于固体CaCO3的滴定,先加入已知过量的HCl标准溶液,待反应完成后,可用标准NaOH溶液返滴定剩余的HCl;对于酸性溶液中Cl的滴定,可先加入已知过量的AgNO3标准溶液使Cl沉淀完全后,再以三价铁盐作指示剂,用NH4SCN标准溶液返滴定过量的Ag+,出现[Fe(SCN)]2+淡红色即为终点。
3、臵换滴定法对于某些不能直接滴定的物质,也可以使它先与另一种物质起反应,臵换出一定量能被滴定的物质来,然后再用适当的滴定剂进行滴定。
这种滴定方法称为臵换滴定法。
例如硫代硫酸钠不能用来直接滴定重铬酸钾和其他强氧化剂,这是因为在酸性溶液中氧化剂可将S2O32–氧化为S4O62–或SO42–等混合物,没有一定的计量关系。
但是,硫代硫酸钠却是一种很好的滴定碘的滴定剂。
这样一来,如果在酸性重铬酸钾溶液中加入过量的碘化钾,用重铬酸钾臵换出一定量的碘,然后用硫代硫酸钠标准溶液直接滴定碘,计量关系便非常好。
实际工作中,就是用这种方法以重铬酸钾标定硫代硫酸钠标准溶液浓度的。
4、间接滴定法有些物质虽然不能与滴定剂直接进行化学反应,但可以通过别的化学反应间接测定。
例如高锰酸钾法测定钙就属于间接滴定法。
由于Ca2+在溶液中没有可变价态,所以不能直接用氧化还原法滴定。
但若先将Ca2+沉淀为CaC2O4,过滤洗涤后用H2SO4溶解,再用KMnO4标准溶液滴定与Ca2+结合的C2O42–,便可间接测定钙的含量。
显然,由于返滴定法、臵换滴定法、间接滴定法的应用,大大扩展了滴定分析的应用范围。
二、滴定液滴定液系指已知准确浓度的溶液,它是用来滴定被测物质的。
(一)配制1.直接法根据所需滴定液的浓度,计算出基准物质的重量。
准确称取并溶解后,臵于量瓶中稀释至一定的体积。
如配制滴定液的物质很纯(基准物质),且有恒定的分子式,称取时及配制后性质稳定等,可直接配制,根据基准物质的重量和溶液体积,计算溶液的浓度,但在多数情况是不可能的。
2.间接法根据所需滴定液的浓度,计算并称取一定重量试剂,溶解或稀释成一定体积,并进行标定,计算滴定液的浓度。
有些物质因吸湿性强,不稳定,常不能准确称量,只能先将物质配制近似浓度的溶液,再以基准物质标定,以求得准确浓度。
(二)标定标定系指用间接法配制好的滴定液,必须由配制人进行滴定度测定。
(三)标定份数标定份数系指同一操作者,在同一实验室,用同一测定方法对同一滴定液,在正常和正确的分析操作下进行测定的份数。
不得少于3份。
(四)复标复标系指滴定液经第一人标定后,必须由第二人进行再标定。
其标定份数也不得少于3份。
(五)误差限度1.标定和复标标定和复标的相对偏差均不得超过0.1%。
2.结果以标定计算所得平均值和复标计算所得平均值为各自测得值,计算二者的相对偏差,不得超过0.15%。
否则应重新标定。
3.结果计算如果标定与复标结果满足误差限度的要求,则将二者的算术平均值作为结果。
(六)使用期限滴定液必须规定使用期。
除特殊情况另有规定外,一般规定为一到三个月,过期必须复标。
出现异常情况必须重新标定。
(七)范围滴定液浓度的标定值应与名义值相一致,若不一致时,其最大与最小标定值应在名义值的±5%之间。
三、对滴定反应的要求1. 反应要按一定的化学方程式进行,即有确定的化学计量关系;2. 反应必须定量进行——反应接近完全(>99.9%);3. 反应速度要快——有时可通过加热或加入催化剂方法来加快反应速度;4. 必须有适当的方法确定滴定终点——简便可靠的方法:合适的指示剂。
四、滴定方式1. 直接滴定法2. 反滴定法3. 臵换滴定法4. 间接滴定法标准溶液和标准物质标准溶液:已知准确浓度的溶液基准物质:能直接配成标准溶液的物质(一)基准物质须具备的条件(1)组成恒定:实际组成与化学式符合;(2)纯度高:一般纯度应在99.5%以上;(3)性质稳定:保存或称量过程中不分解、不吸湿、不风化、不易被氧化等;(4)具有较大的摩尔质量:称取量大,称量误差小;(5)使用条件下易溶于水(或稀酸、稀碱)。
(二)标准溶液的配制1. 标准溶液浓度大小选择的依据(1)滴定终点的敏锐程度;(2)测量标准溶液体积的相对误差;(3)分析试样的成分和性质;(4)对分析结果准确度的要求。
(三)配臵标准溶液的方法(1)直接配制:准确称量一定量的用基准物质,溶解于适量溶剂后定量转入容量瓶中,定容,然后根据称取基准物质的质量和容量瓶的体积即可算出该标准溶液的准确浓度。
(2)间接配制:先配制成近似浓度,然后再用基准物或标准溶液标定(标定一般要求至少进行 3~4 次平行测定,相对偏差在 0.1~0.2% 之间)(四)标准溶液浓度的表示方法(1)物质的量浓度c;(2)物质的质量浓度滴定分析误差(一般要求相对误差± 0.1%)1. 称量误差每次称量误差:± 0.0001g,一份试样称量误差±0.0002g,若相对误差±0.1%,则每一份试样的称量至少为0.2g。
2. 量器误差滴定管读数误差:± 0. 01ml,一份试样量取误差± 0. 02ml,若相对误差±0.1%,则每一份试样体积量至少为±20 ml3. 方法误差:主要是终点误差终点误差——滴定终点与理论终点(化学计量点)不符引起的误差(1)指示剂不能准确地在化学计量点时改变颜色(2)标准溶液的加入不可能恰好在指示剂变色时结束:接近终点时半滴半滴加入 !(3)指示剂本身会消耗少量标准溶液做空白试验(4)杂质消耗标准溶液五、滴定管的种类(1)酸式滴定管(玻塞滴定管)酸式滴定管的玻璃活塞是固定配合该滴定管的,所以不能任意更换。
要注意玻塞是否旋转自如,通常是取出活塞,拭干,在活塞两端沿圆周抹一薄层凡士林作润滑剂(或真空活塞油脂),然后将活塞插入,顶紧,旋转几下使凡士林分布均匀(几乎透明)即可,再在活塞尾端套一橡皮圈,使之固定。
注意凡士林不要涂得太多,否则易使活塞中的小孔或滴定管下端管尖堵塞。
在使用前应试漏。
一般的滴定液均可用酸式滴定管,但因碱性滴定液常使玻塞与玻孔粘合,以至难以转动,故碱性滴定液宜用碱式滴定管。
但碱性滴定液只要使用时间不长,用毕后立即用水冲洗,亦可使用酸式滴定管。
(2)碱式滴定管碱式滴定管的管端下部连有橡皮管,管内装一玻璃珠控制开关,一般用做碱性滴定液的滴定。
其准确度不如酸式滴定管,只要由于橡皮管的弹性会造成液面的变动。
具有氧化性的溶液或其他易与橡皮起作用的溶液,如高锰酸钾、碘、硝酸银等不能使用碱式滴定管。
在使用前,应检查橡皮管是否破裂或老化及玻璃珠大小是否合适,无渗漏后才可使用。
(3)使用前的准备a 在装滴定液前,须将滴定管洗净,使水自然沥干(内壁应不挂水珠),先用少量滴定液荡洗三次,(每次约5~10ml),除去残留在管壁和下端管尖内的水,以防装入滴定液被水稀释。
b 滴定液装入滴定管应超过标线刻度零以上,这时滴定管尖端会有气泡,必须排除,否则将造成体积误差。
如为酸式滴定管可转动活塞,使溶液的急流逐去气泡;如为碱式滴定管,则可将橡皮管弯曲向上,然后捏开玻珠,气泡即可被溶液排除。
c 最后,再调整溶液的液面至刻度零处,即可进行滴定。
滴定管操作注意事项a 滴定管在装满滴定液后,管外壁的溶液要擦干,以免流下或溶液挥发而使管内溶液降温(在夏季影响尤大)。