1 锗和硅的化学制备
- 格式:pdf
- 大小:230.84 KB
- 文档页数:12
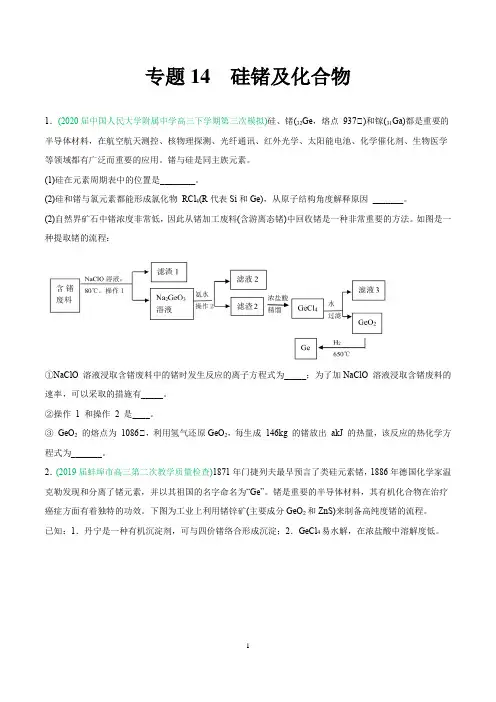
专题14 硅锗及化合物1.(2020届中国人民大学附属中学高三下学期第三次模拟)硅、锗(32Ge,熔点937℃)和镓(31Ga)都是重要的半导体材料,在航空航天测控、核物理探测、光纤通讯、红外光学、太阳能电池、化学催化剂、生物医学等领域都有广泛而重要的应用。
锗与硅是同主族元素。
(1)硅在元素周期表中的位置是________。
(2)硅和锗与氯元素都能形成氯化物RCl4(R代表Si和Ge),从原子结构角度解释原因_______。
(2)自然界矿石中锗浓度非常低,因此从锗加工废料(含游离态锗)中回收锗是一种非常重要的方法。
如图是一种提取锗的流程:①NaClO 溶液浸取含锗废料中的锗时发生反应的离子方程式为_____;为了加NaClO 溶液浸取含锗废料的速率,可以采取的措施有_____。
②操作1 和操作2 是____。
③GeO2的熔点为1086℃,利用氢气还原GeO2,每生成146kg 的锗放出akJ 的热量,该反应的热化学方程式为_______。
2.(2019届蚌埠市高三第二次教学质量检查)1871年门捷列夫最早预言了类硅元素锗,1886年德国化学家温克勒发现和分离了锗元素,并以其祖国的名字命名为“Ge”。
锗是重要的半导体材料,其有机化合物在治疗癌症方面有着独特的功效。
下图为工业上利用锗锌矿(主要成分GeO2和ZnS)来制备高纯度锗的流程。
已知:1.丹宁是一种有机沉淀剂,可与四价锗络合形成沉淀;2.GeCl4易水解,在浓盐酸中溶解度低。
(1)简述步骤①中提高酸浸效率的措施___________(写两种)。
(2)步骤②操作A 方法是___________。
(3)步骤③中的物质在___________(填仪器名称)中加热。
(4)步骤④不能用稀盐酸,原因可能是___________。
(5)写出步骤⑤的化学方程式___________。
写出步骤⑦的化学方程式___________。
(6)请写出一种证明步骤⑦反应完全的操作方法___________。


锗的制备方法锗是一种重要的半导体材料,广泛应用于电子、光电子和太阳能电池等领域。
本文介绍了几种常见的锗的制备方法,包括锗的提纯、单晶生长和薄膜制备等。
下面是本店铺为大家精心编写的3篇《锗的制备方法》,供大家借鉴与参考,希望对大家有所帮助。
《锗的制备方法》篇1一、锗的提纯锗的提纯主要有以下几种方法:1. 离子交换法:利用锗离子选择性强的阳离子交换树脂,将锗从含有锗的矿物中提取出来。
然后再通过电解法将锗离子还原成锗金属。
2. 气相法:将含有锗的矿物与氢气一起加热,使锗转化为挥发性锗氢化物。
然后将锗氢化物通过冷凝器冷却回收,再通过氢气还原法将锗氢化物还原成锗金属。
3. 湿法冶金法:将含有锗的矿物与硫酸、硝酸等强酸一起加热,使锗转化为水溶性的锗化合物。
然后通过离子交换、电解等方法将锗提取出来。
二、锗单晶生长锗单晶生长主要有以下几种方法:1. 直拉法 (Czochralski 法):将多晶锗加热融化,然后通过一个叫做“晶圆炉”的设备,将熔融的锗液体上升到一个细长的晶圆坩埚中。
在晶圆坩埚中,锗液体会慢慢凝固成晶体,然后慢慢被拉出成长为锗单晶。
2. 悬浮区熔法:将多晶锗加热融化,然后在一个高温高压下,将融化的锗通过一个叫做“悬浮区熔炉”的设备,使其在熔体中形成一个稳定的熔体区域。
在这个熔体区域内,锗原子可以自由移动,形成单晶。
三、锗薄膜制备锗薄膜制备主要有以下几种方法:1. 化学气相沉积法 (CVD 法):将锗前驱体气体引入一个反应室中,通过加热反应室和控制反应条件,使锗前驱体气体在基底表面发生化学反应,形成锗薄膜。
2. 溅射法:将锗靶材放置在真空腔中,通过加热靶材和控制真空腔中的气体压力,使锗靶材上的锗原子被溅射到基底表面,形成锗薄膜。
《锗的制备方法》篇2锗的制备方法主要有以下几种:1. 锗的矿物提取法:锗主要存在于硫化物矿物中,如闪锌矿、方铅矿、辉锑矿等。
将含有锗的矿物原料经过破碎、磨粉、选矿等工艺,得到含锗的精矿。

第一章硅、锗的化学制备㈠比较三氯氢硅氢还原法和硅烷法制备高纯硅的优缺点?答:1.S i HCl3氢还原法:优点: 产量大、质量高、成本低,由于S i HCl3中有一个S i-H键,活泼易分解,沸点低,容易制备、提纯和还原。
缺点:B、P杂质较难去除(基硼、基磷量),这是影响硅电学性能的主要杂质。
2.硅烷法:优点: 杂质含量小;无设备腐蚀;不使用还原剂;便于生长外延层。
缺点: 制备过程的安全性要求高。
㈡制得的高纯多晶硅的纯度:残留的B、P含量表示(基硼、基磷量)。
㈢*精馏提纯:利用混合液中各组分的沸点不同来达到分离各组分的目的。
第二章、区熔提纯1.以二元相图为例说明什么是分凝现象?平衡分凝系数?有效分凝系数?答:如图是一个二元相图,在一个系统中,当系统的温度为T0时,系统中有固相和液相。
由图中可知,固相中杂志含量Cs<C L(液相中杂志成分)。
1、这种含有杂志的晶态物质熔化后再结晶时,杂志在结晶的固体和未结晶的液体中浓度不同的现象叫做*分凝现象。
2、在一定温度下,平衡状态时,杂质在固液两相中浓度的比值K0=C S/C L叫作平衡分凝系数。
3、为了描述界面处薄层中杂质浓度偏离对固相中的杂质浓度的影响,把固相杂质浓度C S与熔体内部的杂质浓度C L0的比值定义为*有效分凝系数。
K eff=C S/C L02.推导BPS公式,说明各个物理量的含义并讨论影响分凝系数的因素。
答:*BPS公式推导:书P21~P23式中:K0为平衡分凝系数;K eff为有效分凝系数;f为固液相面的的移动速度;δ为扩散层厚度;D为扩散系数。
影响分凝系数的因素:①当f 远大于D/δ时, fD/δ→+∞,exp(-fD/δ) →0,Keff→1,即固液中杂质浓度差不多.分凝效果不明显。
②当f 远小于D/δ时, fD/δ→0,exp(-fD/δ) →1,Keff→K0,分凝效果明显。
③扩散层厚度和扩散系数,D/δ越小,分凝结果越差。

第一章硅和锗的化学制备第章和锗的化学制备§1-1 硅和锗的物理化学性质1、Si和Ge的物理性质Si、Ge——元素周期表中第Ⅳ族元素Si——银白色Ge——灰色二者熔体密度比固体密度大,故熔化后会体积收缩(锗收缩5.5%,而硅大约收缩10%)55%而硅大约收缩符硅锗性质号单位原子序数Z1432原子量W28.0872.60原子密度 5.22×1022 4.42×1022个/cm3晶体结构金刚石型金刚石型晶格常数a0.54310.5657nm密度d 2.329 5.323g/cm3熔点T1417937℃m沸点T b26002700℃热导率χ 1.570.60W/cm℃W/cm·比热C P0.69500.3140J/g· ℃线热胀系数α 2.33×10 5.75×10cm℃233-6575-6cm·-1性质符号硅锗单位熔化潜热Q 3956534750J/mol 冷凝时膨胀d v+9.0+5.5%介电常数ε11.716.3禁带宽度1153075(0K )E g 1.1530.75eV (300 K) 1.1060.67eV 电子迁移率13503900/V μn cm 2/V·s 空穴迁移率μP 4801900cm 2/V·s 电子扩散系数D n 34.6100.0cm 2/s 空穴扩散系数D P 12.348.7cm 2/s 本征电阻率p i 2.3×10546.0Ω·cm 本征载流子密度n 1.5×1010 2.4×1013cm -34i 杨氏摸量E1.9×107N/cm 2从硅锗的主要物理性质可以看出:1、硅的禁带宽度比锗大,电阻率比锗大四个数量级,Si 可用做高压器件,且工作温度比锗器件高;器件高2、锗的迁移率比硅大,可做低压大电流和高频器件。
2、Si和Ge的化学性质室温下,硅、锗的化学性质比较稳定,但可与强酸、强碱作用。


直拉单晶硅的制备硅、锗等单晶制备,就是要实现由多晶到单晶的转变,即原子由液相的随机排列直接转变为有序阵列;由不对称结构转变为对称结构。
但这种转变不是整体效应,而是通过固液界面的移动而逐渐完成的。
为实现上述转化过程,多晶硅就要经过由固态到熔融态,然后又由熔融态硅到固态晶体硅的转变。
这就是从熔体硅中生长单晶硅所遵循的途径。
从熔体中生长硅单晶的方法,目前应用最广泛的主要有两种:有坩埚直拉法和无坩埚悬浮区熔法。
在讨论这两种制备方法之前,还应讨论在制备单晶过程中必不可少的一些准备工序。
包括掺杂剂的选择、坩埚的选择、籽晶的制备等,分别介绍如下:一、掺杂在制备硅、锗单晶时,通常要加入一定数量杂质元素(即掺杂)。
加入的杂质元素决定了被掺杂半导体的导电类型、电阻率、少子寿命等电学性能。
掺杂元素的选择必须以掺杂过程方便为准,又能获得良好的电学性能和良好晶体完整性为前提。
1掺杂元素的选择(1)根据导电类型和电阻率的要求选择掺杂元素制备N型硅、锗单晶,必须选择Ⅴ族元素(如P、As、Sb、Bi);制备P型硅、锗单晶必须选择Ⅲ族元素(如B、Al、Ga、In、Ti)。
杂质元素在硅、锗晶体中含量的多少决定了硅、锗单晶的电阻率。
电阻率不仅与杂质浓度有关,而且与载流子的迁移率有关。
当杂质浓度较大时,杂质对载流子的散射作用,可使载流子的迁移率大大降低,从而影响材料的导电能力。
考虑到以上因素,从理论上计算了电阻率与杂质浓度的关系曲线,如图9-5所示。
在生产工艺上按电阻率的高低分档。
掺杂有三档:轻掺杂(适用于大功率整流级单晶)、中掺杂(适用于晶体管级单晶)、重掺杂(适用于外延衬底级单晶)。
(2)根据杂质元素在硅、锗中溶解度选择掺杂元素各种杂质元素在硅、锗中溶解度相差颇大。
例如,采用大溶解度的杂质,可以达到重掺杂的目的,又不会使杂质元素在晶体中析出影响晶体性能。
下表列出了常用掺杂元素在硅、锗单晶生长时掺入量的极限,超过了极限量,单晶生长不能进行。

锗是一种晶体硅锗合金材料,由硅、锗、磷等元素组成,具有半导体特性,被广泛应用于电子、光电和半导体领域。
锗提取工艺一般包括以下步骤:
1. 原料准备。
根据化学计量比例混合硅、锗、磷原料,然后将混合物进行破碎、筛分、洗涤等处理,得到粒度均匀的粉末。
2. 碳化炉反应。
将准备好的粉末装入碳化炉,并加入适量的氮气或氩气,使其在高温下进行反应,生成锗单质和碳化硅等产物。
3. 硼掺杂。
将生成的锗单质和碳化硅等材料进行混合,然后在一定条件下加入掺杂剂(如硼),进行掺杂处理。
4. 石墨坩埚熔炼。
将掺杂后的材料装入石墨坩埚中,在高温条件下进行熔炼处理,得到具有晶体结构的锗体。
5. 检测和加工。
对生成的锗体进行检测和测试,检查其性能是否符合要求,并进行裁切和打磨等加工,得到符合规格的锗体材料。
需要注意的是,锗体取工艺要求设备精度高,工艺流程严谨,操作技术熟练,且除尘排放等环保问题也需要得到重视。


半导体材料(复习资料)半导体材料复习资料0:绪论1.半导体的主要特征:(1)电阻率在10-3 ~ 109 ??cm 范围(2)电阻率的温度系数是负的(3)通常具有很高的热电势(4)具有整流效应(5)对光具有敏感性,能产生光伏效应或光电导效应2.半导体的历史:第一代:20世纪初元素半导体如硅(Si)锗(Ge);第二代:20世纪50年代化合物半导体如砷化镓(GaAs)铟磷(InP);第三代:20世纪90年代宽禁带化合物半导体氮化镓(GaN)碳化硅(SiC)氧化锌(ZnO)。
第一章:硅和锗的化学制备第一节:硅和锗的物理化学性质1.硅和锗的物理化学性质1)物理性质硅和锗分别具有银白色和灰色金属光泽,其晶体硬而脆。
二者熔体密度比固体密度大,故熔化后会发生体积收缩(锗收缩5.5%,而硅收缩大约为10%)。
硅的禁带宽度比锗大,电阻率也比锗大4个数量级,并且工作温度也比锗高,因此它可以制作高压器件。
但锗的迁移率比硅大,它可做低压大电流和高频器件。
2)化学性质(1)硅和锗在室温下可以与卤素、卤化氢作用生成相应的卤化物。
这些卤化物具有强烈的水解性,在空气中吸水而冒烟,并随着分子中Si(Ge)?H键的增多其稳定性减弱。
(2)高温下,化学活性大,与氧,水,卤族(第七族),卤化氢,碳等很多物质起反应,生成相应的化合物。
注:与酸的反应(对多数酸来说硅比锗更稳定);与碱的反应(硅比锗更容易与碱起反应)。
2.二氧化硅(SiO2)的物理化学性质物理性质:坚硬、脆性、难熔的无色固体,1600℃以上熔化为黏稠液体,冷却后呈玻璃态存在形式:晶体(石英、水晶)、无定形(硅石、石英砂) 。
化学性质:常温下,十分稳定,只与HF、强碱反应3.二氧化锗(GeO2)的物理化学性质物理性质:不溶于水的白色粉末,是以酸性为主的两性氧化物。
两种晶型:正方晶系金红石型,熔点1086℃;六方晶系石英型,熔点为1116℃化学性质:不跟水反应,可溶于浓盐酸生成四氯化锗,也可溶于强碱溶液,生成锗酸盐。

《半导体材料》教学大纲课程名称:半导体材料课程类别:选修课适用专业:材料化学考核方式:考查总学时、学分:32 学时、2学分一、课程教学目的《半导体材料》是化学与材料科学学院材料化学专业的一门选修课。
半导体科学发展的基础。
本课程主要介绍半导体晶体生长方面的基础理论知识,初步掌握单晶材料生长、制备方法以及常用的锗、硅、化合物半导体材料的基本性质。
通过本课程的学习,使学生掌握半导体材料的相关知识,从而对半导体材料的制备和性质有较全面的认识。
二、课程教学要求本课程的任务是使学生获得半导体晶体生长方面的基础理论知识,初步掌握单晶材料生长、制备方法以及常用的锗、硅、化合物半导体材料的基本性质等相关知识。
三、先修课程学生学习完《功能材料概论》、《材料物理导论》和《材料物理化学》以后开设本课程。
四、课程教学重、难点本课程的重点是掌握半导体晶体生长方面的基础理论知识,单晶材料生长、制备方法以及常用的锗、硅、化合物半导体材料的基本性质等相关知识。
本课程的难点是半导体材料的不同制备方法和过程,以及与所制备出来材料的性质之间的关系。
五、课程教学方法与教学手段教学方法:课程讲授中采用启发式教学,培养学生思考问题、分析问题和解决问题的能力;增加讨论课,调动学生学习的主观能动性;讲课要联系实际并注重培养学生的创新能力。
教学手段:在教学中采用板书、电子教案及多媒体教学等相结合的教学手段,以确保全面、高质量地完成课程教学任务。
六、课程教学内容第一章半导体材料概述 ( 1学时)1.教学内容:(1)人类对半导体材料的使用和研究历史,(2)半导体材料的发展历史和基本特性和分类。
2.重、难点提示(1)教学重点:半导体材料的基本特性及其应用。
(2)教学难点:硅晶体的各向异性。
第二章硅和锗的化学制备(4学时)1.教学内容(1)硅和锗的基本晶体结构和物理化学性质。
(2)化学提纯制备高纯硅的三氯氢硅氢还原法和硅烷法。
(了解硅、锗的化学提纯)2.重、难点提示(1)教学重点:高纯硅的制备。
硅和锗基纳米材料的合成及作为锂离子电池负极材料的研究一、本文概述随着全球对可持续能源需求的日益增长,锂离子电池(LIBs)作为一种高效、环保的储能技术,已广泛应用于电动汽车、便携式电子设备等领域。
作为LIBs的重要组成部分,负极材料的性能对电池的整体性能具有决定性作用。
近年来,硅和锗基纳米材料因其高理论容量、低工作电位和资源丰富等优点,成为LIBs负极材料的研究热点。
本文旨在探讨硅和锗基纳米材料的合成方法,并深入研究其作为锂离子电池负极材料的性能。
我们将概述硅和锗基纳米材料的基本性质,包括其结构、电子特性和电化学性能。
接着,我们将详细介绍硅和锗基纳米材料的合成方法,包括物理法、化学法和生物法等,并对比各种方法的优缺点。
在此基础上,我们将重点研究硅和锗基纳米材料作为LIBs负极材料的电化学性能,包括其容量、循环稳定性和倍率性能等。
通过实验表征和理论计算,我们将深入探讨硅和锗基纳米材料在充放电过程中的结构演变和电化学行为。
本文还将关注硅和锗基纳米材料在实际应用中所面临的挑战,如体积膨胀、导电性差等问题,并提出相应的解决方案。
通过优化材料结构和合成方法,我们期望能够提高硅和锗基纳米材料作为LIBs负极材料的性能,为LIBs技术的发展提供新的思路和方法。
本文旨在全面深入地研究硅和锗基纳米材料的合成及其作为LIBs负极材料的性能,为LIBs技术的发展提供理论支持和实践指导。
二、硅和锗基纳米材料的合成方法硅和锗基纳米材料的合成方法多种多样,每种方法都有其独特的优点和适用场景。
这些合成方法的选择通常取决于所需纳米材料的尺寸、形貌、结构以及应用领域。
以下将详细介绍几种常用的硅和锗基纳米材料合成方法。
化学气相沉积法(CVD):这是一种在气态条件下,通过化学反应生成固态物质并沉积在加热的固态基体表面,进而制备纳米材料的方法。
在硅和锗基纳米材料的合成中,CVD法可以通过精确控制反应条件,制备出具有特定形貌和结构的纳米材料。