无机材料科学基础答案
- 格式:doc
- 大小:472.50 KB
- 文档页数:9

智慧树知到《无机材料科学基础(上)》章节测试答案绪论1、人类历史上第一种人工合成品()。
水泥玻璃陶器合金答案: 陶器2、人类使用材料的历史经历了哪些时代()?石器时代青铜器时代铁器时代水泥时代E:钢铁时代F:硅时代G:新材料时代答案: 石器时代,青铜器时代,铁器时代,水泥时代,钢铁时代,硅时代,新材料时代3、材料的四个基本要素()。
组织结构材料性能合成与制备使用效能答案: 组织结构,材料性能,合成与制备,使用效能4、新型材料是()的一类新兴产业。
知识密集劳动力密集技术密集资金密集答案: 知识密集,技术密集,资金密集5、组成材料科学与工程的四要素的核心是()。
组织结构材料性能合成与制备使用效能答案: 组织结构6、组成材料科学与工程的四要素中()是研究工作的落脚点。
组织结构材料性能合成与制备使用效能答案: 材料性能7、无机材料科学基础是一门()课程。
专业方向专业基础课公共通识答案: 专业基础课8、按照材料的组成,可将材料分为()。
有机高分子材料金属材料无机非金属材料复合材料答案: 有机高分子材料,金属材料,无机非金属材料,复合材料9、按照材料来源可将材料分为()。
功能材料结构材料天然材料人工材料答案: 天然材料,人工材料10、材料是人类社会、用来制造构件、器件的物质()。
可接受的、可容易的、有用的可接受的、可经济的、有用的可接受的、可经济的、功能的常见的、可经济的、有用的答案: 可接受的、可经济的、有用的第一章1、离子键通过()成键?静电偶极吸引力共用电子对电子共有化价电子转移答案: 价电子转移2、共价键的特点()?方向性饱和性键合强键合弱答案: 方向性,饱和性,键合强3、氢键无方向性。
对错答案: 错4、描述电子状态需要那些参数()。
主量子数角量子数磁量子数自旋量子数答案: 主量子数,角量子数,磁量子数,自旋量子数5、下列是共价键晶体的有。
金刚石石墨NaCl晶体铜答案: 金刚石6、n=2的L电子层最多可容纳多少个电子()。

无机材料科学基础习题答案第一章晶体几何基础1-1解释概念:等价点:晶体结构中的一个点,其几何环境和物理环境在同一方向上是相同的。
空间点阵:一种几何图形,通常代表晶体结构中等价点的排列。
节点:空间晶格中的点称为节点。
水晶:内部粒子在三维空间中周期性重复排列的固体。
对称性:物体的相同部分有规律地重复。
对称型:晶体结构中所有点(对称平面、对称中心、对称轴和旋转反延伸轴)的对称元素集是对称的,也称为点群。
晶体:相同对称类型的晶体被归为一类,称为晶体。
晶体取向:将坐标系引入晶体中,以便用数字表示晶体中点、线和平面的相对位置的过程。
空间组:它是指晶体结构中所有对称元素的集合。
Brafi网格:根据晶体结构的顶点群和平移群以及空间晶格的平行六面体的对称性原理,法国学者A .布拉菲将所有晶体结构的空间晶格分为14种类型的空间晶格。
单元电池:能够反映晶体结构特征的最小单位。
单元电池参数:代表晶胞形状和大小的六个参数(A、B、C、α、β、γ)。
1-等效点: 晶体结构中的一个点,其几何环境和物理环境在同一方向上是相同的。
空间点阵:一种几何图形,通常代表晶体结构中等价点的排列。
节点:空间晶格中的点称为节点。
水晶:内部粒子在三维空间中周期性重复排列的固体。
对称性:物体的相同部分有规律地重复。
对称型:晶体结构中所有点(对称平面、对称中心、对称轴和旋转反延伸轴)的对称元素集是对称的,也称为点群。
晶体:相同对称类型的晶体被归为一类,称为晶体。
晶体取向:将坐标系引入晶体中,以便用数字表示晶体中点、线和平面的相对位置的过程。
空间组:它是指晶体结构中所有对称元素的集合。
Brafi网格:根据晶体结构的顶点群和平移群以及空间晶格的平行六面体的对称性原理,法国学者A .布拉菲将所有晶体结构的空间晶格分为14种类型的空间晶格。
单元电池:能够反映晶体结构特征的最小单位。
单元电池参数:代表晶胞形状和大小的六个参数(A、B、C、α、β、γ)。
1: ⑴晶体结构的基本特征:①晶体是一种固体,其内部粒子在三维空间中周期性重复排列。

6-1 说明熔体中聚合物形成过程?答:聚合物的形成是以硅氧四面体为基础单位,组成大小不同的聚合体。
可分为三个阶段初期:石英的分化;中期:缩聚并伴随变形;后期:在一定时间和一定温度下,聚合和解聚达到平衡。
6-2 简述影响熔体粘度的因素?答:影响熔体粘度的主要因素:温度和熔体的组成。
碱性氧化物含量增加,剧烈降低粘度。
随温度降低,熔体粘度按指数关系递增。
6-3 名词解释(并比较其异同)⑴晶子学说和无规则网络学说⑵单键强⑶分化和缩聚⑷网络形成剂和网络变性剂答:⑴晶子学说:玻璃内部是由无数“晶子”组成,微晶子是带有晶格变形的有序区域。
它们分散在无定形介中质,晶子向无定形部分过渡是逐渐完成时,二者没有明显界限。
无规则网络学说:凡是成为玻璃态的物质和相应的晶体结构一样,也是由一个三度空间网络所构成。
这种网络是由离子多面体(三角体或四面体)构筑起来的。
晶体结构网是由多面体无数次有规律重复构成,而玻璃中结构多面体的重复没有规律性。
⑵单键强:单键强即为各种化合物分解能与该种化合物配位数的商。
⑶分化过程:架状[SiO4]断裂称为熔融石英的分化过程。
缩聚过程:分化过程产生的低聚化合物相互发生作用,形成级次较高的聚合物,次过程为缩聚过程。
⑷网络形成剂:正离子是网络形成离子,对应氧化物能单独形成玻璃。
即凡氧化物的单键能/熔点﹥0.74kJ/mol.k 者称为网络形成剂。
网络变性剂:这类氧化物不能形成玻璃,但能改变网络结构,从而使玻璃性质改变,即单键强/熔点﹤0.125kJ/mol.k者称为网络变形剂。
6-4 试用实验方法鉴别晶体SiO2、SiO2玻璃、硅胶和SiO2熔体。
它们的结构有什么不同?答:利用X—射线检测。
晶体SiO2—质点在三维空间做有规律的排列,各向异性。
SiO2熔体—内部结构为架状,近程有序,远程无序。
SiO2玻璃—各向同性。
硅胶—疏松多孔。
6-5 玻璃的组成是13wt%Na2O、13wt%CaO、74wt%SiO2,计算桥氧分数?解:Na2O CaO SiO2wt% 13 13 74mol 0.21 0.23 1.23mol% 12.6 13.8 73.6R=(12.6+13.8+73.6 ×2)/ 73.6=2.39∵Z=4 ∴X=2R﹣Z=2.39×2﹣4=0.72Y=Z﹣X= 4﹣0.72=3.28氧桥%=3.28/(3.28×0.5+0.72)=69.5%6-6 有两种不同配比的玻璃,其组成如下:试用玻璃结构参数说明两种玻璃高温下粘度的大小?解:对于1:Z=4 R 1=O/Si=2.55∴ X 1=2R 1﹣4=1.1 Y 1=Z ﹣X 1= 4﹣1.1=2.9对于2:R 2= O/Si=2.45∴ X 2=2R 2﹣4=0.9 Y 2= 4﹣X 2= 4﹣0.9=3.1∵Y 1﹤Y 2 ∴序号1的玻璃组成的粘度比序号2的玻璃小。

1螺位错:柏格斯矢量与位错线平行的位错。
2同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
3晶胞:指晶体结构中的平行六面体单位,其形状大小与对应的空间格子中的单位平行六面体一致。
4肖特基缺陷:如果正常格点上的原子,热起伏过程中获得能量离开平衡位置,迁移到晶体的表面,在晶格内正常格点上留下空位,即为肖特基缺陷。
肖特基缺陷:如果正常格点上的原子,热起伏过程中获得能量离开平衡位置,迁移到晶体的表面,在晶格内正常格点上留下空位,即为肖特基缺陷。
5聚合:由分化过程产生的低聚合物,相互作用,形成级次较高的聚合物,同时释放出部分Na2O,这个过程称为缩聚,也即聚合。
6非均匀成核:借助于表面、界面、微粒裂纹、器壁以及各种催化位置而形成晶核的过程。
7稳定扩散:扩散质点浓度分布不随时间变化。
8玻璃分相:一个均匀的玻璃相在一定的温度和组成范围内有可能分成两个互不溶解或部分溶解的玻璃相(或液相),并相互共存的现象称为玻璃的分相(或称液相不混溶现象)。
9不一致熔融化合物:是一种不稳定的化合物。
加热这种化合物到某一温度便发生分解,分解产物是一种液相和一种晶相,两者组成与化合物组成皆不相同,故称不一致熔融化合物。
10晶粒生长:无应变的材料在热处理时,平均晶粒尺寸在不改变其分布的情况下,连续增大的过程。
11非本征扩散:受固溶引入的杂质离子的电价和浓度等外界因素所控制的扩散。
或由不等价杂质离子取代造成晶格空位,由此而引起的质点迁移。
(2.5)本征扩散:空位来源于晶体结构中本征热缺陷,由此而引起的质点迁移。
12稳定扩散:若扩散物质在扩散层dx内各处的浓度不随时间而变化,即dc/dt=0。
不稳定扩散:扩散物质在扩散层dx内的浓度随时间而变化,即dc/dt≠0。
这种扩散称为不稳定扩散。
(2.5分)(2.5分)13可塑性:粘土与适当比例的水混合均匀制成泥团,该泥团受到高于某一个数值剪应力作用后,可以塑造成任何形状,当去除应力泥团能保持其形状,这种性质称为可塑性。

(完整版)⽆机材料科学基础习题与解答完整版第⼀章晶体⼏何基础1-1 解释概念:等同点:晶体结构中,在同⼀取向上⼏何环境和物质环境皆相同的点。
空间点阵:概括地表⽰晶体结构中等同点排列规律的⼏何图形。
结点:空间点阵中的点称为结点。
晶体:内部质点在三维空间呈周期性重复排列的固体。
对称:物体相同部分作有规律的重复。
对称型:晶体结构中所有点对称要素(对称⾯、对称中⼼、对称轴和旋转反伸轴)的集合为对称型,也称点群。
晶类:将对称型相同的晶体归为⼀类,称为晶类。
晶体定向:为了⽤数字表⽰晶体中点、线、⾯的相对位置,在晶体中引⼊⼀个坐标系统的过程。
空间群:是指⼀个晶体结构中所有对称要素的集合。
布拉菲格⼦:是指法国学者 A.布拉菲根据晶体结构的最⾼点群和平移群对称及空间格⼦的平⾏六⾯体原则,将所有晶体结构的空间点阵划分成14种类型的空间格⼦。
晶胞:能够反应晶体结构特征的最⼩单位。
晶胞参数:表⽰晶胞的形状和⼤⼩的6个参数(a、b、c、α、β、γ).1-2 晶体结构的两个基本特征是什么?哪种⼏何图形可表⽰晶体的基本特征?解答:⑴晶体结构的基本特征:①晶体是内部质点在三维空间作周期性重复排列的固体。
②晶体的内部质点呈对称分布,即晶体具有对称性。
⑵14种布拉菲格⼦的平⾏六⾯体单位格⼦可以表⽰晶体的基本特征。
1-3 晶体中有哪些对称要素,⽤国际符号表⽰。
解答:对称⾯—m,对称中⼼—1,n次对称轴—n,n次旋转反伸轴—n螺旋轴—ns ,滑移⾯—a、b、c、d1-5 ⼀个四⽅晶系的晶⾯,其上的截距分别为3a、4a、6c,求该晶⾯的晶⾯指数。
解答:在X、Y、Z轴上的截距系数:3、4、6。
截距系数的倒数⽐为:1/3:1/4:1/6=4:3:2晶⾯指数为:(432)补充:晶体的基本性质是什么?与其内部结构有什么关系?解答:①⾃限性:晶体的多⾯体形态是其格⼦构造在外形上的反映。
②均⼀性和异向性:均⼀性是由于内部质点周期性重复排列,晶体中的任何⼀部分在结构上是相同的。

无机材料科学基础曾燕伟答案1、用一根木条当作独木舟,独木舟不能稳定地负载物体。
[判断题] *对(正确答案)错2、红糖在水中溶解,使水的颜色改变,这种变化属于化学变化。
[判断题] *对错(正确答案)3、下列选项中,说法正确的是( )。
[单选题] *A.转基因食品对人体都是有害的B.转基因食品对人体都是有益的C.转基因食品可能存在安全问题(正确答案)4、我们常常能在煤块上看到植物的枝、叶等痕迹,由此可以推测煤是由古代植物变化而成的。
[判断题] *对(正确答案)错5、对“螳螂捕蝉,黄雀在后”这条食物链,下列说法正确的一项是()。
[单选题] *A.蝉是这条食物链的生产者,螳螂和黄雀是消费者B.蝉和螳螂是这条食物链的生产者,黄雀是消费者C.蝉、螳螂、黄雀都是这条食物链的消费者,生产者是植物(正确答案)6、丹顶鹤是有迁徙行为的鸟类,它的迁徙是为了适应环境。
[判断题] *对(正确答案)错7、冥王星属于( )。
[单选题] *A.行星B.小行星C.矮行星(正确答案)8、“地心说”认为,()是宇宙的中心,并且静止不动。
[单选题] *A.地球(正确答案)B.太阳C.月球9、猫咪可以从很高的地方安全地跳下来,这是因为()。
[单选题] *A.猫爪的肉垫坚硬结实B.猫爪的肉垫有利于排汗C.猫爪的肉垫有缓冲作用(正确答案)10、在户外进行空投包实验时,我们可以通过记录数据来帮助改进实验。
下面数据中,不需要记录的是()。
[单选题] *A.是否顺利着陆B.物资是否完好C.外形是否美观(正确答案)11、制作洋葱表皮玻片时滴碘酒,这是为了让细胞染色,便于观察。
( ) [单选题]对(正确答案)错12、我们制作的小船可以装上风力推动装置或蒸汽推动装置。
[判断题] *对(正确答案)错13、下列生活实例中,说法正确的是()。
[单选题] *A.给重型坦克安装很宽的履带是为了固定数量众多的轮子B.图钉尖又细又尖是为了增大受力面积,更方便钉东西C.相同重量的宽肩带书包比窄肩带书包更舒服,是因为压力大小相同时,受力面积越大,凹陷程度越小(正确答案)14、太空椒是因为它的遗传物质发生了变异,所以才长得果大色艳,籽少肉厚。

1,(a )在MgO 晶体中,肖特基缺陷的生成能为6ev ,计算在25℃和1600℃时热缺陷的浓度。
℃时热缺陷的浓度。
(b )如果MgO 晶体中,晶体中,含有百万分之一含有百万分之一mol 的Al2O3杂质,杂质,则在则在1600℃时,MgO 晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
质缺陷占优势?说明原因。
解:(a )根据热缺陷浓度公式:)根据热缺陷浓度公式:exp (-) 由题意由题意△G=6ev=6×G=6ev=6×1.602×1.602×1.602×10-19=9.612×10-19=9.612×10-19=9.612×10-19J 10-19J K=1.38×K=1.38×10-23 J/K 10-23 J/K T1=25+273=298K T2=1600+273=1873K298K :exp =1.92×10-511873K : exp =8×10-9(b )在MgO 中加入百万分之一的Al2O3杂质,缺陷反应方程为:杂质,缺陷反应方程为:此时产生的缺陷为[ ]杂质。
杂质。
而由上式可知:[Al2O3]=[]杂质杂质 ∴当加入10-6 Al2O3时,杂质缺陷的浓度为时,杂质缺陷的浓度为[ ]杂质=[Al 2O 3]=10-6由(a )计算结果可知:在1873 K ,[]热=8×=8×10-9 10-9显然:显然:[ ]杂质>[ ]热,所以在1873 K 时杂质缺陷占优势。
时杂质缺陷占优势。
2,非化学计量化合物FexO 中,Fe3+/Fe2+=0.1,求FexO 中的空位浓度及x 值。
值。
解:解: 非化学计量化合物Fe x O ,可认为是α(mol)的Fe 2O 3溶入FeO 中,缺陷反应式为:中,缺陷反应式为:Fe 2O 32Fe + V +3O Oα 2α α此非化学计量化合物的组成为:此非化学计量化合物的组成为:FeFe O 已知:Fe 3+/Fe 2+=0.1 则:∴ α = 0.044 ∴x =2α+(1-3α)=1-α=0.956又:∵[V 3+]=α =0.044 正常格点数N =1+x =1+0.956=1.956∴空位浓度为3,试写出少量MgO 掺杂到Al 2O 3中和少量YF 3掺杂到CaF 2中的缺陷方程。

名师整理优秀资源4.1 名词解释(a)弗伦克尔缺陷与肖特基缺陷;(b)刃型位错和螺型位错解:(a)当晶体热振动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗伦克尔缺陷。
如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(b)滑移方向与位错线垂直的位错称为刃型位错。
位错线与滑移方向相互平行的位错称为螺型位错。
4.2试述晶体结构中点缺陷的类型。
以通用的表示法写出晶体中各种点缺陷的表示符号。
试举例写出CaCl2中Ca2+置换KCl中K+或进入到KCl间隙中去的两种点缺陷反应表示式。
解:晶体结构中的点缺陷类型共分:间隙原子、空位和杂质原子等三种。
在MX晶体中,间隙原子的表示符号为MI或XI;空位缺陷的表示符号为:VM或VX。
如果进入MX晶体的杂质原子是A,则其表示符号可写成:AM或AX(取代式)以及Ai(间隙式)。
当CaCl2中Ca2+置换KCl中K+而出现点缺陷,其缺陷反应式如下:++2Cl CaCl Cl2CaCl2中Ca2+进入到KCl间隙中而形成点缺陷的反应式为:+2CaCl+2Cl Cl24.3在缺陷反应方程式中,所谓位置平衡、电中性、质量平衡是指什么?解:位置平衡是指在化合物MaXb中,M格点数与X格点数保持正确。
电中性是指在方程式两边应具有相同的b:X=a:M的比例关系,即.名师整理优秀资源有效电荷。
质量平衡是指方程式两边应保持物质质量的守恒。
4.4(a)在MgO晶体中,肖特基缺陷的生成能为6ev,计算在25℃和1600℃时热缺陷的浓度。
(b)如果MgO晶体中,含有百万分之一mol的Al2O3杂质,则在1600℃时,MgO晶体中是热缺陷占优势还是杂质缺陷占优势?说明原因。
解:(a)根据热缺陷浓度公式:(-)exp由题意△G=6ev=6×1.602×10-19=9.612×10-19JK=1.38×10-23 J/KT1=25+273=298K T2=1600+273=1873K-5110=1.92:×exp 298K-9×10=8exp1873K:(b)在MgO中加入百万分之一的Al2O3杂质,缺陷反应方程为:[ ]杂质。

无机材料科学基础课后习题答案宋晓岚黄学辉版无机材料科学基础课程组第二章答案2-1略。
2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
答:(1)h:k:l==3:2:1,∴该晶面的晶面指数为(321);(2)h:k:l=3:2:1,∴该晶面的晶面指数为(321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[],[]答:2-4定性描述晶体结构的参量有哪些定量描述晶体结构的参量又有哪些答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类其特点是什么答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种一个球的周围有多少个四面体空隙、多少个八面体空隙答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙不等径球是如何进行堆积的答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
2-8写出面心立方格子的单位平行六面体上所有结点的坐标。

4.1 名词解释(a )弗伦克尔缺陷与肖特基缺陷;(b )刃型位错和螺型位错 (c )类质同象与同质多晶解:(a )当晶体热振动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗伦克尔缺陷。
如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(b )滑移方向与位错线垂直的位错称为刃型位错。
位错线与滑移方向相互平行的位错称为螺型位错。
(c )类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
6-3 名词解释(并比较其异同)⑴晶子学说:玻璃内部是由无数“晶子”组成,微晶子是带有晶格变形的有序区域。
它们分散在无定形介中质,晶子向无定形部分过渡是逐渐完成时,二者没有明显界限。
无规则网络学说:凡是成为玻璃态的物质和相应的晶体结构一样,也是由一个三度空间网络所构成。
这种网络是由离子多面体(三角体或四面体)构筑起来的。
晶体结构网是由多面体无数次有规律重复构成,而玻璃中结构多面体的重复没有规律性。
⑵单键强:单键强即为各种化合物分解能与该种化合物配位数的商。
⑶分化过程:架状[SiO 4]断裂称为熔融石英的分化过程。
缩聚过程:分化过程产生的低聚化合物相互发生作用,形成级次较高的聚合物,次过程为缩聚过程。
⑷网络形成剂:正离子是网络形成离子,对应氧化物能单独形成玻璃。
即凡氧化物的单键能/熔点﹥0.74kJ/mol .k 者称为网络形成剂。
网络变性剂:这类氧化物不能形成玻璃,但能改变网络结构,从而使玻璃性质改变,即单键强/熔点﹤ 0.125kJ/mol .k 者称为网络变形剂。
5.1试述影响置换型固溶体的固溶度的条件。
解:1.离子尺寸因素 :从晶体稳定性考虑,相互替代的离子尺寸愈相近,则固溶体愈稳定。
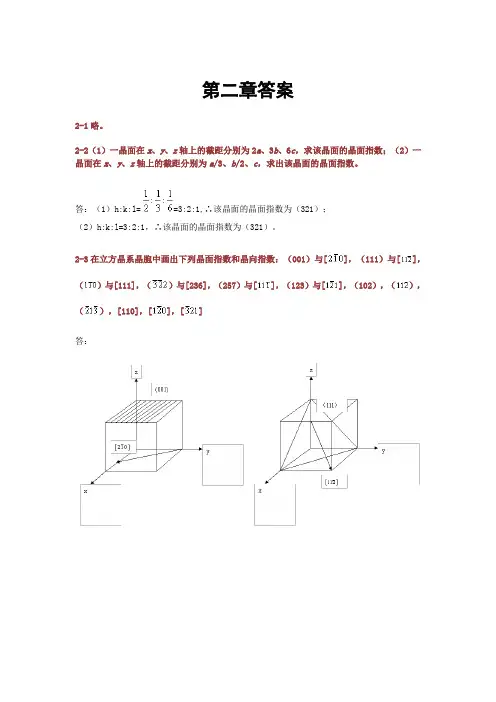
第二章答案2-1略。
2-2(1)一晶面在x、y、z轴上的截距分别为2a、3b、6c,求该晶面的晶面指数;(2)一晶面在x、y、z轴上的截距分别为a/3、b/2、c,求出该晶面的晶面指数。
答:(1)h:k:l==3:2:1,∴该晶面的晶面指数为(321);(2)h:k:l=3:2:1,∴该晶面的晶面指数为(321)。
2-3在立方晶系晶胞中画出下列晶面指数和晶向指数:(001)与[],(111)与[],()与[111],()与[236],(257)与[],(123)与[],(102),(),(),[110],[],[]答:2-4定性描述晶体结构的参量有哪些?定量描述晶体结构的参量又有哪些?答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类?其特点是什么?答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种?一个球的周围有多少个四面体空隙、多少个八面体空隙?答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙?不等径球是如何进行堆积的?答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
2-8写出面心立方格子的单位平行六面体上所有结点的坐标。
答:面心立方格子的单位平行六面体上所有结点为:(000)、(001)(100)(101)(110)(010)(011)(111)(0)(0)(0)(1)(1)(1)。
无机材料科学基础习题答案无机材料科学基础习题答案无机材料科学是一门研究无机材料的结构、性质和制备方法的学科。
它在材料科学领域中占据重要地位,广泛应用于电子、能源、催化、生物医学等领域。
在学习无机材料科学的过程中,习题是不可或缺的一部分。
下面将针对一些常见的无机材料科学基础习题给出详细的解答。
1. 无机材料的分类有哪些?无机材料可以根据其化学成分和结构特点进行分类。
根据化学成分,无机材料可分为金属材料、陶瓷材料、玻璃材料和复合材料等。
根据结构特点,无机材料可分为晶体材料和非晶体材料。
晶体材料又可细分为单晶体、多晶体和纤维晶体等。
2. 什么是晶体?晶体是指具有规则、有序的周期性排列结构的物质。
晶体的结构由晶格和晶胞组成。
晶格是指由无限多个点构成的空间点阵,晶胞则是晶格的最小重复单元。
晶体的结构决定了其特定的物理和化学性质。
3. 什么是晶体的晶格常数?晶格常数是指晶体晶格中相邻两个晶格点之间的距离。
晶格常数可以用来描述晶体的结构特征,常用的单位是埃(Å)或纳米(nm)。
4. 什么是晶体的晶胞参数?晶胞参数是指晶胞的尺寸和形状参数。
晶胞参数包括晶胞的长度、角度和对称性等。
晶胞参数可以通过X射线衍射等实验手段来确定。
5. 什么是晶体的晶系?晶系是指晶体的晶胞对称性。
常见的晶系包括立方晶系、四方晶系、正交晶系、单斜晶系、三斜晶系、六方晶系和三角晶系等。
6. 什么是晶体的晶面?晶面是指晶体表面的平面。
晶面可以用晶体的晶面指数来表示,晶面指数是由晶面与坐标轴相交的长度比值的倒数。
晶面的不同排列和组合决定了晶体的外观和性质。
7. 什么是晶体的晶体结构?晶体结构是指晶体中原子、离子或分子的排列方式。
晶体结构可以通过X射线衍射等实验手段来确定。
常见的晶体结构包括离子晶体、共价晶体和金属晶体等。
8. 什么是无机材料的晶体缺陷?晶体缺陷是指晶体中存在的原子、离子或分子的缺失、插入、替代或位错等不完整性。
晶体缺陷对晶体的物理和化学性质有着重要影响,可以改变晶体的导电性、热导性和光学性质等。
第一章几何结晶学一、名词解释①晶体、②等同点、③空间点阵、④结点、⑤对称、⑥对称型、⑦晶类、⑧单形、⑨聚形、⑩晶体定向、○11晶体常数、○12布拉菲格子、○13晶胞、○14晶胞参数、○15空间群。
二、(1)根据对称型国际符号写出对称型,并指出各对称要素的空间方位关系。
①2/m ;②mm2;③422;④6/mmm 。
(2)写出下列对称型的国际符号①3L23pc 、②L4PC 、③Li4、④L33P (3)下列晶形是对称型为L4PC 的理想形态,判断其是单形或是聚形,并说明对称要素如何将其联系起来的。
(4)下列单形能否相聚而成聚形①四方柱、四方双锥②菱面体、六方柱 ③四角三八面体、平行双面④四方四面体、四方双锥 ⑤四面体、八面体 ⑥斜方柱、四方双锥 三、计算题(2)一个立方晶系晶胞中,一晶面在晶轴X 、Y 、Z 上的截距分别为2a 、1/2a 、2/3a ,求此晶面的晶面指数。
(2)一个四方晶系晶体的晶面,在X 、Y 、Z 轴上的截距分别为3a 、4a 、6c ,求该晶面的晶面指数。
四、填空题(1) 晶体的对称要素中点对称要素种类有_____、_____、_____ 、_____ ,含有平移操作的对称要素种类有_____ 、_____ 。
它们分别是 _____、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 、_____ 。
(2) 晶族、晶系、对称型、结晶学单形、几何单形、布拉菲格子、空间群的数目分别是 _____、_____ 、_____ 、_____ 、_____ 、_____ 。
2-1名词解释(a )弗伦克尔缺陷与肖特基缺陷;(b )刃型位错和螺型位错(c )类质同象与同质多晶解:(a )当晶体热振动时,一些能量足够大的原子离开平衡位置而挤到晶格点的间隙中,形成间隙原子,而原来位置上形成空位,这种缺陷称为弗伦克尔缺陷。
如果正常格点上原子,热起伏后获得能量离开平衡位置,跃迁到晶体的表面,在原正常格点上留下空位,这种缺陷称为肖特基缺陷。
(b )滑移方向与位错线垂直的位错称为刃型位错。
位错线与滑移方向相互平行的位错称为螺型位错。
(c )类质同象:物质结晶时,其晶体结构中部分原有的离子或原子位置被性质相似的其它离子或原子所占有,共同组成均匀的、呈单一相的晶体,不引起键性和晶体结构变化的现象。
同质多晶:同一化学组成在不同热力学条件下形成结构不同的晶体的现象。
2-6(1)在CaF 2晶体中,弗仑克尔缺陷形成能为2.8eV,肖特基缺陷的生成能为5.5eV,计算在25°C 和1600°C 时热2缺陷的浓度?(k=1.38X10-23j/K )(2)如果CaF 2晶体中,含有百万分之一的YF 3杂质,则在1600C 时,。
&耳晶体中时热缺陷占优势还是杂质缺陷232占优势?说明原因。
解:(1)弗仑克尔缺陷形成能为2.8eV ,小于肖特基缺陷形成能5.5eV ,所以CaF 2晶体中主要是弗仑克尔缺陷,肖特基缺陷可忽略不计。
1分当T =25°C=298K 时,热缺陷浓度为:当T =1600C=1873K 时,热缺陷浓度为:(2)CaF 2中含百万分之一(10-6)的YF 3时的杂质缺陷反应为:2YF caF 2>2Y ・+6F +V"3CaFCa由此可知:[YF3]=2[V ;],所以当加入10-6YF3时,杂质缺陷的浓度为:ca[V"]=^[YF ]=5x10-71分Ca 杂23此时,在1600C 下的热缺陷计算为:Ca T Ca ••+V"CaiCaxx +5X 10-7I N 丿298-AG=exp(匚)=exp(2kT—2.8x1.602x10-19 2x1.38x10-23x298)二2.06x10-242分<N 丿1873二exp(-AG 寸)二exp( —2.8x1.602x10-192x1.38x10-23x1873 1.7x10-42分则: [Ca]Ca 即:x (x+5x 10-7)1 =2.89x 10-8, x ^8.1X 10-4-AG二k二沁(寸)=d.7x10-4)2二2.89x10-8显然:[V\]>[V〃],所以在1600°C时是弗仑克尔热缺陷占优势Ca杂Ca热2-10ZnO是六方晶系,a=0・3242nm,c=0・5195nm,每个晶胞中含2个ZnO分子,测得晶体密度分别为5.74,5・606gcm3,求这两种情况下各产生什么型式的固溶体?解:六方晶系的晶胞体积—a2c—>;3.2422x5.19510-24V===4.73cm3在两种密度下晶胞的重量分别为W]=d]V=5.74X4.73X10-23=2.72X10-22(g)W2=d2v=5.606X4.73X10-23=2.65X10-22(g)理论上单位晶胞重W=—瓦—=2.69山旷^@)・•・密度是d1时为间隙型固溶体,是d2时为置换型固溶体。
第二章晶体结构答案2-4定性描述晶体结构的参量有哪些定量描述晶体结构的参量又有哪些答:定性:对称轴、对称中心、晶系、点阵。
定量:晶胞参数。
2-5依据结合力的本质不同,晶体中的键合作用分为哪几类其特点是什么答:晶体中的键合作用可分为离子键、共价键、金属键、范德华键和氢键。
离子键的特点是没有方向性和饱和性,结合力很大。
共价键的特点是具有方向性和饱和性,结合力也很大。
金属键是没有方向性和饱和性的的共价键,结合力是离子间的静电库仑力。
范德华键是通过分子力而产生的键合,分子力很弱。
氢键是两个电负性较大的原子相结合形成的键,具有饱和性。
2-6等径球最紧密堆积的空隙有哪两种一个球的周围有多少个四面体空隙、多少个八面体空隙答:等径球最紧密堆积有六方和面心立方紧密堆积两种,一个球的周围有8个四面体空隙、6个八面体空隙。
2-7n个等径球作最紧密堆积时可形成多少个四面体空隙、多少个八面体空隙不等径球是如何进行堆积的答:n个等径球作最紧密堆积时可形成n个八面体空隙、2n个四面体空隙。
不等径球体进行紧密堆积时,可以看成由大球按等径球体紧密堆积后,小球按其大小分别填充到其空隙中,稍大的小球填充八面体空隙,稍小的小球填充四面体空隙,形成不等径球体紧密堆积。
2-8写出面心立方格子的单位平行六面体上所有结点的坐标。
答:面心立方格子的单位平行六面体上所有结点为:(000)、(001)(100)(101)(110)(010)(011)(111)(0)(0)(0)(1)(1)(1)。
2-9计算面心立方、密排六方晶胞中的原子数、配位数、堆积系数。
答::面心:原子数4,配位数6,堆积密度六方:原子数6,配位数6,堆积密度2-10根据最紧密堆积原理,空间利用率越高,结构越稳定,金刚石结构的空间利用率很低(只有%),为什么它也很稳定答:最紧密堆积原理是建立在质点的电子云分布呈球形对称以及无方向性的基础上的,故只适用于典型的离子晶体和金属晶体,而不能用最密堆积原理来衡量原子晶体的稳定性。
第一章晶体几何基础1-1 解释概念:等同点:晶体结构中,在同一取向上几何环境和物质环境皆相同的点。
空间点阵:概括地表示晶体结构中等同点排列规律的几何图形。
结点:空间点阵中的点称为结点。
晶体:内部质点在三维空间呈周期性重复排列的固体。
对称:物体相同部分作有规律的重复。
对称型:晶体结构中所有点对称要素(对称面、对称中心、对称轴和旋转反伸轴)的集合为对称型,也称点群。
晶类:将对称型相同的晶体归为一类,称为晶类。
晶体定向:为了用数字表示晶体中点、线、面的相对位置,在晶体中引入一个坐标系统的过程。
空间群:是指一个晶体结构中所有对称要素的集合。
布拉菲格子:是指法国学者 A.布拉菲根据晶体结构的最高点群和平移群对称及空间格子的平行六面体原则,将所有晶体结构的空间点阵划分成14种类型的空间格子。
晶胞:能够反应晶体结构特征的最小单位。
晶胞参数:表示晶胞的形状和大小的6个参数(a、b、c、α 、β、γ ).1-2 晶体结构的两个基本特征是什么?哪种几何图形可表示晶体的基本特征?解答:⑴晶体结构的基本特征:①晶体是内部质点在三维空间作周期性重复排列的固体。
②晶体的内部质点呈对称分布,即晶体具有对称性。
⑵14种布拉菲格子的平行六面体单位格子可以表示晶体的基本特征。
1-3 晶体中有哪些对称要素,用国际符号表示。
解答:对称面—m,对称中心—1,n次对称轴—n,n次旋转反伸轴—n螺旋轴—ns ,滑移面—a、b、c、d1-5 一个四方晶系的晶面,其上的截距分别为3a、4a、6c,求该晶面的晶面指数。
解答:在X、Y、Z轴上的截距系数:3、4、6。
截距系数的倒数比为:1/3:1/4:1/6=4:3:2晶面指数为:(432)补充:晶体的基本性质是什么?与其内部结构有什么关系?解答:①自限性:晶体的多面体形态是其格子构造在外形上的反映。
②均一性和异向性:均一性是由于内部质点周期性重复排列,晶体中的任何一部分在结构上是相同的。
异向性是由于同一晶体中的不同方向上,质点排列一般是不同的,因而表现出不同的性质。
1、熔体的概念:不同聚合程度的各种聚合物的混合物硅酸盐熔体的粘度与组成的关系(决定硅酸盐熔体粘度大小的主要因素是硅氧四面体网络连接程度)在熔体中加入LiO2、Na2O 、K2O 和BaO 、PbO 等,随加入量增加,粘度显着下降。
在含碱金属的硅酸盐熔体中,当Al2O3/Na2O ≤1时,用Al2O3代替SiO2可以起“补网”作用,从而提高粘度。
一般加入Al2O3、SiO2和ZrO2有类似的效果。
流动度为粘度的倒数,Φ=粘度的理论解释:绝对速度理论η=η0exp(ΔE/kT)自由体积理论=B exp [ ]=Aexp( )过剩熵理论 = Cexp [ ] = Cexp ( )2、非晶态物质的特点 :近程有序,远程无序3、玻璃的通性(1)各向同性(若有应力,为各向异性) (2)介稳性(3)熔融态向玻璃态转化的可逆与渐变性(4)、熔融态向玻璃态转化时其物化性质随温度变化的连续性4、 Tg 、Tf , 相对应的粘度和特点钠钙硅酸盐熔体粘度与温度关系表明:熔融温度范围内,粘度为50~500dPa·s 。
工作温度范围粘度较高,约103~107dPa·s 。
退火温度范围粘度更高,约~ dPa·s 。
Tg-脆性温度、退火温度,Tf-软化温度、可拉丝的最低温度 5、单键强度 > 335 kJ/mol(或80 kcal/mol)的氧化物——网络形成体。
单键强度 < 250 kJ/mol(或60 kcal/mol)的氧化物——网络变性体。
在250~335 kJ/mol 为——中间体,其作用介于玻璃的网络形成体和网络变性体之间。
6、玻璃形成的热力学观点:熔体是物质在TM 以上存在的一种高能状态。
据随温度降低,熔体释放能量大小不同,冷却途径分为结晶化,玻璃化,分相ΔGv 越大析晶动力越大,越不容易形成玻璃。
ΔGv 越小析晶动力越小,越容易形成玻璃。
玻璃形成的动力学观点:)(00T T KV -α0T T B-)(0T T C D P -∆0T T B-η1过冷度增大,熔体质点动能降低,有利于质点相互吸引而聚结和吸附在晶核表面,有利于成核。
1、熔体的概念:不同聚合程度的各种聚合物的混合物硅酸盐熔体的粘度与组成的关系(决定硅酸盐熔体粘度大小的主要因素是硅氧四面体网络连接程度)在熔体中加入LiO2、Na2O 、K2O 和BaO 、PbO 等,随加入量增加,粘度显著下降。
在含碱金属的硅酸盐熔体中,当Al2O3/Na2O ≤1时,用Al2O3代替SiO2可以起“补网”作用,从而提高粘度。
一般加入Al2O3、SiO2和ZrO2有类似的效果。
流动度为粘度的倒数,Φ=粘度的理论解释:绝对速度理论η=η0exp(ΔE/kT)自由体积理论η=B exp [ ]=Aexp( )过剩熵理论η = Cexp [ ] = Cexp ( )2、非晶态物质的特点 :近程有序,远程无序3、玻璃的通性(1)各向同性(若有应力,为各向异性) (2)介稳性(3)熔融态向玻璃态转化的可逆与渐变性(4)、熔融态向玻璃态转化时其物化性质随温度变化的连续性4、 Tg 、Tf , 相对应的粘度和特点钠钙硅酸盐熔体粘度与温度关系表明:熔融温度范围内,粘度为50~500dPa·s 。
工作温度范围粘度较高,约103~107dPa·s 。
退火温度范围粘度更高,约1012.5~1013.5 dPa·s 。
Tg-脆性温度、退火温度,Tf-软化温度、可拉丝的最低温度 5、单键强度 > 335 kJ/mol(或80 kcal/mol)的氧化物——网络形成体。
单键强度 < 250 kJ/mol(或60 kcal/mol)的氧化物——网络变性体。
在250~335 kJ/mol 为——中间体,其作用介于玻璃的网络形成体和网络变性体之间。
6、玻璃形成的热力学观点:熔体是物质在TM 以上存在的一种高能状态。
据随温度降低,熔体释放能量大小不同,冷却途径分为结晶化,玻璃化,分相ΔGv 越大析晶动力越大,越不容易形成玻璃。
ΔGv 越小析晶动力越小,越容易形成玻璃。
玻璃形成的动力学观点:)(00T T KV -α0T T B-)(0T T C D P -∆0T T B-η1过冷度增大,熔体质点动能降低,有利于质点相互吸引而聚结和吸附在晶核表面,有利于成核。
过冷度增大,熔体粘度增加,使质点移动困难,难于从熔体中扩散到晶核表面,不利于晶核长大。
过冷度与成核速率Iv和晶体生长速率u必有一个极值。
玻璃形成的结晶化学观点:(1)、键强(孙光汉理论)熔点低的氧化物易于形成玻璃(2)、键型三种纯键型在一定条件下都不能形成玻璃。
离子共价混合键,金属共价混合键(重要因素:共价因素和强的极化作用)当离子键向共价键过渡,离子共价混合键,主要在于有SP电子形成的杂化轨道,并构成σ键和π键,通过强烈的极化作用,这种混合键既具有离子键易改变键角、易形成无对称变形的趋势,有利于造成玻璃的远程无序;又有共价键的方向性和饱和性,不易改变键长和键角的倾向,造成玻璃的近程有序,因此容易形成玻璃。
7、玻璃的结构学说(二种玻璃结构学说的共同之处和不同之处)晶子学说的要点:意义:揭示了玻璃的微不均匀性,描述了玻璃结构近程有序的特点。
不足之处:晶子尺寸太小,无法用X射线检测,晶子的含量、组成也无法确知。
无规则网络学说要点:意义:说明了玻璃结构宏观上是均匀的。
解释了结构上是远程无序的,揭示了玻璃各向同性等性质。
不足之处:对分相研究不利,不能完满解释玻璃的微观不均匀性和分相现象两种假说各具优缺点,两种观点正在逐步靠近。
统一的看法为玻璃是具有近程有序、远程无序结构特点的无定形物质。
♥晶子假说着重于玻璃结构的微不均匀和有序性。
♥无规则网络学说着重于玻璃结构的无序、连续、均匀和统计性。
8、玻璃的结构参数根据玻璃类型确定:Z;先计算:R;再计算:X、Y(注意网络中间体Al2O3在其中的作用,以及比较复杂成分的结构参数计算)描述硅酸盐玻璃结构有四个基本参数X-每个多面体中Onb平均数,Y-每个多面体中Ob平均数,Z-每个多面体中O总数,R-玻璃中O总数/网络形成离子总数。
X+Y=Z X+1/2Y=R 或X=2R-Z Y=2Z-2R每个多面体中的O2-总数Z往往已知(硅酸盐和磷酸盐玻璃Z=4、硼酸盐玻璃Z=3)。
R为O/Si比,能描述硅酸盐玻璃的网络连接特点,可据玻璃组成计算出;之后可确定X和Y值。
9、硼的反常现象在硅酸盐Na2O-SiO2系统中:1)当B2O3含量较少时,Na2O/ B2O3>1,结构中“游离”氧充足,B3+以[BO4]四面体状态加入到[SiO4]四面体网络,将断开的网络重新连接起来,结构趋于紧密,粘度随含量升高而增加;2)当Na2O/ B2O3 约为1时(B2O3含量约为15%),B3+形成[BO4]四面体最多,粘度达到最高点。
3)B2O3含量继续增加,较多量的B2O3引入使Na2O/ B2O3<1,“游离”氧不足,B3+开始处于层状[BO3]中,使结构趋于疏松,粘度又逐步下降。
1.热力学在凝聚态体系中应用的特点:化学反应过程的方向性,过程产物的稳定性和生成序,经典热力学应用的局限性2.热力学应用计算方法:1)经典法2)Φ函数法3.纯固相参与的固相反应:给定原料配比条件下,各反应自由能∆G与温度间的关系,及其对固相反应的分析应用。
4.伴有熔体参与的固相反应5.了解金属氧化物的高温稳定性1、相律以及相图中的一些基本概念相、独立组分、自由度等2、水型物质与硫型物质相图的特点(固液界线的斜率?)3、单元系统相图中亚稳区域的特点4、SiO2相图中的多晶转变(重建型转变、位移型转变)5、一致熔化合物和不一致熔化合物的特点6、形成连续固溶体的二元相图的特点(没有二元无变量点)7、相图的坐标系统由什么来决定(相平衡系统中的最大自由度)8、界线、连线的概念,以及他们的关系9、等含量规则、等比例规则、背向规则、杠杆规则、连线规则、切线规则、重心规则。
10、独立析晶(非平衡析晶)11、三元相图析晶路径的分析过程和方法(要熟练掌握)判断化合物的性质划分副三角形标出界线上的温度走向和界线的性质确定无变量点的性质分析具体的析晶路程1、固体中扩散的特点固体质点之间作用力较强,开始扩散温度较高,但远低于熔点;固体是凝聚态,质点以一定方式堆积,质点迁移必须越过势垒,扩散速率较低,迁移自由程约为晶格常数大小;晶体中质点扩散有各向异性。
2、菲克定律(宏观现象)菲克第一定律:稳态扩散;菲克第二定律:不稳态扩散3、扩散系数是一个什么样的参数4、扩散推动力(化学势梯度)5、扩散系数的一般热力学关系式6、质点的扩散方式(五种、其中空位最常见,所需能量最小)易位扩散(1)两个相邻结点位置上的质点直接交换位置进行迁移。
环转易位扩散(2)几个结点位置上的质点以封闭的环形依次交换位置进行迁移。
空位扩散(3)质点从结点位置上迁移到相邻的空位中,在这种扩散方式中,质点的扩散方向是空位扩散方向的逆方向。
间隙扩散(4):间隙质点穿过晶格迁移到另一个间隙位置。
准间隙扩散(5):间隙质点从间隙位置迁到结点位置,并将结点位置上的质点撞离结点位置而成为新的间隙质点。
7、本征扩散、非本征扩散,及其相应的扩散系数D产生本征扩散与非本征扩散的原因,分析、计算由晶体内原子热振动引起。
其缺陷浓度取决于温度的高低。
由这类点缺陷引起的扩散称本征扩散。
由于掺入与晶体中离子不等价的杂质离子而产生的掺杂点缺陷。
由此类缺陷引起的扩散称非本征扩散。
8、萤石结构的ZrO2中Zr4+和O2-哪个扩散的活化能大?(Zr4+缺陷方程的书写)9、固相反应的定义广义:凡是有固相参与的化学反应,都可称为固相反应狭义:固体与固体间发生化学反应生成新的固体产物的过程泰曼温度或烧结温度:固相反应开始的温度远低于反应物的熔点或系统的低共熔温度,通常相当于一种反应物开始呈现显著扩散作用的温度10、固相反应的转化率参与反应的一种反应物,在反应过程中被反应了的体积分数11、固相反应的一般动力学关系(反应的总阻力=各个分阻力之和) 固相反应总速度与各个反应速度之间关系:(反应速度的倒数为反应阻力--串联方式)12、固相反应的特点 (化学反应动力学范围、扩散动力学范围) 13、杨德尔方程 G <0.314、金斯特林格方程 G <0.815、如果要合成某种化合物,从提高反应速率的角度出发,可提供选择 的原料中选择什么原料较好?16、影响固相反应的因素?反应物化学组成和结构的影响:反应物的化学组成 , 反应物的结构及活性 , 反应物的比例 反应物颗粒尺寸及分布的影响 反应温度、压力和气氛的影响 矿化剂及其他影响因素的影响1、相变的概念(相的概念等)指在一定外界条件下,体系中发生的从一相到另一相的变化过程。
相:系统中物理和化学性质相同而且完全均匀的一部分。
2、相变的分类按热力学分类 : 一级相变、二级相变。
按相变发生的方式分类 : 成核-生长型相变; 连续型相变,如斯宾那多(Spinodal )分解 按质点迁移特征分类 :扩散型相变;无扩散型相变,如多晶转变、马氏体转变3、一级相变 : 相变前后若两相的化学势相等,但化学势的一级偏微商(一阶导数)不等的相变。
特征:相变时有相变潜热S 和体积V 的突变二级相变 : 相变时两相的化学势及一级偏微商相等,但二级偏微商不等。
特征:相变时V 、S 无突变,恒压热容Cp 、等温压缩系数β、等压膨胀系数α突变。
()()3132111G G K dt dG J---=()()3131111G G K dt dG K---'=4、固态相变马氏体相变: 是指钢中的奥氏体转变为马氏体的相变。
特点: 1) 结晶学特征:马氏体是沿母相的习性平面生长并与奥氏体母相保持一定的取向关系,形成共格晶界。
2) 相变时不发生扩散,原子只做有规则的重排而不进行扩散。
3) 马氏体转变速度很快,有时速度高达声速。
4) 马氏体相变没有一个特定的温度,而是在一个温度范围内进行。
有序-无序相变: 随温度升降而出现低温有序和高温无序的可逆转变称为有序-无序转变。
只要在高于0K的温度下,质点的热振动会使其位置与方向均发生变化,从而产生位置与方向的无序性。
5、相变过程中的亚稳态理论上应发生相变而实际上不能发生相转变的区域(阴影区)称亚稳区。
6、晶核的形成条件、临界晶核rk。
(要有△T)❑临界晶核半径rK :新相可以长大而不消失的最小晶核半径。
r < rK ,为晶胚:不能稳定成长的新相区域r > rK ,为晶核:可以稳定成长的新相区域7、影响成核速率的因素:核坯的数目、质点加到核坯上的速率I = P·D8、均匀成核、非均匀成核,选择成核剂的要求。
均匀成核:晶核从均匀的单相熔体中产生的几率处处是相同的。
非均匀成核:借助于表面、界面、微粒裂纹、器壁以及各种催化位置等而形成晶核的过程。