人教版选修三物质结构和性质——配位键疑难释疑
- 格式:docx
- 大小:1.39 MB
- 文档页数:5

第二节分子的立体构型[板书]2、配合物(1)定义:通常把金属离子(或原子)与某些分子或离子(称为配体)以配位键结合形成的化合物称为配位化合物。
[讲]已知配合物的品种超过数百万,是一个庞大的化合物家族。
[板书](2)配合物的组成中心原子:配合物的中心原子一般都是带正电的阳离子,过渡金属离子最常见。
配位体:可以是阴离子,也可以是中性分子,配位体中直接同中心原子配合的原子叫配位原子,配位原子必须是含有孤对电子的原子。
配位数:直接同中心原子配位的原子的数目叫中心原子的配位数。
配离子的电荷数:配离子的电荷数等于中心离子和配位体的总电荷数的代数和。
[投影][讲]如:[Co(NH3)5Cl]Cl2这种配合物,其配位体有两种:NH3、Cl-,配位数为5+1=6。
[讲]配合物的命名,关键在于配合物内界(即配离子)的命名。
命名顺序:自右向左:配位体数(即配位体右下角的数字)——配位体名称——“合”字或“络”字——中心离子的名称——中心离子的化合价。
例如[Zn(NH 3)2]SO 4读作硫酸二氨合锌[实验2-2]向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液;若加入极性较小的溶剂(如乙醇),将析出深蓝色的晶体。
[投影][问题]有谁上黑版写出有关的化学方程式? [板书]3、配合物的形成:Cu 2++2NH 3·H 2O=Cu (OH )2↓+2NH 4+Cu (OH )2+4 NH 3·H 2O=[Cu (NH 3)4]2++2OH -+4H 2O [Cu (NH 3)4]2+深蓝色[讲]在[Cu (NH 3)4]2+里,NH 3分子的氮原子给出孤对电子对,Cu 2+接受电子对,以配位键形成了[Cu (NH 3)4]2+ [投影][板书]4、配合物的性质 (1)配合物溶于水后难电离[讲]配合物溶于水易电离为内界配离子和外界离子,而内界2+Cu NH 3H 3N NH 3NH 3的配体离子和分子通常不能电离。

第三課時教學目標1、配位鍵、配位化合物的概念2、配位鍵、配位化合物的表示方法3、採用圖表、比較、討論、歸納、綜合的方法進行教學4、培養學生分析、歸納、綜合的能力教學重點配位鍵、配位化合物的概念教學難點配位鍵、配位化合物的概念教學過程[創設問題情景]什麼是配位鍵?配位鍵如何表示?配位化合物的概念?學生閱讀教材,然後討論交流。
1、配位鍵⑴概念共用電子對由一個原子單方向提供給另一原子共用所形成的共價鍵。
⑵表示A B電子對給予體電子對接受體⑶條件:其中一個原子必須提供孤對電子。
另一原子必須能接受孤對電子軌道。
[提問]舉出含有配位鍵的離子或分子舉例:H3O+NH4+[過渡]什麼是配位化合物呢?[講解]金屬離子或原子與某些分子或離子以配位鍵結合而形成的化合物稱為配合物。
[過渡]配位化合物如何命名?[講解] 硫酸四氨合銅[學生練習命名][Cu(NH3)4]Cl2K3[Fe(SCN)6]Na3[AlF6][小結]本節主要講述了配位鍵和配位化合物。
[練習]1、銨根離子中存在的化學鍵類型按離子鍵、共價鍵和配位鍵分類,應含有A、離子鍵和共價鍵B、離子鍵和配位鍵C、配位鍵和共價鍵D、離子鍵2、下列屬於配合物的是A、NH4ClB、Na2CO3.10H2OC、CuSO4. 5H2OD、Co(NH3)6Cl33、下列分子或離子中,能提供孤對電子與某些金屬離子形成配位鍵的是①H2O ②NH3③F—④CN—⑤COA、①②B、①②③C、①②④D、①②③④⑤4、配合物在許多方面有著廣泛的應用。
下列敘述不正確的是A、以Mg2+為中心的大環配合物葉綠素能催化光合作用。
B、Fe2+的卟啉配合物是輸送O2的血紅素。
C、[Ag(NH3)2]+是化學鍍銀的有效成分。
D、向溶液中逐滴加入氨水,可除去硫酸鋅溶液中的Cu2+。
5.下列微粒:①H3O+②NH4+③CH3COO-④ NH3⑤CH4中含有配位鍵的是A、①②B、①③C、④⑤D、②④6.亞硝酸根NO2-作為配體,有兩種方式。

高三化学选修三知识点总结随着高考的临近,高三学生们都在积极备考各科目,其中化学作为一门重要的科目之一,对于选修三的内容,同学们需要充分了解和掌握。
本文将对高三化学选修三的主要知识点进行总结和归纳,旨在帮助大家更好地复习和理解这一部分的内容。
一、配位化学在高三化学选修三中,配位化学是一个重要的知识点。
配位化学是研究物质中复杂化合物形成和存在的科学。
其中包括配体和中心离子之间的配位键形成以及配位化合物的性质和应用等方面。
在学习配位化学时,我们需要了解几个核心概念:1. 配位键:指的是配体和中心离子通过配位作用所形成的化学键。
2. 配体:参与配位作用的化合物或离子,可以通过提供一个或多个电子对与中心离子形成配位键。
3. 中心离子:指的是配位化合物中被配体所包围的离子。
在配位化学中,我们需要掌握配合物的命名、配位数的判定、配合物的光谱分析等内容。
同时,了解配位离子的水合和配合物的形成常数以及对于配体排列的影响等知识也很重要。
二、化学动力学化学动力学是高三化学选修三的另一个重要知识点。
化学动力学是研究化学反应速率和反应机理的科学。
在学习化学动力学时,我们需要了解以下几个关键概念:1. 反应速率:指的是反应物消失或生成物产生的变化率。
2. 反应级数:指的是反应速率与各参与反应物浓度的关系。
3. 反应机理:指的是描述反应过程中各个步骤和中间体形成的细节。
此外,化学动力学还涉及到反应速率常数、速率方程的推导和应用、表观活化能等知识点。
对于掌握化学动力学的内容,理解反应速率与温度、浓度和催化剂等因素之间的关系也非常重要。
三、化学平衡化学平衡是化学反应进行的一种特殊状态。
在高三化学选修三中,我们需要了解平衡常数、平衡常数与温度的关系、平衡常数的应用等内容。
同时也需要了解平衡常数与反应自由能之间的关系,以及如何利用平衡常数进行反应方向的判断。
在学习化学平衡时,我们还需要了解平衡的移动、平衡浓度的计算和平衡条件等知识。

.化学选修 3《第二章分子构造与性质》知识点总结一.共价键1.共价键的实质及特点共价键的实质是在原子之间形成共用电子对,其特点是拥有饱和性和方向性。
2.共价键的种类①按成键原子间共用电子对的数量分为单键、双键、三键。
②按共用电子对能否偏移分为极性键、非极性键。
③按原子轨道的重叠方式分为σ键和π键,前者的电子云拥有轴对称性,后者电子云具有镜像对称性。
3 .键参数①键能:气态基态原子形成 1 mol化学键开释的最低能量,键能越大,化学键越稳固。
② 键长:形成共价键的两个原子之间的核间距,键长越短,共价键越稳固。
③键角:在原子数超出 2 的分子中,两个共价键之间的夹角。
④键参数对分子性质的影响键长越短,键能越大,分子越稳固.4.等电子原理原子总数同样、价电子总数同样的分子拥有相像的化学键特点,它们的很多性质邻近。
如222二.分子的立体构型1.分子构型与杂化轨道理论杂化轨道的重点当原子成键时,原子的价电子轨道互相混淆,形成与原轨道数相等且能量同样的杂化轨道。
杂化轨道数不一样,轨道间的夹角不一样,形成分子的空间形状不一样。
2.分子构型与价层电子对互斥模型价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包含孤对电子。
(1)中间心原子无孤对电子时,二者的构型一致;(2)中间心原子有孤对电子时,二者的构型不一致。
3.配位化合物(1)配位键与极性键、非极性键的比较( 2)配位化合物①定义:金属离子 (或原子 )与某些分子或离子(称为配体 )以配位键联合形成的化合物。
②构成:如 [Ag(NH 3)2 ]OH ,中心离子为Ag +,配体为NH 3,配位数为2 。
三.分子的性质1.分子间作使劲的比较2.分子的极性(1)极性分子:正电中心和负电中心不重合的分子。
(2)非极性分子:正电中心和负电中心重合的分子。
3.溶解性(1)“相像相溶”规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂.若存在氢键,则溶剂和溶质之间的氢键作使劲越大,溶解性越好。
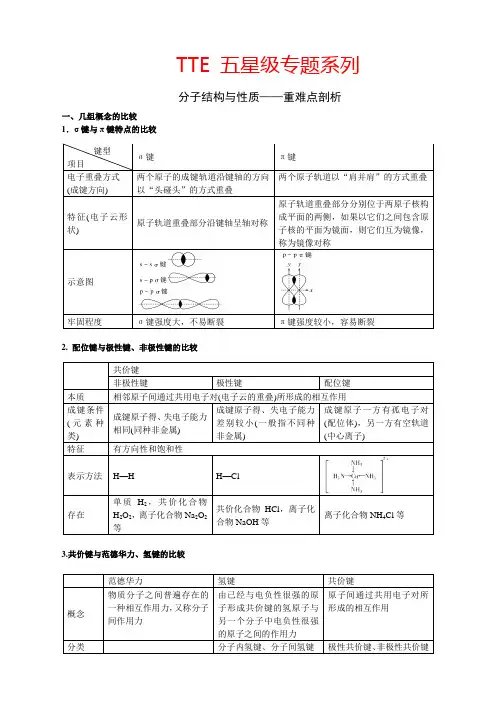
TTE 五星级专题系列分子结构与性质——重难点剖析一、几组概念的比较 1.σ键与π键特点的比较2. 配位键与极性键、非极性键的比较3.共价键与范德华力、氢键的比较键型 项目 σ键π键电子重叠方式 (成键方向) 两个原子的成键轨道沿键轴的方向以“头碰头”的方式重叠两个原子轨道以“肩并肩”的方式重叠特征(电子云形状)原子轨道重叠部分沿键轴呈轴对称原子轨道重叠部分分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,则它们互为镜像,称为镜像对称示意图牢固程度 σ键强度大,不易断裂π键强度较小,容易断裂共价键 非极性键极性键配位键本质 相邻原子间通过共用电子对(电子云的重叠)所形成的相互作用 成键条件(元素种类) 成键原子得、失电子能力相同(同种非金属) 成键原子得、失电子能力差别较小(一般指不同种非金属)成键原子一方有孤电子对(配位体),另一方有空轨道(中心离子)特征有方向性和饱和性表示方法 H —HH —Cl存在 单质H 2,共价化合物H 2O 2,离子化合物Na 2O 2等共价化合物HCl ,离子化合物NaOH 等离子化合物NH 4Cl 等范德华力氢键共价键概念物质分子之间普遍存在的一种相互作用力,又称分子间作用力 由已经与电负性很强的原子形成共价键的氢原子与另一个分子中电负性很强的原子之间的作用力 原子间通过共用电子对所形成的相互作用分类分子内氢键、分子间氢键极性共价键、非极性共价键4. 键参数——键能、键长、键角二、共价键的特征及类型1. 共价键的特征 (1)共价键的饱和性①按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就是共价键的“饱和性”。
H 原子、Cl 原子都只有一个未成对电子,因而只能形成H 2、HCl 、Cl 2分子,不能形成H 3、H 2Cl 、Cl 3等分子。
②共价键的饱和性决定了共价分子的组成。
(2)共价键的方向性①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越大,形成的共价键就越牢固。
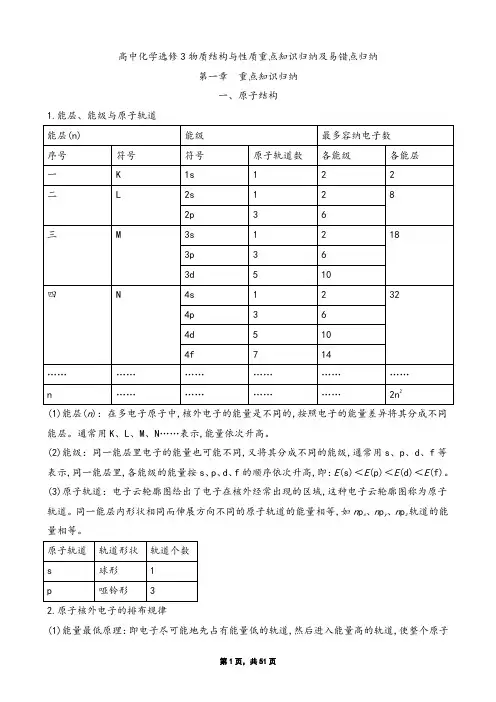
高中化学选修3物质结构与性质重点知识归纳及易错点归纳第一章重点知识归纳一、原子结构1.能层、能级与原子轨道(1)能层(n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
通常用K、L、M、N……表示,能量依次升高。
(2)能级:同一能层里电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序依次升高,即:E(s)<E(p)<E(d)<E(f)。
(3)原子轨道:电子云轮廓图给出了电子在核外经常出现的区域,这种电子云轮廓图称为原子轨道。
同一能层内形状相同而伸展方向不同的原子轨道的能量相等,如n p x、n p y、n p z轨道的能量相等。
2.原子核外电子的排布规律(1)能量最低原理:即电子尽可能地先占有能量低的轨道,然后进入能量高的轨道,使整个原子的能量处于最低状态,所有电子排布规则都需要满足能量最低原理。
下图为构造原理示意图,即基态原子核外电子在原子轨道上的排布顺序图,由构造原理可知,从第三能层开始各能级不完全遵循能层顺序,产生了能级交错排列,即产生“能级交错”现象,能级交错指电子层数较大的某些能级的能量反而低于电子层数较小的某些能级的能量的现象,如:4s<3d、6s<4f <5d,一般规律为n s<(n-2)f<(n-1)d<n p。
注意排电子时先排4s轨道再排3d轨道,而失电子时,却先失4s轨道上的电子。
(2)泡利原理:每个原子轨道里最多只能容纳2个电子,且自旋状态相反。
如2s轨道上的电子排布为,不能表示为。
因为每个原子轨道最多只能容纳2个电子且自旋方向相反,所以从能层、能级、原子轨道、自旋方向四个方面来说明电子的运动状态是不可能有两个完全相同的电子的。
如氟原子的电子排布可表示为1s22s22p2x2p2y2p1z,由于各原子轨道中的电子自旋方向相反,所以9个电子的运动状态互不相同。
(3)洪特规则:当电子排布在同一能级的不同轨道时,基态原子中的电子总是优先单独占据一个轨道,且自旋状态相同。


2020届高三化学选修三物质结构与性质常考题型——配位键和配合物键越强。
同时,中心原子的电荷数和配位数也会影响配位键的强弱。
4、配合物的稳定性:配合物的稳定性取决于配位键的强弱和配位数。
一般来说,配位键越强,配位数越大,配合物越稳定。
5、常见的配合物反应:1)配位键的形成和解离反应2)配合物的氧化还原反应3)配合物的置换反应6、配合物在实际应用中的作用:1)催化剂:如铂金催化剂、酶催化剂等2)药物:如金霉素、铁蛋白等3)染料:如紫外线吸收剂、荧光剂等4)其他:如氧气运输、水处理等在高三化学选修三中,物质结构与性质是一个重要的考试内容。
其中,配位键和配合物是经常出现的考题类型。
配位键是一种特殊的共价键,由一个原子提供孤电子对,另一原子提供空轨道而形成。
配合物是由中心原子和配位体组成的离子或分子,其中,中心原子一般是带正电荷的金属离子,而配位体则含有并提供孤电子对的分子或离子。
配合物在实际应用中有着广泛的作用,如催化剂、药物、染料、氧气运输等。
在研究过程中,需要掌握配位键和配合物的形成条件、强弱、稳定性以及常见的反应类型。
1、乙二胺能与金属离子形成配合物的原因是乙二胺提供孤对电子,金属离子提供空轨道。
其中与乙二胺形成的化合物稳定性相对较高的是Cu2+。
2、CuCl难溶于水但易溶于氨水的原因是氨提供孤对电子,与CuCl形成的配位键更强。
此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为[Cu(NH3)4]2+。
3、Co3在水中易被还原成Co2,而在氨水中可稳定存在的原因是氨提供孤对电子,与Co3形成的配位键更强。
4、对于中心离子为Hg2+等阳离子的配合物,配位体给出电子能力越强,则配位键就越强,配合物也就越稳定。
因此,HgI4^2-比HgCl4^2-更稳定,因为I元素的电负性比Cl元素大,I原子提供孤电子对的倾向更大,与Hg2+形成的配位键更强。
5、NF3与NH3的空间构型相同,但NF3不易与Cu2+形成配离子。

高三化学配位键知识点
配位键是化学中的一种重要概念,主要涉及电子的共享和空轨道的形成。
以下是关于配位键的一些知识点:
1. 配位键的形成:当一个原子或分子提供孤电子对,而另一个原子或分子提供空轨道时,配位键形成。
2. 配位键的表示:配位键通常用“→”来表示,箭头指向接受孤电子对的原子。
3. 配合物:在配合物中,中心原子或离子与配体通过配位键结合,形成复杂结构。
4. 共价键与配位键的区别:共价键涉及电子的共用,而配位键则是一方提供空轨道,一方提供电子。
5. 配位键的类型:包括σ配键和π配键,其中σ配键表示成键电子云沿着成键的两个原子核的连线方向移动,而π配键则表示成键电子云垂直于成键的两个原子核的连线方向移动。
总的来说,理解配位键需要掌握电子的共享和空轨道的形成等基本概念,同时要了解配合物的结构和性质。
2020届高三化学选修三物质结构与性质常考题型——配位键和配合物【方法和规律】1、配位键(一种特殊的共价键)(1)孤电子对:分子或离子中没有跟其他原子共用的电子对称为孤电子对(2)配位键的形成:成键的两个原子或离子一方提供孤电子对,一方提供空轨道而形成的共价键。
即:共用电子对由一个原子单方向提供给另一原子共用所形成的共价键(3)成键的性质:共用电子对对两个原子的电性作用(4)配位键的表示方法:常用“―→”来表示配位键,箭头指向接受孤电子对的原子即:BA电子对接受体电子对给予体−→−,如:NH+4可表示为(5)成键条件:其中一个原子提供孤对电子,另一原子提供空轨道2、配合物(1)中心原子:提供空轨道接受孤对电子的原子叫中心原子。
中心原子一般是带正电荷的金属离子(此时又叫中心离子),过渡元素最常见如:Fe3+、Cu2+、Zn2+、Ag+(2)配位体:含有并提供孤电子对的分子或离子,即电子对的给予体。
常见的配位体:H2O、NH3、SCN—、CO、N2、X—、OH—、CN—(3)配位原子:配体中提供孤对电子的原子叫配位原子,如:H2O中的O原子,NH3中的N原子(4)配离子:由中心原子(或离子)和配位体组成的离子叫做配离子,如:[Cu(NH3)4]2+、[Ag(NH3)2]+(5)配位数:作为配位体直接与中心原子结合的离子或分子的数目,即形成的配位键的数目称为配位数如:[Cu(NH3)4]2+的配位数为4,[Ag(NH3)2]+的配位数为2(6)配离子的电荷数:配离子的电荷数等于中心离子和配位体电荷数的代数和(7)内界和外界:配合物分为内界和外界,期中配离子称为内界,与内界发生电性匹配的的阳离子(或阴离子)称为外界,如:[Cu(NH3)4]SO4的内界是[Cu(NH3)4]2+,外界是SO42—,配合物在水溶液中电离成内界和外界两部分即:[Cu(NH3)4]SO4===[Cu(NH3)4]2++SO42—,而内界很难电离,其电离程度很小,[Cu(NH3)4]2+ Cu2++4NH33、配位键的强弱:配位键的强弱取决于配位体给电子的能力,配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定【例题精讲】配位键的形成条件答题策略其中一个原子提供孤对电子,另一原子提供空轨道答题模×××提供孤对电子,×××提供空轨道1、[2019·全国卷Ⅰ·节选]乙二胺能与Mg2+、Cu2+等金属离子形成稳定环状离子,其原因是______________________________________________,其中与乙二胺形成的化合物稳定性相对较高的是________(填“Mg2+”或“Cu2+”)2、[2019·海南卷·节选]CuCl难溶于水但易溶于氨水,其原因是__________________________________________,此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为_______3、Co3+在水中易被还原成Co2+,而在氨水中可稳定存在,其原因为___________________________________________________________________4、研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定。
人教版选修三物质结构与性质——配位键高考题汇编1. 气态氯化铝(Al2Cl6) 是具有配位键的化合物,分子中原子间成键的关系如下图所示,请将图中,你认为是配位键的斜线上加上箭头。
2.①AICl3在NaCl、KCI融熔盐中能形成Al2CI7-,其结构如图所示。
其中AI原子的杂化轨道类型为____ , 配位键数目为____.3.在CrCI3的水溶液中,一定条件下存在组成为[CrCI n(H2O)6-n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R-H) ,可发生离子交换反应:[CrCI n(H2O)6-n]x++xR-H→R x[CrCI n(H2O)6-n]+xH+交换出来的H经中和滴定,即可求出x和n,确定配离子的组成。
将含0.0015mol[CrCI n(H2O)6-n]x+的溶液,与R-H 完全交换后,中和生成的H+需浓度为0.1200 mol/LNaOH溶液25.00ml可知该配离子的化学式为.[答案][CrCI(H2O)5]2+[解析](3)根据提供数据,该配离子通过离子交换树脂后生成的n(H+)=0.1200mol/Lx0.025L=0.003mol,则1:X=0.0015:0.003,解得x=2。
则该配离子的化学式为[CrCI(H2O)5]2+.4.元素W(Cu)的一种氯化物晶体的晶胞结构如图所示,该氯化物的化学式是________,它可与浓盐酸发生非氧化还原反应,生成配合物H n WCl3,反应的化学方程式为________________________,[答案]CuCI CuCI+2HCI===H2CuCI3(或CuCI+2HCI===H2[CuCl3])5.金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是,反应的化学方应程式为[答案]H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行。
Cu+H2O2+4NH3===[Cu(NH3)4]2++20H-6.向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。
不考虑空间构型,[Cu(OH)4]2的结构可用示意图表示为7.过渡金属配合物Ni(Co)n的中心原子价电子数与配体提供电子总数之和为18,则n= .Co与N2结构相似,Co分子内σ键于π键个数之比为_[答案]41:28.若BCl3与XY n。
通过B原子与X原子间的配位键结合形成配合物,则该配合物提供孤对电子的原子是_[答案]x9.X的氯化物与氨水反应可形成配合物[X(NH3)4]Cl2,1mol该配合物中含有σ键的数目为_[答案]1610.A-、B+和C3+三种离子组成的化合物B3CA6。
(K3FeF6),其中化学键的类型有____ ;该化合物中存在一个复杂离子,该离子的化学式为____,配位体是____。
(A为F,B为K,C为Fe) [答案]离子键、配位键[FeF6]3-;11.NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一1molNH4BF4有____mol配位键。
[答案]212.(1)R2+的水合离子中,提供孤电子对的原子是____。
(2)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是________________。
(R为Cu、X为N,Y为02)[答案](1)0(2)2Cu+8NH3·H20+O2===2[Cu( NH3)4]2++4OH-+6H2O13.(2014-全国卷II,T37)这5种元素(H、N、O、S、Cu)形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示)。
该化合物中,阴离子为__________,阳离子中存在的化学键类型有__________;该化合物中加热时首先失去的组分是__________,判断理由是_[答案]SO42-共价键和配位键H2O H2O与Cu2+的配位键比NH3与Cu2+的弱[解析]根据题目中的信息可知,5种元素(H、N、0、S、Cu)形成的一种1:1型的离子化合物中,阴离子呈四面体结构,可知该阴离子是SO42-,阳离子呈轴向狭长的八面体结构,结合图2,可知该化合物的化学式[Cu(NH)4(H2O)2]SO4,阳离子是[Cu(NH)4(H2O)2]2+,则阳离子中含有共价键和配位键。
14.Cr3+基态核外电子排布式为________;配合物[Cr(H2O)6]3+中,与Cr3+形成配位键的原子是_________(填元素符号)。
[答案][Ar]3d015.CaF2难溶于水,但可溶于含Al3+的溶液中,原因是_______(用离子方程式表示)。
已知AIF63+在溶液中可稳定存在。
[答案]Al3++3CaF2===3Ca2++AIF63+16.在Ni基催化剂作用下,CH4和CO2反应可获得化工原料CO和H2。
①基态Ni原子的电子排布式为_____,该元素位于元素周期表的第__族。
②Ni能与CO形成正四面体形的配合物Ni(CO)4,lmolNi(CO)4中含有____molσ键。
[答案]①1S22S22P63S23d84S2或[Ar]3d94s2VIII②817.CO能与金属Fe形成Fe(CO)5,该化合物熔点为253K,沸点为376K,其固体属于________晶体。
[答案]分子18.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,不考虑空间构型,[Zn(CN)4]2-的结构可用示意图表示为_________19.该化合物(CuCl)难溶于水但易溶于氨水,其原因是______。
此化合物的氨水溶液遇到空气则被氧化为深蓝色,深蓝色溶液中阳离子的化学式为______[答案]Cu+可与氨形成易溶于水的配位化合物(或配离子)[Cu(NH3)4]2+20.研究表明,对于中心离子为Hg2+等阳离子的配合物,若配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定.预测HgCl42-与HgI42-的稳定性强弱,并从元素电负性的角度加以解释.答:HgCl42-比HgI42-更______(填“稳定”或“不稳定”),因为______.根据配位体给出电子能力越强,则配位体与中心离子形成的配位键就越强,配合物也就越稳定,可知I给出电子的能力大于Cl,即元素的电负性越弱,配位键越强,电负性:Cl>I,所以HgCl42-比HgI42-更不稳定;故答案为:不稳定;Cl比I电负性强,给出电子能力较弱,形成配位键较弱,配合物较不稳定.21.(1)CuCl2溶液有时呈蓝色,有时呈绿色,这是因为在CuCl2溶液中存在如下的平衡:[Cu(H2O)4]2+蓝色+4CI-⇌[CuCI4]2+绿色+4H2O现欲使溶液由绿色变成蓝色,请写出可采用的两种方法:Co(NH3)5BrSO4可形成两种钴的配合物,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4和[Co(NH3)5SO4]Br,在第一种配合物的溶液中加BaCl2溶液时,现象是;如果在第二种配合物的溶液中加入BaCl2溶液时,现象是,若加入AgNO3溶液时,现象是.解:(1)使溶液由绿色变成蓝色,应使平衡向左移动,能够使化学平衡向逆反应方向移动的措施即可.方法一:根据化学平衡移动原理,可以加入硝酸银溶液,使之和氯离子反应来减少氯离子的浓度,使得平衡左移;方法二:根据化学平衡移动原理,加入水稀释,平衡向着离子数目增加的方向进行,即向着逆反应方向进行,故答案为:加入硝酸银溶液;加水稀释;(2)配合物中外界离子在水溶液里能发生电离,內界原子不能发生电离,第一种配合物中,硫酸根离子为外界,在水溶液里能该配合物电离出SO42-,SO4 2-和Ba 2+反应生成白色沉淀,离子方程式为SO42-+Ba2+=BaSO4↓,所以在第一种配合物的溶液中加BaCl2溶液时,看到的现象是有白色沉淀生成;第二种配合物中SO42-为內界,该配合物在水溶液里不能电离出自由移动的SO4 2-,所以如果在第二种配合物的溶液中加入BaCl2溶液时,现象是没有白色沉淀生成;溴离子为外界,在水溶液里该配合物电离出溴离子,溴离子和银离子反应生成淡黄色溴化银沉淀,反应方程式为Ag++Br-=AgBr↓,所以看到的现象是有淡黄色沉淀生成,故答案为:产生白色沉淀生成;无现象;产生淡黄色沉淀生成配位键疑难释疑配位键及配位化合物知识尽管在教材中所占内容不多,但它常常与化学键、轨道杂化及物质性质等内容结合在一起设计问题,因而明晰配位键的本质、存在、形成条件等相关内容具有很重要的意义。
一、配位键与共价键的本质是否相同:原子之间形成共价键时,若共用电子对只是由一-方原子提供电子,而非来自双方原子,这样的共价键就称为配位键,故配位键-定是共价键,也就具有共价键的特征:方向性与饱和性,所以说配位键与共价键没有本质上的差异。
共价键不--定是配位键,关键是看共用电子对的来源是-一个成键原子还是两个成键原子提供的,若是由成键的一个原子单方面提供的则为配位键,若是由成键双方原子共同提供的则是普通共价键,所以说配位键与共价键只是在形成过程上有所不同而已。
如浓氨水与盐酸反应生成氯化铵,因氨气分子中的氮原子有一对孤电子,氢离子有空轨道,故H+与氨气通过配位键结合成铵根离子,尽管铵根离子中4个氮氢键的形成过程不同,但实验证明这4个氮氢键的性质完全相同,没有任何差异,这也进一步证明配位键与共价键是没有本质区别的。
二、形成配位键有何条件:配位键是一种特殊的共价键,并不是任意的两个原子相遇就能形成。
它要求成键的两个原子中一个原子A有孤对电子,另-一个原子B有接受孤对电子的“空轨道”,所以配位键的表示方法为A→B, A称为配体,B 称为中心原子或离子。
有时为了增强成键能力,中心原子或离子B 利用能量相近的空轨道进行杂化后,再来接收以配体原子A的孤电子对。
配位键既可以存在于分子中(如H2SO4等),又可以存在于离子之中(如铵根离子、水合氢离子等) ,如图所示:例1:气态氯化铝(AI2C16)是具有配位键的化合物,分子中原子之间的关系如图示。
请在图中标出你认为是配位键的斜线加上箭头。
解析:配位键是指成键双方一方提供空轨道一方提供孤对电子。
氯元素最外层有7个电子通过1个共用电子对就可以形成8电子稳定结构。
所以氯化铝(AI2C16)中与两个铝形成共价健的氯原子中,有一条是配位键,氯原子提供电子,铝提供空轨道。
三、含有配位键的化合物就是配位化合物吗配位化合物一般指由过渡金属的原子或离子(价电子层的部分d轨道和s、p轨道是空轨道)与含有孤对电子的分子(如CO、NH3、H2O)或离子(如CI-、CN-、NO2-等)通过配位链结合形成的化合物。