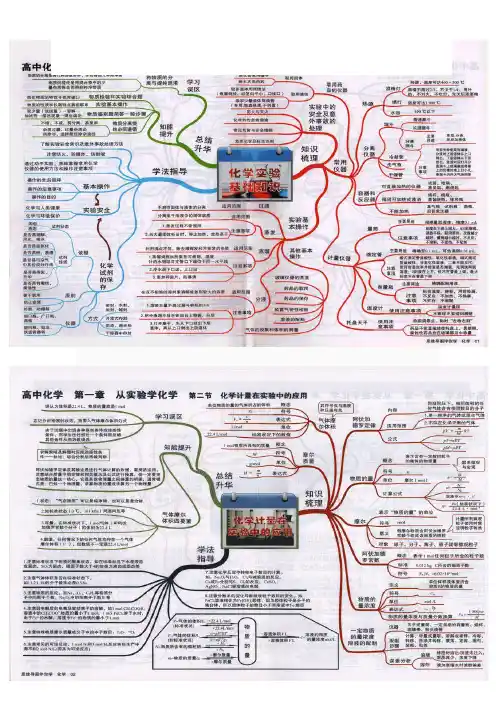
【中学思维导图】图解人教版高中化学选修3物质结构与性质
- 格式:pdf
- 大小:938.61 KB
- 文档页数:6




高中化学第二章化学物质及其变化策一节物魔的组成、性质和分类广阙壹异形偉1凰袄旰竺乌歼晶体叫�✓� 哎元正竺叶;日已畿干竺·干昌体l知能提升叫/""'』T化仑物构戌高子竺屯真于晶体、--v,、-、.,、--v---'安戎俜度岭戎角度知道分子.颠干、寞子、元聿等概念的含义及褒示方湛知道物澄宣化.化学查化和喇珊性质`化半性匮正确地对无机恤进行分类,尤其毓分辨碱.喊,丛、氧化物釴从不阳的角度区分化学反应炎型区分溶液.湟液.胶体,了解胶体的性赋判断闯位景、何晕凳形体、阿分异构体`阿系柳熟记井正碱书写常见元鬻的名称和符号正檐书写常见的电干式,结构示宣团.化掌式、分子式,结构式和结构荀式廷斛化合价的概念和颠则.榷娥化合价正确书写化学式或攘鸯化学式求出化合价知谱际.守恒定律的含义。
正噙书写化学方栈式、热化学方槐式,寓子方程式、电韬反应式高中化学第二章化学物质及其变化第二节寓子反应2电解撰和非龟鳞质均为化合物、单厥和漫合辏既不是电赋咧也不是非电航质3俸一些準濬性盐晶然在水中涫斛瘦不大.但涫于水的全却电寓,所以是强电解咦4电觥厚漕渭的马电性猩码由白由移功的寓千的电倩益和坟霆决定,与电鹹质的道砚无关知识缺陷.如:滇漕.有色”与飞量渭-.不械掌■物质的溶滇性.擒展阔的化孛反应审题不编.如:忽略了噩设的限劓篆件挖峰不力如:溶潦的黯碱性一整胄干具青惺篡化性思戴不全.如复杂问陋需夷定性和定量绩合酌擅是化合笥,其次在木滚液或饿酗状芯熊否弄电恩蝶髯侧伴惊学化学04,撞酗`遠咧、大多数盐,水溶液中完全龟高1霸臻`蜗碱、少数盐,水滚液中沉分龟寓湾质被濡爆糟威急蝗尽赃伸你学化掌OO常见可生咸沉池的霞千阳了工三已邓归,.•• 噜窃一.义寸、S心:·.PO只so:-a-.o, 飞,·.,�、O il二0才、汉牙c,'噜'f古、M,i'l s只OH气col飞虹。




选修三物质结构与性质总结一.原子结构与性质.1、认识原子核外电子运动状态,了解电子云、电子层(能层)、原子轨道(能级)的含义.电子云:用小黑点的疏密来描述电子在原子核外空间出现的机会大小所得的图形叫电子云图.离核越近,电子出现的机会大,电子云密度越大;离核越远,电子出现的机会小,电子云密度越小.电子层(能层):根据电子的能量差异和主要运动区域的不同,核外电子分别处于不同的电子层.原子由里向外对应的电子层符号分别为K、L、M、N、O、P、Q.原子轨道(能级即亚层):处于同一电子层的原子核外电子,也可以在不同类型的原子轨道上运动,分别用s、p、d、f表示不同形状的轨道,s轨道呈球形、p轨道呈纺锤形,d轨道和f轨道较复杂.各轨道的伸展方向个数依次为1、3、5、7.2.(构造原理)了解多电子原子中核外电子分层排布遵循的原理,能用电子排布式表示1~36号元素原子核外电子的排布.(1).原子核外电子的运动特征可以用电子层、原子轨道(亚层)和自旋方向来进行描述.在含有多个核外电子的原子中,不存在运动状态完全相同的两个电子.(2).原子核外电子排布原理.①.能量最低原理:电子先占据能量低的轨道,再依次进入能量高的轨道.②.泡利不相容原理:每个轨道最多容纳两个自旋状态不同的电子.③.洪特规则:在能量相同的轨道上排布时,电子尽可能分占不同的轨道,且自旋状态相同.洪特规则的特例:在等价轨道的全充满(p6、d10、f14)、半充满(p3、d5、f7)、全空时(p0、d0、f0)的状态,具有较低的能量和较大的稳定性.如24Cr [Ar]3d54s1、29Cu [Ar]3d104s1.(3).掌握能级交错1-36号元素的核外电子排布式.ns<(n-2)f<(n-1)d<np3.元素电离能和元素电负性第一电离能:气态电中性基态原子失去1个电子,转化为气态基态正离子所需要的能量叫做第一电离能。
常用符号I1表示,单位为kJ/mol。

探索世界把握规律时代精神精华哲学基本问题联系第一方面的save 是第二saves的前提 基础二对一是深化 展开区别内容第一方面思存本源第二方面思存同一性思维能否正确认识存在地位第一最重要的方面第二基本问题的从属方面意义第一物新only标准 两大阵营第二可不可知论不可知论忽略了社会实践的发展和人类的认识能力的提高基本派别基本观点古代唯物主义否神创说,世界物质近代形而上学唯物主义原子本源辩证唯物主义 历史唯物主义物决意 意对物能动社本质上 客观物体社活本质 物质的常见观点五行,荀子(阴阳),范缜(形神),王夫之(气理)狄德罗,培根物质本质,物决意,意对物反社会存在决社会意识,。
反作用合理性唯物根向,本质正确自科基础 丰展唯物科学的 世界观方法论 无产阶级 思想武器局限性缺少科学依据,把复杂问题简单化机械性,形而上学性,历史观的唯心主义无,这是最好的共同性根本观点上一致的,都承认物质本原,物质第一性意识第二性,物质决定意识探索世界本质认识规律理解含义含义(know)规律是事物运动过程中固有的本质的,必然的,稳定的联系理解(know)固有的规律的客观性本质规律的联系,隐藏在事物现象之间必然的确定不一,必然如此的稳定不多变不易逝note(konw)哲学≠具体规律,共性与个性,一般与个别规律≠规律现象规律客观性∴无好坏之分规律是联系,联系不一定是规律规律有条件的客观规律性 主观能动性 辩证关系辩证关系客观不移,否则惩罚主观能动,能认用规方法论尊客规律 主观能动 基础前提主观能动 认利规律 必要条件反对错误倾向反对夸大意识 能动作用 唯意识主义片面客观 安于现状 无所作为 因循守旧正确发挥主观能动性人能够能懂地认识世界目的性 自觉选择性 能动创造性not only外部现象but also 本质规律人能够能动地改造世界反映客观 指导改造by实践观念变现实 创造目的事物意识能动性受客观规律制约正确意识 符合客观 正确指导 预期目标方法论要求尊重规律 正确发挥 主观能动 正确意识 克服错误把握世界规律世界普遍联系的联系的普遍性 客观性 多样性普遍性原理:anything and otherthing,事物各个部分之间相互联系 世界整体 普遍联系方法论:普遍联系 观点看题既要看到。
《选修三物质结构与性质》知识归纳一、能层与能级1、能层(电子层:n):在多电子原子中,核外电子的能量是不同的,按照电子的能量差异将其分成不同能层。
由里向外,分别用字母:K、L、M、N、O、P、Q表示相应的第一、二、三、四、五、六、七能层。
各能层最多容纳的电子数为2n2;在同一个原子中,离核越近,电子能量越低2、能级:同一能层里的电子的能量也可能不同,又将其分成不同的能级,通常用s、p、d、f等表示,同一能层里,各能级的能量按s、p、d、f的顺序升高,即:E(s)<E(p)<E(d)<E(f)①K层指包含一个能级,即s能级;L层包含两个能级,s和p能级;M层包含三个能级,s、p和d能级;N层包含四个能级,s、p、d、f能级②每个能层中,能级符号的顺序是ns、np、nd、nf……③s、p、d、f……可容纳的电子数依次是1、3、5、7……的两倍④同一能级容纳的电子数相同3、电子云:原子核外电子绕核高速运动是没有确定的轨道的,就好像一团“带负电荷的云雾”笼罩在原子核周围,这种“带负电荷的云雾”称之为电子云。
电子云密集(单位体积内小黑点多)的地方,电子出现的机会多;反之,电子云稀疏(单位体积内小黑点少)的地方,电子出现的机会少。
即电子云表示电子在核外单位体积内出现几率的大小,而非表示核外电子多少4、原子轨道:不同能级上的电子出现概率约为90%的电子云的空间轮廓图称为原子轨道(1)原子轨道的形状①s电子的原子轨道都是球形的,每个s能级各有1个原子轨道,能层序数越大,s原子轨道的半径越大;能量:E1s<E2s<E3s,随着能层序数的增大,电子在离核更远的区域出现的概率减小,电子云越来越向更大的空间扩展②p电子的原子轨道是纺锤形(哑铃形),每个p能级有3个轨道,它们互相垂直,分别以p x、p y、p z为符号。
p原子轨道的平均半径也随能层序数增大而增大③能级与原子轨道数和容纳的电子数的关系能级s(球形)p(纺锤形)d f原子轨道1357容纳的电子数261014二、基态原子的核外电子排布式1、构造原理:多电子的核外电子排布总是按照能量最低原理,由低能级逐步填充到高能级。
高中化学选修3知识点图示大全第一章原子结构与性质一.原子结构1.能级与能层2.原子轨道3.原子核外电子排布规律(1)能量最低原理现代物质结构理论证实,原子的电子排布遵循构造原理能使整个原子的能量处于最低状态,简称能量最低原理。
构造原理和能量最低原理是从整体角度考虑原子的能量高低,而不局限于某个能级。
(2)泡利(不相容)原理:基态多电子原子中,不可能同时存在4个量子数完全相同的电子。
换言之,一个轨道里最多只能容纳两个电子,且电旋方向相反(用“↑↓”表示),这个原理称为泡利(Pauli)原理。
(3)洪特规则:当电子排布在同一能级的不同轨道(能量相同)时,总是优先单独占据一个轨道,而且自旋方向相同,这个规则叫洪特(Hund)规则。
比如,p3的轨道式为或,而不是。
洪特规则特例:当p、d、f轨道填充的电子数为全空、半充满或全充满时,原子处于较稳定的状态。
即p0、d0、f0、p3、d5、f7、p6、d10、f14时,是较稳定状态。
前36号元素中全空状态的有4Be 2s22p0、12Mg 3s23p0、20Ca 4s23d0;半充满状态的有:7N 2s22p3、15P 3s23p3、24Cr 3d54s1、25Mn 3d54s2、33As 4s24p3;全充满状态的有10Ne 2s22p6、18Ar 3s23p6、29Cu 3d104s1、30Zn 3d104s2、36Kr 4s24p6。
4.基态原子核外电子排布的表示方法(1)电子排布式①用数字在能级符号的右上角表明该能级上排布的电子数,这就是电子排布式,例如K:1s22s22p63s23p64s1。
②为了避免电子排布式书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号表示,例如K:[Ar]4s1。
(2)电子排布图(轨道表示式)每个方框或圆圈代表一个原子轨道,每个箭头代表一个电子。
如基态硫原子的轨道表示式为二.原子结构与元素周期表1.原子的电子构型与周期的关系(1)每周期第一种元素的最外层电子的排布式为ns1。