高中化学奥林匹克竞赛培训讲义(全).doc
- 格式:doc
- 大小:328.04 KB
- 文档页数:15


高中化学奥林匹克竞赛辅导讲座第1讲 气 体【竞赛要求】气体。
理想气体标准状态。
理想气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定原理。
【知识梳理】一、气体 气体、液体和固体是物质存在的三种状态。
气体的研究对化学学科的发展起过重大作用。
气体与液体、固体相比较,具有两个明显特点。
1、扩散性 当把一定量的气体充入真空容器时,它会迅速充满整个容器空间,而且均匀分布,少量气体可以充满很大的容器,不同种的气体可以以任意比例均匀混合。
2、可压缩性当对气体加压时,气体体积缩小,原来占有体积较大的气体,可以压缩到体积较小的容器中。
二、理想气体如果有这样一种气体:它的分子只有位置而无体积,且分子之间没有作用力,这种气体称之为理想气体。
当然它在实际中是不存在的。
实际气体分子本身占有一定的体积,分子之间也有吸引力。
但在低压和高温条件下,气体分子本身所占的体积和分子间的吸引力均可以忽略,此时的实际气体即可看作理想气体。
三、理想气体定律 1、理想气体状态方程将在高温低压下得到的波义耳定律、查理定理和阿佛加德罗定律合并,便可组成一个方程:pV = nRT (1-1) 这就是理想气体状态方程。
式中p 是气体压力,V 是气体体积,n 是气体物质的量,T 是气体的绝对温度(热力学温度,即摄氏度数+273),R 是气体通用常数。
在国际单位制中,它们的关系如下表:表1-1 R 的单位和值(1-1)式也可以变换成下列形式:pV = MRT (1-2) p =V m ·M RT = M RT ρ 则: ρ = RTpM (1-3) 式中m 为气体的质量,M 为气体的摩尔质量,ρ为气体的密度。
对于一定量(n 一定)的同一气体在不同条件下,则有:111T V P = 222T V P (1-4) 如果在某些特定条件下,将(1-1)、(1-2)和(1-3)式同时应用于两种不同的气体时,又可以得出一些特殊的应用。
如将(1-1)式n =RTpV,在等温、等压、等容时应用于各种气体,则可以说明阿佛加德罗定律。


实用文档烃类化学讲高中化学奥林匹克竞赛辅导讲座第13【竞赛要求】C=C有机化合物基本类型及系统命名。
烷、烯、炔、环烃、芳香烃的基本性质及相互转化。
异构现象。
加成。
马可尼科夫规则。
取代反应。
芳香烃取代反应及定位规则。
芳香烃侧链的取代反应和氧化反应。
【知识梳理】一、有机化合物的分类和命名(一)有机化合物的分类 1、按基本骨架分类)脂肪族化合物:分子中碳原子相互结合成碳链或碳环。
(1 )芳香族化合物:碳原子连接成特殊的芳香环。
(2)杂环化合物:这类化合物具有环状结构,但是组成环的原子除碳外,还有氧、硫、氮等其他元(3 素的原子。
2、按官能团分类官能团是决定某类化合物的主要性质的原子、原子团或特殊结构。
显然,含有相同官能团的有机化合物具有相似的化学性质。
常见的官能团及相应化合物的类别表13-1CC碳碳双键烯烃CC碳碳叁键炔烃卤代烃卤素原子—X—羟基 OH 醇、酚O CC醚基醚OC H 醛基醛OC 羰基酮等OC OH羧基羧酸OR C 酰基化合物酰基大全.实用文档氨基—NH 胺2硝基—NO 硝基化合物2磺酸基—SOH 磺酸3巯基—SH 硫醇、硫酚氰基—CN 腈(二)有机化合物的命名1、烷烃的命名烷烃通常用系统命名法,其要点如下:(1)直链烷烃根据碳原子数称“某烷”,碳原子数由1到10用甲、乙、丙、丁、戊、己、庚、辛、壬、癸表示,如CHCHCHCH叫丁烷,自十一起用汉数字表示,如CH,叫十一烷。
24311232(2)带有支链烷烃的命名原则:A.选取主链。
从烷烃构造式中,选取含碳原子数最多的碳链为主链,写出相当于这一碳链的直链烷烃的名称。
B.从最靠近取代基的一端开始,用1、2、3、4……对主链进行编号,使取代基编号“依次最小”。
C.如果有几种取代基时,应依“次序规则”排列。
D.当具有相同长度的碳链可选做主链时,应选定具有支链数目最多的碳链为主。
例如:、脂环烃的命名2脂环烃分为饱和的脂环烃和不饱和的脂环烃。
饱和的脂环烃称为环烷烃,不饱和的脂环烃称环烯烃或环炔烃。

高中化学奥林匹克竞赛辅导讲座第4讲原子结构与元素周期律[竞争要求]核外电子运动状态:用s、p、d等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能、电子亲合能、电负性。
四个量子数的物理意义及取值。
单电子原子轨道能量的计算。
s、p、d原子轨道图像。
元素周期律与元素周期系。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右性质变化一般规律。
原子半径和离子半径。
s、p、d、ds、f区元素的基本化学性质和原子的电子构型。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高氧化态与族序数的关系。
对角线规则。
金属性、非金属性与周期表位置的关系。
金属与非金属在周期表中的位置。
半金属。
主、副族重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。
铂系元素的概念。
[知识分类]一、核外电子的运动状态1、微观粒子的二重性(1)光的波动性λ波长:传播方向上两个相邻峰(谷)之间的距离。
频率v:频率就是物质(光子)在单位时间内振动的次数。
单位是hz(1hz=1s1)。
-光速c=λv真空中2.998×108ms~-1=3×108ms1,大气中降低(但变化很小,-可忽略)。
波数V=1?(cm1)-(2)光的微粒性1900年,根据实验情况,提出了原子只能不连续地吸收和发射能量的观点。
这种不连续能量的基本单位称为光量子,光量子的能量(E)与频率(V)成正比。
即:e=h?(4-1)式中h为普朗克常数,等于6.626×10c34js(3)白光是复色光可见光的颜色与波长紫-绿-黄-橙-红波长(nm)400-430430-470470-500500-560560-590590-630630630-760(4)电子的波粒二象性-物质波-1-1923年,L·德布罗意在类比爱因斯坦的光子理论后,提出电子不仅具有粒子性质,而且还具有波性质。

奥林匹克竞赛有机化学要义精讲一.有机物系统命名法根据IUPAC命名法及1980年中国化学学会命名原则,按各类化合物分述如下。
1.带支链烷烃主链选碳链最长、带支链最多者。
编号按最低系列规则。
从靠侧链最近端编号,如两端号码相同时,则依次比较下一取代基位次,最先遇到最小位次定为最低系统(不管取代基性质如何)。
例如,命名为2,3,5-三甲基己烷,不叫2,4,5-三甲基己烷,因2,3,5与2,4,5对比是最低系列。
取代基次序IUPAC规定依英文名第一字母次序排列。
我国规定采用立体化学中“次序规则”:优先基团放在后面,如第一原子相同则比较下一原子。
例如,称2-甲基-3-乙基戊烷,因—CH2CH3>—CH3,故将—CH3放在前面。
2.单官能团化合物主链选含官能团的最长碳链、带侧链最多者,称为某烯(或炔、醇、醛、酮、酸、酯、……)。
卤代烃、硝基化合物、醚则以烃为母体,以卤素、硝基、烃氧基为取代基,并标明取代基位置。
编号从靠近官能团(或上述取代基)端开始,按次序规则优先基团列在后面。
例如,3.多官能团化合物(1)脂肪族选含官能团最多(尽量包括重键)的最长碳链为主链。
官能团词尾取法习惯上按下列次序,—OH>—NH2(=NH)>C≡C>C=C如烯、炔处在相同位次时则给双键以最低编号。
例如,(2)脂环族、芳香族如侧链简单,选环作母体;如取代基复杂,取碳链作主链。
例如:(3)杂环从杂原子开始编号,有多种杂原子时,按O、S、N、P顺序编号。
例如:4.顺反异构体(1)顺反命名法环状化合物用顺、反表示。
相同或相似的原子或基因处于同侧称为顺式,处于异侧称为反式。
例如,(2)Z,E命名法化合物中含有双键时用Z、E表示。
按“次序规则”比较双键原子所连基团大小,较大基团处于同侧称为Z,处于异侧称为E。
次序规则是:(Ⅰ)原子序数大的优先,如I>Br>Cl>S>P>F>O>N>C>H,未共享电子对:为最小;(Ⅱ)同位素质量高的优先,如D>H;(Ⅲ)二个基团中第一个原子相同时,依次比较第二、第三个原子;(Ⅳ)重键分别可看作(Ⅴ)Z优先于 E,R优先于S。

皇泉州民德市追俊学校高中化学奥林匹克竞赛讲义第一章原子结构与元素周期系考点归纳:近年来的化学试题中有关原子结构与元素周期系试题,大致有以下考点:1. 确元素在元素周期表中的位置,并预测它的性质。
2. 考察创能力。
打破元素在中的正常排布规律,让参赛者在全条件下或“规律”的情况下,进行元素的电子排布或重绘制元素周期表,并推测元素的化合价、性质。
3. 根据几种元素间的关系,推测其在周期表中的位置。
4. 用化学、物理学科知识,考察最科技成果。
趋势预测:今后的化学竞赛试题,将更调化学与物理知识点上的衔接,强调原子结构与元素周期系知识在日常生活中的用。
考查参赛者打破“旧知识”,建立“知识”的创造性思维能力。
笔者认为:若考查上述知识点,仍将在上述几个方面做文章。
一. 相对原子质量元素的相对原子质量(原子量)是指一种元素的1摩尔质量对核素12C的1摩尔质量的1/12 的比值。
这个义表明:①元素的相对原子质量是纯数。
②单核素元素的相对原子质量于该元素的核素的相对原子质量。
③多核素元素的相对原子质量于该元素的天然同位素相对原子质量的加权平均值。
二. 原子结构(一)原子结构(核外电子运动)的玻尔行星模型1. 氢原子光谱1833年巴尔麦找出氢原子光谱可见光区各谱线波长之间的关系为B是常数。
在19里德堡总结出谱线之间的普遍联系通式为ν=R(1/n12-1/n22),R为里德堡常数,其值为3.19×1015周/秒。
上述公式n1和n2对于各区谱线的关系为:紫外区:n1=l,n2=2,3,4……可见区:n1=2,n2=3,4, 5.......红外区:n1=3,n2=4,5,6……2. 玻尔理论(核外电子运动特点)19玻尔在普朗克量子论、爱因斯坦光子学论和卢瑟福的有核原子模型的基础上,为了阐明氢原子光谱的结果,提出了原子结构理论的三点假设,称为玻尔理论,其要点如下:①原子核外的电子不是在任意轨道上绕核运动,而是轨道角动量P必须符合以下条件:P=nh/2π,n为正整数,h为普朗克常数。
学习必备 欢迎下载黄冈中学化学奥赛培训教程系列(精美 word 版)有机化学第一节 有机化学基本概念和烃1、下列构造式中:①指出一级、二级、三级碳原子各一个。
②圈出一级烷基、二级烷基、三级烷基各一个。
CH 3 CH 3CH 3 CH 3CCH 2C CHCH 2CH 3CH 3 CHCH 3CH 3CH 3 CH 3 CH 3 一级烷基↓解析: CH 3CCH 2CCH CH 2CH 3CH 3CHCH 3↑ ↑ ↑3℃ 2℃ 1℃三级烷基CH 3三级烷基2、已知下列化合物的结构简式为: (1) CH 3CHClCHClCH 3 ( 2) CH 3CHBrCHClF( 3) CH 3CHClCHCH2CH 3 CH 3分别用透视式、纽曼式写出其优势构象。
解析:用透视式和纽曼式表示构象,应选择C 2 —C 3 间化学键为键轴,其余原子、原子团相当于取代基。
这四个化合物透视式的优势构象为(见图)其纽曼式的优势构象见图3、( 2000 年广东省模拟题)用烃 A 分子式为C10H16,将其进行臭氧化后,水解得到HCHO 和 A 催化加氢后得烃B, B 化学式为 C10H20,分子中有一个六元环,用键线式写出A,B 的结构。
解析:从 A 催化加氢生成的 B 的化学式可推知,原 A 分子中有两个C=C 键和一个六元环。
从水解产物可知, C1与 C6就是原碳环连接之处HCHO 的羰基,只能由C3支链上双键臭氧化水解生成。
所以 A 的结构为, B 的结构为。
4、下列化合物若有顺反异构,写出异构体并用顺、反及E、 Z 名称命名。
5、(河南省98 年竞赛题)写出符合C6H10的所有共轭二烯烃的异构体,并用E—Z命名法命名。
解析:6、用化学方法鉴别下列化合物:CH 3CH2CH2CH3,CH 3CH 2CH=CH 2, CH 3CH 2C≡ CH 。
解析:( 1)用 Br 2, CH 3CH 2CH=CH 2与 CH 3CH2 C≡ CH 可褪色, CH 3CH 2CH 2CH 3不反应。

高中化学奥林匹克竞赛辅导讲座第15讲 生物分子化合物和高分子化合物初步 【竞赛要求】糖的基本概念。
葡萄糖、果糖、甘露糖、半乳糖。
糖苷。
纤维素与淀粉。
氨基酸、多肽与蛋白质的基本概念。
DNA 与RNA 。
【知识梳理】 一、糖类糖类物质是指多羟基醛或多羟基酮以及能水解生成多羟基醛或多羟基酮的化合物。
糖类可分为单糖、低聚糖和多糖。
(一)单糖1、单糖的组成及结构 (1)葡萄糖的组成及结构 ①链状结构式由元素分析和分子量测定确定了葡萄糖的分子式为C 6H 12O 6。
其平面结构式为:CH 2OHCHOHCHOHCHOHCHOHCHO其费歇尔投影式为:D –(+)–葡萄糖CHOCH 2OH OH OHHO OH HHH H在葡萄糖的投影式中,定位编号最大的手性碳原子上的羟基位于右边,按照单糖构型的D 、L 表示法规定,葡萄糖属于D – 型糖,又因葡萄糖的水溶液具有右旋性,所以通常写为D –(+)– 葡萄糖。
葡萄糖是已醛糖,分子中有4个手性碳原子,应有16个光学异构体,其中8个为D 型,8个为L 型。
2、变旋光现象及环状结构式变旋光现象:某些旋光性化合物的旋光度在放置过程中会逐渐上升或下降,最终达到恒定值而不再改变的现象。
实验发现,结晶葡萄糖有2种。
一种是从乙醇溶液中析出的晶体(熔点146℃),配成水溶液测得其比旋光度为+112度,通常称为α – D –(+)– 葡萄糖,该水溶液在放置过程中,其比旋光度逐渐下降到 +52.7度的恒定值;另一种是从吡啶溶液中析出的晶体(熔点150℃),配成水溶液测得其比旋光度为+19度,称为β – D –(+)– 葡萄糖,该水溶液在放置过程中,比旋光度逐渐上升到 +52.7度的恒定值。
上述实验现象用开链式结构难以解释。
人们提出:葡萄糖具有分子内的醛基与醇羟基形成半缩醛的环状结构。
由于六元环最稳定,故由C 5上的羟基与醛基进行加成,形成半缩醛,并构成六元环状结构,组成环的原子中除了碳原子外,还有一个氧原子。

高中化学奥赛讲座(一)烃的衍生物【竞赛要求】卤代烃、醇、酚、醚、醛、酮、酸、酯、胺、酰胺、硝基化合物、磺酸的基本性质及相互转化。
异构现象。
【知识梳理】一、卤代烃(一)卤代烃的化学反应卤代烃是烃分子中一个或多个氢原子被卤素原子取代后所生成的化合物。
卤代烃分子结构中含有C—X键,由于卤素的电负性比碳大,碳卤键中电子云偏向卤素,使碳原子带部分正电荷,卤素易以X-的形式被取代,这种取代称为亲核取代反应(简写为SN)。
活泼金属也可以与卤代烃反应,生成金属有机化合物。
由于碳卤键的极性,使β碳原子上的氢原子与卤素原子一起脱去,发生消除反应而形成碳碳重键。
另外卤代烃还可被多种试剂还原生成烃。
卤代烃的化学反应如下:1、亲核取代反应(1)水解反应RX + H2O ROH + HX卤代烷水解是可逆反应,而且反应速度很慢。
为了提高产率和增加反应速度,常常将卤代烷与氢氧化钠或氢氧化钾的水溶液共热,使水解能顺利进行。
RX + H2O ROH + NaX(2)氰解反应RX + NaCN RCN + NaX氰基经水解可以生成为羧基(–COOH),可以制备羧酸及其衍生物。
也是增长碳链的一种方法。
如由乙烯来制备丙酸:CH2═CH2 CH3CH2Cl CH3CH2CN CH3CH2COOH(3)氨解反应RX + NH3 RNH2(4)醇解反应RX + NaOEt ROEt + NaX(5)与硝酸银的醇溶液反应RX + AgNO3 RONO2 + AgX↓此反应常用于各类卤代烃的鉴别。
不同卤代烃与硝酸银的醇溶液的反应活性不同,叔卤代烷 > 仲卤代烷 > 伯卤代烷。
另外烯丙基卤和苄基卤也很活泼,同叔卤代烷一样,与硝酸银的反应速度很快,加入试剂可立即反应,仲卤代烷次之,伯卤代烷加热才能反应。
2、消除反应卤代烷与氢氧化钾的醇溶液共热,分子中脱去一分子卤化氢生成烯烃,这种反应称为消除反应,以E表示。
RCH2CH2Br + NaOH RCH═CH2 + NaBr + H2O不同结构的卤代烷的消除反应速度不同,3oR-X > 2oR-X > 1oR-X 。
● 竞赛时间3小时。
迟到超过半小时者不能进考场。
开始考试后1小时内不得离场。
时间到,把试卷(背面朝上)放在桌面上,立即起立撤离考场。
● 试卷装订成册,不得拆散。
所有解答必须写在指定的方框内,不得用铅笔填写。
草稿纸在最后一页。
不得持有任何其他纸张。
● 姓名、报名号和所属学校必须写在首页左侧指定位置,写在其他地方者按废卷论处。
● 允许使用非编程计算器以及直尺等文具。
1.008Zr Nb Mo Tc Ru Rh Pd Ag CdIn Sn Sb Te I Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Ac-Lr HLi BeB C N O F Na MgAl Si P Cl S K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Rb Cs Fr Sr BaRaY La Lu -6.9419.01222.9924.3139.1040.0885.4787.62132.9137.3[223][226]44.9647.8850.9452.0054.9455.8558.9363.5558.6965.3910.8126.9869.7212.0128.0972.61114.8204.4118.7207.2112.4200.6107.9197.0106.4195.1102.9192.2101.1190.298.91186.295.94183.992.91180.991.22178.588.9114.0116.0019.0030.9774.92121.8209.032.0778.96127.6[210][210][210]126.979.9035.454.00320.1839.9583.80131.3[222]He Ne Ar KrXe Rn相对原子质量Rf Db Sg Bh Hs Mt7~9位,而有的元素的相对原子质量的有效数字位数少至3~4位,为什么?第2题(12分)将H 2O 2慢慢加入到SbF 5的HF 溶液中得一白色固体A ,A 是一种盐类,其阴离子呈八面体结构。
2009年云南师大附中高中化学奥赛培训■理论部分初赛基本要求1.有效数字。
在化学计算和化学实验中正确使用有效数字。
定量仪器(天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。
运算结果的有效数字。
2.理想气体标准状态。
理想气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定。
气体溶解度(亨利定律)。
3.溶液浓度与固体溶解度及其计算。
溶液配制(浓度的不同精确度要求对仪器的选择)。
重结晶及溶质一溶剂相对量的估算。
过滤与洗涤操作、洗涤液选择、洗涤方式选择。
溶剂(包括混合溶剂)与溶质的相似相溶规律。
4.容量分析的基本概念。
被测物、基准物质、标准溶液、指示剂、滴定反应等。
分析结果的准确度和精密度。
滴定曲线与突跃(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。
酸碱指示剂的选择。
高猛酸钾、重铅酸钾、硫代硫酸钠、EDTA为标准溶液的滴定基本反应与分析结果计算。
(缓冲溶液)?5.原子结构。
核外电子运动状态,用s、p、d等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能和电负性。
6.元素周期律与元素周期系。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右的性质变化一般规律;$、d、ds. p、f•区。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高化合价与族序数的关系。
对角线规则。
金属性、非金属性与周期表位置的关系。
金属与非金属在周期表中的位置。
半金属。
主、副族重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。
钳系元素的概念。
7.分子结构。
路易斯结构式(电子式)。
价层电子对互斥模型对简单分子(包括离子)立体结构的预测。
杂化轨道理论对简单分子(包括离子)立体结构的解释。
共价键。
b键和兀键。
大兀键。
共轨(离域)的一般概念。
等电子体的一般概念。
8.配合物。
配合物与配离子的基本概念。
路易斯酸碱的概念。
重要而常见的配离子的中心离子(原子)和重要而常见的配体(水、轻离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和炷等)。
第一讲化学反应一.本质1. 能量的驱动有些焓驱动有些熵驱动2. 竞争反应KCLO3KCLO4+KCL3.影响的因素溶剂酸度温度溶剂例:在水溶液中(在气相)H2S+SO3H2S+SO3S+SO2+H2O无水乙醚硫代硫酸钠H2S+SO3−−−−→Na2S2O3+H2SO4Na2SO4+H2S2O3H2S2O3S +H2SO3H2SO3SO2+H2OCu(NO3)2.3H2O Cu(NO3)2+3H2OCu+N2O4N2O4NO+NO3_高价趋向变为离子N2O5NO2++NO3_2PCL5PCL4++PCL6——PBr54++Br_Al(NO3)2的制备温度的影响CH2=CH-CH=CH2+Br2{CH2-CH-CH=CH2Br BrCH2Br-CH=CH-CH2Br}低温时,以速率控制为主高温时,以平衡位置为主3. 浓度4. 酸度以以KMnO4为例子酸性Mn2+浅红色中性MnO2碱性MnO42-5. 压强4Na+CCL4C(少量)+4NaCl 乌慈反应趋向生成内能低的物质状态CO2(分子晶体)CO2(原子晶体)同一种物质1.微粒相同结构一样内能高低的判断结构的对称性(如果对称,内能低,不对称,内能高)二.特征自发进行反应物内能高生成物内能低三.反应类型(无机,有机都使用)取代反应:具有饱和键的反应一般是取代反应加成反应缩合反应取代反应的特点同种电荷替代同种电荷NaCN+Cl2ClCN+NaCl共价化合物都能水解S2Cl2+2H2O Ho-S-S-Oh+2HClS2(oH)2+H2O 2S +H2SO3FeC2O4FeCO3+COFeO+CO2+COFeO+CO Fe+CO2FeC2O4Fe+2CO2凡是不具有正常价态一定有氧化反应二聚趋势较弱2ClO2CL2O4【CLO】[CLO3]2CLO3CL2O6[CLO2][CLO4]2CaCL2CaCL4Ca[CaCL4]CLO CL2O2CL[CLO2]Au:+1 : +3AuCL22AuCL Au相当于CLCsAu = CsCL 松紧理论N8N5N3不要忘记N3-加成反应:具有不饱和键的反应一般是加成反应(排除氧化还原反应)本质:异性电荷的吸引常见基因试剂{给质子试剂:H2O H-NH2给电子试剂NH3质子化能:得到质子后放出的能量u≠0用力的合成判定偶极距NH3ƒNH2-+H+NH2-ƒNH-+H+NH-ƒN3-+H+不存在第三级电离Mg+NH3→Mg(NH2)2+1/2H2↑↑MgNH+NH3↑3CH3OH+NH3→N(CH3)3+3H2OCH3-C-OH + HOC2H5→CH3-C-(OH)2OH OC2H5−−→CH3-C-OH→CH3-C-OC2H5H+O OHCl-CN : Cl-C≡N 三分子加成三.缩合反应脱去小分子 eg. H2O[H OH] H2N-C-NH2 + H-NH-C-NH2→H2N-C-NO O O四. 应试技巧1. 考虑具体条件2. 搞清楚生成物的可能情况,自我诊断,产物分子结构越对称,越好3. 注意量的变化(1)。
2009年云南师大附中高中化学奥赛培训■理论部分初赛基本要求1.有效数字。
在化学计算和化学实验中正确使用有效数字。
定量仪器(天平、量筒、移液管、滴定管、容量瓶等)的精度与测量数据有效数字。
运算结果的有效数字。
2.理想气体标准状态。
理想气体状态方程。
气体密度。
分压定律。
气体相对分子质量测定。
气体溶解度(亨利定律)。
3.溶液浓度与固体溶解度及其计算。
溶液配制(浓度的不同精确度要求对仪器的选择)。
重结晶及溶质一溶剂相对量的估算。
过滤与洗涤操作、洗涤液选择、洗涤方式选择。
溶剂(包括混合溶剂)与溶质的相似相溶规律。
4.容量分析的基本概念。
被测物、基准物质、标准溶液、指示剂、滴定反应等。
分析结果的准确度和精密度。
滴定曲线与突跃(酸碱强度、浓度、溶剂极性对滴定突跃影响的定性关系)。
酸碱指示剂的选择。
高猛酸钾、重铅酸钾、硫代硫酸钠、EDTA为标准溶液的滴定基本反应与分析结果计算。
(缓冲溶液)?5.原子结构。
核外电子运动状态,用s、p、d等来表示基态构型(包括中性原子、正离子和负离子)核外电子排布。
电离能和电负性。
6.元素周期律与元素周期系。
主族与副族。
过渡元素。
主、副族同族元素从上到下性质变化一般规律;同周期元素从左到右的性质变化一般规律;$、d、ds. p、f•区。
元素在周期表中的位置与核外电子结构(电子层数、价电子层与价电子数)的关系。
最高化合价与族序数的关系。
对角线规则。
金属性、非金属性与周期表位置的关系。
金属与非金属在周期表中的位置。
半金属。
主、副族重要而常见元素的名称、符号及在周期表中的位置、常见氧化态及主要形态。
钳系元素的概念。
7.分子结构。
路易斯结构式(电子式)。
价层电子对互斥模型对简单分子(包括离子)立体结构的预测。
杂化轨道理论对简单分子(包括离子)立体结构的解释。
共价键。
b键和兀键。
大兀键。
共轨(离域)的一般概念。
等电子体的一般概念。
8.配合物。
配合物与配离子的基本概念。
路易斯酸碱的概念。
重要而常见的配离子的中心离子(原子)和重要而常见的配体(水、轻离子、卤离子、拟卤离子、氨分子、酸根离子、不饱和炷等)。
鳌和物。
重要而常见的配合剂及其重要而常见的配合反应。
配合反应与酸碱反应、沉淀反应、氧化还原反应的联系(定性说明)。
配合物空间结构和异构现象基本概念。
配合物的杂化轨道理论。
八面体场的晶体场理论。
T 产离子的颜色。
9.分子间作用力。
范德华力。
氢键(形成氢键的条件、氢键的键能、氢键与分子结构及物理性质关系)。
其他分子间作用力的一般概念。
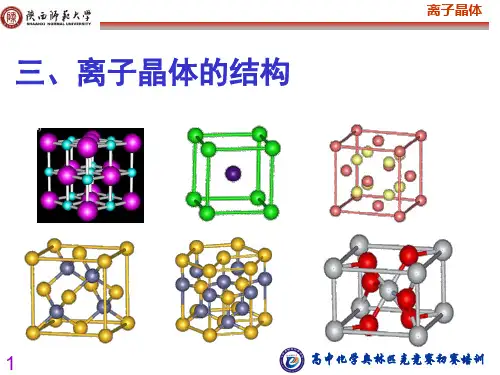
10・晶体结构。
晶胞。
原子坐标。
晶胞中原子数目或分子数的计算及与化学式的关系。
分子晶体、原子晶体、离子晶体和金属晶体。
配位数。
晶体的堆积与填隙模型。
常见的晶体结构类型。
如; NaCk CsCk闪锌矿(ZnS)、萤石(CaF2)>低温石英、金刚石、石墨、硒、冰、干冰、尿素、方解石、钙钛矿、钾、镁、铜等。
11・化学平衡。
平衡常数与转化率。
酸碱平衡常数大小与酸碱强度的定性关系。
溶度积。
利用平衡常数的计算。
12.离子方程式的正确书写与配平。
13・电化学。
氧化态。
氧化还原的基本概念和反应的书写和配平。
原电池。
电极符号、电极反应、原电池符号、原电池反应。
标准电极电势。
用标准电极电势判断反应的方向及氧化剂与还原剂的强弱。
电解池的电极符号与电极反应。
电解与电镀。
电化学腐蚀。
常见化学电源。
pH、络合剂、沉淀剂对氧化还原反应的影响的定性说明。
14.元素化学。
卤素、氧、硫、氮、磷、碳、硅、锡、铅、硼、铝。
碱土金属、碱金属、稀有气体。
钛、锐、铅、猛、铁、钻、银、铜、银、金、锌、汞。
周期表同族元素的性质递变。
周期表同周期元素的性质递变。
氧化物和氢氧化物的酸碱性和两性。
常见难溶盐。
氢化物的基本分类和主要性质。
常见无机酸碱的形态和基本性质。
水溶液中常见离子的颜色、化学性质、定性检出(不使用特殊试剂)和分离。
制备的单质的一般方法。
15・有机化学。
有机化合物基本类型一一烷、烯、怏、环桂、芳香绘、卤代炷、醇、酚、醛、醛、酮、酸、酯、胺、酰胺、硝基化合物、磺酸的系统命名、基本性质及相互转化。
C=C加成, 马可尼科夫规则。
C=O加成。
取代反应。
芳香坯取代反应及定位规则。
芳香桂侧链的取代反应和氧化反应。
分子的手性及不对称碳原子的R、S构型判断。
16、天然高分子与合成高分子化学初步。
一、原子结构与元素周期系考点归纳:纵观近年来的化学试题中有关原子结构与元素周期系试题,大致有以下考点:1、确定新元素在元素周期表中的位置,并预测它的性质。
2、考察创新能力。
打破元素在三维世界中的正常排布规律,让参赛者在全新条件下或“规律”的情况下,进行元素的电子排布或重新绘制元素周期表,并推测元素的化合价、性质等。
3、根据几种元素间的关系,推测其在周期表中的位置。
4、应用化学、物理等学科知识,考察最新科技成果。
趋势预测:今后的化学竞赛试题,将更加强调化学与物理知识点上的衔接,强调原子结构与元素周期系知识在日常生活中的应用。
考查参赛者打破“旧知识”,建立“新知识”的创造性思维能力。
笔者认为:若考查上述知识点,仍将在上述几个方面做文章。
一.相对原子质量元素的相对原子质量(原子量)是指一种元素的1摩尔质量对核素,2C的1摩尔质量的1/12的比值。
这个定义表明:①元素的相对原子质量是纯数。
②单核素元素的相对原子质量等于该元素的核素的相对原子质量。
③多核素元素的相对原子质量等于该元素的天然同位素相对原子质量的加权平均值。
二.原子结构(一)原子结构(核外电子运动)的玻尔行星模型1.氢原子光谱T)1833年巴尔麦找出氢原子光谱可见光区各谱线波长之间的关系为B是常数。
在1913年里德堡总结出谱线之间的普遍联系通式为v=R (l/ni2-l/n22) , R为里德堡常数,其值为3.19X1015周/秒。
上述公式ni和lb对应于各区谱线的关系为:紫外区:ii] = l, »2=2, 3, 4 .......可见区:ni=2, 112=3, 4, 5 .......红外区:叫=3, 112=4, 5, 6 .......2.玻尔理论(核外电子运动特点)1913年玻尔在普朗克量子论、爱因斯坦光子学论和卢瑟福的有核原子模型的基础上,为了阐明氢原子光谱实验的结果,提出了原子结构理论的三点假设,称为玻尔理论,其要点如下:①原子核外的电子不是在任意轨道上绕核运动,而是轨道角动量P必须符合以下条件:P = nh/2n, Il为正整数,h为普朗克常数。
符合上述条件的轨道称为稳定轨道,在稳定轨道上运动的电子并不放出能量。
②电子的轨道离核越远,能量越高。
通常电子是在离核最近的轨道上运动,这时原子的能量最低, 称为基态。
当原子从外界获得能量时,电子可以跃迁到离核较远的高能量轨道上去,此时称为激发态。
③激发态是不稳定的,电子会从较高能级跃迁到较低的能级,并把多余的能量以光的形式释放出同时玻尔还根据经典力学和量子化条件计算和推导了能量公式:片 13>6Z 2J^n- ------------------- 0—■ n 玻尔理论有很大的局限性,它只能解释氢原子光谱,不能解释多电子体系的原子光谱,甚至对 氢光谱的精细结构亦无法解释。
19世纪初,由于光的干涉、衍射和光电效应等实验,人们对微观粒 子运动的特殊规律——波粒二象性有所认识,这两种性质通过普朗克常数定量地联系起来,E = hv P=h/k,从而很好地揭示了光的本质。
其中E 为能量,P 为动量,入为波长,h 为普朗克常数。
后来 电子衍射实验证明了电子的波长k=h/mv, m 为电子的质量,1)为电子运动的速度。
(二)氢原子结构(核外电子运动状态)的量子力学模型① 几率密度和电子云I W| $表示电子在核外空间单位体积元里出现的几率,称为几率密度。
几率密度与该区域的总 体积的乘积为电子在该区域里出现的几率。
电子云是描述电子在核外空间运动的一种图象,它是与几率密度I 护|2相联系的,它从统计的 概念出发对核外电子出现的几率密度作形象化的图示。
即是I 护|彳的具体图象。
② 四个量子数的物理意义a ・主量子数n 它表示电子层层数和电子离核的平均距离以及能量的高低。
取值为1, 2, 3,・・・, 0(正整数)。
b ・角量子数1 它决定原子轨道(或电子云)的形状,取值为0, 1, 2, (n-l )o 如1=0时,为s 轨道,星球形分布;1=1时,为p 轨道,呈哑铃形分布;1=2时为d 轨道,呈花瓣形分布。
在 多电子体系中1还与能量有关,如同一主层中各亚层轨道的能量还有差别,即E ns <E np <E ndc ・磁量子数m 它决定原子轨道(或电子云)在空间的伸展方向。
取值为0, ±1, ±2,・・・,±1如1=1时,m 可有三个值,即0, +1,・1,说明p 亚层轨道有三个不同的伸展方向,即Px 、Py 、 Pz 三种轨道。
d ・自旋量子数ni£它不依赖于n 、1、m,不是薛定谭方程求解的结果,而是实验测定的结果。
它 证明电子绕自身的轴进行顺时针或逆时针方向旋转。
取值分别为+1/2或・1/2。
三. 核外电子排布、元素周期系和元素周期性1・核外电子排布规律:①能量最低原理②保里不相容原理③洪特规则。
2•屏蔽效应 在多电子原子中,由于其它电子对某一电子的排斥作用而抵销了一部分核电荷,从 而引起有效核电荷的降低,削弱了核电荷对该电子的吸引,这种作用称为屏蔽作用或屏蔽效应。
由 于屏蔽效应的结果,使具有相同主量子数的不同亚层轨道发生能级分裂。
1小的电子,其它电子对 它的屏蔽效应小,它的能量低,即:E ns <E np <E nd <E nf3•钻穿效应它是指外层电子钻到内层空间而靠近原子核的现象。
各亚层电子钻穿效应大小的顺 序为ns>np>nd>nf o 电子钻得越深,它受到其它电子的屏蔽作用就越小,受核的吸引力越强,因 而能量也越低。
所以n 相同1不同的各亚层轨道能量顺序为E ns <E…P <E nd <E…fo 当n 、I 均不同时, 出现能级交错,即目$<£3〃。
这种现象与电子的钻穿效应有关。
由于4§电子的钻穿能力比3d 强, 虽然4$的最大峰比3d 离核远,但由于它来。
hv- E z — E l9E L E\ » = ----------- n有小峰钻到离核很近处,它对降低轨道能量影响很大,以至造成艮,VEm4 •原子结构和元素在周期表中位置的关系①元素的周期数原子最外层的n数值即为该元素的所在周期数。
一个能级组相当于一个周期,周期有长短之分。
短周期(能级组内仅含有s、P能级)。
长周期(能级组内除s、P能级外,还含有d、f能级)。