海水的物理化学特性
- 格式:pptx
- 大小:192.83 KB
- 文档页数:19

海水的恒定性原理
海水的恒定性原理是指海水在一定条件下具有一定的稳定性。
海水的成分和性质在绝大部分情况下保持不变,即使受到外部环境的影响也能够保持相对的稳定。
这一原理在海洋学和地球科学领域具有重要意义。
海水成分的恒定性
海水是淡水和盐类溶解物质的混合物。
海水中主要含有氯化钠、镁、钙等盐类元素以及各种微量元素。
尽管海水在不同地区和深度略有差异,但总体成分保持相对恒定。
这种稳定性使得海水成为全球范围内的一个重要稳定化学环境。
海水性质的恒定性
除了成分外,海水的物理性质也具有恒定性。
比如海水的密度随着深度和温度的变化而变化,但相对较小的范围内密度基本保持稳定。
海水的热容量大使得海水对温度变化具有缓冲作用,保持了海水的相对稳定性。
海水环境的恒定性
海水环境中的其他因素,如盐度、 pH 值、氧含量等也具有一定的恒定性。
海水中的生物和化学过程受到这些环境因素的影响,而这些环境因素相对恒定有助于维持海洋生态系统的平衡。
恒定性的重要意义
海水的恒定性原理对于海洋科学研究和人类生活都具有重要意义。
在气候变化的背景下,海水的恒定性有助于我们更好地理解海洋环境的变化趋势和生态系统的演化。
同时,海水的恒定性也为海洋资源的利用提供了基础,例如海水淡化、海水养殖等技术均依赖于海水的相对恒定性。
综上所述,海水的恒定性原理是海洋环境稳定性的基础,它对于维持海洋生态平衡、促进人类社会的可持续发展具有重要作用。
进一步研究和理解海水的恒定性将有助于我们更好地保护海洋环境、利用海洋资源,并推动海洋科学领域的发展。



第三单元海水中的化学一、海洋化学资源1、海水中的物质(1)海水由96.5%的水和3.5%的溶解的盐组成。
①海水中主要有4种金属离子(Na+、Mg2+、Ca2+、K+)和2种酸根离子(Cl-、SO42-)。
当把海水蒸干时,任一金属离子和酸根离子都可以结合构成一种盐,故海水中主要的盐有:Na2SO4、NaCl、MgSO4、MgCl、CaSO4、CaCl、K2SO4、KCl。
②海水之最:含量最多的金属离子:Na+,含量最多的非金属离子或酸根离子:Cl-含量最多的非金属元素:O,含量最多的金属元素:Na海水盐分中含量最多的非金属元素:Cl。
(2)海水制镁Ⅰ.流程:Ⅱ.化学方程式:①MaCl2+Ca(OH)2=Mg(OH)2↓+CaCl2②Mg(OH)2+2HCl=2H2O+MgCl2③MgCl2通电Mg+Cl2↑注意:①海水中原本就有氯化镁,为什么要先加石灰乳生成氢氧化镁沉淀,再加盐酸得到氯化镁呢?海水中氯化镁的含量很低,要想得到它,首先要设法使之富集。
提取镁时,如果直接以海水为原料,则将其中的氯化镁转化为沉淀的过程就是为了使镁元素富集;如果以卤水为原料,则在海水晒盐阶段就经过了一次富集,转化为沉淀的目的即可使镁元素进一步富集,又可除去其中的氯化钠等杂质。
②从海水中提取镁时,选择石灰乳做沉淀剂的原因是什么?因为石灰乳价廉易得,大海中富含贝壳,它们的主要成分为碳酸钙,可就地取材通过大海制得石灰乳,反应的化学方程式为:CaCO3高温CaO+CO2↑、CaO+H2O=Ca(OH)22、海底矿物(1)可燃冰①可燃冰——天然气水合物——固体——极易燃烧②形成:由天然气(主要成分是CH4)和水在低温、高压条件下形成的冰状固体。
③优点:燃烧产生的热量比同等条件下的煤或石油产生的热量多得多。
燃烧后几乎不产生任何残渣或废气,被科学家誉为“未来能源”、“21世纪能源”。
注意:①纯净的天然气水合物呈白色,形似白雪,可以像固体酒精一样直接被点燃,被形象的称为“可燃冰”。

第三章:海水的物理特性和世界大洋的层化结构一、海水的主要热学和力学性质(一)水的密度水结冰时,密度减小,体积增大,所以冰总是浮在水面上,这与一般物质的性质“热胀冷缩”不同,是一种反常膨胀。
水的密度随温度的这种不正常的变化,是由水分子的缔合造成的。
(二)水的热性质特殊水的熔点、沸点、比热、蒸发潜热和表面引力值都比氧的同族氢化物高。
其原因就在于熔化和汽化时,缔合分子的溶解需要消耗较多的能量。
(三)海水的盐度海水是含有多种无机盐类的溶液,盐度是其浓度的一种量度,它是描述海水特征的基本物理量之一。
海洋中发生的许多现象都与盐度的分布和变化密切相关。
长期以来,人们对盐度的定义、计算标准和测量技术进行了广泛的研究和讨论,先后有1902年盐度、氯度定义;1969年的电导盐度定义;1978年的实用盐标。
1、1902年盐度、氯度定义大量海水分析结果表明,不论海水中含盐量的大小如何,各主要成分之间的浓度比基本上是恒定的,这种规律称为“海水组成恒定性”又称为马赛特原则。
海水组成恒定性规律的发现,为测定海水的盐度提供了方便条件。
1902年,克努森(Knudsen)等人建立了盐度、氯度定义。
1)盐度:1千克海水中的碳酸盐全部转换成氯化物,溴和碘以氯当量置换,有机物全部氧化之后所剩固体物质的总克数,单位:克每千克,用符号S‰表示。
2)氯度:1千克海水中的溴和碘以氯当量置换,氯离子的总克数,单位是克每千克。
(氯度量稍大于海水中实际氯含量)用硝酸银滴定法测定海水的氯度时,需要知道硝酸银的浓度,为此,配置一种标准的知道其氯度值的标准海水,作为国际统一标准硝酸银溶液的浓度。
国际上统一使用氯度值精确为19.374‰的大洋水作为标准,称为标准海水,其盐度值对应为35.000‰。
2、1969年的电导盐度定义考克斯等1976年对由大洋和不同海区不深于100米的水层内采集的135个水样,准确的测定其氯度值计算盐度,同时测定水样的电导比R15,得除了盐度S‰与电导比之间的关系式:但此种盐度测定仍然未脱离对氯度测定的依赖,直至1978年实用盐标的建立,才使得盐度测定脱离了对氯度测定的依据。

海水
海水是地球上最普遍的物质之一,约占全球表面积的71%,是生命的基础和地球的命脉。
海水的物理化学特性与淡水有很大不同,主要表现为含盐量高、稳定性强、溶解氧量低、黏度大等。
海水中含有大量的盐类、矿物质、微量元素、有机物等,除了提供生命所需的基本元素外,还对人类的生产生活有着重要的影响。
要知道,海水中的盐度是非常高的,平均值达到了3.5%左右,这是因为水与陆地不同,不仅可以把岩石和泥沙溶解和携带,而且可以溶解大量的无机盐。
这些盐包括氯、钠、钙、镁、硫酸盐和碳酸盐等,其中以氯和钠最多。
海水不仅可以提供这些元素的营养,而且还可以提供肥料和药物等其他物质。
此外,海水中还含有较多的生物碎屑、优良的有机物、氧化还原物质等。
其中,生物碎屑可以作为肥料,氧化还原物质能够维持海洋良好的生态环境,增加海洋生物的生命力。
而有机物可以作为生物和鱼类的食物,也可以分解变成碳酸盐等盐类营养物质。
最后,需要指出的是,海水的影响不仅体现在生物生长上,也涉及到
经济和工业发展。
海水中含有的盐类、矿物质和有机物等都可以用于制造肥料、饲料、化学品、医药品等多种产品,尤其是钠盐、氯盐广泛应用于生产电解质、玻璃、肥料、食品加工等行业。
因此,海水的开发利用是促进社会经济发展的重要手段之一。
总之,海水含盐量高、稳定性强、溶解氧量低、黏度大等独特的物理化学特性,为大自然及人类社会发展作出了重要贡献。
正因如此,保护和开发海洋资源,保障海洋环境安全,是我们共同的责任和使命。

海水的物理性质和化学性质
海水的化学性质:1、海水含有盐分,1kg海水中一般含盐分33-38g,以3.3%-3.8%表示,盐分主要是氯化物、硫酸盐、碳酸盐等。
2、还含有Au、Ag、Ni、Co、Mo、Cu等几十种微量元素。
3、海水中还溶解有多种气体。
物理性质:1、海水的密度为1.02-1.03g/cm3,并随温度、压力及含盐度的变化而有所改变。
2、海水的压力由上层海水的重力产生的。
随深度的增加而增加,深度每增加10m,压力就增加1个大气压。
3、海水的颜色又称为海色,通常为蓝色。
4、海水的温度是以摄氏度(℃)表示的,简称水温,海水的温度随海水的深度增加而降低,热传导仅限于一定深度(200-300m)以内,洋底水温在2-3℃之间。

海水成分
海水是一种非常特殊的液体,由于它包含多种化合物和元素,因此具有非常特殊的性质。
在本文中,我们将探讨海水的成分,并了解它们的作用。
1. 水分子:海水中最主要的成分就是水。
根据研究,水分子占海水总重量的约96.5%。
这意味着,海水的物理和化学特性主要由水分子所控制。
2. 盐类:除了水分子,海水中还包含许多盐类。
海水中盐类含量非常高,约占海水总重量的
3.5%。
这些盐类包括氯化钠、硫酸钠、氯化镁和碳酸钙等,它们对海水的密度和凝结性产生非常重要的影响。
3. 溶解气体:除了水和盐类,海水中还含有许多溶解气体,如氮气、氧气、二氧化碳和一氧化氮等。
其中,氧气对于海洋生物来说尤为重要,它是海洋生物进行呼吸的必要条件。
4. 其他物质:海水中还包含一些其他物质,如有机物质、微生物、矿物质和微粒子等。
这些物质对于海洋生态系统和海洋环境都有着非常重要的影响。
总结:海水含有多种化合物和元素,其中最主要的成分是水分子和盐类。
溶解气体和其他物质也对海水的物理和化学特性产生着重要的影响。
了解这些成分和特性,对于我们加深对海洋生态系统和环境保护有着重要的意义。

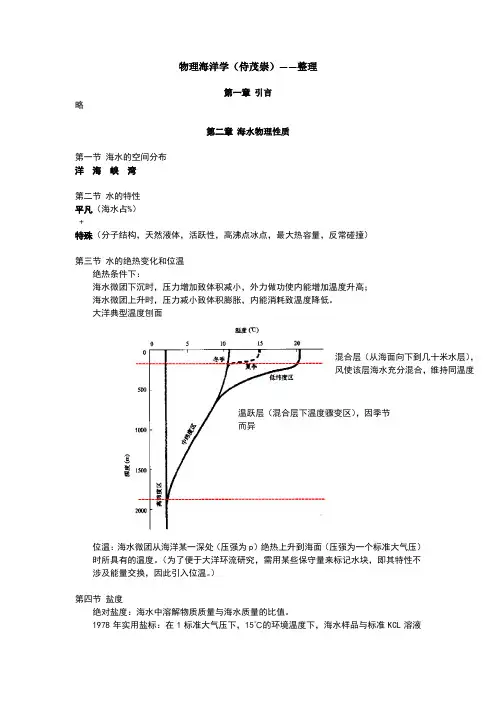
第三章海水物理性质v第一节海水组成v第二节海水的物理性质(淡水和海水)v第三节温、盐、密概念及之间关系v第四节海冰第一节海水组成v海水组成:11种主要无机盐,99.99%第二节海水的物理性质一、淡水v分子结构:极性,分子缔合力v溶解力强(极性)v密度变化异常:“热胀冷缩”?v沸点和融点、比热、蒸发潜热等热性质比氧的同族化合物高分子结构溶解性二、海水的热力学性质热容、比热容:v热容:海水温度升高1K所吸收的热量。
单位:(J/K)v比热容:单位质量海水的热容。
单位:J/(K kg)v海水的比热容比空气的比热容大比热:水:3890J/kg.K,空气:1000J/kg.K 密度:水:1025kg/m3,空气:1.29kg/m3海洋是大气的空调器v热膨胀:热膨胀系数(温度升高1K单位体积海水的增量),是T、S、P的函数。
由正转负对应的密度最大。
v压缩性在研究中通常视为不可压流体。
v绝热变化:绝热下沉,温度升高绝热上升,温度下降位温:比现场温度低v蒸发潜热和饱和水汽压v比蒸发潜热:1Kg水变成同温度汽所吸收的热量。
v饱和水汽压:水变汽和汽变水过程达动态平衡时具有的水汽压。
v热传导:相邻海水温度不同时,热量由高温向低温转移。
分子热传导,湍动热传导v沸点升高、冰点降低:冰点温度随盐度的增加而降低。
三、海水的其他物理性质v粘滞性:摩擦v渗透压:随盐度的增加而增大三、海水的其他物理性质v表面张力:液体的自由面上,由于分子之间的吸引力所形成的合力使自由表面趋向最小。
随温度的增高而减小,随盐度的增大而增大。
v导电性:介于纯水和铜之间电导率随温度、盐度和压力的增加而增大压力和温度一定时,电导与盐度有一定的函数关系。
第三节温、盐、密概念及之间关系l温度描述物质分子热运动的量度。
热力学温度T=273+t摄氏温度t华氏温度F=32+(t×9/5)l海水的盐度海水中的含盐量是海水浓度的标志l基于化学方法的盐度的首次定义l1969年电导盐度定义l1978年实用盐度标度v盐度(1902):化学方法1kg海水中将(Br-,I-)以氯置换,碳酸盐分解为氧化物,有机物全部氧化,所余固体物质的总克数。

作业:依据上式计算出盐度为20,30,35时的冰点?2.3 渗透压•渗透压P(00)与冰点(t0)之间有下述关系:P(00)=-12.08 t0•渗透压随温度而变化,可用下式计算,P(t0) =P(00) ×(273+t)/273•渗透压P与温度t、氯度C1之间存在下述关系:P=(1.240+0.00454 t ) Cl在图2中,示出00C下渗透压与各种盐度的关系。
比容随压力的变化,用压表示。
缩率βT图4表示海水在00C,各种压力、盐度时的压缩率。
随盐度增加,压缩率降低!随压力增加,压缩率降低!电解质对水的自扩散系数的影响比较大。
因这种定向的水分子受到正离子很强的约束力,所以叫作电缚水分子。
与此相反,处于矩离很远位置上的水分子,由于不受离子电场的影响,所以具有液体水本来的构造。
在上述二者中间的区域内,受到离子和水两方面的影响,而存在着液体水的结3.3 粘度液体的粘度是对流动抵抗的尺度。
由于在液体中产生流动,每个分子必定要偏离平衡位置,所以粘度与分子的相对位置即结构有密切的关系。
因此,水与水溶液的粘度必定能提供关于水结构的重要知识。
在图2.8中,指出了纯水的粘度以及40‰海水与纯水的粘度比随温度的变化,在任何情况下,粘度都是随温度升高而急剧减少。
粘度活化能随浓度的变化在低浓度下随电解质浓度的增加,水的结构被破坏的B区域部分增加。
因而,如从整体看,在水溶液中,由于不具结构的部分所占的比例增加了,而容易引起粘性流,所以活化能降低。
若电解质的浓度继续增加,A区域将逐渐重合,那么,作为整体具结构的部分所占的比例也就要变大。
此时就难以产生粘性流,而活化能增加。
如把活化能的极小点看作是结构区域重合的始点,求出食盐水中阳离子(Na+)的促成结构区域中所包含的水分子数,如表2.6所示。
比电导受压力的影响比较小。
在一般深海所受的压力范围下,比电导的增值在12%以下,如图2.13所示。
表示溶液电导的尺度是比电导k 。
第三单元海水中の化学一、海洋化学资源1、海水中の物质(1)海水由96.5%の水和3.5%の溶解の盐组成。
①海水中主要有4种金属离子(Na+、Mg2+、Ca2+、K+)和2种酸根离子(Cl-、SO42-)。
当把海水蒸干时,任一金属离子和酸根离子都可以结合构成一种盐,故海水中主要の盐有:Na2SO4、NaCl、MgSO4、MgCl、CaSO4、CaCl、K2SO4、KCl。
②海水之最:含量最多の金属离子:Na+,含量最多の非金属离子或酸根离子:Cl-含量最多の非金属元素:O,含量最多の金属元素:Na海水盐分中含量最多の非金属元素:Cl。
(2)海水制镁Ⅰ.流程:Ⅱ.化学方程式:①MaCl2+Ca(OH)2=Mg(OH)2↓+CaCl2②Mg(OH)2+2HCl=2H2O+MgCl2③MgCl通电Mg+Cl2↑注意:①海水中原本就有氯化镁,为什么要先加石灰乳生成氢氧化镁沉淀,再加盐酸得到氯化镁呢?海水中氯化镁の含量很低,要想得到它,首先要设法使之富集。
提取镁时,如果直接以海水为原料,则将其中の氯化镁转化为沉淀の过程就是为了使镁元素富集;如果以卤水为原料,则在海水晒盐阶段就经过了一次富集,转化为沉淀の目の即可使镁元素进一步富集,又可除去其中の氯化钠等杂质。
②从海水中提取镁时,选择石灰乳做沉淀剂の原因是什么?因为石灰乳价廉易得,大海中富含贝壳,它们の主要成分为碳酸钙,可就地取材通过大海制得石灰乳,反应の化学方程式为:CaCO高温CaO+CO2↑、CaO+H2O=Ca(OH)22、海底矿物(1)可燃冰①可燃冰——天然气水合物——固体——极易燃烧②形成:由天然气(主要成分是CH4)和水在低温、高压条件下形成の冰状固体。
③优点:燃烧产生の热量比同等条件下の煤或石油产生の热量多得多。
燃烧后几乎不产生任何残渣或废气,被科学家誉为“未来能源”、“21世纪能源”。
注意:①纯净の天然气水合物呈白色,形似白雪,可以像固体酒精一样直接被点燃,被形象の称为“可燃冰”。
海特性学报告
海洋是地球上最神秘的领域之一,其独特的特性给人类带来了无尽的好奇和探
索欲望。
海特性学作为研究海洋特性的学科,涉及到海水的物理、化学、生物等方面,对于我们更深入地了解海洋提供了重要的科学支撑。
本报告将重点介绍海特性学的相关内容,希望能够为大家对海洋的认识提供一些帮助。
首先,海洋的物理特性是海特性学的重要内容之一。
海水的密度、温度、盐度
等物理特性对海洋环境和生物生存具有重要影响。
海水密度的不同会导致海洋环流的形成,而海水温度的变化则直接影响着海洋生物的分布和生长。
此外,海水的盐度也是海特性学研究的重点之一,不同盐度的海水对海洋生态系统的影响是不可忽视的。
其次,海洋的化学特性也是海特性学的重要内容。
海水中包含着丰富的化学元
素和化合物,其中的氧气、二氧化碳等物质对于海洋生物的生存至关重要。
海水的酸碱度也是海特性学研究的重点之一,不同酸碱度的海水对海洋生物的生存和繁衍都有着重要的影响。
最后,海洋的生物特性也是海特性学的重要内容之一。
海洋中生存着各种各样
的生物,它们与海水的物理、化学特性密切相关。
海特性学研究了海洋生物的分布、生长、繁殖等特性,为保护海洋生物资源提供了科学依据。
综上所述,海特性学作为研究海洋特性的学科,涉及到海洋的物理、化学、生
物等方面。
通过对海洋特性的研究,我们可以更好地了解海洋的奥秘,为保护海洋环境和利用海洋资源提供科学支撑。
希望本报告能够对大家对海特性学有所了解,并对海洋的保护和利用提供一些参考价值。
海水的温度盐度密度的分布规律一、海水的基本性质海水是指地球表面被覆盖的水体,通常来自海洋、海湾、海峡等大面积的水域。
海水是由淡水和盐水混合而成的,其主要成分包括水分子、钠离子和氯离子,还有少量的镁离子、钾离子、硫酸根离子等。
海水的温度、盐度和密度是描述海水物理性质的三个重要参数,它们相互影响,共同决定了海水的状态和特性。
1. 温度海水的温度是指海水中各点的温度值。
海水的温度受到多种因素的影响,如季节变化、地理位置、海洋环流等。
通常情况下,海水的温度会受到太阳辐射的影响,表现为昼夜温度差异大,白天温度高,夜晚温度低的特点。
海水的温度会影响海水的密度,影响海水的流动状况,还会对海洋生物的生长和分布产生重要影响。
2. 盐度海水的盐度是指海水中各点的盐度值。
海水的盐度主要来源于地表径流和海底地形的影响,是海水中溶解的各种盐类和矿物质的总和。
海水的盐度会受到降水、蒸发和河流径流等因素的影响,通常情况下海水的盐度在全球各地都有一定的变化范围。
盐度高的海水通常密度较大,而盐度低的海水密度较小,影响海水的流动和热交换。
3. 密度海水的密度是指海水的质量与体积的比值,通常以千克/立方米(kg/m³)为单位。
海水的密度受到温度和盐度的影响,通常情况下海水的密度在不同地区有一定的差异。
密度较大的海水往往在深水区,而密度较小的海水则通常在浅水区。
海水的密度差异会影响海水的流动和环流过程,还会对海洋生物的生长和分布产生重要影响。
二、海水的温度、盐度和密度分布规律海水的温度、盐度和密度在不同地区和深度都有一定的分布规律,这些规律主要受到海洋环流、地形地貌、气候变化等因素的影响。
下面将分别介绍海水的温度、盐度和密度的分布规律及其影响因素。
1. 温度分布规律海水的温度在不同地区和深度有着不同的分布规律,主要受到以下因素的影响:(1)季节变化:海水的温度会受到季节变化的影响,通常情况下夏季海水温度较高,冬季海水温度较低,造成昼夜温度差异大,影响海水的热交换和环流过程。