人教版化学必修第一册第一章第一节第一课时物质的分类
- 格式:pptx
- 大小:760.97 KB
- 文档页数:40

统编人教版高中化学必修第一册《第一节物质的分类及转化》优质课公开课课件、教案第一章物质的分类及转化第1.1节物质的分类《物质的分类》主要包括了简单分类法及其应用和分散系及其分类两个内容。
新课标中要求根据物质的组成和结构进行分类。
在整个高中化学中,本节课起到很好的承先启后、提纲挈领的重要作用。
学生通过对分类法的学习能够对以往的化学知识进行系统化的梳理,并且为今后将要学习的更为庞大的化学知识体系奠定重要的基础。
同时学生学习了这种分类方法,打破了以往化学中以“族”的概念来学习化学知识,而以元素及其化合物的类别的视角去研究化学,从而使得化学知识更具有生活性。
【核心素养】宏观辨识与微观探析:学会根据物质的组成和性质对物质进行分类,理解分类的多样性,知道交叉分类法和树状分类法。
变化观念与平衡思想:通过探究活动,学习与他人合作交流,提高分析问题和解决问题的能力。
实验探究与创新意识:通过对胶体性质的实验探究,让学生进一步体会实验方法在化学研究中的重要作用,使学生学会科学、合理运用观察、比较、实验等方法,提高学生的实验、推理、分析、归纳能力。
科学精神与社会责任:通过本节课的学习,对自己所熟悉的知识进行分类,感受到分类法对化学科学研究和学习的重要性,能在以后学习生活中中进行实际应用。
【重难点】1.知道分类方法并能根据物质的组成和性质对物质进行分类2.胶体、溶液、浊液之间的比较,胶体性质【课前准备】学生自主预习、多媒体课件【教学过程】新课引入:开门见山,直接引入课题。
新课讲授:一、分类的方法1、单一分类法单一分类法就是对被分类的对象只用一种标准进行分别归类的分类方法只含一种元素的物质不一定是单质,如:O2、O3的混合物、金刚石与石墨的混合物等,只含有一种元素的纯净物才是单质。
2、交叉分类法交叉分类法就是对被分类的对象应用多种不同的单一分类法进行分类3、树状分类法树状分类法是对同类事物按照某种属性进行分类。
被分类的对象的整体与分出类型间的关系以树状陈列式表示。


《物质的分类及转化》教学设计一、教材分析“元素与物质的分类”是《普通高中化学课程标准(版)》中主题2“常见的无机物及其应用”中二级标题“元素与物质”的内容,在新人教版教材中位于第一章“物质及其变化”的第一节“物质的分类及转化”。
本节内容既承接了初中的相关知识,又为后续化学反应的分类以及元素化合物的知识打下基础,同时对学生核心素养(尤其是“宏观辨识与微观探析”“证据推理与模型认知”)的发展亦起到重要作用。
从章标题来看,新教材将旧教材中的第二章移至第一章,很好地衔接了初中化学的相关内容,降低了学生初学高中化学知识的难度。
从节标题来看,本节内容增加了“物质的转化”这部分内容,使学生认识到物质转化的途径。
在本课时的具体内容设置方面,新人教版在物质分类方法层面变化不大,但增加了物质分类的角度(通过物质性质分类),并加入同素异形体、酸(碱)性氧化物、物质的转化等知识点,体系更加完整。
二、学情分析1.学生已了解或掌握的与本节课相关的知识点如下:(1)物质由元素组成;(2)物质的分类;(3)CO2、CaO的化学性质。
2.学生已具备一定的推理能力(演绎推理、类比推理等),但还需要教师加以引导。
三、素养目标【教学目标】1.能根据元素组成和物质性质对物质进行分类;2.能结合物质的类别说明或预测物质的性质,进而实现物质的转化;3.能体会到分类对化学研究的重要意义。
【评价目标】1.通过对表格中物质的分析,诊断并发展学生对物质分类角度和方法的认识;2.通过对酸(碱)性氧化物以及物质转化图的探讨,诊断并发展学生对物质性质及转化的分析推理能力;3.通过对图书分类与物质转化的分析,诊断并发展学生对分类价值的认识。
四、教学重点、难点1.教学重点:物质的树状分类法;酸(碱)性氧化物;物质的转化2.教学难点:物质的转化五、教学方法1.问题链(围绕着框图中的物质进行一系列问题驱动)2.演绎推理(含碳元素物质的分类、同素异形体、Na2O的性质物质的转化)3.类比推理(碱性氧化物的性质)六、教学设计思路本节课先从图书馆的分类引入物质分类的意义及角度,而后以框图的形式呈现了一些物质,整节课围绕着这些物质依次探讨两种分类法、同素异形体、酸(碱)性氧化物等内容,并在此基础上进行拓展,学习物质的转化。




人教版高中化学必修第一册《第一节物质的分类及转化》说课稿一、教材背景和教学目标1. 教材背景《第一节物质的分类及转化》是人教版高中化学必修第一册的第一节内容,介绍了化学的基本概念以及物质的分类及转化规律。
2. 教学目标•掌握基本化学概念,如物质、元素、化合物等;•熟悉物质的分类方法,并能根据不同的分类方法进行归类;•了解物质的转化规律,包括化学反应及其表示方法。
二、教学重点和难点分析1. 教学重点•物质的分类方法及其特点;•物质转化的基本规律。
2. 教学难点•理解物质的分类方法与元素、化合物的概念之间的关系;•理解物质转化规律与化学反应及其表示方法之间的关系。
三、教学过程设计1. 导入(5分钟)为了引起学生对本节内容的兴趣,可以通过以下方式导入:(例子1)老师带一些物质样品,如铁粉、盐酸、水等,让学生观察这些物质,发现它们有什么不同,引导学生思考物质的分类方法。
(例子2)老师出示一些物质的图片或名称,让学生根据特点进行分类,如固体、液体、气体等,引导学生思考分类的依据。
2. 学习与讨论(30分钟)2.1 物质的分类方法及特点提醒学生注意教材P1的内容,解释物质的分类和元素、化合物的概念,重点讲解以下几种分类方法:(1)按物质的存在状态分类:固体、液体、气体;(2)按物质的组成分类:元素、化合物、混合物;(3)按物质的性质分类:金属、非金属、金属loids。
引导学生思考不同分类方法的特点及其适用场合,鼓励学生发表自己的观点,并进行讨论。
2.2 物质的转化规律与化学反应讲解物质的转化规律及其与化学反应的关系。
解释化学反应的定义及其表示方法,包括化学方程式、物质的组成与变化等。
引导学生通过实例理解物质转化规律与化学反应之间的关系,例如铁与盐酸的反应,让学生观察并描绘出方程式。
3. 练习与巩固(15分钟)出示一些练习题,让学生运用所学知识进行练习,如:1.将以下物质进行分类:水、氧气、铁、二氧化碳、盐、可可粉。
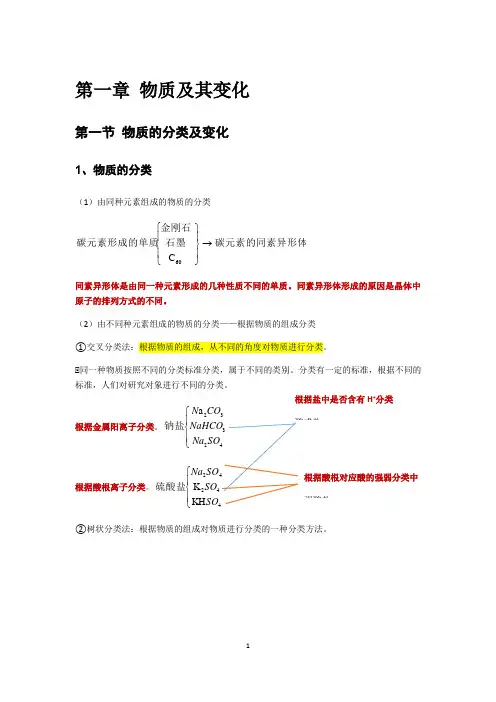
第一章 物质及其变化第一节 物质的分类及变化1、物质的分类(1)由同种元素组成的物质的分类碳元素的同素异形体石墨金刚石碳元素形成的单质→⎪⎭⎪⎬⎫⎪⎩⎪⎨⎧60C 同素异形体是由同一种元素形成的几种性质不同的单质。
同素异形体形成的原因是晶体中原子的排列方式的不同。
(2)由不同种元素组成的物质的分类——根据物质的组成分类 ①交叉分类法:根据物质的组成,从不同的角度对物质进行分类。
★同一种物质按照不同的分类标准分类,属于不同的类别。
分类有一定的标准,根据不同的标准,人们对研究对象进行不同的分类。
根据金属阳离子分类。
⎪⎩⎪⎨⎧42332a SO Na NaHCO CO N 钠盐根据酸根离子分类。
⎪⎩⎪⎨⎧44242KH K SOSO SO Na 硫酸盐②树状分类法:根据物质的组成对物质进行分类的一种分类方法。
根据盐中是否含有H +分类酸式盐根据酸根对应酸的强弱分类中 强酸盐⎪⎪⎪⎪⎪⎪⎩⎪⎪⎪⎪⎪⎪⎨⎧⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎪⎪⎩⎪⎪⎪⎨⎧⎪⎩⎪⎨⎧⎪⎪⎪⎪⎩⎪⎪⎪⎪⎨⎧..................................................................................................................O Na NaCl NaOH HCl .................Cl Na ..................22混合物有机化合物等——氧化物等——盐等——碱等——酸无机化合物化合物稀有气体等——非金属单质等——金属单质单质纯净物物质 (3)根据物质的性质的分类氧化物⎩⎨⎧→等。
O Na ,如应生成盐和水的氧化物碱性氧化物:能与酸反等CO ,如应生成盐和水的氧化物酸性氧性氧化物:能与222、分散系及其分类(1)概念①分散系:化学上把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中形成的混合物。
★分散系一定是混合物,所以蒸馏水不是分散系。


高一化学必修一物质的分类知识点人教版高中化学必修一知识点有从实验学化学、化学物质及其变化、金属及其化合物、非金属及其化合物、化学计量在实验中的应用、用途广泛的金属材料等。
今天小编在这给大家整理了高一化学必修一,接下来随着小编一起来看看吧!高一化学必修一(一)第一节物质的分类胶体分散系相关概念1. 分散系:一种物质(或几种物质)以粒子形式分散到另一种物质里所形成的混合物,统称为分散系。
2. 分散质:分散系中分散成粒子的物质。
3. 分散剂:分散质分散在其中的物质。
4、分散系的分类:当分散剂是水或其他液体时,如果按照分散质粒子的大小来分类,可以把分散系分为:溶液、胶体和浊液。
分散质粒子直径小于1nm的分散系叫溶液,在1nm-100nm之间的分散系称为胶体,而分散质粒子直径大于100nm的分散系叫做浊液。
下面比较几种分散系的不同:分散系溶液胶体浊液分散质的直径<1nm(粒子直径小于10-9m)1nm-100nm(粒子直径在10-9 ~ 10-7m)>100nm(粒子直径大于10-7m)分散质粒子单个小分子或离子许多小分子集合体或高分子巨大数目的分子集合体实例溶液酒精、氯化钠等淀粉胶体、氢氧化铁胶体等石灰乳、油水等性质外观均一、透明均一、透明不均一、不透明稳定性稳定较稳定不稳定能否透过滤纸能能不能能否透过半透膜能不能不能鉴别无丁达尔效应有丁达尔效应静置分层注意:三种分散系的本质区别:分散质粒子的大小不同。
三、胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
胶体的性质:① 丁达尔效应——丁达尔效应是粒子对光散射作用的结果,是一种物理现象。
丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。
当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。

第一章第一节:物质的分类及其转化1.同素异形体:同种元素不同形态的单质例:氧气(O2)、臭氧(O3);红磷、白磷;金刚石、石墨、C602.胶体与溶液的鉴别方法:“丁达尔效应”第一章第二节:离子反应1.电解质:在水溶液里或熔融状态下能导电的化合物。
例:酸、碱、盐、金属氧化物、H2O非电解质:在水溶液里和熔融状态下都不能导电的化合物。
例:大多数有机物: 乙醇、蔗糖,非金属氧化物: CO2 , SO2等,NH3【注意】(1)单质和混合物既不是电解质也不是非电解质;(2)某些非电解质溶于水时与水反应生成电解质从而使溶液导电,但是该化合物依然是非电解质(例如:CO2)2、电离方程式:如:NaCl = Na+ + Cl-注意1、拆分要准确(原子团不可拆分),像NO3-、SO42-、OH-、NH4+、CO32-等。
2、原子个数守恒,电荷守恒。
3. 酸:电离时生成的阳离子全部是H+ 的化合物。
碱:电离时生成的阴离子全部是OH-的化合物盐:电离时能生成金属阳离子(或者NH4+)和酸根阴离子的化合物。
4.离子方程式的书写:写、拆、删、检可拆物质: 易溶于水—强酸、强碱、可溶性盐不能拆(仍用化学式表示)的物质: 难溶物、难电离物质、气体、单质、氧化物、H2O第一章第三节:氧化还原反应化合价口诀:(1) 熟记常见元素的化合价钾钠银氢正一价,钙镁钡锌正二价。
氟氯溴碘负一价,通常氧是负二价。
铜正一二铝正三,铁有正二和正三。
碳有正二和正四,硫有负二、正四和正六。
(2)化合价:化合物中元素的正负化合价的代数和为零,单质化合价为零。
1.氧化还原反应的特征:化合价的升降氧化还原反应的本质:电子的转移2.最高价:只具有氧化性最低价:只具有还原性中间价:既具有氧化性,又具有还原性反应第二章第一节:钠及其化合物1.钠的保存:钠保存在石蜡油或煤油中2.化学性质:①与氧气反应4Na + O2 ====2Na2O(白色固体)2Na + O2 ==== Na2O2(淡黄色固体)条件:加热②与水反应2Na + 2H2O = 2NaOH + H2↑,现象:③与酸、盐溶液反应3.钠着火:用干燥的沙土扑灭4.过氧化钠性质:与H2O,与CO2反应:供氧剂、氧化剂漂白剂(应用)化学反应方程式:2Na2O2+2H2O =4NaOH+O2↑ 离子反应方程式:2Na2O2+2H2O=4Na++4OH-+O2↑2Na2O2 + 2CO2 = Na2CO3 + O2 2Na2O2 + 2CO2 = Na2CO3 + O2 5.Na2CO3和NaHCO3的性质比较:溶解性,水溶液碱性,热稳定性:Na2CO3 > NaHCO3,与盐酸反应快慢:NaHCO3 < Na2CO3相互转化:Na2CO3转为NaHCO3:①H2O + CO2 ②加适量HClNaHCO3转为Na2CO3:①加热△ ②加NaOH5.钠及其化合物火焰为黄色;钾及其化合物焰色为紫色(通过蓝色钴玻璃观察)第二章第二节氯及其化合物1.氯气的性质:①与单质反应H2+Cl2=2HCl(条件:点燃)②Cl2 + H2O = HCl + HClO 2HClO == 2HCl+O2↑(条件:光照)氯水的主要成分:三分子Cl2、H2O、HClO 四离子H+、Cl-、ClO-、OH-湿润的氯气具有普遍性漂白性,干燥的氯气不具有漂白性③漂白液的制取Cl2 + 2NaOH =NaCl+ NaClO + H2O(有效成分:NaClO )④漂白粉的制取2Cl2+2Ca(OH)2=CaCl2+ Ca(ClO) 2 +2H2O(有效成分:Ca(ClO) 2)2.氯气的制备4.氯离子的检测:先滴加适量稀硝酸,然后滴入AgNO3溶液第二章第三节:物质的量的计算浓溶液配稀溶液:c(浓溶液)×V(浓溶液)= c(稀溶液)×V(稀溶液)2.一定物质的量浓度溶液的配制步骤:计算,称量,溶解,(冷却后)移液,洗涤(后轻轻摇动容量瓶),定容,摇匀,装瓶贴标签称量时:托盘天平精确度为0.1g,左物右码,对于有腐蚀性的氢氧化钠应放在玻璃器皿中称量溶解:玻璃棒作用加速溶解洗涤:减少溶质的损失定容:玻璃棒作用引流误差分析:俯高仰低.。