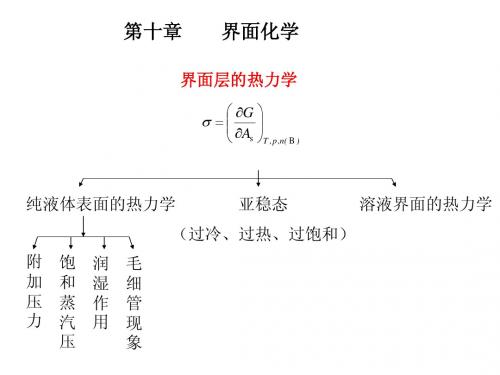
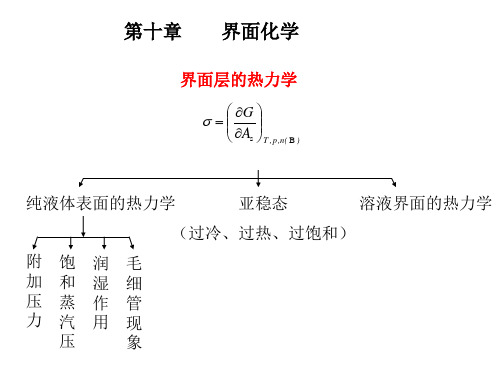
第十章 界面化学
- 格式:pptx
- 大小:2.18 MB
- 文档页数:106

第十章界面化学 课后作业题解10.3 计算373.15K 时,下列情况下弯曲液面承受的附加压力。
已知373.15K 时水的表面张力为58.91×10-3N.m -1。
(1)水中存在的半径为0.1μm 的小气泡;(2)空气中存在的半径为0.1μm 的小液滴;(3)空气中存在的半径为0.1μm 的小气泡。
解:10.4 在298.15K 时,将直径为0.1mm 的玻璃毛细管插入乙醇中。
问需要在管内加多大的压力才能防止液面上升?若不加任何压力,平衡后毛细管内液面的高度为多少?已知该温度下乙醇的表面张力为22.3×10-3N.m -1,密度为789.4 kg.m -3 ,重力加速度为9.8m.s -2。
设乙醇能很好地润湿玻璃。
解:乙醇能很好地润湿玻璃,可看作cos θ=0,所以r=r 1(曲率半径与毛细管半径相等)需要在管内加892 Pa 的压力才能防止液面上升。
若不加任何压力,平衡后毛细管内液面的高度为0.115m 。
kPa 2356Pa 2356400101091584r 4p 3kPa 1178Pa 1178200101091582r 2p 217373==⨯⨯=γ=∆==⨯⨯=γ=∆----..)())((Pa 892100.051022.32r 2p 33=⨯⨯⨯=γ=∆--m 1150100.0589789.41022.32gr 2h 33..=⨯⨯⨯⨯⨯=ργ=--10.9 已知在273.15K 时,用活性炭吸附CHCl 3,其饱和吸附量为93.8dm 3.kg -1,若CHCl 3的分压力为13.375 kPa ,其平衡吸附量为82.5 dm 3.kg -1。
试求:(1)朗缪尔吸附等温式中的b 值;(2)CHCl 3的分压为6.6672 kPa 时,平衡吸附量为若干?解:(1)朗缪尔吸附等温式(2)根据朗缪尔吸附等温式10.14 293.15K 时,水的表面张力为72.75mN.m -1,汞的表面张力为486.5mN.m -1,而汞和水之间的界面张力为375mN.m -1,试判断:(1)水能否在汞的表面上铺展开?(2)汞能否在水的表面上铺展开?解:(1)水能在汞的表面上铺展(2)汞不能在水的表面上铺展bp 1bp V V m +=b 375131b 37513893582....+=0m 38.75mN 72.75-375-486.5--S -1->⋅==γγγ=水水汞汞0m -788.75mN 486.5-375-72.75--S -1-<⋅==γγγ=汞水汞水1-3m kg 73.58dm 6.66720.54591 6.66720.545993.8bp 1bp V V ⋅=⨯+⨯⨯=+=1kPa 545901-82.593.8375131b -=⎪⎭⎫ ⎝⎛⨯=..10.17 292.15K 时,丁酸水溶液的表面张力可以表示为)bc 1(a -0+γ=γln ,式中0γ为纯水的表面张力,a 和b 皆为常数。

第十章界面化学思考题答案1.已知水在两块玻璃间形成凹液面,而在两块石蜡板间形成凸液面。
试解释为什么两块玻璃间放一点水后很难拉开,而两块石蜡板间放一点水后很容易拉开?答:水在两玻璃和两石蜡板间的状态如下图。
水能润湿玻璃,在两块玻璃之间的水层两端液面呈凹形,故其附加压力方向指向空气,使水层内的压强小于外部大气压强,两者相差2γ/r,即相当于两块玻璃板外受到2γ/r的压力作用,所以要把它们分开很费力。
且两板越靠近,此压力差越大,使两板难以拉开。
石蜡板的情况相反,液体压力p大于外压力,易于拉开。
2.如下图所示,在一玻璃管两端各有一大小不等的肥皂泡。
当开启活塞使两泡相通时,试问两泡体积将如何变化?为什么?2图3图答:开启活塞后,大泡将变大,小泡将变小。
活塞关闭时,由于肥皂泡膜产生附加压力,Δp=p内-p外=4γ/r.泡的半径r越小,附加压力越大,而大、小泡的p外是相同的,故小泡内空气压力大于大泡内空气压力。
因此打开活塞后,小泡内空气就流向大泡,导致小泡变成更小。
当小泡收缩至其半径等于玻璃管口半径时的r最小,若再收缩,其曲率半径反而增大。
所以当小泡收缩至其曲率半径与大泡半径相等时,停止收缩。
3.如上图所示,玻璃毛细管A插入水中后,水面上升高度应能超过h,因此推断水会从弯口B处不断流出,于是便可构成第一类永动机,如此推想是否合理?为什么?答:不合理,由于毛细管上方弯曲,当液面上升到顶端后,又沿弯曲管下降到弯口B处,液面下降时,由于弯曲部分液体受到重力作用,使凹液面的曲率半径由r增大到r',故附加压力也相应减小到Δp'=2γ/r ' 。
到B处,Δp'与B处高度的静压力达到平衡,曲率不再变化(仍是凹液面)。
故水滴不会落下。
4.一定量的小麦,用火柴点燃并不易着火。
若将它磨成极细的面粉,并使之分散在一定容积的空气中,却很容易着火,甚至会引起爆炸。
这是为什么?答:这有两方面原因。
磨成极细的面粉后,比表面积大大增加,磨得越细,其表面能越高,所处的状态就越不稳定,其化学活性也越大,因而容易着火。


第十章界面现象请回答下列问题:(1)常见的亚稳定状态有哪些?为什么会产生亚稳定状态?如何防止亚稳定状态的产生?解:常见的亚稳定状态有:过饱和蒸汽、过热或过冷液体和过饱和溶液等。
产生亚稳定状态的原因是新相种子难生成。
如在蒸气冷凝、液体凝固和沸腾以及溶液结晶等过程中,由于要从无到有生产新相,故而最初生成的新相,故而最初生成的新相的颗粒是极其微小的,其表面积和吉布斯函数都很大,因此在系统中产生新相极其困难,进而会产生过饱和蒸气、过热或过冷液体和过饱和溶液等这些亚稳定状态,为防止亚稳定态的产生,可预先在系统中加入少量将要产生的新相种子。
(2)在一个封闭的钟罩内,有大小不等的两个球形液滴,问长时间恒温放置后,会出现什么现象?解:若钟罩内还有该液体的蒸气存在,则长时间恒温放置后,出现大液滴越来越大,小液滴越来越小,并不在变化为止。
其原因在于一定温度下,液滴的半径不同,其对应的饱和蒸汽压不同,液滴越小,其对应的饱和蒸汽压越大。
当钟罩内液体的蒸汽压达到大液滴的饱和蒸汽压时。
该蒸汽压对小液滴尚未达到饱和,小液滴会继续蒸发,则蒸气就会在大液滴上凝结,因此出现了上述现象。
(3)物理吸附和化学吸附最本质的区别是什么?解:物理吸附与化学吸附最本质的区别是固体与气体之间的吸附作用力不同。
物理吸附是固体表面上的分子与气体分子之间的作用力为范德华力,化学吸附是固体表面上的分子与气体分子之间的作用力为化学键力。
(4)在一定温度、压力下,为什么物理吸附都是放热过程?解:在一定温度、压力下,物理吸附过程是一个自发过程,由热力学原理可知,此过程系统的ΔG<0。
同时气体分子吸附在固体表面,有三维运动表为二维运动,系统的混乱度减小,故此过程的ΔS<0。
根据ΔG=ΔH-TΔS可得,物理吸附过程的ΔH<0。
在一定的压力下,吸附焓就是吸附热,故物理吸附过程都是放热过程。
在K及下,把半径为1×10-3m的汞滴分散成半径为1×10-9m小汞滴,试求此过程系统的表面吉布斯函数变为多少?已知汞的表面张力为·m-1。