元
金属卤化物 非金属卤化物
素 水解性:对应氢氧化物不
3
是强碱的都易水
解,产物为氢氧
化物或碱式盐
易水解, 产物为两种酸
BX3,SiX4,PCl3
记:Sn(OH)Cl,SbOCl,BiOCl
卤化物的键型及性质的递变规律:
同一周期:从左到右,阳离子电荷数
增大,离子半径减小,离子型向共价型过
P 渡,熔沸点下降。
8 H H 2 S 4 I ( O 浓 H 2 S 4 2 ) I 42 O H
能否选用其他酸用复分解反应制备HBr和HI?
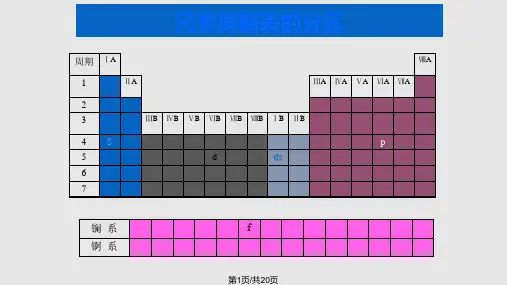
15.1.4 卤化物 多卤化物 卤素互化物
1.卤化物: 卤素与电负性比较小的元素生成的化合物。
P (1) 卤化物的分类
区 金属卤化物:
元 素
离子 C型 s N FaB ,: Ca 2,lL C , a3 lCl
3
共价A A 型lgC 3C ,Slln- (构 1C 4,8Fl型 )eeC 3,Tl iC 4(高 l 氧化值 )
非金属卤化物: B3F ,Si4F,PC 5,Sl 6 F等
(2) 卤化物的性质:
性质:
离子型
熔点:
高
共价型 低
P 溶解性: 大多易溶于水 易溶于有机溶剂
区 导电性:水溶液,熔融导电 无导电性
(3) Br2(l)
氧化剂: C 2 l2B - rB 2 r2- Cl
纯化:3 B 2 3 r C 3 2 - 5 O - B B r3 - r 3 O C 2 (歧 O )
P
B3 - r 5 O - B 6 rH 32 B 32 r O H
区 (4) I2 (s)
(反歧化)
结论: