高中化学必修一氯气、氯水
- 格式:ppt
- 大小:3.92 MB
- 文档页数:28

高中新课程化学必修1—氯气与水的反应摘要:新课程明确提出要实现三维目标:既知识与技能、过程与方法、情感态度与价值观,构建起课堂教学比较完整的目标体系。
由以知识为本位、学科为本位转向以学生的发展为本位,真正对知识、能力、态度进行有机整合,表达对人的生命存在及其发展的整体关怀。
关键词:实验探究氯气次氯酸性质新课程的理想课堂教学应该包蕴三某某念:生活性、发展性和生命性。
新的高中化学课程倡导多样化的教学方式。
注重培养学生对化学的兴趣。
更加重视化学实验的教学。
提出了许多有趣的并与教学内容密切相关的实验和科技活动内容。
力求培养学生具有学习和挖掘化学问题的能力。
如何使化学课堂教学能适应新课程标准的实施要求,优秀的教学设计是一个关键。
本文设计的这节课是苏版新教材《化学必修1》中的第二个实验探究活动——氯气与水的反应。
知识和能力方面的教学目标是:〔1〕氯气的物理性质——可溶性。
〔2〕氯气的化学性质——与水的反应。
〔3〕氯气与水反应的生成物——次氯酸的特性。
过程与方法方面的教学目标是:使学生知道观察、实验、比较、分类等方法在研究物质性质过程中的应用。
知道研究物质性质的一般程序。
情感、态度和价值观方面的教学目标是:通过引导学生活动、实验、探究,让他们体验怎样科学、合理地运用观察方法。
体会实验方法在化学研究中的作用,激发学生学习化学的兴趣,让他们乐于探究物质变化的奥秘;利用他们亲手做漂白实验,培养他们将化学知识与生产生活相结合的意识。
那么,在这堂课的教学中,怎样才能很好地将“知识与技能、过程与方法、情感态度与价值观〞这三方面相互联系,融为一体。
真正表达知识、能力、态度三个方面的有机整合。
把新课程的三维目标落到课堂教学的实处呢?经过认真钻研教材和充分准备实验,我设计了以下教学过程及教学环节。
1.提问质疑,创设情景氯气能溶于水并与水反应吗?见过妈妈洗衣服或床单被罩时加漂白粉吗?你知道我们用的雪白的纸X是用发黄的麦草制出来的吗?“非典“时期,〞广泛使用的“84消毒液〞为什么能消毒杀菌城市自来水厂用什么给自来水消毒?告诉学生这都是我们今天要探究的氯气与水反应的生成物之一次氯酸的功劳。


高一化学必修一氯水知识点氯水是我们在高一化学必修一课程中经常接触到的一个实验。
它是一种具有氯气溶解于水中的溶液,化学式为Cl2(aq)。
通过这个实验,我们能够学习到许多关于氯气和溶液性质的知识。
下面,就让我们一起来探索一下有关氯水的知识点。
首先,我们需要了解氯水的制备方法。
制备氯水的常见方法有两种:一种是通过将氯气通入冷水中,另一种是通过将氯气通入热水中。
这两种方法的区别在于在不同的条件下,氯气的溶解度会发生变化。
一般来说,在较低温度下,氯气在水中的溶解度较高,而在较高温度下,氯气在水中的溶解度较低。
接下来,让我们来探讨一下氯水的性质。
氯水具有一定的氧化性和漂白性。
由于氯气本身是一种强氧化剂,所以氯水可以和许多物质反应,使它们氧化或褪色。
这也是为什么我们常常使用氯水来进行漂白的原因。
此外,氯水还具有消毒的作用。
由于氯气的抗菌性能,氯水可以有效地杀灭许多病菌和细菌。
因此,在一些需要消毒的场合,如实验室、医院等,氯水被广泛使用。
然而,尽管氯水有上述诸多优点,但它也存在一些安全隐患。
首先,由于氯气具有刺激性和有毒性,制备或使用氯水时必须注意安全。
在进行制备氯水的实验时,必须在通风良好的地方进行,以防止氯气对人体的伤害。
同时,在使用氯水时应避免接触皮肤或吸入氯气。
另外,氯水还会与一些物质发生反应产生有害物质。
例如,氯水与酸反应会生成一氧化氯,这是一种臭味刺激且有毒的气体。
因此,在使用氯水时,需要注意选择与之搭配使用的物质,以避免产生有害物质。
此外,我们还需要注意氯水的储存问题。
氯水应该储存在暗处,避免阳光直射。
因为阳光能够使氯水中的氯气逸出,造成浓度降低。
同时,避免与易燃物质接触,以防止引发火灾或爆炸。
除了了解氯水的制备和性质外,我们还需要知道一些与氯水相关的实际应用。
首先是氯水在漂白方面的应用。
由于氯水具有漂白的能力,因此在纺织、造纸、食品加工等行业中被广泛使用。
其次是氯水在水处理中的应用。
由于氯水的杀菌能力,它常被用于水处理过程中,以保证饮用水的水质安全。





最新人教版高中化学必修一第4章第2节《富集在海水中的元素——氯》(第1课时)教案整体设计从容说课氯及其化合物知识作为本章第二节教学内容,其设计意图是:1.氯是一种比较典型的、重要的非金属元素。
教科书选择氯气的性质、用途以及Cl-的检验等内容进行比较全面的学习和研究,不但可以让学生了解典型非金属单质及其化合物的性质,而且对学生全面认识化学元素,尤其是了解其他非金属元素及其化合物的性质,形成正确的观点、掌握正确的学习方法等具有重要的作用。
2.氯是富集在海水中的一种元素,资源丰富。
而且食盐、漂白粉等含氯的化合物大家都非常熟悉,与日常生活比较贴近,学习时,容易使学生产生一种亲近感,有一种似曾相识的感觉,容易产生强烈的求知欲望,有效地降低了学习的难度,较好地体现了一种人文关怀。
3.通过本节的学习,可以培养学生的归纳能力、举一反三的能力、自主学习的能力。
而自主学习的能力又是一切能力的基础,也是教学的最高境界——教是为了不教。
理论联系实际,突出知识的重要用途,是本节编排的一个特色。
重点知识判断的重要依据之一就是实用性。
氢气在氯气中的燃烧是工业上制盐酸的重要方法,氯气与水反应是氯气用于自来水消毒的原理所在,离子检验是化学实验的重要内容,也是一项重要的基本技能。
因此,这些重点知识的学习对学生知识与能力的发展有非常重要的作用。
而氯气的实验室制法,与现实联系不多,实际用途不大,而且,尾气氯气的毒性比较大,容易对环境造成污染,容易使学生产生一种不正确的认识及一种恐惧感,不利于学生以后对实验的学习及掌握。
因此,在新教材中就删去了“氯气的实验室制法”。
这样,就使学生的注意力顺着教材的顺序,自然而然地转移到用途上来,体现了编者的意图。
教材中把有关“氯气的实验室制法”放到“科学史话”中作了介绍,而且是以探究的形式让学生自己去写反应方程式,既化解了难点,又培养了学生的探究能力,真是一举两得。
另外,教材在内容上也体现了对立统一规律和辩证唯物主义观点。


第二节富集在海水中的元素——氯(第1课时氯气的性质和氯水的性质)【明确学习目标】1.了解氯元素的存在,了解氯气的主要物理性质,认识燃烧现象的本质。
2.从原子结构特点理解氯气的主要化学性质(金属、非金属)(学习重点)3.掌握氯气与水的反应,认识氯水的主要成分和性质,次氯酸的主要性质。
(学习重难点)课前预习案【知识回顾】检验溶液中亚铁离子可用的试剂是【新课预习】一、活泼的黄绿色气体——氯气1.氯元素的存在:氯元素在自然界中以存在,主要以形式存在于海水和陆地的盐矿中。
2.氯原子结构示意图为,其最外层有个电子,在化学反应中很容易形成8电子的,故氯气具有。
3.氯气的物理性质氯气在低温和加压条件下可以转变为和,闻气体的方法:4.氯气的化学性质:写出下列反应的化学方程式。
(1)Cl2与金属的反应①与Na的反应:;②与Fe的反应:;③与Cu的反应:。
(2)Cl2与非金属的反应① Cl2与H2的反应:;② Cl2还能跟大多数非金属单质化合,与磷单质反应生成PCl5和PCl3:。
(3) Cl2与水的反应①常温下1体积水可溶解约体积氯气,,溶于水的氯气约1/3与水反应,氯水呈,化学方程式为:得到的水溶液叫,离子方程式为:,(4)与其它物质的反应,氯气具有很强的,能与一些具有的物质反应,如(5)次氯酸(HClO)的性质:①弱酸性:酸性比碳酸弱,电离方程式为:。
②不稳定性:不稳定,只存在于水溶液中,在光照下易分解放出氧气,反应的化学方程式为:。
③强氧化性:能杀菌消毒,具有漂白作用,能漂白。
【预学中的疑难问题】课堂探究案一.活泼的黄绿色气体——氯气【实验探究1:氯气与单质的反应】通过演示实验或教师讲解,填写下表。
(2)铁与盐酸反应生成二价铁,铁与氯气反应生成二价铁还是三价铁?这说明了什么?参加?(3)结合课本P83第二个“思考与交流”,思考燃烧是否一定要有O2燃烧的现象有什么共同特点?【实验探究2:与水的反应】新制氯水的成分:(1)溶液中含有H+,具有______性。
第二节 氯及其化合物 第1课时 氯气的性质[核心素养发展目标] 1.从氯原子结构,特别是最外层电子角度,结合实验探究,认识氯气的强氧化性,培养宏观辨识与微观探析相结合探究物质性质的能力。
2.初步了解次氯酸的弱酸性、强氧化性和不稳定性,结合其漂白性,认识氯气、次氯酸在生产、生活中的应用,增强环保意识,强化社会责任感。
一、氯气与单质的反应1.认识氯气(1)氯是一种重要的“成盐元素”,在自然界中除了以NaCl 、MgCl 2、CaCl 2等形式大量存在于海水中,还存在于陆地的盐湖和盐矿中,即以化合态存在。
(2)氯气的物理性质颜色 状态 气味 毒性 溶解性密度 黄绿色气体有刺激性气味有毒25 ℃时,1体积的水可溶解约2体积的氯气比空气大思考1 将氯气用软管通入到田鼠洞中可用于消灭田鼠,这是利用了氯气哪些性质?这启示我们在遇到氯气泄漏时应该怎样做?提示 将氯气通入到田鼠洞中起灭鼠作用,一方面是利用其密度比空气大,可沉于洞底,另一方面是氯气有毒。
遇到氯气泄漏,要去上风向的高处躲避。
2.氯气与单质的反应(1)原子结构:氯的原子结构示意图为,在化学反应中很容易得到1个电子,因此,氯气的化学性质非常活泼,表现出强氧化性。
(2)与金属单质的反应化学方程式反应现象 与钠反应 2Na +Cl 2=====△2NaCl 产生大量白色烟 与铁反应 2Fe +3Cl 2=====△2FeCl 3 产生大量棕褐色烟 与铜反应Cu +Cl 2=====△CuCl 2产生大量棕黄色烟特别提醒 氯气在加热条件下能与大多数金属化合,生成高价金属氯化物,体现了氯气较强的氧化性。
(3)与非金属单质H 2的反应①实验现象:纯净的氢气在氯气中安静地燃烧,发出苍白色火焰,集气瓶口上方出现白雾。
②化学方程式:H 2+Cl 2=====点燃2HCl 。
思考2 Cu 、Fe 、H 2在Cl 2中燃烧,体现了Cl 2的什么性质?你对燃烧的本质有什么新的认识。
氯及其化合物高中化学必修一知识点氯元素位于元素周期表中第三周期第ⅦA族,氯原子最外电子层上有7个电子,在化学反应中很容易得到1个电子形成Cl-。
小偏整理了氯及其化合物高中化学必修一知识点,感谢您的每一次阅读。
氯及其化合物高中化学必修一知识点氯原子结构示意图为氯元素位于元素周期表中第三周期第ⅦA族,氯原子最外电子层上有7个电子,在化学反应中很容易得到1个电子形成Cl-,化学性质活泼,在自然界中没游离态的氯,氯只以化合态存在(主要以氯化物和氯酸盐)。
1、氯气(Cl2):(1)物理性质:黄绿色有刺激性气味有毒的气体,密度比空气大,易液化成液氯,易溶于水。
(氯气收集方法—向上排空气法或者排饱和食盐水;液氯为纯净物)(2)化学性质:氯气化学性质非常活泼,很容易得到电子,作强氧化剂,能与金属、非金属、水以及碱反应。
①与金属反应(将金属氧化成最高正价)Na+Cl2===点燃2NaClCu+Cl2===点燃CuCl22Fe+3Cl2===点燃2FeCl3(氯气与金属铁反应只生成FeCl3,而不生成FeCl2。
)(思考:怎样制备FeCl2?Fe+2HCl=FeCl2+H2↑,铁跟盐酸反应生成FeCl2,而铁跟氯气反应生成FeCl3,这说明Cl2的氧化性强于盐酸,是强氧化剂。
)②与非金属反应Cl2+H2===点燃2HCl(氢气在氯气中燃烧现象:安静地燃烧,发出苍白色火焰)将H2和Cl2混合后在点燃或光照条件下发生爆炸。
燃烧:所有发光发热的剧烈化学反应都叫做燃烧,不一定要有氧气参加。
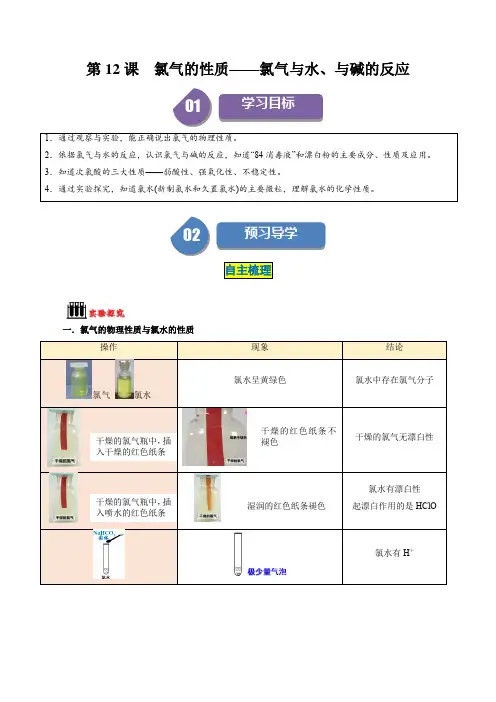
③Cl2与水反应Cl2+H2O=HCl+HClO离子方程式:Cl2+H2O=H++Cl—+HClO将氯气溶于水得到氯水(浅黄绿色),氯水含多种微粒,其中有H2O、Cl2、HClO、Cl-、H+、OH-(极少量,水微弱电离出来的)。
氯水的性质取决于其组成的微粒:(1)强氧化性:Cl2是新制氯水的主要成分,实验室常用氯水代替氯气,如氯水中的氯气能与KI,KBr、FeCl2、SO2、Na2SO3等物质反应。