SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量
- 格式:ppt
- 大小:191.00 KB
- 文档页数:19






sds聚丙烯酰胺凝胶电泳测定蛋白质相对分子量的原理;
SDS聚丙烯酰胺凝胶电泳是一种蛋白质分析方法,常用于测定蛋白质的相对分子量。
其原理是利用SDS(十二烷基硫酸钠)使蛋白质带负电,使蛋白质在凝胶中按照相对分子量大小进行分离。
具体原理如下:
1. SDS:SDS是一种表面活性剂,它可以与蛋白质发生结合,使得所有蛋白质带有相同的电荷密度。
2. 蛋白质解不性:在SDS存在条件下,蛋白质发生解性,其中SDS会形成不溶解的复合物,使蛋白质具有均一负电荷。
3. 凝胶电泳:将SDS处理后的蛋白质样品加于聚丙烯酰胺凝胶电泳胶板上,施加电场使蛋白质迁移。
4. 分离:由于凝胶电泳胶阻力不同,蛋白质经过一段时间后在凝胶上分离成锥形区带。
5. 相对分子量测定:在同一凝胶中,已知相对分子量已知的标准蛋白质样品与待测蛋白质样品进行分析,通过对比标准蛋白质样品的迁移距离和待测蛋白质样品的迁移距离,可以推算出待测蛋白质样品的相对分子量。
需要注意的是,由于SDS聚丙烯酰胺凝胶电泳是以相对分子量进行分析的,所以对于蛋白质的准确分子量测定,还需结合其他方法如质谱等进行综合分析。

sds-聚丙烯酰胺凝胶电泳实验报告.
实验目的:通过SDS-聚丙烯酰胺凝胶电泳技术,分离蛋白质并测定分子量。
实验原理:SDS-聚丙烯酰胺凝胶电泳是一种分离蛋白质的标准方法,可对不同来源和大小的蛋白质进行分离和鉴定。
在本实验中,通过将蛋白质溶解于含有SDS和2-巯基乙醇等条件下的试样缓冲液中,以使蛋白质带有几乎相同的负电荷,通过电泳使蛋白质在聚丙烯酰胺凝胶中以大小不同的分子量在电场作用下移动,最终被染色,进行分离鉴定。
实验步骤:
1.准备实验材料:SDS-PAGE电泳装置、试样缓冲液、聚丙烯酰胺凝胶、蛋白质样品、电泳缓冲液等。
2.制备SDS-PAGE电泳凝胶:按照说明书,将聚丙烯酰胺凝胶拆封并放置在实验室温度下一段时间,使其柔软。
3.制备电泳缓冲液:按照说明书,取适量的Tris、glycine和SDS等物质,配制电泳缓冲液,使其达到所需浓度。
4.制备试样缓冲液:按照说明书,取适量的Tris、SDS和2-巯基乙醇等物质,配制试样缓冲液。
5.制备样品:取适量的蛋白质样品,在试样缓冲液中煮沸一段时间,使蛋白质分子展开。
6.装样:将制备好的样品加入聚丙烯酰胺凝胶电泳装置样品槽中。
7.电泳:按照说明书,调整电泳缓冲液pH值和电泳电压等条件,开启电泳装置,进行电泳操作。
8.染色:将电泳板取出,进行荧光染色或银染色法。
9.图像处理:使用图像分析系统或其他软件,进行蛋白质条带的分析和图像处理。
实验结果:经过SDS-PAGE电泳后,样品中的蛋白质在凝胶中呈现出大小不同的分子量条带,通过荧光染色或银染色可以清晰地看到分离的蛋白质条带。
根据蛋白质的分子量大小,可以判断样品中含有哪些蛋白质。
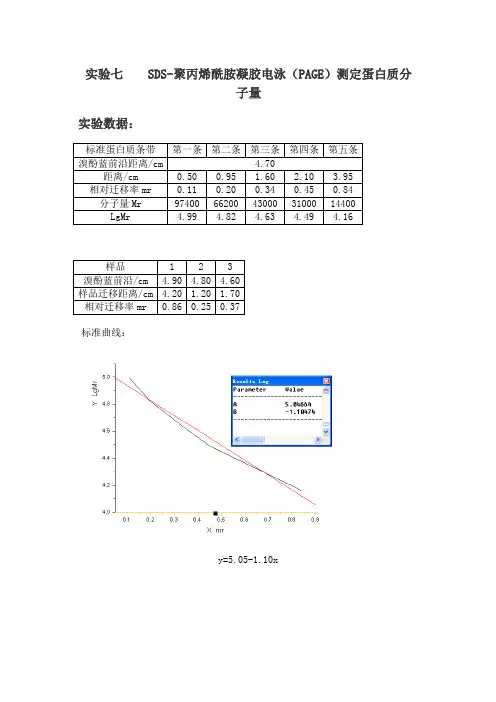
实验七SDS-聚丙烯酰胺凝胶电泳(PAGE)测定蛋白质分子量实验数据:标准蛋白质条带第一条第二条第三条第四条第五条溴酚蓝前沿距离/cm 4.70距离/cm 0.50 0.95 1.60 2.10 3.95 相对迁移率mr 0.11 0.20 0.34 0.45 0.84 分子量Mr 97400 66200 43000 31000 14400LgMr 4.99 4.82 4.63 4.49 4.16样品 1 2 3溴酚蓝前沿/cm 4.90 4.80 4.60样品迁移距离/cm 4.20 1.20 1.70相对迁移率mr 0.86 0.25 0.37标准曲线:y=5.05-1.10x结果:样品 1 2 3Mr 12706 59566 43954mr 4.104 4.775 4.643一. 实验目的和要求1 学习SDS-PAGE测定蛋白质分子量的原理。
2 掌握垂直板电泳的操作方法。
3 运用SDS-PAGE测定蛋白质分子量及染色鉴定。
二 .实验原理带电质点在电场中向带有异相电荷的电极移动,这种现象称为电泳。
区带电泳是在半固相或胶状介质上加一个点或一薄层样品溶液,然后加电场,分子在支持介质上或支持介质中迁移。
支持介质的作用主要是为了防止机械干扰和由于温度变化以及大分子溶液的高密度而产生的对流。
区带电泳使用不同的支持介质,早期有滤纸、玻璃珠、淀粉粒、纤维素粉、海砂、海绵、聚氯乙烯树脂;以后有淀粉凝胶、琼脂凝胶、醋酸纤维素膜,现在则多用聚丙烯酰胺(PAGE)和琼脂糖凝胶。
PAGE根据其有无浓缩效应,分为连续系统和不连续系统两大类,连续系统电泳体系中缓冲液pH值及凝胶浓度相同,带电颗粒在电场作用下,主要靠电荷和分子筛效应。
不连续系统中由于缓冲液离子成分,pH,凝胶浓度及电位梯度的不连续性,带电颗粒在电场中泳动不仅有电荷效应,分子筛效应,还具有浓缩效应,因而其分离条带清晰度及分辨率均较前者佳。
SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小。

实验8 SDS-聚丙烯酰胺凝胶电泳法测定蛋白质的相对分子量Mr原理蛋白质在聚丙烯酰胺凝胶电泳中, 蛋白质的迁移率取决于它所带净电荷及分子的大小和形状。
在聚丙烯酰胺凝胶系统中加入阴离子去污剂十二烷基磺酸钠(sodium dodecyl sulfate,简称SDS)和还原剂(如巯基乙醇)处理蛋白质样品, 则蛋白质分子中的二硫键被还原, 1g蛋白质可定量结合1.4g SDS。
由于SDS呈解离状态, 使蛋白质亚基带上大量的负电荷, 其数值大大超过蛋白质分子原有的电荷量, 因而掩盖了不同种类蛋白质间原有的电荷差别。
各种蛋白质-SDS复合物表现出相等的电荷密度, 在聚丙烯酰胺凝胶上电泳时, 它们纯粹按照分子的大小由凝胶的分子筛效应来进行分离, 有效迁移率与相对分子量的对数成很好的线性关系。
用这种方法测定蛋白质的Mr, 简便、快速, 只需要廉价的设备和μg量的蛋白质样品。
所得的结果, 在Mr为15000~200000的范围内, 与用其他方法测得的Mr相比, 误差一般在±10%以内。
因此SDS测定Mr的方法, 已得到非常广泛的应用和迅速的发展。
现在经SDS-聚丙烯酰胺凝胶研究过的蛋白质已经有很多种了。
实验证明, 在蛋白质溶液中加入SDS和巯基乙醇后, 巯基乙醇可使蛋白质分子中的二硫键;SDS能使蛋白质的氢键、疏水键打开, 并结合到蛋白质分子上形成蛋白质-SDS复合物。
在一定的条件下, SDS与大多数蛋白质的结合比为1.4gSDS/1g蛋白质。
由于十二烷基硫酸根带负电, 使各种蛋白质的SDS复合物都带上相同密度的负电荷, 它的量大大超过了蛋白质分子原有的电荷量, 因而掩盖了不同种类的蛋白质间原有的电荷差别。
1.在用SDS-凝胶电泳法测定蛋白质的Mr时, 应注意以下几个问题:如果蛋白质-SDS复合物不能达到1.4gSDS/1g蛋白质的比率并具有相同的构象, 就不能得到准确的结果。
影响蛋白质和SDS结合的因素主要有以下3个: ⑴二硫键是否完全被还原: 只有在蛋白质分子内的二硫键被彻底还原的情况下, SDS才能定量地结合到蛋白质分子上去, 并使之具有相同的构象。

实验七 SDS —聚丙烯酰胺凝胶电泳法测定蛋白质的分子量一、 实验原理了解SDS-聚丙烯酰胺凝胶电泳的原理,学会用这种方法测定蛋白质的相对分子量 二、实验原理带电的颗粒(蛋白质)在电场的作用下,移动的速度是根据此公式,在同一电场强度(v /d)和电极缓冲液(η)条件下,带电的各种蛋白质成分,移动的速度决定于各蛋白质的带电量(q)和自身分子的大小(6πr)。
若使各蛋白质成分的带电量(q)相近似时,则各蛋白质成分移动的速度就只决定于各蛋白质成分自身分子的大小(6πr)。
1967年Shapiro 等人发现,在聚丙烯酰胺凝胶中加入阴离子去污剂十二烷基硫酸钠(sodium dodecylsulfate ,SDS),不影响凝胶的形成,而蛋白质的电泳迁移率则主要取决于它的自身分子量的大小。
加入SDS 之所以能获得如此的效应,是因为SDS 能打开蛋白质分子间的氢键和疏水键,使蛋白质变性成为松散的线状。
同时大多数蛋白质的每个氨基酸都能与固定量的SDS 相结合[溶液中的SDS 总量,至少要比蛋白质的量高3倍以上,大多数蛋白质与SDS 按1:1.4(W /W)的比例结合],形成SDS 一蛋白质复合物。
其结果: (1)由于SDS 解离后带有很强的负电荷,致使SDS 一蛋白质复合物都带上了相同密度的负电荷,其电量大大超过了蛋白质分子原有的电荷量,基本掩盖了不同种类蛋白质间原有的电荷差异。
(2)SDS 与蛋白质结合后,改变了蛋白质原有构象,使所有蛋白质水溶液中的形状都近似椭圆柱形。
不同SDS 一蛋白质复合物的短轴直径都一样,约为18nm ,而长轴则与蛋白质分子的大小成正比。
这样SDS 一蛋白质复合物在凝胶电泳中的迁移率,就不再受蛋白质原有电荷及其形状的影响了,而只取决于椭圆柱长度,即蛋白质分子的大小。
需要注意的是:为使SDS 与蛋白质能充分的按比例结合,必须将蛋白质间的二硫键完全打开。
因此,在用SDS 处理蛋白质样品时,必须同时用巯基乙醇处理。

SDS- 聚丙烯酰胺凝胶电泳法测定蛋白质分子量【目的】1 . 掌握 SDS-PAGE 测定蛋白质分子量的操作方法。
2 . 熟悉 SDS-PAGE 测定蛋白质分子量的原理。
【原理】带电粒子在电场中向着与其自身电荷方向相反的电极移动, 称为电泳。
不同蛋白质分子具有不同的大小、形状, 在一定的 pH 环境中带有不同的电荷量, 因而在一定的电场中所受的电场引力及介质对其的阻力不同, 二者的作用结果使不同蛋白质分子在介质中以不同的速率移动, 经过一定的时间后得以分离, 这就是电泳分离蛋白质及核酸生物大分子的基本原理。
聚丙烯酰胺凝胶电泳就是以聚丙烯酰胺凝胶作为电泳介质的电泳。
在电泳时, 蛋白质在介质中的移动速率与其分子的大小, 形状和所带的电荷量有关, 为了使其只与蛋白质分子的大小有关, 从而利用蛋白质在介质中的迁移率来测定蛋白质的分子量, 就需要消除蛋白质分子的形状和所带电荷量的不同对迁移率的影响或减小到可忽略不计的程度。
SDS 是十二烷基硫酸钠( sAium dAecyl sulfate )的简称, 它是一种阴离子表面活性剂, 加入到电泳系统中能使蛋白质的氢键和疏水键打开, 并结合到蛋白质分子上(在一定条件下, 大多数蛋白质与 SDS 的结合比为 1.4 g SDS/ 1 g 蛋白质), 使各种蛋白质 -SDS 复合物都带上相同密度的负电荷, 其数量远远超过了蛋白质分子原有的电荷量, 从而掩盖了不同种类蛋白质间原有的电荷差别, 使电泳迁移率只取决于分子大小这一因素, 于是根据标准蛋白质分子量的对数和迁移率所作的标准曲线, 可求得未知物的分子量。
SDS 与蛋白质结合后引起蛋白质构象的改变。
SDS- 蛋白质复合物的流体力学和光学性质表明, 它们在水溶液中的形状, 近似于雪茄烟形状的长椭园棒, 不同蛋白质的 SDS 复合物的短轴长度都一样(约为 18? , 即 1.8 nm ), 而长轴则随蛋白质分子量成正比的变化。
SDS-PAGE测定蛋白质分子量
SDS-PAGE(sodium dodecyl sulfate polyacrylamide gel electrophoresis)测定蛋白质分子量,简便、快速且重复性好,是一种常用的蛋白质分子量测定方法。
百泰派克生物科技提供基于SDS-PAGE或质谱的蛋白质分子量测定服务。
SDS-PAGE
SDS-PAGE即十二烷基硫酸钠聚丙烯酰胺凝胶电泳,是一种间断的电泳系统,通常用于分离分子量在5—250kDa之间的蛋白质。
十二烷基硫酸钠(sodium dodecyl sulfate ,SDS)和聚丙烯酰胺凝胶(polyacrylamide gel ,PAG)组合使用可以消除结构和电荷的影响,从而仅根据分子量的差异来分离蛋白质。
SDS-PAGE测定蛋白质分子量。
SDS-PAGE测定蛋白质分子量
蛋白质分子量即蛋白质相对分子质量,是蛋白质化学式中各个原子的相对原子质量的和。
蛋白质分子量正确与否往往预示着蛋白质的结构和功能正确与否。
测定蛋白质分子量的方法有很多,SDS-PAGE是主要方法之一,也是实验室使用最普遍的一种。
在SDS-PAGE中,已知分子量的标准蛋白质和未知样品同时电泳。
染色后,根据标准蛋白质的相对迁移率和分子量的对数,可得到一条标准曲线,利用未知样品的相对迁移率可在标准曲线上求得其分子量。
另外,SDS-PAGE法可分为还原电泳和非还原电泳,还原电泳中蛋白质二硫键被还原使得蛋白质可以充分伸展,因此使
测定结果更为准确。
sds聚丙烯酰胺凝胶电泳测定蛋白质实验报告实验报告:SDS聚丙烯酰胺凝胶电泳测定蛋白质1. 实验目的:本实验旨在使用SDS聚丙烯酰胺凝胶电泳技术对蛋白质进行分离和测定,并研究样品中蛋白质的分子量。
2. 实验原理: SDS聚丙烯酰胺凝胶电泳是一种常用的蛋白质分离和测定方法。
在此方法中,蛋白质样品首先与SDS(十二烷基硫酸钠)反应,使蛋白质在电泳过程中带有负电荷。
然后,蛋白质样品被加载到聚丙烯酰胺凝胶中,经过电泳分离。
由于SDS的作用,蛋白质在凝胶中的迁移速度与其分子量成反比。
最后,通过染色或蛋白质标记物检测,可以确定蛋白质的相对分子量。
3. 实验步骤: a. 准备SDS聚丙烯酰胺凝胶:按照制备凝胶的方法制备所需的聚丙烯酰胺凝胶,包括配制凝胶溶液、注射样品孔和负载样品等步骤。
b. 样品制备:将待测蛋白质样品加入SDS缓冲液,并加热至高温,使蛋白质与SDS反应,使其带负电荷。
c. 电泳操作:将样品加载到凝胶中,连接电源进行电泳,设定合适的电压和时间进行分离。
d. 染色和可视化:电泳完成后,将凝胶染色以可视化蛋白质条带,常用的染色方法包括银染、共染等。
e. 分析和测定:根据标准蛋白质的移动距离和相对分子量,通过比较和分析样品中蛋白质的相对分子量。
4. 实验结果:在实验中,通过SDS聚丙烯酰胺凝胶电泳分离和染色,观察到样品中的蛋白质条带。
根据标准蛋白质的移动距离和相对分子量,可以推断样品中蛋白质的相对分子量。
实验结果可以用图表形式展示,包括蛋白质条带的位置和相对分子量的估计。
1/ 25. 结果分析与讨论:分析实验结果,比较样品中蛋白质的相对分子量与已知标准蛋白质的相对分子量之间的差异。
根据条带的位置和相对分子量的估计,可以推断样品中的蛋白质组成和含量。
讨论实验中可能出现的误差和不确定性,并提出改进的建议。
6. 结论:根据实验结果,可以得出关于样品中蛋白质的相对分子量和组成的结论。
总结实验的目的、方法和结果,并指出实验的局限性和未来的研究方向。
. 样作为实验组来 同上项目三 SDS -聚丙烯酰胺凝胶电泳(SDS-PAGE )测定蛋白质分子量一实训目的1 掌握 SDS-PAGE 测定蛋白质分子量的操作步骤2 学会聚丙烯酰胺凝胶电泳测定蛋白质分子量的原理 二实训原理用聚丙烯酰胺凝胶电泳法分离鉴定蛋白质(protein ),主要依赖于电荷效应和分子筛效应。
再与标准样品对照即可确定各区带的成分。
要利用凝胶电泳测定某样品的蛋白质分子量就必须去掉其电荷效应,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小。
SDS 能破坏蛋白质分子间以及其他物质分子间的非共价键使蛋白质的构象发生变化,继而使蛋白质变性解离成单一亚基,从而降低或消除了各种蛋白质分子间的天然电荷差异,形成 S DS-蛋白质负离子,因此,当电泳时,蛋白质分子的迁移率取决于其分子大小,当蛋白质分子量在 1.2X104~16.5X104 之间时,蛋白质的迁移率和分子量的对数呈直线关系,符合下列方程。
LogMW =K -bm(LogMW 为分子量的对数,K 、b 为常数,m 为迁移率)若将已知分子量的标准蛋白质的迁移率对分子量的对数作图,可获得一条标准曲线,未知蛋 白质在相同条件下进行电泳根据它的电泳迁移率即可在标准曲线上求得其分子量 三、实训器材序号 1 2 3 4 56 设备名称垂直板电泳槽及附件 直流稳压稳流电泳仪 微量进样器玻璃注射器玻璃平板电炉 规格,型号可变压数量1 12 1 41序 试剂纯度、浓度 作用配 制 需要工具 需要工具号 方法1低分子量标 准蛋白质样 2mg /ml以标准样品为 对照即可确定 见 表 格 下 水浴锅、小烧 杯,玻璃棒 本样品各区带的 方成分210~20mg/ml水浴锅、小烧品3浓缩胶缓冲 液测定蛋白质的 分子量呈弱酸性,使甘 同上 氨酸解离很少, 在电场作用下, 涌动效率低,二 氯离子含量高,杯,玻璃棒天平、容量 瓶、棕色试剂 瓶保 证 电 泳 的 作为催化剂,产去掉其电荷效SDS加速剂,可催化4分离胶缓冲 液形成较高的电 位梯度压着蛋 白质聚集在一 起,凝缩为一狭 小区带。