中科大物理化学实验十二:溶液中的吸附作用和表面张力的测定
- 格式:pdf
- 大小:714.17 KB
- 文档页数:9

实验二十一溶液中的吸附作用和表面张力的测定课程名称物理化学实验实验名称溶液中的吸附作用和表面张力的测定姓名学号专业班级实验日期一、实验目的1.了解表面张力的性质,表面能的意义以及表面张力和吸附的关系。
2.掌握一种测定表面张力的方法——最大气泡法。
二、实验原理1.Γ=﹣c/RT×(dσ/d c)T(以σ~c作图→以求出Γ)2.Γ=Γ∞×Kc/(1+Kc)c/Γ=c/Γ∞+1/KΓ∞(以c/Γ~c作图→以求出Γ∞)3.S。
=1/Γ∞N A (以求出S。
)4.σ=K×ΔP三、注意事项1.测定用的毛细管一定要洗干净,否则气泡可能不能连续稳定的流过,而使压差计不稳定,如发生此种现象,毛细管应重洗。
2.毛细管一定要保持垂直,管口刚好插到与液面接触。
3. 在数字式微压差测量仪上,应读出气泡单个逸出时的最大压力差。
四、 数据记录五、 数据处理1.在25℃时σH2O =71.97×10﹣3N /m ΔP =366Pa ∴仪器常数K为∶K =H2OPσ∆=371.9710N m 366Pa⨯﹣/=1.97×10﹣42. 由σ=K ·P ∆得∶3.溶液的表面张力σ与浓度c 的关系曲线4.可求出各点的切线斜率(dσ)T ﹐还可根据Γ=﹣c(d σ)T 5.Γ与c 的关系图6.直线斜率为 9.8×104 L /(m ·mol )1∞Γ=9.8×104 m 2/mol ∴Γ∞=1.02×10﹣5mol /m 2 7.S 0=·1N∞Γ=1.58×10﹣19m ²六、思考题1.用最大气泡法测定表面张力时为什么要读最大压力差? 答∶若抽气速度太快,气泡的形成与逸出速度快而不稳定,亦使U型压力计中的酒精所处的位置相对不稳定,不易观察出其最高点而引起的较大的误差。
2.哪些因素影响表面张力测定结果?如何减小以致消除这些实验的影响?答∶温度、气泡逸出速度、毛细管是否干净及毛细管的尖端是否与液面相切会影响测定结果。

溶液中的吸附作用和表面张力的测定PB09206xxxAbstract:This Experiment is designed to measure the surface tension of a series of butyl alcohol solutions with different concentration by maximum bubble pressure method. The molecular section area of butyl alcohol can be calculated with the help of Langmuir isothemal equation.关键词:溶液中的吸附作用最大气泡压力法表面张力的测定一、前言表面活性剂在催化、去污、乳化、润湿、起泡以及选矿等工业及日常生活中应用极其广泛,研究这些物质的表面效应具有十分重要的应用价值。
表面张力是重要的物理化学参数,是研究表面压、表面吸附量、分子横截面积等表面效应的基础。
关于表面张力的测定,常见的方法有毛细上升法,环法,吊片法,最大气泡压力法等方法,其中最大泡压法对仪器的要求比较低,精度相对对较高,是测量液体表面张力的一种常见方法。
1二、实验部分1.毛细管常数的测定.按照实验装置示意图,将清洗干净的仪器连接组装好,打开恒温水浴(万和HK-2A超级恒温槽)使仪器稳定在25oC的状态。
取一支毛细管,检查确认没有破损后用铬酸洗液和蒸馏水反复清洗。
毛细管洁净与否将是本实验能否成功的关键。
如果毛细管没有清洗干净将导致实验中无法形成均匀稳定的气泡,影响最终的实验结果。
向洗净的分液漏斗中注入适量的蒸馏水,打开数字式微压差测量仪(DMP-2B),对压强进行校零,将装有毛细管的橡胶塞安装到分液漏斗上,且保证体系有良好的气密性。
打开分液漏斗的活塞,使漏斗内的液面下降至恰好与毛细管口相切,此时压差计的示数为负值或为在零附近的正值,压差计实数过大的话说明体系的密封性存在问题。

溶液中的吸附作用及表面张力的测定中国科学技术大学少年班学院摘要:本实验通过最大气泡压力法对不同浓度的正丁醇溶液的表张力进行测定,并由此计算溶液界面上的吸附量并由饱和时吸附量的值计算得到正丁醇的分子截面积。
关键词:最大气泡压力法,表面张力,正丁醇,表面吸附1前言对于液体而言,其界面和表面处的性质尤为重要,可以决定其很多用处,而对于这部分性质而言,表面张力是其中最重要的一个数值,例如表面活性剂和表面吸附都要以表面张力为基础。
对于表面张力的测定则由很多方法,例如液膜法和泡压法,本实验采用的泡压法是利用溶液中气泡在涨破瞬间的压力来计算得到表面张力数值的。
2实验部分2.1实验仪器及试剂HK-2A型超级恒温水浴DMP-2B型数字式微压差测量仪Perfluid Model BT50b 气泵恒温套管,毛细管,100mL容量瓶,2mL移液管正丁醇,蒸馏水,铬酸洗液2.2实验设计2.2.1吸附量的求得吸附量定义为溶液中表层与里层浓度之差,曾经有人用刮下表层液膜并测定其中溶质浓度的方法来计算吸附量,这种方法虽然来自于最原始的对于吸附量的定义,但是用刀片刮下表层液膜这一点上操作起来十分困难,而吉布斯则从热力学上对吸附量的数值进行了推导,得到了吸附量与其他各个热力学函数之间的关系式:Γ=−cRT (ðσðc)T(1)其中σ为溶液的表面张力,c为溶液浓度,T为温度,溶液浓度和温度都容易得到,故此时的任务便是求得(ðσðc )T项,为了求出偏导数的值,则至少要测量多组表面张力-浓度数据,而其中表面张力的测定便要用到最大气泡压力法。
2.2.2最大气泡压力法测定表面张力对于毛细管口处的一个气泡而言,它受到内外两个压力差的作用,同时还受到毛细管口一圈处表面张力的作用,在表面张力的作用下,气泡仍然停留在管口处不溢出,而当气压差达到一定大小的时候,表面张力无法再维持住气泡,则气泡此时会从管口溢出,在溢出时,两个作用力大小应该相等,可以得到关系式:2πrσ=ρg∆P (2)等式左侧为气泡受到的表面张力,其中r为毛细管管口半径,右侧则为压力差在气泡上的作用力,在测定的时候,∆P的数值可以从微压计上读出,但是毛细管半径和溶液密度的数值则不易得到,而在溶液密度变化不大的情况下,对于两个情况下的表面张力和压力差数值,可以近似得到:∆P1∆P2=σ1σ2(3)由上式可以得知,只要在某种已知表面张力的液体中进行一次测定,之后每一次便都可以通过压力差的数值得到表面张力的数值,定义K′=σ1∆P1为毛细管常数,则对于某一固定的毛细管而言,此常数为一定值,而某一情况下的表面张力则可以表达为σ=K′∆P (4)由此便可以计算得到任意情况下的表面张力数值。

【DOC】溶液中的吸附作用和表面张力的测定
吸附作用是指一种物质在表面上形成的极小的颗粒,其主要来源于溶质与固体接触表面之间的力学或化学作用。
它可以增强溶质与固体之间的相互作用强度,从而影响溶质的活性和溶液的物理性质。
由于这种作用,溶液表面生成一个新的“界面”,使原有一种溶液有千变万化的表现。
表面张力是指液体表面承受的力,是液体自身有限的张力表现出来的参数。
它是影响液体流变性能的关键因素之一,也是液体的重要性质之一。
此外,表面张力也影响着液体表面的其他性质,比如:表面活性剂的吸附与混溶能力、表面污染物的吸附能力、溶质的极性和分散性等等。
因此,测定溶质中的吸附作用及溶液表面张力非常重要。
常见的测定溶质中的吸附作用的方法有实验检测和模型预测两种,它们之间相关度很高,能够综合考察不同溶质的吸附作用及其机理。
一般而言,实验检测是介观检测性质,比如:液体表面张力等,而模型预测则可以从微观角度反映溶质之间的相互作用,并能够深入分析吸附作用及其机理。
通常,液体表面张力的测定可以采用传统的实验检测方法,例如:气液界面法、粘度计等。
以气液界面法为例,通过测量小液滴的重量就可以计算出液体表面张力。
其他方法如粘度计测定、机械张力法、上清法等也是测量液体表面张力的常用方法之一;而扫描电镜等技术可以分析吸附过程中液体表面的构型,从而加深对溶质吸附的认知。
本文从实验检测和模型预测的角度讨论了溶质中的吸附作用及表面张力测定的方法与技术,从而为进一步研究和应用提供借鉴与参考。


溶液中的吸附作用和表面张力的测定溶液中的吸附作用和表面张力的测定——最大气泡压力法【摘要】本实验采用最大气泡压力法测定了一系列不同浓度的正丁醇溶液的表面张力,并根据Gibbs吸附公式和Langmuir等温方程式的到了表面张力与溶液吸附作用的关系,用作图法求出了正丁醇分子横截面积,从实验上进一步了解表面张力的性质以及表面张力和吸附的关系,并得到了一个测量表面张力的简单有效而又精确的方法。
【关键词】最大气泡法表面张力吸附作用一、前言正丁醇是一种表面活性物质,可以使溶液表面张力下降。
利用最大气泡压力法,可以测量出正丁醇溶液的表面张力。
根据表面张力与气泡压力的关系,由σ-c曲线可以求出溶液界面上的吸附量和单个正丁醇分子的横截面积(S)。
1、物体表面的分子和内部分子能量也不同,表面层的分子受到向内的拉力,有自动缩小的趋势,表面分子的能量比内部分子大。
体系产生新的表面(∆A)所需耗费功(W)的量,其大小应与∆A成正比。
在等温下形成1m2新的表面所需的可逆功为σ,称为单位表面的表面能,其单位为N·m-1,通常称为表面张力。
2、纯液体情形下,表面层的组成与内部的组成相同,因此液体降低体系表面自由能的途径是缩小其表面积。
对于溶液,溶质会影响表面张力,调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大。
反之同理 。
这种表面浓度与溶液里面浓度不同的现象叫“吸附”。
Gibbs 用热力学的方法推导出吸附与溶液的表面张力及溶液的浓度间的关系式Γ =T c RT c ⎪⎭⎫ ⎝⎛-∂∂σ 当()∂σ∂c T <0时,Γ >0,称为正吸附。
反之,()∂σ∂cT >0时,Γ <0,称为负吸附。
正丁醇溶液浓度极小时,溶质分子平躺在溶液表面上,当浓度增加到一定程度时,被吸附了的表面活性物质分子占据了所有表面形成了单分子的饱和吸附层。

最大气泡压力法对溶液吸附作用和表面张力的探究PB09007215中国科学技术大学地球和空间科学学院摘要 本实验对正丁醇水溶液的吸附作用和表面张力进行探讨,通过最大气泡压力法对不同浓度下正丁醇溶液表面张力进行测定,并运用热力学知识分析其性质及其与吸附作用的关系,计算正丁醇分子横截面积。
关键词 CH 3(CH 2)3OH 最大气泡压力法 表面张力 吸附作用1.前言表面张力,即表面层分子沿着与表面相切的方向垂直作用于表面上任意单位长度线段的表面紧缩力【1】,是液体最重要的性质之一,与所处温度、压力、液体组成及共存的相的组成等都有关系。
吸附作用,即一种界面现象,是在界面层中的一个组分或多各组分的浓度与它们在体相中浓度不同的界面现象【2】.美国物理学家、化学家J.W.Gibbs 在1873~1878年期间对经典热力学规律进行总结,并全面解决了热力学体系平衡问题,提出了Gibbs 吸附公式【2】Γ =Tc RT c⎟⎠⎞⎜⎝⎛−∂∂σ 式中,Γ——气一液界面上的吸附量(mol·m -2); σ——溶液的表面张力(N·m -1); T ——绝对温度(K );c -溶液浓度(mol·m -3); R ——气体常数(8.314J·mol -1·K -1)。
应用Gibbs 吸附公式,并结合Langmuir 等温方程式,在一定温度下,吸附量与溶液浓度之间的关系可表示为ΓΓ=⋅+⋅∞K C K C1Γ∞为饱和吸附量,K 为经验常数进而结合正丁醇分子在气-液界面上散步形式,即可求得其分子横截面积。
2.实验部分(一) 仪器与试剂试剂:正丁醇(分析纯)仪器: HK-2A 型恒温水槽 南京南大万和科技有限公司;DMP-2B 型数字式微压差测量仪 南京南大万和科技有限公司;恒温套管 1个; 毛细管(半径为0.15~0.2mm ) 1个;100mL 容量瓶7个; 2mL 移液管 1个;250mL 分液漏斗1个; 500mL 的塑料烧杯 1个;(二) 实验过程1、毛细管常数的测定:按实验装置图装好仪器,打开恒温水浴,使其温度稳定于25℃。

溶液中的吸附作用和表面张力的测定———最大气泡压力法 黄汉弘 PB09206262摘要:本实验通过最大气泡压力法来测定不同浓度正丁醇溶液的表面张力,从而了解表面张力的性质,表面能的意义以及表面张力和吸附的关系。
关键词:吸附作用 表面张力 正丁醇 最大气泡压力法引言:1、物体表面的分子和内部分子所处的境况不同,因而能量也不同,表面层的分子受到向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面(∆A )所需耗费功(W )的量,其大小应与∆A 成正比。
-W =σ∆A如果∆A =1m 2,则-W =σ,即在等温下形成1m 2新的表面所需的可逆功。
故σ称为单位表面的表面能,其单位为N ·m -1。
这样就把σ看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
它表示表面自动缩小的趋势的大小。
表面张力是液体的重要特性之一,与所处的温度、压力、液体的组成共存的另一相的组成等有关。
纯液体的表面张力通常指该液体与饱和了其自身蒸气的空气共存的情况而言。
2、在纯液体情形下,表面层的组成与内部的组成相同,因此液体降低体系表面自由能的唯一途径是尽可能缩小其表面积。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面自由能。
根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大,反之,溶质使溶液的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
这种表面浓度与溶液里面浓度不同的现象叫“吸附”。
显然,在指定温度和压力下,吸附与溶液的表面张力及溶液的浓度有关。
Gibbs 用热力学的方法推导出它们间的关系式 Γ =Tc RT c ⎪⎭⎫ ⎝⎛-∂∂σ 式中,Γ——气一液界面上的吸附量(mol ·m -2);σ——溶液的表面张力(N ·m -1); T ——绝对温度(K );c -溶液浓度(mol ·m -3); R ——气体常数(8.314J ·mol -1·K -1)。
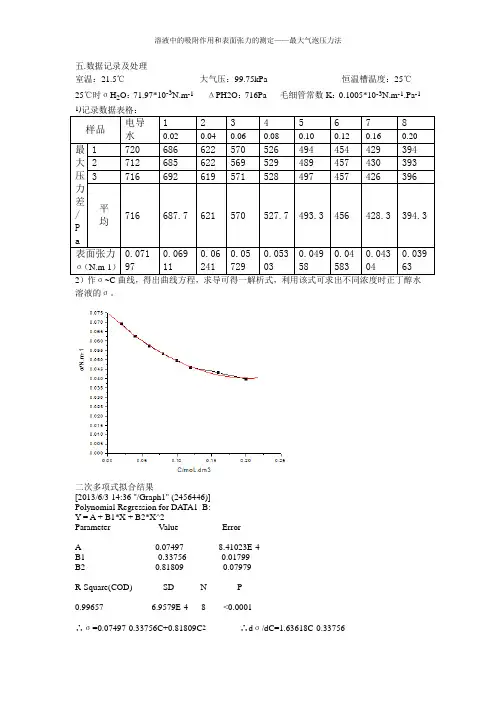
五.数据记录及处理室温:21.5℃ 大气压:99.75kPa 恒温槽温度:25℃ 25℃时σH 2O :71.97*10-3N.m -1 ΔPH2O :716Pa 毛细管常数K :0.1005*10-3N.m -1.Pa -1 1)记录数据表格:样品电导水 123456780.020.040.060.080.100.120.160.20最大压力差/P a1 720 686 622 570 526 494 454 429 394 2 712 685 622 569 529 489 457 430 393 3 716692 619 571 528 497 457 426 396平 均 716687.7 621 570 527.7 493.3 456 428.3 394.3表面张力σ(N.m-1) 0.071970.06911 0.06241 0.05729 0.05303 0.04958 0.04583 0.04304 0.039632)作σ~C 曲线,得出曲线方程,求导可得一解析式,利用该式可求出不同浓度时正丁醇水溶液的σ。
二次多项式拟合结果[2013/6/3 14:36 "/Graph1" (2456446)] Polynomial Regression for DATA1_B: Y = A + B1*X + B2*X^2Parameter Value Error ------------------------------------------------------A 0.07497 8.41023E-4 B1 -0.33756 0.01799 B2 0.81809 0.07979 ------------------------------------------------------- R-Square(COD) SD N P ------------------------------------------------------- 0.99657 6.9579E-4 8 <0.0001 -------------------------------------------------------∴σ=0.07497-0.33756C+0.81809C 2 ∴d σ/dC=1.63618C-0.33756再由计算可得下表:正丁醇浓度C(mol.dm-3)dσ/dC Γ(mol.m2)C/Γ(m2/L) 0.02 -0.304836 2.4587*10-6 8134.37990.04 -0.272112 4.3895*10-6 9112.65510.06 -0.239389 5.7925*10-6 10358.2210.08 -0.206665 6.6676*10-6 11998.3200.1 -0.173942 7.0148*10-6 14255.5730.12 -0.141218 6.8341*10-6 17559.0050.16 -0.075771 4.8891*10-6 32725.8590.2 -0.010324 0.8327*10-6 240182.53 3)作Γ~C图,如下:4)作C/Γ~C图,如下(除去坏点):由上图的直线斜率得:1/Γ∞=161247.62781 即Γ∞=6.20*10-6mol.m-2S0=1/(Γ∞*Ñ)=2.68*10-19m2δ=Γ∞M/ρ=6.20*10-6*74.14/0.8109=5.67*10-4六.思考题1)温度和压强的变化对测定结果有何影响?答:温度的变化对结果会有很大影响,表面张力是分子性质,而温度会影响分子的热运动动能。


12.1实验目的与要求:1. 通过测定不同浓度(C )正丁醇水溶液的表面张力(b ),由b -c 丁醇分子的横截面积(S o )。
2. 了解表面张力的性质、表面能的意义以及表面张力和吸附的关系。
3. 掌握一种测定表面张力的方法一一最大气泡法。
12.2预习要求:1. 掌握最大气泡压力法测定表面张力的原理。
2. 了解影响表面张力测定的因素。
3. 了解如何由表面张力的数据求正丁醇的横截面积。
12.3 实验原理:1.物体表面的分子和内部分子所处的境况不同,因而能量也不同,向内的拉力,所以液体表面都有自动缩小的趋势。
如要把一个分子由内部迁移到表面,就需要对抗拉力而 作功,故表面分子的能量比内部分子大。
增加体系的表面,即增加了体系的总能量。
体系产生新的表面 A )所需耗费功(W )的量,其大小应与△ A 成正比。
-W=b^ A (12.1 )如果△ A =l rf,则-W= b,即在等温下形成1 rf 新的表面所需的可逆功。
故 b 称为单位表面的表面能,其 单位为N- m 1。
这样就把b 看作为作用在界面上每单位长度边缘上的力,通常称为表面张力。
它表示表面 自动缩小的趋势的大小。
表面张力是液体的重要特性之一,与所处的温度、压力、液体的组成共存的另一 相的组成等有关。
纯液体的表面张力通常指该液体与饱和了其自身蒸气的空气共存的情况而言。
图12-1 分子间作用力示意图2.在纯液体情形下,表面层的组成与内部的组成相同,因此液体降低体系表面自由能的唯一途径是尽 可能缩小其表面积。
对于溶液,由于溶质会影响表面张力,因此可以调节溶质在表面层的浓度来降低表面 自由能。
根据能量最低原理,溶质能降低溶液的表面张力时,表面层中溶质的浓度应比溶液内部大,反之, 溶质使溶液的表面张力升高时,它在表面层中的浓度比在内部的浓度低。
这种表面浓度与溶液里面浓度不 同的现象叫“吸附”。
显然,在指定温度和压力下,吸附与溶液的表面张力及溶液的浓度有关。