2017-2018学年高一化学必修2教师用书:专题3 第1单元
- 格式:doc
- 大小:396.91 KB
- 文档页数:9

高中化学必修2教学参考书(新人教)说明为了帮助教师理解和体会课程标准,更好地使用教科书,我们根据教育部制订的《普通高中化学课程标准(实验)》和人民教育出版社、课程教材研究所化学课程教材研究开发中心编著的《普通高中课程标准实验教科书化学2(必修)》的内容和要求,结合高中化学教学实际,组织编写了本教师教学用书,供高中化学教师教学时参考。
全书按教科书的章节顺序编排,每章包括本章说明、教学建议和教学资源三个部分。
本章说明是按章编写的,包括教学目标、内容分析和课时建议。
教学目标指出本章在知识与技能、过程与方法和情感态度与价值观等方面所要达到的教学目的;内容分析从地位和功能、内容的选择与呈现、教学深广度以及内容结构等方面对全章内容做出分析;课时建议则是建议本章的教学课时。
教学建议是分节编写的,包括教学设计、活动建议、问题交流和习题参考。
教学设计对各节的内容特点、知识结构、重点和难点等作了较详细的分析,并对教学设计思路、教学策略、教学方法等提出建议。
活动建议是对科学探究、实验等学生活动提出具体的指导和建议。
问题交流是对“学与问”、“思考与交流”等教科书中栏目所涉及的有关问题给予解答或提示。
习题参考则是对各节后的习题给予解答或提示。
教学资源是按章编写的,主要编入一些与本章内容有关的教学资料、疑难问题解答,以及联系实际、新的科技信息和化学史等内容,以帮助教师更好地理解教科书,并在教学时参考。
参加本书编写工作的有:王晶、王作民、李桢、吴海建、孙琳琳、张晓娟、宋锐等。
本书的审定者:李文鼎、王晶。
责任编辑:吴海建。
图稿绘制:李宏庆、张傲冰。
由于时间仓促,本书的内容难免有不妥之处,希望广大教师和教学研究人员提出意见和建议,以便修订改进。
人民教育出版社课程教材研究所化学课程教材研究开发中心2004年6月第一章物质结构元素周期律 (1)本章说明 (1)教学建议第一节元素周期表 (2)第二节元素周期律 (5)第三节化学键 (6)教学资源 (8)第二章化学反应与能量 (14)本章说明 (14)教学建议第一节化学能与热能 (17)第二节化学能与电能 (23)第三节化学反应的速率和限度 (31)教学资源 (36)第三章有机化合物 (42)本章说明 (42)教学建议第一节最简单的有机化合物──甲烷 (43)第二节来自石油和煤的两种基本化工原料 (46)第三节生活中两种常见的有机物 (48)第四节基本营养物质 (50)教学资源 (51)第四章化学与可持续发展 (59)本章说明 (59)教学建议第一节开发利用金属矿物和海水资源 (61)第二节化学与资源综合利用、环境保护 (64)教学资源 (67)第一障物质结构元素周期律本章说明一、教学目标1.能描述元素周期表的结构,知道金属、非金属在元素周期表中的位置。

第2课时不同类型的晶体1.了解构成氯化钠、金刚石、足球烯、干冰、石英的微观粒子的排列方式,知道晶体可以分成离子晶体、分子晶体、原子晶体、金属晶体。
(重点) 2.初步形成“结构决定性质、性质反映结构”的观念。
3.知道四类晶体的主要特性。
(重点)基础·初探]1.晶体2.四类晶体的构成(1)离子晶体含义:离子化合物中的阴、阳离子按一定的方式有规则地排列形成的晶体。
①构成微粒:阴、阳离子;②微粒间作用力:离子键。
(2)分子晶体含义:由分子构成的物质所形成的晶体。
①构成微粒:分子;②微粒间作用力:分子间作用力。
(3)原子晶体含义:原子间通过共价键结合形成的空间网状结构的晶体。
①构成微粒:原子;②微粒间作用力:共价键。
(4)金属晶体(了解)含义:由金属单质或合金形成的晶体是金属晶体。
①构成微粒:金属阳离子和自由电子;②微粒间作用力:金属键。
探究·升华]思考探究]1.NaCl晶体结构图每个Na+周围等距紧邻的Cl-有______个,每个Cl-周围等距紧邻的Na+有______个,晶体中Na+与Cl-的个数比为________。
【提示】661∶12.干冰晶体结构模型构成晶体的微粒是________。
微粒之间依靠________结合在一起。
【提示】CO2分子分子间作用力3.二氧化硅晶体结构模型构成晶体的微粒是________,每个Si原子周围结合4个O原子,每个O原子周围结合2个Si原子。
二氧化硅晶体是由Si原子和O原子按________的比例所组成的立体网状结构的晶体。
【提示】Si和O1∶2认知升华]1.晶体的结构与性质特点2.四类晶体的构成题组·冲关]题组晶体的构成与空间微观结构1.下列叙述正确的是()A.构成分子晶体的微粒一定含有共价键B.离子晶体中一定只含有离子键C.同主族元素形成的氧化物的晶体类型一定相同D.熔化时无须破坏化学键的晶体一定是分子晶体【解析】稀有气体形成的分子晶体中无化学键,A错误;离子晶体中一定含有离子键,也可能含有共价键,如NaOH,B错误;在ⅣA族中,碳的氧化物CO、CO2形成的晶体为分子晶体,硅的氧化物SiO2属原子晶体,C错误;分子晶体熔化时破坏的是分子间作用力,无化学键的破坏,D正确。
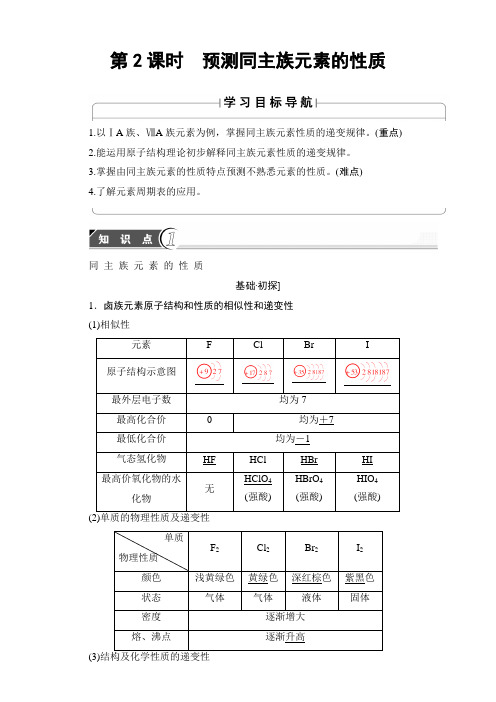
第2课时预测同主族元素的性质1.以ⅠA族、ⅦA族元素为例,掌握同主族元素性质的递变规律。
(重点)2.能运用原子结构理论初步解释同主族元素性质的递变规律。
3.掌握由同主族元素的性质特点预测不熟悉元素的性质。
(难点)4.了解元素周期表的应用。
同主族元素的性质基础·初探]1.卤族元素原子结构和性质的相似性和递变性(1)相似性(3)(1)卤素单质按F2、Cl2、Br2、I2的顺序颜色变浅,密度增大。
()(2)卤素单质都是有色物质。
()(3)HCl、HBr、HI的还原性依次减弱。
()(4)卤族元素的单质越活泼,其熔点和沸点就越高。
()【答案】(1)×(2)√(3)×(4)×2.碱金属元素原子结构和性质的相似性与递变性(1)相似性①原子的最外电子层都有1个电子。
②最高化合价均为+1价。
③都是活泼的金属元素,单质都能与氧气、水等物质发生反应。
④最高价氧化物对应的水化物一般具有很强的碱性。
(2)递变性(1)ⅠA族元素全部是金属元素。
()(2)碱性:RbOH>KOH>NaOH。
()(3)原子半径:Li>Na>K。
()(4)氧化性:Li+>Na+>K+。
()【答案】(1)×(2)√(3)×(4)√3.同主族元素性质的递变规律合作·探究]探究背景]某研究性学习小组设计了一组实验来探究同主族元素性质的递变规律。
(Ⅰ)甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素碳和硅的非金属性强弱比较的实验研究。
(Ⅱ)乙同学设计了如图2装置来验证ⅦA族元素性质的递变规律,图2中A、B、C三处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸条(已知常温下浓盐酸与高锰酸钾能反应生成氯气)。
探究问题]1.甲同学设计的实验应该使用哪些试剂?【提示】稀硫酸、碳酸钠、Na2SiO3溶液。

第一节元素周期表课时1 元素周期表1.简单了解元素周期表的发展历程。
2.了解元素周期表的编排原则及结构。
3.能描述元素在元素周期表中的位置。
(重点)1.元素周期表的发展历程诞生⇒1869年,俄国化学家门捷列夫编制出第一张元素周期表。
↓依据⇒按照相对原子质量由小到大排列,将化学性质相似的元素放在同一纵行。
↓意义⇒揭示了化学元素间的内在联系,成为化学发展史上的重要里程碑之一。
↓发展⇒随着化学科学的发展,元素周期表中为未知元素留下的空位先后被填满。
↓成熟⇒当原子的组成及结构的奥秘被发现后,编排依据由相对原子质量改为原子的核电荷数,形成现行的元素周期表。
2.元素周期表的编排原则(1)原子核外电子层数目相同的元素,按原子序数递增的顺序从左到右排成横行。
(2)原子核外最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。
题组·冲关]1.下列说法正确的是()【导学号:30032000】A.我们现在常用的元素周期表中元素排序的依据是相对原子质量的大小B.元素周期表中同一横行的元素电子层数相同C.元素周期表中同一纵行的元素的最外层电子数相同D.元素周期表已发展成一个稳定的形式,它不可能再有新的变化了【解析】A项,现在使用的周期表的元素排序是根据原子序数的大小;C项,同一纵行的元素的最外层电子数不一定相同,如He与Ne;D项,元素周期表的形式多种多样。
【答案】 B2.下列元素在同一横行的为()A.H与C B.C与SC.S与Cl D.F与Na【答案】 C1.周期(1)概念:具有相同的电子层数而又按原子序数递增的顺序排列的一横行,叫做一个周期。
(2)与原子结构的关系:周期的序数就是该周期元素具有的电子层数。
(3)分类:短周期—包括第一、二、三周期∣长周期—包括第四、五、六、七周期2.族(1)概念:把不同横行中最外层电子数相同的元素,按电子层数递增的顺序由上而下排成纵行。
(2)与原子结构的关系:元素周期表中主族元素的族序数等于其最外层电子数。

第1节认识有机化合物第1课时有机化合物的性质1.了解有机物的性质。
2.了解甲烷的结构。
3.掌握甲烷的化学性质。
(重点)4.掌握取代反应的概念、特点。
(重点)甲烷的存在、用途和结构基础·初探]1.有机化合物(1)定义:绝大多数含碳元素的化合物。
(2)共性2.(1)存在:甲烷是天然气、沼气、坑道气(或瓦斯)的主要成分。
(2)用途:甲烷可用作燃料和化工原料。
3.甲烷的组成与结构1.含碳元素的化合物一定是有机物吗?【提示】不一定。
碳元素的单质、氧化物、碳酸盐等都是无机物。
2.标准状况下,11.2 L CH4分子中所含共价键的数目是多少?【提示】2×6.02×1023或2N A。
核心·突破]1.结构式:用短线来表示一对共用电子的图式叫做结构式。
2.一个碳原子以4个单键与其他原子相结合时,无论这4个原子是否相同,都分别在四面体的顶点上,但不一定为正四面体,也不可能在同一平面上,并且最多有3个原子共面。
题组·冲关]1.以下关于甲烷的说法中错误的是()A.甲烷分子是由极性键构成的分子B.甲烷分子具有正四面体结构C.甲烷分子中四个C—H键是完全等价的键D.甲烷分子中具有非极性键【解析】甲烷分子中只含有4个C—H极性键。
【答案】 D2.下列各图均能表示甲烷的分子结构,哪一种更能反映其真实存在的状况()A.ⅠB.ⅡC.ⅢD.Ⅳ【解析】在这几种形式中,分子结构示意图、球棍模型及填充模型均能反映甲烷分子的空间构型,但填充模型更能形象的表达出H、C的位置及所占比例;电子式只反映原子的最外层电子的成键情况。
【答案】 D3.8 g CH4的物质的量为_____,在标准状况下的体积为____,所含电子数为_____,与_____mol NH3所含的氢原子数目相同。
【答案】0.5 mol11.2 L5N A或3.01×10242 3甲烷的性质基础·初探]1.物理性质2.化学性质通常情况下,甲烷性质稳定,与强氧化剂、酸、碱都不反应。

第三章金属及其化合物3.1.2 金属与酸和水的反应(时间:30分钟)一、选择题1.一小块金属钠长时间置于空气中,可能有下列现象,这些现象出现的先后顺序是①变成白色粉末②变暗③变成白色固体④变成液体A.①②③④B.②③④① C.②③①④ D.③②④①【答案】B【解析】钠在空气中发生如下变化:Na→Na2O→NaOH→Na2CO3·10H2O→Na2CO3。
反应现象为:钠由银白色变暗,之后变成白色固体(NaOH),白色固体潮解变成液体,与空气中的CO2、H2O 结合形成白色晶体(Na2CO3·10H2O),最后晶体风化,变成白色粉末(Na2CO3)。
2.向一小烧杯中分别加入等体积的水和煤油,片刻后再向该烧杯中轻缓地加入一绿豆大小的金属钠,可能观察到的现象为图中的【答案】A3.下列关于钠与水反应的说法中,不正确的是①将小块的钠投入滴有紫色石蕊试液的水中,反应后溶液变红②将钠投入稀盐酸中,钠先与水反应,后与HCl反应③钠在水蒸气中反应(密闭)时因温度高会发生燃烧现象④将两小块质量相等的金属钠,一块直接投入水中,另一块用锡箔包住,在锡箔上刺些小孔,然后按入水中,两者放出的氢气质量相等A.②B.②③C.②③④D.①②③④【答案】D【解析】①钠与水反应产生氢氧化钠,能使紫色石蕊试液变蓝,而不能使紫色石蕊试液变红;②钠与水反应的本质是钠与H+反应,所以钠先与HCl反应,后与水反应;③钠在水蒸气中反应产生的是氢气,尽管温度高且反应放热,但无氧气,故不能燃烧;④钠的密度比水小,浮在水面上时会有部分钠与O2反应,而用锡箔包住的钠不会与氧气反应,所以与水反应的钠的质量不相等,两者放出氢气的质量也不相等。
答案选D。
4.将一小块金属钠投入下列溶液中,既能产生气体又会出现沉淀的是A.稀硫酸B.稀氢氧化钠溶液C.硫酸铜溶液D.氯化铵溶液【答案】C5.金属Ti(钛)是一种具有许多优良性能的较为昂贵的金属,钛和钛合金被认为是21世纪的重要金属材料。
课时3 核素同位素1.了解质量数和A Z X的含义。
2.了解核素、同位素的概念。
(重点)3.了解原子的构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系。
(重难点)原子的构成[基础·初探]教材整理 原子的构成与质量数 1.原子的构成 (1)构成原子⎩⎪⎨⎪⎧原子核⎩⎨⎧质子(相对质量为1,带1个单位正电荷)中子(相对质量为1,不带电)核外电子(带1个单位负电荷)(2)原子的表示方法即A Z X 代表一个质量数为A 、质子数为Z 的X 原子。
2.质量数 (1)质量数质子和中子的相对质量都近似为1,如果忽略电子的质量,将原子核内所有质子和中子的相对质量取近似整数值相加,所得的数值即为质量数,用符号A 表示。
(2)两个关系①质量数(A)=质子数(Z)+中子数(N)(质量关系)②原子序数=核电荷数=质子数=核外电子数(原子中的数量关系)【特别提醒】有关粒子间的关系(1)质量数(A)=质子数(Z)+中子数(N)(2)质子数=核电荷数=中性原子的核外电子数(3)阳离子:质子数=核外电子数+电荷数(4)阴离子:质子数=核外电子数-电荷数[题组·冲关]1.某元素的一个原子形成的离子可表示为b a X n-,下列说法正确的是()A.b a X n-含有的中子数为a+bB.b a X n-含有的电子数为a-nC.X原子的质量数为a+b+nD.X原子的质量约为b6.02×1023g【解析】中子数等于质量数减去质子数,为b-a,A选项错误;该离子含有的电子数为a+n,B选项错误;原子变成离子时,质量数与核外电子数无关,所以X原子的质量数为b,C选项错误;D选项正确。
【答案】 D2.核内中子数为N的R2+,质量数为A,则它的n g氧化物中所含质子的物质的量是()【导学号:30032013】A.nA+16(A-N+8)mol B.nA+16(A-N+10)molC.(A-N+Z)mol D.nA(A-N+6)mol【解析】化学变化中质子数、中子数均不变,故R2+的质量数为A,中子数N,则R原子的质量数也为A,中子数也为N,故R原子的质子数为A-N,二价R2+的氧化物为RO,摩尔质量为(A+16)g·mol-1,n g RO的物质的量为n16+Amol。
第4课时糖类1.了解糖类的组成及存在。
2.了解糖类的主要性质及生理功能。
(重点)基础·初探]教材整理1糖类的组成和物理性质教材整理2糖类的化学性质和应用1.麦芽糖、淀粉和纤维素的水解反应2.葡萄糖的主要性质(1)生理氧化1 mol葡萄糖缓慢氧化放出2 803 kJ能量,热化学方程式为C6H12O6(s)+6O2(g)―→6CO2(g)+6H2O(l) ΔH=-2_803_kJ·mol-1。
(2)与银氨溶液反应葡萄糖与银氨溶液在碱性条件可形成银镜,发生银镜反应。
(3)与新制的Cu(OH)2悬浊液反应葡萄糖与新制Cu(OH)2悬浊液在碱性条件下生成砖红色沉淀。
(4)在酒化酶作用下,葡萄糖转化为乙醇的化学方程式为C6H12O6――→酒化酶2C2H5OH+2CO2↑。
3.淀粉的特征反应淀粉遇碘变蓝色,该反应常用于检验碘单质或淀粉。
4.糖类的用途(1)葡萄糖:用于制镜工业、医药、糖果制造业。
(2)淀粉:人类的营养物质,为人体提供能量,生产葡萄糖,酿酒。
(3)纤维素:生产葡萄糖、制造酒精。
淀粉和纤维素制酒精的反应流程如下:淀粉(纤维素)――→一定条件水解葡萄糖――→酒化酶酒精―→乙酸。
探究·升华]思考探究]1.葡萄糖的氧化反应及检验方法,请完成下列实验(1)与银氨溶液反应(2)2【提示】 还原 新制Cu(OH)2悬浊液2.淀粉的主要性质探究(1)淀粉溶液――→滴加碘水现象:________,结论:淀粉遇________变________。
(2)淀粉溶液――→加入硫酸溶液△(4~5 min )――→冷却溶液――→分装⎣⎢⎢⎡溶液a ――→碘水若不变蓝说明淀粉水解 ,若变蓝,说明还有 。
溶液b ――→NaOH 溶液中和中和溶液――→新制Cu (OH )2悬浊液――→△沸腾→若生成砖红色沉淀,说明淀粉水解生成________。
在上述实验中,H 2SO 4的作用是________,加入NaOH 的作用是______。
第一单元 化学是认识和创造物质的科学1.能用化学发展史说明并体会人类对物质及其变化的认识是逐步发展和深入的。
2.了解化学科学在人类认识物质世界方面的重要作用。
3.了解化学在合成新物质、提高人类生活质量方面的重要作用。
4.了解金属活动性与金属冶炼方法的联系,知道金属冶炼的本质。
(重点)基础·初探]1.金属的冶炼 (1)金属使用的发展历程(2)写出金属Fe 、Cu 、Al 、Na 的冶炼所涉及的化学方程式 ①Fe :Fe 2O 3+3CO=====高温2Fe +3CO 2,Fe 2O 3+2Al=====高温2Fe +Al 2O 3。
②Cu :Fe +CuSO 4===Cu +FeSO 4。
③Al :2Al 2O 3=====通电熔融4Al +3O 2↑。
④Na :2NaCl=====通电熔融2Na +Cl 2↑。
2.化学科学理论的建立与发展(1)19世纪时的化学科学理论。
①以道尔顿原子论、分子结构和原子价键理论为中心内容的经典原子分子论的建立。
②1869年门捷列夫发现了元素周期律。
③质量作用定律的提出奠定了化学反应的动力学基础。
④尿素的合成,彻底动摇了“生命力论”。
(2)20世纪时的化学科学理论。
①化学家鲍林提出了氢键理论和蛋白质分子的螺旋结构模型,为DNA 分子双螺旋结构模型的提出奠定了基础。
②扫描隧道显微镜的发展,实现了对原子或分子的操纵。
探究·升华]思考探究]1.什么是金属的冶炼?金属冶炼的实质是什么?【提示】 将金属从其化合物中还原出来用于生产和制造各种金属材料的过程在工业上称为金属的冶炼。
冶炼金属的实质是用还原的方法使金属化合物中的金属离子得到电子变成金属原子。
2.路易斯酸、碱理论包括哪些内容?【提示】 凡能给出质子(H +)的物质是酸。
凡能接受质子(H +)的物质是碱。
若某物质既能给出质子又能接受质子,称之为两性物质。
3.NaHSO 4溶液具有酸性,Na 2CO 3溶液具有碱性,那么NaHSO 4是酸吗?Na 2CO 3是碱吗?【提示】 NaHSO 4不是酸,属于盐类。
第三单元 人工合成有机化合物1.通过分析由乙烯制取乙酸乙酯的合成路线,了解有机物合成的路线和方法。
(重点)2.了解常见高分子材料的合成反应。
3.认识高分子化合物的链节和单体,能根据高分子判断单体,根据单体写出高分子化合物。
(重点)4.了解高分子材料在生产生活中的独特功能及有机合成的发展方向。
基础·初探]1.以乙烯为原料合成乙酸乙酯 (1)常规合成路线根据所学知识,常用的合成路线为此过程中发生反应的化学方程式及反应类型: ①CH 2===CH 2+H 2O ――→催化剂CH 3CH 2OH ,加成反应。
②2CH 3CH 2OH +O 2――→催化剂△2CH 3CHO +2H 2O ,氧化反应。
③2CH 3CHO +O 2――→催化剂2CH 3COOH ,氧化反应。
④CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ,酯化反应或取代反应。
(2)其他合成路线2.酯的合成甲酸(HCOOH)、乙酸、甲醇(CH 3OH)、乙醇在一定条件下于同一反应体系中发生酯化反应,理论上可生成的酯的结构简式有HCOOCH 3、HCOOC 2H 5、CH 3COOCH 3、CH 3COOC 2H 5。
探究·升华]思考探究]1.以食盐、水、乙炔为原料合成氯乙烯,写出反应的化学方程式。
【提示】 2NaCl +2H 2O=====通电2NaOH +H 2↑+Cl 2↑ H 2+Cl 2=====点燃2HClCH ≡CH +HCl ―→CH 2===CHCl2.写出以淀粉为原料,制备乙酸乙酯的化学方程式(无机试剂自选)。
【提示】 (C 6H 10O 5)n +n H 2O ――→酶n C 6H 12O 6 C 6H 12O 6――→酒化酶2CH 3CH 2OH +2CO 2 CH 3CH 2OH +O 2――→醋酸菌CH 3COOH +H 2O CH 3COOH +CH 3CH 2OH ――→浓硫酸△CH 3COOCH 2CH 3+H 2O3.写出由乙烯合成乙酸乙酯的化学方程式。
第3课时 煤的综合利用 苯1.了解煤的气化、液化和干馏的原理及主要产物。
2.认识苯的分子组成和结构特征。
(重点) 3.认识苯的化学性质及其应用。
(重点)探究·升华]思考探究]1.为了减少污染,提高煤炭的热效率,要对煤进行综合利用。
对煤进行综合利用的方法有哪些?【提示】 煤综合利用的方法有煤的气化、煤的液化和煤的干馏等。
2.煤的气化、液化、干馏都属于化学变化吗? 【提示】 都属于化学变化。
3.煤的气化和液化有何区别?【提示】 煤的气化是将煤转化为可燃性气体的过程,主要是利用煤在高温时与水蒸气反应生成CO 、H 2等。
煤的液化是将煤转化为液体燃料,如燃料油等。
4.煤的干馏的产物是什么?【提示】 煤的干馏是将煤隔绝空气加强热使之分解得到焦炭、煤焦油、焦炉气、粗苯、粗氨水等产品。
认知升华]煤的综合利用⎩⎪⎨⎪⎧(1)概念:把煤转化为可燃性气体的过程(2)原理:高温时煤与水蒸气作用生成水煤气:C +H 2O (g )=====高温CO +H2(3)目的:生成的气体作燃料或化工原料气(4)产品:H 2、CO 、CH4⎩⎪⎪⎨⎪⎪⎧(1)概念:把煤转化为液体燃料的过程(2)原理:①直接液化:煤+H 2→燃料油; ②间接液化:煤――→气化CO 和H 2→ 液体燃料(3)目的:制取液体燃料,合成液态碳氢化合物 和含氧有机化合物(4)产品:液体燃料⎩⎪⎨⎪⎧(1)概念:将煤隔绝空气加强热使之发生分解的过程(2)原理:煤发生复杂的物理、化学变化(3)目的:获得固态的焦炭、液态的煤焦油、 气态的焦炉气(4)产品:焦炭、煤焦油、粗苯、粗氨水、焦炉气等题组·冲关]题组 煤的综合利用 1.下列叙述正确的是( )A .煤的气化、液化和干馏是煤综合利用的主要方法B .煤的气化、液化是物理变化,煤的干馏是化学变化C .煤是混合物,其中含有苯、甲苯、二甲苯等有机化合物D .水煤气的主要成分是H 2和CO ,由水煤气可以合成汽油【解析】 煤的气化、液化和干馏都是化学变化;煤干馏后得到的煤焦油中含有苯、甲苯、二甲苯。
【答案】 A2.当前,我国的主要燃料是煤、石油和液化石油气,下列有关这些燃料的说法正确的是( )A .煤就是炭,因此煤是只含碳元素的纯净物B .煤的干馏也就是煤的气化,所得产物是CO 和H 2的混合物C .通常所说的液化石油气的主要成分是甲烷D .石油主要是由烷烃、环烷烃和芳香烃组成的混合物【解析】 煤是由复杂的有机物和无机物组成的,组成元素中含量最高的是碳,其次是氢和氧,还有硫、磷等,故A 项错误;煤的干馏是将煤隔绝空气加强热,使其分解,而煤的气化是将煤转化为可燃性气体的过程,故B 项错误;石油主要成分是烷烃、环烷烃、芳香烃,通常所说的石油气主要成分是气态烃类的混合物,故C 项错误,D项正确。
【答案】 D【规律方法】五种常见气体及主要成分基础·初探]1.苯的组成与结构(1)组成与结构(2)结构特点①分子构型:平面正六边形结构,分子中六个碳原子和六个氢原子共平面。
②化学键:六个碳碳键完全相同,是一种介于C—C和C===C之间的特殊共价键。
2.苯的物理性质3.苯的化学性质(1)稳定性:苯不能(填“能”或“不能”)使溴水褪色,也不能被酸性高锰酸钾溶液氧化。
(2)燃烧(氧化反应)化学方程式:2C 6H 6+15O 2――→点燃12CO 2+6H 2O 。
现象:产生明亮且带浓烟的火焰。
(3)与浓硝酸反应(取代反应) 化学方程式:探究·升华]思考探究]1.将少量苯加入盛有水的试管中,有什么现象?说明什么? 【提示】 分层,上层为苯,说明苯难溶于水且密度比水的小。
2.将少量苯加入溴水中,有什么现象?说明什么?【提示】 分层,上层为橙红色,说明苯不与Br 2水反应,Br 2易溶于苯中。
3.将少量苯加入酸性KMnO 4溶液中,有什么现象?说明什么? 【提示】 分层,下层为紫色,说明苯不能与酸性KMnO 4溶液反应。
4.是同一物质还是同分异构体呢?【提示】 同一物质。
5.综上事实,可说明苯的结构如何?【提示】 苯分子中的碳碳键是介于单键和双键的特殊键,不存在单、双键交替。
认知升华] 1.苯的结构特点 (1)特殊化学键苯分子中不存在碳碳单键,也不存在碳碳双键,而是一种介于碳碳单键和碳碳双键之间的特殊共价键。
(2)平面形结构①苯分子是平面正六边形结构,六个C 和六个H 共平面。
②拓展:直接连在苯环上的原子共平面,如中所有原子共平面。
2.苯性质的特殊性(1)易发生取代反应①苯与溴的反应题组·冲关]题组苯的组成、结构与性质1.关于苯分子结构的叙述正确的是()A.含有三个碳碳双键和三个碳碳单键B.分子中6个碳碳键完全相同C.所有碳原子都在同一平面上,氢原子不在该平面上D.每两个键之间的夹角都为60°【解析】苯是对称的六元环,是由六个相同的介于碳碳双键和碳碳单键之间的独特的键形成的,每两个键之间的夹角均为120°,C6H6分子中12个原子在同一平面上。
【答案】 B2.下列说法中能说明苯不是单、双键交替结构的是( ) A .苯的一溴代物无同分异构体B .苯不能使溴水或酸性KMnO 4溶液褪色C .苯的对二溴代物无同分异构体D .苯的邻二溴代物有同分异构体【解析】 如果苯分子中是单、双键交替的话,它能与溴水发生加成反应,能使酸性高锰酸钾溶液褪色,其一溴代物、对位二溴代物无同分异构体,若邻二溴代物有同分异构体:,则不能说明。
【答案】 B3.下列物质中,在一定条件下既能发生加成反应,又能发生取代反应,但不能使酸性KMnO 4溶液褪色的是 ( )A .甲烷B .苯C .乙烯D .乙烷【解析】 甲烷和乙烷都属于烷烃,只能发生取代反应,不能发生加成反应,也不能使酸性KMnO 4溶液褪色;乙烯能发生加成反应,不易发生取代反应,能使酸性KMnO 4溶液褪色;而苯既能发生取代反应,又能发生加成反应,但不能使酸性KMnO 4溶液褪色。
【答案】 B探究·升华]思考探究]1.设烃的分子式为C x H y ,写出烃完全燃烧的方程式。
【提示】 设烃的总分子通式为C x H y ,完全燃烧的化学方程式为: C x H y +⎝ ⎛⎭⎪⎫x +14y O 2――→点燃x CO 2+12y H 2O 。
2.等质量的两种烃C x H y 完全燃烧,耗氧量与哪些量有关系?【提示】 等质量的烃C x H y 完全燃烧时,若烃中氢元素的质量分数越大,其耗氧量越大,即若y 的值越大,则该烃完全燃烧时耗氧量也越大,产生的H 2O 也越多,但产生的CO 2却越少。
3.等物质的量的两种烃C x H y 完全燃烧,耗氧量与哪些量有关系?【提示】 对于等物质的量(1 mol)的烃C x H y 完全燃烧时,消耗氧气的物质的量为⎝ ⎛⎭⎪⎫x +y 4mol ,若⎝ ⎛⎭⎪⎫x +y 4的值越大,消耗氧气的物质的量也越大。
认知升华]1.烃的燃烧化学方程式不论是烷烃、烯烃还是苯,它们的组成均可用C x H y 来表示,当它在氧气或空气中完全燃烧时,其方程式可表示如下:C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃x CO 2+y 2H 2O 。
2.气态烃燃烧的体积变化(1)在T >100 ℃时,ΔV =⎝ ⎛⎭⎪⎫x +y 2-⎣⎢⎡⎦⎥⎤1+⎝ ⎛⎭⎪⎫x +y 4=y4-1。
当y >4时,ΔV >0,即体积增大; 当y =4时,ΔV =0,即体积不变; 当y <4时,ΔV <0,即体积减小。
(2)在T <100 ℃时,ΔV =-⎝ ⎛⎭⎪⎫y 4+1<0说明任何烃在100 ℃以下完全燃烧时,体积都是减小的。
3.烃燃烧时耗氧量n (O 2)、生成二氧化碳量n (CO 2)、生成水量n (H 2O)的比较 (1)烃C x H y ,燃烧时 n (O 2)=⎝ ⎛⎭⎪⎫x +y 4;n (CO 2)=x ; n (H 2O)=y2。
(2)质量相同的烃C x H y (转换成CH yx ),燃烧时①质量相同的含氢质量分数较大的烃,燃烧时耗氧量较多、生成二氧化碳量较少、生成水量较多。
②最简式相同的烃,不论以何种比例混合,只要混合物的总质量一定,完全燃烧后的耗氧量、生成二氧化碳量、生成水的量也一定。
题组·冲关]题组1 耗氧量的计算判断1.等质量的下列烃完全燃烧时,消耗氧气最多的是( ) A .CH 4 B .C 2H 6 C .C 3H 6D .C 6H 6【解析】 分子组成为C n H m 的烃,m ∶n 的值越大,即含氢的质量分数越大,在质量相同时耗氧量越多。
在四种烃中,CH 4中m (H)∶m (C)的值最大,故其完全燃烧消耗氧气最多。
【答案】 A2.下列各组化合物中,不论两者以什么比例混合,只要总质量一定,则完全燃烧时消耗O 2的质量和生成水的质量或CO 2质量不变的是( )A .CH 4 C 2H 6B .C 2H 6 C 3H 6 C .C 2H 4 C 3H 6D .C 2H 4 C 3H 4【解析】 质量相同的两种烃C x H y ,yx 相等时,生成的CO 2和H 2O 均相等,C 项符合要求。
【答案】 C题组2 烃组成的判断与综合计算3.两种气态烃以任意比例混合,在105 ℃时1 L 该混合烃与9 L 氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L 。
下列各组混合烃中符合此条件的是( )【导学号:31792081】A .CH 4 C 2H 4B .CH 4C 3H 8 C .C 2H 4 C 3H 8D .C 2H 2 C 3H 8【解析】 C x H y +⎝ ⎛⎭⎪⎫x +y 4O 2――→点燃x CO 2+y 2H 2O ,反应前后体积不变,有1+x +y 4=x +y2,y =4即两种烃无论以何种比例混合,混合后氢原子数都应等于4,唯一的情况就是两种烃各自氢原子数等于4。
【答案】 A4.现有CH 4、C 2H 4、C 2H 6三种有机物:(1)等质量的以上物质完全燃烧时耗去O 2的量最多的是________。
(2)相同状况下,相同体积的以上三种物质完全燃烧时耗去O 2的量最多的是________。
(3)等质量的以上三种物质燃烧时,生成二氧化碳最多的是________,生成水最多的是________。
(4)在120 ℃、1.01×105 Pa 时,有两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是________。
【解析】 (1)等质量的烃C x H y 完全燃烧时,氢元素的质量分数越大,耗氧量越大,CH 4、C 2H 4、C 2H 6中的y x 依次为41、42、62,故CH 4耗O 2最多。