关于湿法冶金的概念
- 格式:doc
- 大小:284.00 KB
- 文档页数:11

湿法冶金设备-绪论湿法冶金设备是指在冶金工业中使用水和溶液进行冶炼和提取金属的一类设备。
湿法冶金是一种传统的冶炼工艺,已有数千年的历史。
随着技术的不断进步和需求的不断增加,湿法冶金设备也得到了不断的改进和发展,为冶金工业的发展做出了重要贡献。
湿法冶金设备在冶金工业中具有广泛的应用。
它可以用于金矿、银矿、铜矿等金属矿石的冶炼和提取。
通过硫酸法、氰化法、氯化法等不同的湿法冶炼工艺,可以将金属矿石中的金属成分提取出来,并进一步进行精炼和加工,制成各种金属产品。
湿法冶金设备还可以用于冶炼有色金属,如铜、铝、镍等。
通过电解、氧化等工艺,可以将有色金属矿石中的金属成分提取出来,并制成各种有色金属产品。
湿法冶金设备的使用具有一定的优势。
首先,湿法冶金设备可以利用水和溶液作为介质,在冶炼过程中产生的热量可以通过水冷却的方式散发出去,从而降低了冶炼过程中的能耗。
其次,湿法冶金设备可以通过溶液中的化学反应来实现金属的提取和分离,这种方式相对于干法冶炼更加高效和精确。
此外,湿法冶金设备还可以将废弃物和有害物质与溶液中的金属成分分离,从而实现资源的回收和环境的保护。
然而,湿法冶金设备也存在一些问题和挑战。
首先,湿法冶金设备的设计和建设需要考虑到水资源的可持续利用和环境的保护。
水是湿法冶金过程中的重要介质,但水资源的供应和处理成本往往较高。
其次,湿法冶金设备在操作过程中需要控制好溶液的浓度和温度,以及化学反应的速度和方向,这对设备的自动化和智能化提出了一定的要求。
此外,湿法冶金设备的维护和保养也需要一定的技术和经验,以保证设备的正常运行和寿命。
为了解决以上问题和挑战,湿法冶金设备的改进和发展趋势主要有以下几个方面。
首先,湿法冶金设备的节能和环保化是当前的主要方向。
通过改进设备的设计和工艺,减少能耗和废弃物的产生,实现资源的高效利用和环境的低碳排放。
其次,湿法冶金设备的自动化和智能化是未来的发展方向。
通过引入先进的控制系统和传感器技术,实现设备的自动操作和优化控制,提高生产效率和产品质量。


湿法冶金浸出技术湿法冶金浸出技术是指利用液体介质将金、银、铜、铝等金属元素从矿石或其他固态材料中溶解出来的技术。
这种技术被广泛应用于非铁金属冶炼、稀有金属冶炼、废弃物处理等领域。
湿法冶金浸出技术的基本原理是,在液体介质中,矿石或其他固态材料中的金属元素被化学反应或化学吸附溶解出来。
溶解后的金属离子可通过电解、沉淀、络合、溶解度等方式进一步得到纯金属。
在湿法冶金浸出技术中,液体介质是非常重要的。
常见的液体介质有稀酸、酸、碱等。
这些液体介质中的化学成分与矿物中的金属元素发生反应,从而使金属元素溶解在介质中。
金矿石的化学成分主要是金和硫化铁。
在使用氰化物溶解金矿石时,氰化物在水中形成离子,和金化学反应,生成氰化金离子,溶解在水中。
硫化铁和氰化物反应,生成一氰化化铁离子,通过氧化、水解等方式进行还原。
湿法冶金浸出技术在工业生产中有广泛应用。
在铜冶炼中,氧化和硫化铜矿是主要的原料,其使用浸出法进行处理。
在硫酸亚铁盐中浸出铜矿,则使用的是酸性液体介质。
在稀有金属冶炼中,常使用浸出法处理稀土矿。
湿法冶金浸出技术也被广泛应用于废弃物处理领域。
在锌处理厂,通过浸出法处理废旧电池中的锌,将锌溶解出来。
在废弃电子产品中,含有如金、银、铜等贵金属,通过浸出法可将其溶解并回收。
湿法冶金浸出技术在不同领域具有不同的应用特点和优势。
在非铁金属冶炼领域,该技术可以处理各种类型的非铁矿,如铝土矿、磷灰石、锰矿和钾矿等。
通过浸出法处理非铁矿可以提高矿石回收率,降低运输成本,并减少对自然资源的消耗。
湿法冶金浸出技术的化学反应速度较快,操作过程相对简单,而且可以通过控制液体介质的化学成分,实现精准的物质分离。
在稀有金属冶炼领域,湿法冶金浸出技术已被广泛应用于稀土元素的分离和提纯。
稀土元素由于矿石中的含量极低,因此其提取成本较高。
但通过采用湿法浸出技术,将矿石浸出后,可以将稀土元素与其他金属分离开来,提高浸出效率和提纯效率,从而降低稀土元素的生产成本。



浅论湿法冶金与火法冶金工艺摘要:湿法冶金原理是以相应溶剂,以化学反应原理,提取和分离矿石中的金属的过程,又叫水法冶金。
火法冶金原理是以高温从矿石中冶炼出金属或其化合物的过程,火法冶金过程不包含水溶液参与,所以又叫干法冶金。
与火法冶金相比,湿法冶金的原料获取简便,原料中各种有价值的金属利用率高,环境保护效果好,而且其冶金过程能够实现自动化并连续进行。
文章将分别介绍两者冶金方法以及几种金属的常见比较先进的冶炼工艺,以供参考。
关键词:湿法冶金;火法冶金;工艺一、概述湿法冶金的一般步骤有:①用化学溶剂将原料中部分转入在溶液中,称为浸取;②过滤残渣,洗涤回收夹带于残渣中的有用部分;③提取溶液,比较常用的是离子交换和溶剂萃取技术还可以用化学沉淀;④在净化液中获取金属及其化合物。
在目前的工艺条件下,金、银、铜、锌、镍、钴等纯金属常采用点解提取法。
以含氧酸形式在溶液中存在的铝、钨、钼、钒等常用氧化物提取,最后还原获得金属。
除此之外很多金属或化合物都能够用湿法方法提取。
就目前来看,世界上全部的氧化铝、氧化铀、大于74%的锌、大于12%的铜都是用湿法生产的。
火法冶金也叫高温冶金。
主要是采用高温将矿石中金属或金属化合物提取出来的过程。
火法冶金水溶液不参与反应。
目前火法冶金工艺在钢铁冶炼、有色金属造锍溶炼和熔盐电解以及铁合金生产等方面比较常用。
火法冶金的一般工艺为矿石准备、冶炼、精炼这几部分,主要采用还原-氧化反应的化学反应形式进行。
二、湿法冶金工艺(一)往载金钢毛中加硫酸方法:将载金钢毛装入大号塑料桶中,往桶中边加硫酸边加开水,加至一定量,然后搅拌,直至钢毛溶解完。
过滤,Fe溶于液体被分离出来,得到固相①,而固相①中主要成分为Au、Ag及石英砂、炭泥等杂物。
反应如下:2Fe+6H2SO4(浓)=(加热)Fe2(SO4)3+3SO2↑+6H2O现象:铁逐渐溶解,生成无色有刺激性气味的气体,溶液变为黄色。
讨论:这一步骤主要目的是将载金钢毛中的Fe除去。

湿法冶金工艺流程
《湿法冶金工艺流程》
湿法冶金是一种利用水溶液来提取金属的工艺。
它包括了从矿石中提取金属的过程,其中矿石被浸入含有化学物质的水溶液中,金属离子被溶解到水中,然后通过沉淀或其他方法从水溶液中分离出金属。
湿法冶金工艺流程是一个复杂而精细的过程,通常包括以下基本步骤:
1. 矿石破碎和粉磨:首先将矿石破碎成小块,然后通过粉磨使其细化成粉末状。
2. 浸出:矿石粉末被浸入含有化学溶剂的水溶液中,这个过程被称为浸出。
溶液中的金属离子开始溶解到水中形成金属盐。
3. 沉淀:通过加入化学试剂或改变溶液的条件(如温度、pH 值等),使金属离子从溶液中沉淀出来,形成固体的金属沉淀物。
4. 过滤和干燥:将金属沉淀物通过过滤分离出溶液,然后对沉淀物进行干燥,得到纯净的金属。
湿法冶金工艺流程在生产中起着重要作用,它被广泛应用于提取铜、铅、锌、镍、钴、金、银等金属。
而且湿法冶金工艺相对于干法冶金来说,可以处理低品位矿石且生产出更高纯度的
金属产品。
然而,湿法冶金也面临着一些挑战,如对环境的影响和工艺流程的复杂性,需要使用大量的化学试剂和水,并产生大量的废水和废渣。
因此,在使用湿法冶金工艺时,需要重视环保、资源节约和安全生产等问题。
总的来说,《湿法冶金工艺流程》是一个综合性、复杂性和技术含量高的工艺流程,它能够为金属提取提供一种有效的方式,但也需要在生产过程中引起重视和关注。
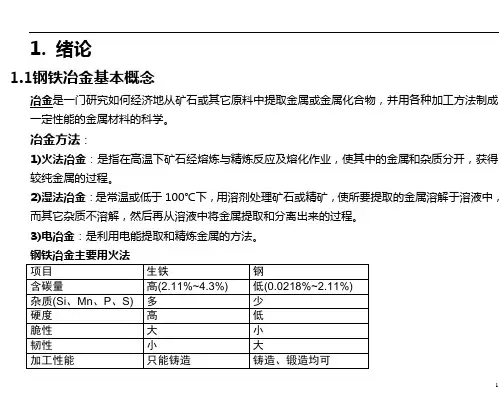
1. 绪论1.1钢铁冶金基本概念冶金是一门研究如何经济地从矿石或其它原料中提取金属或金属化合物,并用各种加工方法制成一定性能的金属材料的科学。
冶金方法:1)火法冶金:是指在高温下矿石经熔炼与精炼反应及熔化作业,使其中的金属和杂质分开,获得较纯金属的过程。
2)湿法冶金:是常温或低于100℃下,用溶剂处理矿石或精矿,使所要提取的金属溶解于溶液中,而其它杂质不溶解,然后再从溶液中将金属提取和分离出来的过程。
3)电冶金:是利用电能提取和精炼金属的方法。
1.2钢铁工业在国民经济中的地位评价一个国家的工业发达程度↓工业化水平国民生活水准↓↓工业生产所占比重↓工业机械化自动化程度交通工具市政设施工业化水平的标志民用住宅生活用品↓↓劳动生产率提高需要大量的基础材料↓↓需要大量的机械设备↓钢铁产品↓1) 价格低廉2) 有较高的强度和韧性3) 易于加工制造4) 所需原料资源丰富5) 冶炼工艺成熟、效率高1.3钢铁工业的发展1856年英国人H.Bessemer发明底吹酸性空气转炉炼钢法。
1864年法国人Martin发明酸性平炉法炼钢。
1878年英国人S.G.Thomas发明碱性底吹空气转炉炼钢法1899年法国人Heroult发明三相交流电弧炉。
1948年德国人Robert成功进行氧气顶吹转炉炼钢试验。
2007年11月24日世界最大的Corex熔融还原炉在我国宝钢投产。
国内最大转炉⑴底吹空气转炉的发明⑵平炉时代⑶电弧炉的发明⑷氧气转炉时代⑸直接还原和熔融还原二次世界大战后的四十多年中,钢铁工业获得重大发展新中国成立以后,特别是改革开放以来,我国钢铁工业有了重大发展中国既是钢铁大国,也是钢铁穷国1、从1996年中国大陆钢产量首次超过一亿吨大关,并跃居世界第一位以后,中国钢产量连年快速增长,并一直保持钢产量世界排名第一的位臵,中国钢产量已经连续13年居世界第一位。
2008年中国钢铁产量5.02亿吨,相当于日美俄印韩德乌巴等8国的总和。

湿法冶金的名词解释湿法冶金是一种常见的冶金工艺,用水或其他液体溶解剂作为反应介质,在一定温度和压力下进行金属的分离、提纯、合成和回收。
与干法冶金相比,湿法冶金具有许多独特的优势,尤其适用于低品位矿石和复杂矿石的处理。
一、浸出和萃取浸出是湿法冶金中最基础的步骤之一,它是将金属从原始矿石中提取出来的过程。
在浸出过程中,矿石通常被破碎和抛光,然后被放入一个大型反应器中与特定的溶解剂接触。
溶解剂可以是水,也可以是酸或碱等化学物质。
溶解剂的选择取决于原始矿石的特性和所需分离金属的类型。
通过浸出,金属在溶解剂中溶解,形成含有金属离子的溶液。
而萃取是从溶液中选择性地分离和回收目标金属的过程。
一种常见的萃取方法是将溶液与一种称为提取剂的有机物接触。
提取剂分子具有两个或多个亲和性不同的配体基团,可以选择性地与特定金属离子形成络合物。
通过与提取剂相互作用,金属离子被从溶液中吸附到有机相中,从而实现金属的富集。
二、沉淀和结晶沉淀是一种常见的湿法冶金技术,用于从溶液中分离和回收金属。
在沉淀过程中,化学反应被利用来使金属以固体沉淀的形式从溶液中析出。
这通常涉及添加一种沉淀剂,例如盐酸或硫酸,与溶液中的金属离子产生反应,生成难溶的金属盐。
这种金属盐会以固体颗粒的形式沉淀下来,沉淀物可以经过过滤或沉淀分离设备进行分离和回收。
与沉淀相似,结晶也是一种从溶液中分离和纯化金属的方法。
结晶是通过控制溶液中金属的浓度和温度来实现的。
在适当的条件下,溶液中的金属离子会被引发结晶,形成结晶体。
通过结晶,金属可以以纯净晶体的形式得到回收。
三、电解和电沉积电解是一种利用电流将金属阳离子还原成纯金属的技术。
在电解过程中,一个金属阳极(即被氧化的金属)和一个金属阴极(即目标金属)被放置在电解槽中,中间由电解液隔离。
当电流通过电解槽时,金属阳离子会移动到阴极上并还原成金属原子,从而在阴极上沉积金属。
电沉积是一种类似于电解的过程,但它主要用于生产金属薄膜或涂层。


湿法冶金的概念湿法冶金是一种通过在液相介质中处理金属矿石来提取金属的冶金方法。
与干法冶金相比,湿法冶金更加灵活,适用于处理各种矿石类型,并且能够根据需要调整处理参数以提高金属的回收率。
湿法冶金包括液相浸出、溶解、分离和纯化等过程,而这些过程通常是在溶剂中进行的。
下面将详细介绍湿法冶金的概念及其应用。
首先,湿法冶金的核心概念是将金属矿石浸入溶剂中,通过化学反应或物理分离等方式将金属从矿石中提取出来。
在湿法冶金中,溶剂的选择至关重要,它需要具有高效溶解金属的能力,并且对其他矿石组分具有较小的溶解能力。
一般来说,酸性、碱性或者浸出剂等都可以作为溶剂来使用。
而且,湿法冶金通常需要依赖化学反应来促进金属的溶解和分离。
湿法冶金的应用非常广泛,从初级金属提取到高级金属精炼都可以使用湿法冶金方法。
其中,浸出和溶解是湿法冶金中最常见的过程,其目的是将金属从矿石中析出。
浸出通常涉及使用酸性或碱性溶液,将金属从矿石中溶解出来。
而溶解则是使用特定的化学溶剂来将金属溶解出来。
浸出和溶解过程通常与其他物理或化学处理过程相结合,如固液分离、浸出剂的再生和废液处理等。
湿法冶金广泛应用于黄金、银、铜、铁、钴、镍、锌等金属的提取。
例如,黄金提取通常使用氰化物溶剂,将黄金从矿石中溶解出来,然后通过电解或吸附等方式将金属还原成金属状态。
铜的提取通常使用硫酸或氯化物作为溶剂,将铜从矿石中溶解出来,然后通过铁粉还原得到金属铜。
而锌的提取则常常使用硫酸或氯化物作为溶剂,在高温条件下将锌从矿石中溶解出来,并通过电解等方式纯化得到金属锌。
湿法冶金的优点之一是能够处理一些难处理的矿石,如含砷、含铜、含锌和难溶于酸碱的矿石。
此外,湿法冶金对矿石的物理性质要求相对较低,处理过程中的温度、浓度和压力等参数可以根据需要来调整。
此外,湿法冶金还具有较低的操作成本和较高的金属回收率。
然而,湿法冶金也存在一些局限性,如溶剂选择的限制、处理废水和废液的环境污染等问题。
湿法冶金(一)湿法冶金是利用浸出剂将矿石、精矿、焙砂及其他物料中有价金属组分溶解在溶液中或以新的固相析出,进行金属分离、富集和提取的科学技术。
由于这种冶金过程大都是在水溶液中进行,故称湿法冶金。
湿法冶金的历史可以追溯到公元前200年,中国的西汉时期就有用胆矾法提铜的记载。
但湿法冶金近代的发展与湿法炼锌的成功、拜尔法生产氧化铝的发明以及铀工业的发展和20世纪60年代羟肟类萃取剂的发明并应用于湿法炼铜是分不开的。
随着矿石品位的下降和对环境保护要求的日益严格,湿法冶金在有色金属生产中的作用越来越大。
湿法冶金主要包括浸出、液固分离、溶液净化、溶液中金属提取及废水处理等单元操作过程。
一、浸出浸出是借助于溶剂选择性地从矿石、精矿、焙砂等固体物料中提取某些可溶性组分的湿法冶金单元过程。
根据浸出剂的不同可分为酸浸出、碱浸出和盐浸出。
根据浸出化学过程分为氧化浸出和还原浸出。
根据浸出方式分为堆浸、就地浸、渗滤浸、搅拌浸出、热球磨浸出、管道浸出、流态化浸出。
根据浸出过程的压力可分为常压浸出和加压浸出。
影响浸出速度的因素主要有固体物料的组成、结构和粒度、浸出剂的浓度、浸出的温度、液固相相对流动的速度和矿浆粘度等。
(一)以溶剂分类1.酸浸出是用酸作溶剂浸出有价金属的方法。
常用的酸有无机酸和有机酸,工业上采用硫酸、盐酸、硝酸、亚硫酸、氢氟酸和王水等。
硫酸的沸点高,来源广,价格低,腐蚀性较弱,是使用最广泛的酸浸出剂。
在有色冶金中硫酸常用于氧化铜矿的浸出、锌焙砂浸出、镍锍和硫化锌精矿的氧压浸出等。
盐酸的反应能力强,能浸出多种金属、金属氧化物和某些硫化物。
如用来浸出镍锍、钴渣等。
但盐酸及生成的氯化物腐蚀性较强,设备防腐要求较高。
硝酸是强氧化剂,价格高,且反应析出有毒的氮氧化物,只在少数特殊情况下才使用。
2.碱浸出用碱性溶液作溶剂的浸出方法。
常用的碱有氢氧化钠、碳酸钠和硫化钠。
铝土矿加压碱浸出是碱浸出最重要的应用实例。
碱浸出还用于浸出黑钨矿、铀矿(Na2CO3浸出UO3)、硫化和氧化锑矿(Na2S+NaOH浸出)等。
湿法冶金发展的方向和方法湿法冶金是一种利用液相介质进行金属提取和精炼的技术。
与传统的干法冶炼相比,湿法冶金具有操作灵活、环境友好、原料利用率高等优势。
本文将探讨湿法冶金的发展方向和方法,以及相关的技术和应用。
湿法冶金的发展方向可以从以下几个方面来考虑:1.环境友好:目前,全球环境问题日益严重,各国纷纷加强环境保护。
湿法冶金具有较低的排放和能源消耗,将成为未来冶金工艺的发展趋势。
未来的湿法冶金应当注重减少废气、废水和固体废弃物的排放,提高资源利用率。
2.自动化和智能化:随着科学技术的不断进步,自动化和智能化已经成为各个行业的发展方向。
湿法冶金也需要加强在设备、控制系统和管理方面的自动化和智能化,提高生产效率和产品质量。
3.资源的综合利用:湿法冶金可以高效地提取和精炼金属,但同时也伴随着一定的能源消耗和废物排放。
未来湿法冶金应该注重资源的综合利用,通过回收和再生利用废弃物,减少对原料的依赖,实现循环经济和可持续发展。
湿法冶金的方法主要包括以下几种:1.化学浸出法:化学浸出法是湿法冶金的基础方法之一,通过溶剂将目标金属从矿石或废物中浸出。
常见的化学浸出法包括酸浸法、氧化浸出法和氰化浸出法等。
化学浸出法具有操作简单、适用范围广的优点,广泛应用于金、铜、锌等金属的提取和精炼。
2.溶剂萃取法:溶剂萃取法是一种通过有机溶剂在两相系统中提取和分离金属的方法。
通过选择合适的有机溶剂,可以实现对不同金属的选择性提取。
溶剂萃取法广泛用于稀有金属的提取和分离,如钕、镨、钴等。
3.电解法:电解法是一种利用电解过程进行金属的提取和精炼的方法。
通过将金属离子在电解液中还原到阴极上,实现金属的分离和纯化。
电解法广泛应用于铜、锌、铝等金属的冶炼。
4.沉淀法:沉淀法是一种利用沉淀反应进行金属的提取和分离的方法。
通过选择适当的沉淀剂和调节反应条件,可以使目标金属以沉淀物的形式从溶液中沉淀出来。
沉淀法常用于金、银等贵金属的提取和分离。
1.锌锰干电池(1) 湿法冶金法该法基于Zn,MnO2可溶于酸的原理,将电池中的Zn,MnO2与酸作用生成可溶性盐进入溶液,溶液经过净化后电解生产金属锌和电解MnO2或生产其它化工产品、化肥等。
湿法冶金又分为焙烧-浸出法和直接浸出法。
焙烧-浸出法是将废电池焙烧,使其中的氯化铵、氯化亚汞等挥发成气相并分别在冷凝装置中回收,高价金属氧化物被还原成低价氧化物,焙烧产物用酸浸出,然后从浸出液中用电解法回收金属,焙烧过程中发生的主要反应为:MeO+C→Me+CO↑A(s)→A(g)↑浸出过程发生的主要反应:Me+2H+→Me2++H2↑MeO+2H+→Me2++H2O电解时,阴极主要反应:Me2++2e→Me直接浸出法是将废干电池破碎、筛分、洗涤后,直接用酸浸出其中的锌、锰等金属成分,经过滤,滤液净化后,从中提取金属并生产化工产品。
反应式为:MnO2+4HCl→MnCl2+Cl2↑+2H2OMnO2+2HCl→MnCl2+H2OMn2O3+6HCl→2MnCl2+Cl2↑+3H2OMnCl2+NaOH→Mn(OH)2+2NaClMn(OH)2+氧化剂→MnO2↓+2HCl电池中的Zn以ZnO的形式回收,反应式如下:Zn2++2OH-→ZnO2-→Zn(OH)2(无定型胶体)→ZnO(结晶体)+H2O(2) 常压冶金法该法是在高温下使废电池中的金属及其化合物氧化、还原、分解和挥发以及冷凝的过程。
方法一:在较低的温度下,加热废干电池,先使汞挥发,然后在较高的温度下回收锌和其它重金属。
方法二:先在高温下焙烧,使其中的易挥发金属及其氧化物挥发,残留物作为冶金中间产品或另行处理。
湿法冶金和常压治金处理废电池,在技术上较为成熟,但都具有流程长、污染源多、投资和消耗高、综合效益低的共同缺点。
1996年,日本TDK公司对再生工艺作了大胆的改革,变回收单项金属为回收做磁性材料。
这种做法简化了分离工序,使成本大大降低,从而大幅度提高了干电池再生利用的效益。
1 关于湿法冶金得概念,阐述正确得就是(C)。
A、湿法冶金就是指原料含水,或过程需要水得,或者就是过程能够产生水得金属生产过程B、湿法冶金就是指以水为反应介质,但水不能参与冶金反应得金属生产过程C、在常温(或低于100℃)常压或高温(100~300℃)高压下,用溶剂处理矿石、精矿或含金属物料,使所要提取得金属溶解于溶液中,而尽量抑制其她杂质不溶解,然后再从溶液中将金属或其化合物提取与分离出来得过程yjfYVde。
aO1xo9t。
D、指在金属生产得所有环节中温度都不超过 300℃并且以水为反应介质得过程2 湿法冶金通常又可称为(BD)。
A、常温冶金B、水法冶金C、干法冶金D、化工冶金E、溶剂冶金3 湿法冶金得优点包括 ( B、C、D)、A、处理规模大,生产效率高B、湿法冶金过程有较强得选择性,即在水溶液中控制适当条件使不同元素能有效地进行选择性分离C、有利于综合回收有价元素D、劳动条件好、无高温及粉尘危害。
一般有毒气体排放较少E、一般没有大量废气、废渣产生4 湿法冶金得优势很多,包括(A、B)。
A、对许多矿物原料得处理而言,湿法冶金得成本较低,这些与其高选择性、宜处理价廉得低品位复杂矿有关B、采用湿法冶金得方法制备各种新型材料或其原料更有其突出得优点C、能够通过极简单得工艺一步实现脉石及杂质元素得分离D、不涉及任何高温、高压过程,完全就是在常温与常压下操作,对设备结构、材质、操作要求极低5 目前,多数得(B)、少数得(D)、全部得(E)都就是用湿法冶金得方法生产得。
A、铅B、锌C、铁D、铜E、氧化铝F、钢6 几乎所有(B )矿物原料得处理及其纯化合物得制备、(D)得提取等也都就是用湿法冶金得方法完成得。
A、轻金属B、稀有金属C、黑色金属D、贵金属E、重金属F、钢铁7 湿法冶金工艺流程包括下述哪些步骤?(B 、D 、E 、F 、G)A 、 熔炼B 、 原料得预处理C 、 吹炼D 、 浸出E 、净化F 、 析出化合物或金属G 、 固液分离 8 湿法冶金中,原料得预处理一般包括(B 、D 、E 、F)。
A 、 熔化B 、 粉碎C 、 成型D 、预活化E 、 矿物得预分解F 、 预处理除有害杂质9 当两个物质(或更多得物质)组成溶液时,其广延量除开质量外就是不具有可加性得。
A 、 体积B 、 压强C 、 可加性D 、 可积性E 、 一级微商 21 AC10 若一溶液由若干种物质组成,各组分得摩尔数分别为 n1,n2,n3,、、nk,X 为某一热力学性质,则组元得偏摩尔量得定义式为()。
11 人们把溶质在水溶液中存在得各种形态-离子、未离解得中性分子统称(D)。
A 、 溶质 B 、 溶剂 C 、 悬浮物 D 、 溶解物种 12 盐酸水溶液中有哪几种溶解物种?(C 、D) A. H 2O B 、 HCl C 、 H + D 、 Cl - E 、 OH -13 偏摩尔数量就是在(A 、D)条件下,广延量对摩尔数得偏微商,切不可对其她条件套用。
A 、 恒温 B 、 恒容 C 、 恒焾 D 、 恒压 14 体系中第 i 组分得某个偏摩尔数量不仅与本组分得性质有关,而且还取决于(C)。
A 、体系得平衡成分,即取决于组分 i 得绝对数量B 、体系得平衡成分,即取决于组分 i 相态C 、体系得平衡成分,取取决于组分 i 与其余组分得比例关系D 、体系得绝对数量,取取决于体系总得物质摩尔数15 关于体系偏摩尔体积 i V 意义得理解,错误得就是(A 、C 、D 、E)。
A 、向无限大得体系中加入一摩尔组分 i 后体积得变化 B 、体系中组元 i 分子或(原子)得绝对总体积C 、向有限得体系中加入足够小得 dn i 摩尔得组分 i 所引起得体积变化 d i V ,则 d i V 与d i n 之比值就就是i VD 、无论按哪种方式来理解偏摩尔体积,体系得平衡成分,或者说所论溶液得总浓度实质上就是应均无变化。
E 、纯物质组成溶液时,其偏摩尔量就是可加得16 一个有水溶液溶解物种参加得反应,计算其某一广延量时,必须使用溶解物种得(B)。
A 、 摩尔量 B 、 偏摩尔量 C 、 化学势 D 、 离子体积 17 物质得偏摩尔吉布斯自由能又称为(B),一般用符号(D)表示。
A 、 摩尔吉布斯自由能 B 、 化学势 C 、 Gk D 、 Gm 18 离子熵就是指(C)。
A 、 离子得摩尔熵B 、 纯电解质得摩尔熵C 、 电解质水溶液中得离子得偏摩尔熵D 、 电解质水溶液得熵 19 用一般得电动势法或其她方法测出得就是(B),它就是正负两种离子得熵得“(C)”。
A 、 电解质水溶液得熵B 、 水溶液中电解质得偏摩尔熵C 、 与D 、 乘积E 、纯电解质得摩尔熵20 离子得相对熵就是指(A 、B 、C 、D)。
A 、规定在任何温度下氢离子得标准熵等于零B 、由氢离子得“零”熵规定出发,任何离子 i 在任何温度下得标准熵皆可求得C 、但这种方式求得得离子熵不就是真值,而就是其相对值,因此称之为相对熵D 、离子相对熵得计算需要电解质溶液测定熵得数值 21 离子得相对熵用符号(A)表示。
A. i S B 、 i S C 、 相对i,S D 、 R i S22 符号 HCl S 就是指(D)。
A 、 盐酸得绝对熵B 、 盐酸得摩尔熵C 、 盐酸得相对熵D 、 盐酸得标准相对偏摩尔熵23 要计算 Ba 2+得 2Ba S ,可以采用下述哪些数据? (A 、C)A 、 硝酸与硝酸钡得标准偏摩尔相对熵B 、 硝酸与氯化钡得标准偏摩尔相对熵C 、 盐酸与氯化钡得标准偏摩尔相对熵D 、 硫酸与氯化钡得标准偏摩尔相对熵 24 要计算醋酸根离子得标准相对熵,可以采用下述哪些数据? (A 、B 、D)A 、 盐酸、氯化钠与醋酸钠得标准偏摩尔相对熵B 、 盐酸、氯化钾与醋酸钾得标准偏摩尔相对熵C 、 硝酸、氯化铵与硫酸铵D 、 硝酸、硝酸钠与醋酸钠 25 假设硝酸得标准偏摩尔相对熵为 8、90J/(K 、mol),硝酸钾得标准偏摩尔相对熵为 12、53J/(K 、mol),则钾离子得标准相对熵为(C) A 、 8、90 B 、 12.53 C 、 3、63 D 、 4、52 26 实验测定氯化铜得标准偏摩尔相对熵为 15、23J/(K 、mol),硫酸得标准偏摩尔相对熵为 9、56J/(K 、mol),硫酸铜得标准偏摩尔相对熵为 8、43J/(K 、mol),则氯离子得标准相对熵为(A)J/(K 、mol)。
A. 16.36 B 、 -1.13 C 、 9、56 D 、 5、67 27 离子 i 得绝对熵,以符号(B)表示。
A. i S B 、 i S C 、 相对i,S D 、 R i S28 在温度 298K 下H +得绝对熵值为(B)J/(K 、mol)。
A 、 -17、89B 、 -20.92C 、 15、69D 、 17、54 29 任何离子得绝对熵值与其相对熵值之间存在着关系(A)。
A 、 z .S S i 9220i,298298,-= B 、 z .S S i 9220i,298298,+=C 、 z .S S i 9220i,298298,--= D 、 z .S S i 9220i,298298,+-= 30 在离子得绝对熵与其相对熵值得换算公式中,就是否需要用到离子得电荷数?(C)A 、 否B 、 就是,但取其绝对值C 、 就是,阳离子取正值,阴离子取负值D 、 就是,一价离子取正值,二价及二价以上取负值 31 当您使用一本手册时,您必须注意手册中得离子熵就是相对熵还就是绝对熵,最简单得判断方法就是(D)。
A 、 瞧手册中钠离子得熵就是多少B 、 瞧手册中氯离子得熵就是多少C 、 瞧手册中氢氧根离子得熵就是多少D 、 瞧手册中 H +得熵就是多少32 一些 -z n XO 或-z m p XO H -型阴离子在 298K 时得偏摩尔熵可以用(B)公式计算。
A 、 C 、考切尔(Coutrure)公式B 、 R 、E 、康尼克(Connick)公式C 、 海尔根孙(Helgeson)公式D 、 R 、洛孙(Lowson)公式33 R 、E 、康尼克公式为(C)。
A 、 184.45.525.02.27ln 232.402298⨯⎪⎪⎭⎫ ⎝⎛--+=z rm z M R SB 、++=2Me 29813.71S n SC 、 ()n z S 28.056.1940.182298--=D 、 z .S S i 9220i,298298,-=34 R 、E 、康尼克公式中得 n 就是指(D)。
A 、 离子电荷数B 、 离子电荷数得绝对值C 、 阴离子中得中心离子数D 、 阴离子中氧原子数35 对于酸式含氧酸根离子,R 、E 、康尼克公式中得 n 就是指(C)。
A 、 阴离子中氢原子数B 、 阴离子中氢氧原子总数C 、 阴离子中氧原子数与氢原子数之差D 、 中心原子数 36 R 、洛孙公式用于计算()型离子得偏摩尔熵。
MeOH +,Me(OH)237 R 、洛孙公式就是(B)。
A 、 184.45.525.02.27ln 232.402298⨯⎪⎪⎭⎫ ⎝⎛--+=z rm z M R SB 、 ++=2Me 29813.71S n SC 、 ()n z S 28.056.1940.182298--=D 、 z .S S i 9220i,298298,-=38、R 、洛孙公式++=2Me 29813.71S n S 中n 就是指(D)。
A 、 离子中金属原子数B 、 离子中氧原子数C 、 离子中氢原子数D 、 离子中 OH 得个数39 C 、考切尔公式就是用来计算(D)型离子得偏摩尔熵。
A 、 -z n XOB 、 -z m p XO H C 、 MeOH +, Me(OH)2 D 、 ()-2n m OH MeO40 C 、考切尔公式就是(A)。
A 、 184.45.525.02.27RlnM 232.402298⨯⎪⎪⎭⎫ ⎝⎛--+=z rm z SB 、++=2Me 29813.71S n SC 、 ()n z S 28.056.1940.182298--=D 、 z .S S i 9220i,298298,-=41C 、考切尔公式184.45.525.02.27RlnM 232.402298⨯⎪⎪⎭⎫ ⎝⎛--+=z rm z S中,R, M, z, r, m 分别就是指(D)。
A 、 分子量,气体常数,氧原子数,氢原子半径,金属原子质量B 、 气体常数,氧原子数,氢原子半径,分子量,金属原子质量C 、 气体常数,金属质量,氧原子数,氢原子半径,金属原子质量D.气体常数,分子量,离子电荷数,有效半径,离子中结合得非氢氧根氧原子数 42 离子熵对应原理就是(C 、E)在分析大量实测数据得基础上而得出得一个经验公式。