试验原理硬水软化
- 格式:ppt
- 大小:1.78 MB
- 文档页数:37

硬水软化的方法
硬水软化就是将硬水中的钙、镁等可溶性盐除去的过程,硬水软化的方法很多,常用的有膜分离法、电磁法、离子交换法、加药法、石灰法。
若水的硬度是暂时硬度,可采用煮沸法。
若水的硬度是暂时硬度,这种水经过煮沸以后,水里所含的碳酸氢钙或碳酸氢镁就会分解成不溶于水的碳酸钙和难溶于水的氢氧化镁沉淀。
这些沉淀物析出,水的硬度就可以降低,从而使硬度较高的水得到软化。
若水的硬度是永久硬度,往往使用以下几种方法。
1、离子交换法:采用特定的阳离子交换树脂,以钠离子将水中的钙镁离子置换出来,由于钠盐的溶解度很高,所以就避免了随温度的升高而造成水垢生成的情况。
这种方法是目前最常用的标准方式。
2、膜分离法:纳滤膜(NF)及反渗透膜(RO)均可以拦截水中的钙镁离子,从而从根本上降低水的硬度。
3、石灰法:向水中加入石灰,主要是用于处理大流量的高硬水,只能将硬度降到一定的范围。
4、电磁法:采用在水中加上一定的电场或磁场来改变离子的特性,从而改变碳酸钙(碳酸镁)沉积的速度及沉积时的物理特性来阻止硬水垢的形成。
5、加药法:向水中加入专用的阻垢剂,可以改变钙镁离子与碳酸根离子结合的特性,从而使水垢不能析出、沉积。
目前工业上可以使用的的阻垢剂很多。


硬水软化的原理
硬水软化的原理是通过去除水中的钙和镁离子,使水变得软化。
这可以通过两种常见的方式来实现:离子交换和反渗透。
离子交换是硬水软化的主要方法之一。
硬水中的钙和镁离子被具有高亲和力的树脂颗粒捕获并与之交换。
树脂中的钠离子或氢离子取而代之,从而使水中的钙和镁离子被去除。
这个过程也被称为树脂再生,当树脂饱和时,一定量的盐水(通常是盐水溶液)会通过树脂床,把吸附在树脂上的钙和镁离子冲刷掉,然后再用新的盐水溶液来再生树脂,使其恢复吸附能力。
反渗透是另一种用于硬水软化的方法。
这是一种通过渗透和过滤的过程,使用半透膜来分离水中的离子和杂质。
通过施加高压,水被迫通过选择性透性膜,而溶解在水中的钙和镁离子等离子和微粒则被膜阻挡,从而得到软化的水。
该过程相对效率高,而且通常不需要额外的化学物质。
无论采用离子交换还是反渗透,处理后得到的水都可以被认为是软水。
软化的水除去了钙和镁离子,使得水具有更低的硬度,对首页和管道系统的腐蚀性降低,减少了垢石的产生,并且减少了洗涤和清洁所需的清洁剂用量。
因此,硬水软化是一种常见的水处理方式,特别适用于需要低硬度水的家庭、工业和商业应用。

硬水软化的方法硬水软化的方法一、软水和硬水:水是日常生活中不可缺少的物质。
天然水在长期与空气、岩石和土壤等长期接触,溶解了许多无机盐、有机物等杂质,因而天然水一般均含有杂质。
(水中溶解的无机盐有钙和镁的酸式碳酸盐、碳酸盐、氯化物、硫酸盐、硝酸盐等)。
(提问) 一般天然水里含有哪些离子?根据水中溶有的钙镁离子的量多少,可以将水进行分类:硬水:含有较多Ca2+、Mg2+离子的水。
(如:天然水等)软水:含有较少Ca2+、Mg2+离子的水。
(如:雨水,蒸馏水等)二、硬水的性质及分类:1、硬水的通性:★肥皂水制备:将中性肥皂削成薄片,取10g溶于 100mL 80%的酒精中,静置数日后,倾出上层清液,再用80%的酒精稀释10倍。
★天然水:要先进行检验,如Ca2+、Mg2+离子含量较少,可适当溶进少量的可溶性钙、镁盐,以使与蒸馏水有明显区别。
水的硬度:以水中溶有Ca2+、Mg2+离子的多少来衡量。
水的硬度是天然水固有的内在特征,不存在没有硬度的天然水。
★国际上对水的硬度的表示方法很不统一。
我国目前以“德国度”表示。
该方法是:将水中的Ca2+、Mg2+离子都看作Ca2+离子,并将其质量折算成CaO 的质量,1L 水中含有10mg CaO 称为1度。
0 – 4 度很软的水4 – 8 度软水8 – 16 度中硬水16 – 30 度硬水30以上最硬水为保证人们身体健康,我国饮用水的硬度统一规定为不超过25度。
2、硬水的分类:由引起硬水的原因不同,硬水可分为:暂时硬水:由钙和镁的碳酸氢盐所引起的硬水硬水永久硬水:由钙的镁的硫酸盐、氯化物等引起的硬水。
★天然水大多同时具有暂时硬度和永久硬度.因此,一般所说水的硬度是泛指上述两种硬度的总和。
3、暂时硬水的性质:由于暂时硬水是由碳酸氢盐所引起的,因而当暂时硬水受热时会分解而得到相应的沉淀如:Ca(HCO3)2 == CaCO3↓ + CO2↑ + H2OMg(HCO3)2 == MgCO3↓ + CO2↑ + H2O但由于氢氧化镁的溶解性比碳酸镁的溶解性要小得多,因而继续加热时,碳酸镁要转化为氢氧化镁:MgCO3 + 2H2O == Mg(OH)2↓ + CO2↑因而长期加热暂时硬水得到的水垢是碳酸钙和氢氧化镁的混合物。

硬水软化的方法实验室
在实验室中,可以使用以下方法来软化硬水:
1. 离子交换法:在实验室中,可以使用离子交换树脂来软化硬水。
将硬水通过离子交换柱,树脂中的阴离子(如氯离子)与硬水中的阳离子(如钙离子、镁离子)发生交换,实现软水的制备。
2. 反渗透法:反渗透法是一种通过半透膜来去除水中的离子和杂质的方法。
在实验室中,可以使用反渗透设备将硬水通过半透膜,使得其中的钙离子、镁离子等离子被去除,从而得到软化的水。
3. 蒸馏法:蒸馏法可以通过水的沸腾和冷凝来去除水中的离子和杂质。
在实验室中,可以将硬水加热至沸腾,然后将蒸气冷凝成液态水,从而得到软化的水。
4. 添加络合剂:络合剂是一种可以与水中的金属离子形成稳定的络合物的化合物。
在实验室中,可以向硬水中加入适量的络合剂,使其中的金属离子与络合剂形成络合物,从而降低硬度。
需要注意的是,不同实验室的硬水硬度程度可能有所不同,因此具体选择哪种方法软化硬水需要根据实际情况来确定。

水的软化实验报告实验分析1.加热软化实验:从本次实验结果来看,加热20min之后,水的硬度较大程度降低,继续加热,处理效果甚微。
2.离子交换软化实验:理论上,在树脂达到交换饱和之前,出水硬度应随着处理时间增大而缓慢增大,而实验结果却与之相反。
分析原因如下:实验之初,未调整好自来水流速,流速过高。
在交换过程中,离子进行扩散-交换-扩散系列步骤,所以,一般情况下,交换液流速大,在树脂层的停留时间缩短,未与树脂充分接触交换,水中的部分钙、镁离子未来得及交换就随出水流出。
当流速调整适当后,树脂与自来水逐渐充分接触,因此,出水硬度也逐渐下降。
在60min时,出水硬度开始上升,表示树脂交换已基本达到饱和,此时处理总水量为322mL。
3.误差分析:(1)本次实验滴定所用的EDTA体积都比较小,对操作技术和仪器质量都要求极高,滴定终点的判断准确度、滴定时读数有微小偏差、滴定管有微量漏液都会对实验结果造成较大影响。
(2)未保证整个实验过程的水流速相同,影响出水硬度。
4.结合实验与所学知识,总结出影响离子交换容量的因素有:(1)流速:流速越大,在树脂层停留时间越短,未充分接触交换,树脂利用率降低;而过小的流速会造成原水只与树脂表面离子进行交换,水不能进入树脂内部(树脂表面通常仅提供20%的交换容量,树脂内部结构能提供80%交换容量)(2)水与树脂的接触时间:接触时间越长,交换越充分,相对单位树脂产水能力下降。
(3)树脂层的高度:离子交换柱树脂层高度越低,流速对其交换能力的影响就越大,当树脂层达到一定高度时,流速对其交换能力的影响可降到比较低的程度。
(4)温度:水温增加能加快内扩散,提高交换能力。
(5)树脂类型:不同树脂交联度等不同,交换能力不同。
5.实验结论:加热法和离子交换法均能使水的硬度降低。
相比而言,离子交换法对水的软化效果更好。

实验硬水的软化实验一、实验目的了解硬水软化的两种方法。
二、实验原理通常把含有较多Ca2+、Mg2+的天然水叫做硬水。
硬水有许多危害,故在使用之前,应除去或减少所含的Ca2+、Mg2+,降低水的硬度.这就是硬水的软化。
本实验采用药剂法及离子交换法。
药剂法是在水中加人某些化学试剂,使水中溶解的钙盐、镁盐成为沉淀物析出。
常用的试剂有石灰、纯碱、磷酸钠等。
根据对水质的要求,可以用一种或几种试剂。
若水的硬度是由Ca(HCO3)2或Mg(HCO3)2所引起的,这种水称为暂时硬水,可用煮沸的方法,将Ca(HCO3)2、Mg(HCO3) 2分解生成不溶性CaCO3、MgCO3及Mg(OH)2沉淀,使水的硬度降低。
若水的硬度是由Ca2+、Mg2+的硫酸盐或盐酸盐所引起的这种水称为永久硬水,可采用药剂法(如石灰纯碱法)来降低水的硬度。
离子交换法是利用离子交换剂或离子交换树脂来软化水的方法。
离子交换剂中的阳离子能与水中的Ca2+、Mg2+交换,从而使硬水得到软化,如图1所示。
三、仪器和药品(1) 仪器试管、砂纸、酒精灯、三角架、试管夹、酸式滴定管(100mI,)。
(2) 药品CaSO4 (2mol/L)、石灰水(饱和)、肥皂水、NaCO3 (1moI/L)、阳离子交换树脂(已处理好,H型)、玻璃棉。
四、实验步骤殛问题思考(1)对硬水的识别取三支试管,分别加入蒸馏水、暂时硬水[含有Ca(HCO3)2的水]和永久硬水[含有CaCO3的水]各3mL,在每一支试管里倒人肥皂水约2mL。
观察在哪支试管里有钙肥皂生成?为什么?(2)暂时硬水的软化取两支试管各装暂时硬水5mL,把一支试管煮沸约2~3min;在另一支试管里加人澄清的石灰水1一2mL,用力振荡。
观察两试管中发生的现象,说明了什么问题?写出反应方程式。
(3)永久硬水的软化在一支试管里加CaSO4溶液3mL作为永久硬水。
先用加热的方法,煮沸是否能除去Ca2+后滴人NaCO3溶液1mL,有什么现象发生?为什么?写出反应式。

硬水软化的原理
硬水软化是指通过一些方法减少或去除水中的硬度物质,使水变得更软。
硬水的主要成分是钙、镁等离子,这些离子会与水中的碳酸根离子结合,形成不溶性的碳酸钙或碳酸镁盐类。
因此,硬水的碳酸盐含量较高,导致水质硬度较高。
硬水软化的原理可以通过两个主要方式实现:离子交换和化学还原。
离子交换是最常用的硬水软化方法之一,主要通过树脂柱来完成。
树脂柱上的树脂具有一定的离子交换功能,可以将水中的钙、镁离子与树脂中的其他离子交换,使水中的钙、镁离子被去除。
当树脂柱中的交换位点饱和时,需要进行再生,即用浓盐酸或盐水进行冲洗,将吸附的钙、镁离子洗掉,从而恢复树脂的交换能力。
化学还原是另一种硬水软化方法,其中最常见的是添加磷酸盐化学络合剂。
这些络合剂中的磷酸根离子可以与钙、镁离子结合形成溶解度较高的络合物,从而使钙、镁离子不再与碳酸根离子结合而形成不溶性盐。
这样逐渐加入络合剂的过程中,水中的钙、镁离子会逐渐被络合剂包裹,形成可溶性的络合物,从而达到软化硬水的效果。
总的来说,硬水软化的原理主要是通过离子交换和化学还原这两种方式减少或去除水中的钙、镁离子,降低水的硬度,使水更加柔软。

硬水软化的方法范文硬水是指在含有高浓度金属离子(如钙离子和镁离子)的水中,这些金属离子与水中的碳酸根离子结合形成碳酸钙和碳酸镁,从而形成水垢。
硬水在日常生活中常常带来一些不便,例如垢病、洗涤剂的洗涤效果较差、管道堵塞等问题。
因此,软化硬水成为了一个重要的任务。
在此推荐以下几种常用的硬水软化方法。
1.离子交换离子交换是最常见和最常用的一种硬水软化方法。
它利用具有负电荷的离子交换树脂,如氢氧化铝、钙盐树脂等,吸附水中的钙和镁离子,释放出其上的钠离子,从而软化水质。
这种方法需要设备的支持,效果好但成本较高。
2.加热法加热法也是一种常见的软化硬水的方法。
通过加热硬水,可以使其中的钙和镁离子与碳酸根离子反应生成碳酸钙和碳酸镁,进而生成水垢。
然后,通过过滤的方法去除水垢,从而软化硬水。
加热法操作简单而且成本较低,但不能完全去除硬水中的钙和镁离子。
3.磷酸盐添加法磷酸盐添加法是一种化学方法,通过加入适量的磷酸盐溶液来软化硬水。
磷酸能与钙和镁离子形成不溶性的磷酸钙和磷酸镁,从而减少水中的钙和镁离子浓度,实现软化效果。
然而,长期使用磷酸盐会对环境和人体健康造成一定的影响。
4.逆渗透逆渗透是一种膜分离技术,通过高压作用下,使得水分子从低浓度的溶液中逆向渗透到高浓度的溶液中。
逆渗透可以有效地去除水中的杂质,包括硬水中的钙和镁离子,从而实现软化硬水的目的。
逆渗透设备价格较高,但是能够产生高质量的软化水。
5.石碱法石碱法是传统的一种软化硬水方法,通过加入石灰和碱类物质(如重炭酸钠、氢氧化钠等)来软化硬水。
石灰中的钙氢氧化物反应生成钙碱土,可与水中的碳酸钙和碳酸镁结合成沉淀,从而软化水质。
这种方法操作简单,成本较低,但对于循环冷却水等大规模水处理系统不太适用。
6.电解法电解法利用电解原理来软化硬水。
通过将硬水通过电解池,水中的钙和镁离子会在阳极上沉积,从而实现软化水质。
这种方法适用于家庭级和小规模的水处理设备,操作简单,但效果相对较差。

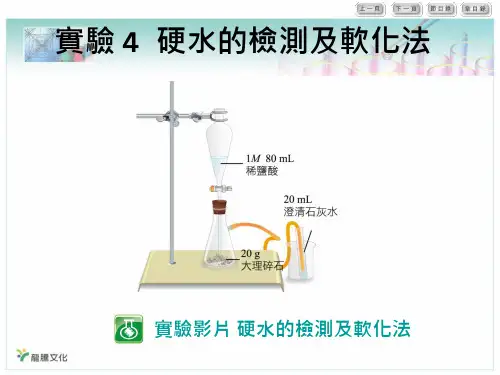
硬水的软化的实验原理硬水是指含有大量溶解性钙、镁等离子的水,其主要成分为碳酸钙和硫酸钙等。
硬水将对水质和生活带来不便,如在煮水、清洗、洗涤、浇灌等方面产生不良影响。
因此,通过软化硬水可以减少其中的钙、镁离子含量,提高水质的柔软度。
下面将介绍硬水软化的实验原理。
硬水通过软化可以通过钠离子交换来实现。
软化硬水的主要方法是使用具有很强离子交换能力的树脂材料,如阴离子交换树脂。
这种树脂含有大量的阴离子交换基团,具有高度选择性地吸附和释放水中的阳离子,从而实现硬度离子的去除。
一般情况下,软化硬水的实验过程可以分为以下几个步骤:1. 准备树脂:在实验开始前,需要将阴离子交换树脂进行处理,以去除其上的杂质和离子。
常见的处理方法包括反复用去离子水、盐酸等进行反复清洗,直至排出的水质呈中性。
2. 将硬水与阴离子交换树脂接触:将预处理好的树脂装入实验容器中,然后将硬水与树脂接触。
这一过程可以通过装有树脂的漏斗或柱状容器来完成。
3. 阴离子交换:硬水中的钙、镁等离子会与树脂中的阴离子交换基团发生离子交换反应,而被弱酸树脂所吸附。
常见的交换基团包括羧基(-COOH)等。
4. 离子交换平衡:经过一段时间的接触,交换反应会到达平衡,树脂上的交换基团以吸附和释放的方式,将硬度离子吸附到树脂上,并释放相应量的钠离子到水中。
5. 洗涤树脂:交换完毕后,需要用纯净水对树脂进行洗涤,以将吸附在树脂上的余量离子冲洗掉。
这一步骤可以通过将纯净水反复流过树脂上,直至冲洗液排出时不再呈碱性。
通过上述实验原理,硬水中的钙、镁等硬度离子可以被阴离子交换树脂所吸附,从而实现硬水的软化。
这种方法具有高效、简便、经济的特点,对改善水质、减少水垢产生等有着良好的效果。
值得注意的是,树脂使用一段时间后需要进行再生或更换,以恢复其吸附能力。
第1篇一、实验目的本实验旨在通过实际操作,学习和掌握水质软化的原理和方法,了解不同水质软化技术的特点和应用,提高对水质软化工艺的认识和操作技能。
二、实验原理水质软化主要是去除水中的钙、镁离子,降低水的硬度。
常用的水质软化方法有离子交换法、化学法、热力法等。
本实验主要采用离子交换法,利用离子交换树脂去除水中的钙、镁离子。
三、实验材料与仪器1. 实验材料:- 原水:硬水- 离子交换树脂:强酸型阳离子交换树脂- 稀盐酸:用于再生树脂- 烧杯、漏斗、滤纸、玻璃棒、滴定管、pH计、电导率仪等2. 实验仪器:- 离子交换柱- 离子交换树脂床- 实验台四、实验步骤1. 准备实验材料:称取适量的离子交换树脂,用水冲洗至无悬浮物。
2. 装填离子交换柱:将冲洗干净的离子交换树脂均匀装入离子交换柱中,高度约为20cm。
3. 树脂预处理:用原水冲洗离子交换树脂床,直至出水清澈。
4. 水质软化:将硬水缓慢加入离子交换柱,调节流速,使硬水充分与树脂接触。
5. 出水检测:用pH计和电导率仪检测软化水的pH值和电导率,判断水质软化效果。
6. 树脂再生:将用过的树脂取出,用稀盐酸浸泡,使其恢复交换能力。
7. 树脂反冲洗:用清水冲洗树脂,去除残留的盐酸和杂质。
8. 再次水质软化:重复步骤4,检测水质软化效果。
五、实验结果与分析1. 水质软化效果:经过实验,软化水的pH值和电导率均低于原水,说明水质软化效果良好。
2. 树脂再生效果:经过再生处理,树脂的交换能力得到恢复,说明再生效果良好。
3. 实验数据分析:根据实验数据,计算水质软化率、树脂再生率等指标,分析实验结果。
六、实验结论1. 离子交换法是一种有效的水质软化方法,可以去除水中的钙、镁离子,降低水的硬度。
2. 实验结果表明,采用离子交换法进行水质软化,可以达到良好的效果。
3. 树脂再生处理可以恢复树脂的交换能力,延长树脂的使用寿命。
七、实验讨论1. 影响水质软化效果的因素:实验过程中,发现水质软化效果受原水水质、树脂质量、流速等因素的影响。
硬水软化原理工业硬水是管道中的钙、镁等矿物质会否沉积的工业专有名词,硬度越高,钙质越容易沉淀,造成水管、锅炉等设备阻塞,硬水必须软化吗?如果是工业用的话最好还是软化一下比较好,避免一些安全事故,下面我们一起看一下硬水软化原理吧。
硬水软化主要采用离子交换原理,将源水中的钙,镁离子置换出去,流出的水就是去掉了钙镁离子,硬度极低的软化水。
当离子树脂吸收一定量的钙镁离子后就必须进行再生——用饱和的食盐水浸树脂层,把树脂上的钙镁离子再置换出来,恢复树脂的交换能力,并将废液污水排出下面进一步的研究指出:当某一地区水中的矿物质溶量很高的时候,饮用水将成为人们吸收钙等成分的主要溶于水中的钙是最易为人体吸收的。
2、缺点:(1)和肥皂反应时产生不溶性的沉淀,降低洗涤效果。
(2)工业上,钙盐镁盐的沉淀会造成锅垢,妨碍热传导,严重时还会导致锅炉爆炸。
由于硬水问题,工业上每年因设备、管线的维修和更换要耗资数千万元。
(3)硬水的饮用还会对人体健康与日常生活造成一定的影响。
没有经常饮硬水的人偶尔饮硬水,会造成肠胃功能紊乱,即所谓的“水土不服”;用硬水烹调鱼肉、蔬菜,会因不易煮熟而破坏或降低食物的营养价值;用硬水泡茶会改变茶的色香味而降低其饮用价值;用硬水做豆腐不仅会使产量降低,而且影响豆腐的营养成分。
奶粉冲泡中的使用时,奶粉因为本身含有蛋白质和矿物等营养成分,加上高硬度的硬水的冲泡会加重对宝宝身体的负担。
婴儿的内脏还未发育完全,矿物成分过量摄入可能会引起消化不良,所以矿物成分含量较低的软水更适合冲泡奶粉。
硬水对大家生活的影响:1、镜面布满水渍;2、全棉衣服或毛巾板结僵硬,多次洗涤后颜色黯淡;3、热水器、增湿器等设备管路阻塞、流量减小、寿命缩短;4、洁白的浴缸或座便器等设备泛黄;5、龙头、淋喷头结满水垢、滋生细菌、镀铬的表面水渍斑斑;6、洗澡后皮肤干燥、粗糙、发痒;7、头发干枯、打结,不易梳理,只能用专用洗发膏;8、水质发黄,有铁锈;9、增加了肾胆结石发病几率;10、形成锅垢,阻碍加热器的传热,锅垢太厚时,会使锅炉局部过热,引起锅炉破裂而造成事故,有时还会引起锅炉爆炸;11、弥漫着消毒水的难闻气味;12、指出的冰块颜色混浊,有异味。
硬水软化的原理
硬水是指含有较高浓度钙离子和镁离子的水,这些离子会使水变得难以起泡,
不易溶解肥皂,并且在管道和设备表面留下水垢。
因此,硬水对生活和工业生产都会带来一定的影响。
为了解决这一问题,人们提出了软化水的方法,即通过一定的方式去除水中的钙离子和镁离子,将硬水变为软水。
那么,硬水软化的原理是什么呢?
硬水软化的原理主要有离子交换和化学沉淀两种方式。
首先,我们来说说离子交换。
离子交换是指通过离子交换树脂将水中的钙离子
和镁离子与树脂上的钠离子进行交换,从而软化水质。
通常,离子交换树脂是一种高分子聚合物,具有大量的离子交换基团。
当硬水通过离子交换树脂层时,树脂上的钠离子会与水中的钙离子和镁离子发生置换反应,使得水中的钙和镁被固定在树脂上,而树脂上的钠离子则溶解到水中,从而软化了水质。
这种方法能够有效地去除水中的钙和镁离子,使硬水变为软水。
其次,化学沉淀也是一种常用的硬水软化方法。
化学沉淀是指在水中加入一定
的化学药剂,使得水中的钙离子和镁离子发生沉淀反应,从而去除水中的硬度离子,软化水质。
常用的化学药剂包括氢氧化钠、石灰等。
当这些化学药剂与水中的钙和镁离子发生反应时,会生成相对稳定的沉淀物,从而使水中的硬度离子被去除,水质变软。
总的来说,硬水软化的原理主要是通过离子交换和化学沉淀来去除水中的钙离
子和镁离子,从而软化水质。
这些方法都能有效地将硬水变为软水,解决了硬水给生活和工业生产带来的问题。
在实际应用中,我们可以根据具体情况选择合适的方法进行硬水软化,以保证水质的良好和设备的正常运行。
硬水软化的方法一、软水和硬水:水是日常生活中不可缺少的物质;天然水在长期与空气、岩石和土壤等长期接触,溶解了许多无机盐、有机物等杂质,因而天然水一般均含有杂质;水中溶解的无机盐有钙和镁的酸式碳酸盐、碳酸盐、氯化物、硫酸盐、硝酸盐等;提问一般天然水里含有哪些离子根据水中溶有的钙镁离子的量多少,可以将水进行分类:硬水:含有较多Ca2+、Mg2+离子的水;如:天然水等软水:含有较少Ca2+、Mg2+离子的水;如:雨水,蒸馏水等二、硬水的性质及分类:1、硬水的通性:★肥皂水制备:将中性肥皂削成薄片,取10g溶于 100mL 80%的酒精中,静置数日后,倾出上层清液,再用80%的酒精稀释10倍;★天然水:要先进行检验,如Ca2+、Mg2+离子含量较少,可适当溶进少量的可溶性钙、镁盐,以使与蒸馏水有明显区别;水的硬度:以水中溶有Ca2+、Mg2+离子的多少来衡量;水的硬度是天然水固有的内在特征,不存在没有硬度的天然水;★国际上对水的硬度的表示方法很不统一;我国目前以“德国度”表示;该方法是:将水中的Ca2+、Mg2+离子都看作Ca2+离子,并将其质量折算成CaO的质量,1L 水中含有10mg CaO 称为1度;0 – 4 度很软的水4 – 8 度软水8 – 16 度中硬水16 – 30 度硬水30以上最硬水为保证人们身体健康,我国饮用水的硬度统一规定为不超过25度;2、硬水的分类:由引起硬水的原因不同,硬水可分为:暂时硬水:由钙和镁的碳酸氢盐所引起的硬水硬水永久硬水:由钙的镁的硫酸盐、氯化物等引起的硬水;★天然水大多同时具有暂时硬度和永久硬度.因此,一般所说水的硬度是泛指上述两种硬度的总和;3、暂时硬水的性质:由于暂时硬水是由碳酸氢盐所引起的,因而当暂时硬水受热时会分解而得到相应的沉淀如:CaHCO32 == CaCO3↓ + CO2↑ + H2OMgHCO32 == MgCO3↓ + CO2↑ + H2O但由于氢氧化镁的溶解性比碳酸镁的溶解性要小得多,因而继续加热时,碳酸镁要转化为氢氧化镁:MgCO3 + 2H2O == MgOH2↓ + CO2↑因而长期加热暂时硬水得到的水垢是碳酸钙和氢氧化镁的混合物;利用这个性质可区别暂时硬水与永久硬水;三、硬水的软化:概念:降低水中钙、镁离子的含量,就叫做硬水的软化;软化硬水常用有方法:一加热煮沸法:只能降低水的暂时硬度,不能降低永久硬度;二药剂软化法:石灰纯碱法利用加入药剂的方法来降低水中钙、镁离子的含量;三离子交换法:离子交换剂包括天然或或人造沸石、磺化煤和离子交换树脂等物质;磺化煤使硬水软化的原理:当硬水通过时,硬水里的钙离子和镁离子与磺化煤的钠离子发生离子交换,生成CaR2和MgR2 ,因而实现溶液中的钙、镁离子含量的降低,硬水软化;其方程式为: 2NaR + Ca2+ == CaR2 + 2Na+2NaR + Mg2+ == MgR2 + 2Na+硬水又分为暂时硬水和永久硬水;暂时硬水的硬度是由碳酸氢钙与碳酸氢镁引起的,经煮沸后可被去掉,这种硬度又叫碳酸盐硬度;永久硬水的硬度是由硫酸钙和硫酸镁等盐类物质引起的,经煮沸后不能去除;以上两种硬度合称为总硬度;当水滴在大气中凝聚时,会溶解空气中的二氧化碳形成碳酸;碳酸最终随雨水落到地面上,然后渗过土壤到达岩石层,溶解石灰碳酸钙和碳酸镁产生暂时硬水;一些地区的溶洞和溶洞附近的硬水就是这样形成的;硬水有许多缺点:1.和肥皂反应时产生不溶性的沉淀,降低洗涤效果;利用这点也可以区分硬水和软水2.工业上,钙盐镁盐的沉淀会造成锅垢,妨碍热传导,严重时还会导致锅炉爆炸;由于硬水问题,工业上每年因设备、管线的维修和更换要耗资数千万元;3.硬水的饮用还会对人体健康与日常生活造成一定的影响;没有经常饮硬水的人偶尔饮硬水,会造成肠胃功能紊乱,即所谓的“水土不服”;用硬水烹调鱼肉、蔬菜,会因不易煮熟而破坏或降低食物的营养价值;用硬水泡茶会改变茶的色香味而降低其饮用价值;用硬水做豆腐不仅会使产量降低、而且影响豆腐的营养成分;那么硬水毫无是处了吗不对,否则怎么会有那么多的人买矿泉水喝呢 ;原来钙和镁都是生命必需元素中的宏量金属元素;科学家和医学家们调查发现,人的某些心血管疾病,如高血压和动脉硬化性心脏病的死亡率,与饮水的硬度成反比,水质硬度低,死亡率反而高;其实,长期饮用过硬或者过软的水都不利与人体健康;我国规定:饮用水的硬度不得超过25度 ;硬水经过处理后可以转化为软水;下面介绍硬水软化的三种主要方法:1. 煮沸法只适用于暂时硬水煮沸暂时硬水时的反应:CaHCO32 =CaCO3 ↓+H2O+CO2↑MgHCO32 =MgCO3↓ +H2O+CO2↑由于CaCO3不溶,MgCO3 微溶,所以碳酸镁在进一步加热的条件下还可以与水反应生成更难溶的氢氧化镁:MgCO3 +H2O = MgOH2 ↓+CO2↑由此可见水垢的主要成分为CaCO3和MgOH22. 石灰——纯碱法工业用在这种方法中,暂时硬度加入石灰就可以完全消除,HCO3-都被转化成CO32-;而镁的永久硬度在石灰的作用下会转化为等物质的量的钙的硬度,最后被去除;反应过程中,镁都是以氢氧化镁的形式沉淀,而钙都是以碳酸钙的形式沉淀;Ca2+aq --石灰-苏打法--> CaCO3sMg2+aq--石灰-苏打法--> MgOH2s3. 离子交换法这种方法中用到的离子交换剂,有无机和有机两种;无机离子交换剂,如沸石等;有机离子交换剂包括:碳质离子交换剂——磺化酶,阴阳离子交换树脂等;而且一般的离子交换剂在失效后还可以再生;离子交换软化水的原理水的离子交换软化过程是硬性矿物质,主要是钙和镁被钠交换或取代的过程;这些矿物质性质上是离子的常称作离子化杂质,这意味着它们带有电荷,由于同种电荷相斥,异种电荷相吸,因此有可能产生离子交换;水中的钙、镁离子实际上是溶解的矿石;当水流经岩层和地壤时溶解了钙和镁的沉积物,这种溶解的矿物最终进入到地下水层;当水从地下水层被抽到表面时,水中含有溶解的硬性矿物质,这种水称为硬水;软水器使溶解在水中的钙镁硬性矿物质被软化剂树脂上的软性矿物质钠交换;所有这三种矿物都是叫做阳离子的带正电荷离子;在适当的压力容器中,含硬性矿物的水通过离子交换树脂可发生离子交换反应;在现代的软水器中装有千百万颗微细的聚苯乙烯/二乙烯苯塑料球,所有小球都含有许多吸引正离子的负电荷交换位置;当树脂处在再生状态时,这些负电荷交换位置为带正电荷的钠离子占据;当钙和镁经过树脂贮槽时,它们与树脂小球接触,从交换位置上取代钠离子,从而被除去;鉴于如下两个理由,离子交换是可能的:1. 所有的阳离子并非都有相同强度的正电荷;2. 树脂优先结合带较强电荷的阳离子,钙和镁离子的电荷比钠最离子强,取代钠阳离子,然后向下通过树脂床,流出软水器,这样软水器就送出了“软”水;离子交换树脂是一类具有离子交换功能的高分子材料;在溶液中它能将本身的离子与溶液中的同号离子进行交换;按交换基团性质的不同,离子交换树脂可分为阳离子交换树脂和阴离子交换树脂两类;阳离子交换树脂大都含有磺酸基—SO3H、羧基—COOH或苯酚基—C6H4OH等酸性基团,其中的氢离子能与溶液中的金属离子或其他阳离子进行交换;例如苯乙烯和二乙烯苯的高聚物经磺化处理得到强酸性阳离子交换树脂,其结构式可简单表示为R—SO3H,式中R代表树脂母体,其交换原理为2R—SO3H+Ca2+ R—SO32Ca+2H+这也是硬水软化的原理;阴离子交换树脂含有季胺基-NCH33OH、胺基—NH2或亚胺基—NR′H等碱性基团;它们在水中能生成OH-离子,可与各种阴离子起交换作用,其交换原理为R—NCH33OH+Cl- R—NCH33Cl+OH-由于离子交换作用是可逆的,因此用过的离子交换树脂一般用适当浓度的无机酸或碱进行洗涤,可恢复到原状态而重复使用,这一过程称为再生;阳离子交换树脂可用稀盐酸、稀硫酸等溶液淋洗;阴离子交换树脂可用氢氧化钠等溶液处理,进行再生;离子交换树脂的用途很广,主要用于分离和提纯;例如用于硬水软化和制取去离子水、回收工业废水中的金属、分离稀有金属和贵金属、分离和提纯抗生素等10 硬水及其软化一、软水和硬水水是日常生活和工农业生产不可缺少的物质;水质的好坏对生产和生活影响很大;天然水跟空气、岩石和土壤等长期接触,溶解了许多杂质,如无机盐类、某些可溶性有机物以及气体等;水里溶解的无机盐有钙和镁的酸式碳酸盐、碳酸盐、氯化物、硫酸盐、硝酸盐,等等;也就是说,天然水里一般含有Ca2+、Mg2+等阳离子和这些离子的种类和数量有所不同;例如,溶有二氧化碳的水,遇到主要成分是碳酸钙的岩石时,会使碳酸钙逐渐变成可溶性的碳酸氢钙:CaCO3+CO2+H2O=CaHCO32有的天然水里含Ca2+和Mg2+比较多,在这种水里加入肥皂水,就会发生沉淀;实验2-5 用两个试管分别取蒸馏水、天然水5~6mL,各注入少量肥皂水,振荡;观察发生的现象;通过实验,我们可以看到盛有蒸馏水的试管里泡沫很多,没有沉淀产生;在盛有天然水的试管里泡沫较少,并出现絮状沉淀;这是因为天然水里含有Ca2+或Mg2+,肥皂跟Ca2+或Mg2+起反应以后,生成了不溶于水的物质①;通常把溶有较多量的Ca2+和Mg2+的水,叫做硬水;只溶有少量或不含Ca2+和Mg2+的水,叫做软水;如果水的硬度②是由碳酸氢钙或碳酸氢镁所引起的,这种硬度叫做暂时硬度;具有暂时硬度的水经过煮沸以后,水里所含的碳酸氢钙就分解而生成不溶性的碳酸钙:CaHCO32 CaCO3↓+CO2↑+H2O水里所含的碳酸氢镁先形成难溶于水的碳酸镁沉淀;MgHCO32 MgCO3↓+CO2↑+H2O碳酸镁虽然难溶于水,但它仍有少量能溶解在水里在18℃时,它的溶解度为,相当于110mg/L;因此,当继续加热煮沸时,碳酸镁就跟水发生反应,生成了更难溶的氢氧化镁在18℃时,它的溶解度为,相当于/L;这样,水里溶解的Ca2+和Mg2+就转变成为碳酸钙和氢氧化镁的沉淀,从水里析出,水的硬度就可以降低,从而使硬度高的水得到软化;如果水的硬度是由钙和镁的硫酸盐或氯化物等所引起的,这种硬度叫做永久硬度;永久硬度不能用加热的方法软化;天然水大多同时具有暂时硬度和永久硬度,因此,一般所说水的硬度是泛指上述两种硬度的总和;二、硬水的软化水的硬度高对生活和生产都有危害;洗涤用水如果硬度太高,不仅浪费肥皂,而且衣物也不易洗干净;长期饮用硬度很高或硬度过低的水,都不利于人体的健康;锅炉用水硬度太高,特别是暂时硬度太高,十分有害;因为经过长期烧煮后,水里的钙盐和镁盐会在锅炉内结成锅垢,使锅炉内的金属管道的导热能力大大降低,这不但浪费燃料,而且会使管道局部过热,当超过金属允许的温度时,锅炉管道将变形或损毁,严重时会引起锅炉爆炸事故;很多工业部门,如纺织、印染、造纸、化工等,都要求用软水;因此,对天然水进行处理,以降低或消除它的硬度是很重要的;硬水软化的方法通常有药剂软化法和离子交换法等;这里只简单介绍离子交换法;离子交换法是用离子交换剂①软化水的一种方法;在工业上常用磺化煤NaR做离子交换剂;磺化煤是黑色颗粒状物质,它不溶于酸和碱;这种物质的阳离子会跟溶液里其他物质的阳离子发生离子交换作用;如图2-6所示,在离子交换柱里装有磺化煤;把硬水从离子交换柱的上口注入,使硬水慢慢地流经磺化煤;当硬水通过磺化煤时,硬水里的Ca2+和Mg2+跟磺化煤的Na+起离子交换作用,因而使硬水得到软化,反应可以表示如下:2NaR+Ca2+=CaR2+2Na+2NaR+Mg2+=MgR2+2Na+实验2-6 把实验2-5所用的天然水经离子交换剂软化以后,用试管取5~6mL,注入少量肥皂水,振荡;通过实验,我们可以看到,硬水软化以后,加入肥皂水振荡时,泡沫很多,就没有沉淀产生了;磺化煤的Na+全部为Ca2+和Mg2+所代替后,磺化煤就失去了软化硬水的能力;但是用质量分数为8%~10%氯化钠溶液浸泡,CaR2和MgR2跟Na+就又会发生交换作用,重新生成NaR,从而又恢复了磺化煤软化硬水的能力,这个过程叫做再生;可以表示如下:CaR2+2Na+=2NaR+Ca2+这种软化硬水的方法具有质量高,设备简单,占地面积小,操作方便等优点,因此,目前使用比较普遍;①肥皂的主要成分是硬脂酸钠NaC18H35O2,肥皂跟Ca2+或Mg2+起反应生成的CaC18H35O22或MgC18H35O22是不溶于水的物质;②水的硬度常用一种规定的标准来衡量;通常把1L水里含有10mg CaO或相当于10mg CaO称为 1度以1°表示;水的硬度在8°以下的称为软水;在8°以上的称为硬水;硬度大于30°的是最硬水;①离子交换剂包括天然或人造沸石、磺化煤和离子交换树脂等物质;煮不烂豆子的水这是一个关于硬水和软水来历的故事;美国南北战争期间,有一队北方士兵来到一个泉水淙淙的村庄;因为时间已近中午,他们便就地架起行军锅,挑来了附近的山泉水,烧起饭菜来;就餐时,当他们舀起煮熟的豆子放在嘴里咀嚼时,士兵们发现,这些豆子比平时硬得多,他们责怪炊事员没把豆子煮透;后来,炊事员把豆子又煮了好久,但是吃起来还是一样的硬;奇怪,豆子还是原来的豆子,锅还是原来的锅,难道问题出在水上面的确如此;原来就是水在作怪;从此,人们就把这种特殊的水称为“硬水”,把其他的水则称为“软水”;1.硬水:含有钙盐和镁盐的天然水;通常,地下水如井水、泉水含盐量较大,地面水如河水、湖水含盐量较小;在硬水中,钙、镁可以以碳酸盐、碳酸氢盐、硫酸盐、氯化物和硝酸盐等形式存在;当硬水中钙和镁主要以碳酸氢盐,如CaHCO32、MgHCO32形式存在时,称为暂时硬水,当这种硬水加热煮沸时,碳酸氢盐会分解成碳酸盐而沉淀除去如果硬水中钙和镁主要以硫酸盐、硝酸盐和氯化物等形式存在,则称为永久硬水,它们不能用煮沸的方法除去;硬水中的钙盐和镁盐能与肥皂硬脂酸钠作用,生成不溶性的硬脂酸盐,降低肥皂的去污能力;如果锅炉内使用硬水,当加热时钙盐和镁盐会在锅炉内壁上结成水垢;降低锅炉的热导率,增加能耗,甚至缩短锅炉的使用寿命,有时还会堵塞管道;因此,锅炉用水必须经过软化处理见;硬水中含盐量通常以硬度来表示;硬度单位常用“度”表示,1度相当于每升水中含10mg的CaO,生活饮用水的总硬度要求小于25度;2.软水:只含少量可溶性钙盐和镁盐的天然水,或是经过软化处理的硬水;天然软水一般指江水、河水、湖淡水湖水;经软化处理的硬水指钙盐和镁盐含量降为~50 毫克/升后得到的软化水;虽然煮沸就可以将暂时硬水变为软水,但在工业上若采用此法来处理大量用水,则是极不经济的;软化水的方法有:①石灰 -苏打法 ;先测定水的硬度,然后加入定量的氢氧化钙和碳酸钠,硬水中的钙、镁离子便沉淀析出:CaHCO32+CaOH22CaCO3↓+2H2OMgHCO32+2CaOH2 MgOH2↓+2CaCO3↓+2H2OCaSO4+Na2CO3CaCO3↓+Na2SO4②磷酸盐软水法;对于锅炉用水,可以加入亚磷酸钠NaPO3作为软水剂,它与钙、镁离子形成络合物,在水煮沸时钙、镁不会以沉淀形式析出,从而不会形成水垢;此法不适合于饮用水的软化;③离子交换法;沸石和离子交换剂虽然都不溶于水,但其中的钠离子和氢离子可与硬水中的钙、镁离子发生交换反应,使钙、镁离子被沸石、人造沸石、离子交换剂吸附而被除去;长期使用后失效的沸石和离子交换剂可以通过再生而重复使用,故此法是既经济又先进的软水法;离子交换原理1. 反应过程全自动软水器是运用离子交换的原理,用软水器中的钠离子交换树脂吸附水中的钙、镁离子,释放钠离子,使水质得到软化的工作过程完全自动化的水处理设备,水质软化的反应方程式为:其中以R代表树脂本体2RNa+Ca2+=-R2Ca+2Na+ 2RNa+Mg2+=R2Mg+2Na+吸附钙、镁离子饱和后的树脂经过钠盐溶液的处理,可重新转化为钠型而恢复其交换能力,这一再生过程的反应式为:R2Ca+2NaCl=2RNa+CaCl2 R2Mg+2NaCl=2RNa+MgCl2上述正向和反向离子交换的反复进行,就可使软化水持续不断地产生;离子交换树脂发展离子交换现象早在18世纪中期就为汤普森Thompson所发现;直至1935年亚当斯Aclams和霍姆斯Holmes研究合成了具有离子交换功能的高分子材料,即第一批离子交换树脂——聚酚醛系强酸性阳离子交换树脂和聚苯胺醛系弱碱性阴离子交换树脂;离子交换树脂的大发展主要是在第二次世界大战以后;当时美国和英国一些公司成功地地合成了聚苯乙烯系阳离子交换树脂,在此基础上又陆续开发了交换容量高、物理-化学稳定性好的其他聚苯乙烯系离子树脂,相继又开发了聚丙烯酸系阳离子树脂;20世纪60年代,离子交换树脂的发展又取得了重要突破,美国罗姆-哈斯公司Rohm anes Hass和色可赛思公司success合成了一系列物理结构和过去完全不同的大孔结构离子交换树脂;这类树脂除具有普通离子交换树脂的交换基团外,同时还有像无机和碳质吸附剂及催化剂那样的大孔型毛细孔结构,使离子交换树脂兼具了离子交换和吸附的功能,为离子交换树脂的广泛应用开辟了新的前景;离子交换树脂和它的应用技术的发展一直是相互促进、互相依赖的;承受离子交换树脂的发展,树脂应用技术也在不断改善,开始是间歇式工艺,很快就发展到固定床工艺,20世纪60年代后逆流技术及连续式离子交换工艺,双层床技术等获得了很快的发展,这些新的应用技术和工艺的开发,使离子交换树脂在许多领域的应用更加有效的经济;20世纪70年代后,人们正以极大的兴趣,注意着热再生离子交换技术的发展;离子交换树脂介绍离子交换树脂是一类具有离子交换功能的高分子材料;在溶液中它能将本身的离子与溶液中的同号离子进行交换;按交换基团性质的不同,离子交换树脂可分为阳离子交换树脂和阴离子交换树脂两类;阳离子交换树脂大都含有磺酸基—SO3H、羧基—COOH或苯酚基—C6H4OH等酸性基团,其中的氢离子能与溶液中的金属离子或其他阳离子进行交换;例如苯乙烯和二乙烯苯的高聚物经磺化处理得到强酸性阳离子交换树脂,其结构式可简单表示为R—SO3H,式中R代表树脂母体,其交换原理为2R—SO3H+Ca2+ R—SO32Ca+2H 这也是硬水软化的原理;阴离子交换树脂含有季胺基-NCH33OH、胺基—NH2或亚胺基—NR′H等碱性基团;它们在水中能生成OH-离子,可与各种阴离子起交换作用,其交换原理为R—NCH33OH+Cl- R—NCH33Cl+OH- 由于离子交换作用是可逆的,因此用过的离子交换树脂一般用适当浓度的无机酸或碱进行洗涤,可恢复到原状态而重复使用,这一过程称为再生;阳离子交换树脂可用稀盐酸、稀硫酸等溶液淋洗;阴离子交换树脂可用氢氧化钠等溶液处理,进行再生;离子交换树脂的用途很广,主要用于分离和提纯;例如用于硬水软化和制取去离子水、回收工业废水中的金属、分离稀有金属和贵金属、分离和提纯抗生素等;离子交换树脂的绿色再生工艺离子交换水处理技术经历了百余年的发展历程,至今已成为软化和脱盐处理中占主导地位的水处理方式;离子交换树脂工作失效后能用酸碱盐化学药剂再生后反复使用,这是这种水处理方式的优点,但树脂再生所带来的环境污染又迫切需要解决.作者在研究电去离子EDI工作过程时发现,在EDI净水设备中,在直流电场作用下,水被电离为H+和OH-离子,并被利用来再生填充在其底层的树脂,因此,这部分树脂是不断得到电再生的新鲜树脂,从而,保证出水水质很好;由此联想到,利用EDI 净水设备中这一电再生过程来再生混床中的混合离子交换树脂,结果发明了离子交换树脂电再生方法及装置,开创性地找到了对环境无污染的离子交换树脂绿色再生工艺11、混床树脂电再生为了将EDI净水设备中树脂可自再生的现象利用来再生普通混床树脂,作者设计了一个结构类似于EDI净水设备的树脂体外电再生器,只要源源不断将普通混床中的失效树脂,从原混床中抽出,再从体外电再生器进口送入,在直流电场的作用下,就有再生好的树脂从其出口连续流出;在体外再生器内,进行着树脂的电再生过程原有混床树脂的化学酸碱再生工艺非常复杂,常有分离、再生、混合、清洗等再生步骤;然而,在混床采用电再生时操作就很简单,不必将阴、阳树脂分离,用水力输送法直接将原混床中失效树脂送入体外电再生器,一边将失效树脂送入进行体外电再生,一边又将再生好的树脂送回原混床或其他储器,实现了体外电再生器中树脂的流态化电再生2;清华大学、天津大学、武汉大学和华北电力大学等高等院校与企业合作,组成五个研究团队,验证了树脂电再生的可行性;试验证明,失效树脂经电再生后的再生度可达到与化学法再生相媲美的程度2;2、复床树脂电再生复床是指阳树脂和阴树脂分置于两个设备中,一为阳床,另一为阴床,以区别于这两种树脂混合同置于一个设备中的混床;复床树脂与混床树脂相比,其体外电再生装置的区别在于:复床树脂电再生装置膜对构成中增添了双极膜,这相当于在混床树脂电再生室中间插了双极膜,将其一分为二,一变为复床中阳床树脂电再生室,另一变为复床中阴床树脂电再生室;这时,在直流电场作用下,水电离所产生的H+和OH-离子,分别进入各自的阳、阴离子再生室,与相应的失效树脂发生交换反应,使失效树脂相应转化为H型和OH型,实现电再生;同时,又避免发生对树脂电再生过程有危害的副反应,因为复床位于脱盐系统的前端,失效阳床树脂除了吸着了水中所含的大部分Na+ 离子外,还吸着了水中所含的全部Ca2+ 和Mg2+ 离子,如果将这种树脂送入原来的混床电再生室中,那么电再生时水电离所生成的H+离子,可与树脂上所含Ca2+ 、Mg2+ 和Na+ 离子交换,交换下来的Ca2+ 和Mg2+ 离子就可能与水电离所生成的OH-离子发生反应,生成CaOH2或MgOH2沉淀,覆盖在树脂或膜的表面,堵塞孔道,影响后续的离子迁移、扩散和交换过程,最终使树脂电再生难以持续下去;所谓双极膜是由阴离子交换树脂层、阳离子交换树脂层和中间界面亲水层所组成,在直流电场的作用下,它能将水直接电离为H+和OH-离子,并形成H+和OH-离子彼此反向的离子流;因此,将一张双极膜插在原一个混床树脂再生室中间,就可将其分成复床再生用阴、阳床树脂各自再生的两个电再生室河北建筑科技学院和华北电力大学组成的研究团队,分别进行了利用双极膜的复床树脂电再生试验;试验表明,可分别将阴、阳失效树脂电再生至接近化学再生的程度2;本文作者还发明了一种复床树脂电再生的装置3;3、树脂电再生法与化学再生法的对比评价资源消耗。
硬水软化的方法硬水软化的方法一、软水和硬水:水是日常生活中不可缺少的物质。
天然水在长期与空气、岩石和土壤等长期接触,溶解了许多无机盐、有机物等杂质,因而天然水一般均含有杂质。
(水中溶解的无机盐有钙和镁的酸式碳酸盐、碳酸盐、氯化物、硫酸盐、硝酸盐等)。
(提问) 一般天然水里含有哪些离子?根据水中溶有的钙镁离子的量多少,可以将水进行分类:硬水:含有较多Ca2+、Mg2+离子的水。
(如:天然水等)软水:含有较少Ca2+、Mg2+离子的水。
(如:雨水,蒸馏水等)二、硬水的性质及分类:1、硬水的通性:★肥皂水制备:将中性肥皂削成薄片,取10g溶于 100mL 80%的酒精中,静置数日后,倾出上层清液,再用80%的酒精稀释10倍。
★天然水:要先进行检验,如Ca2+、Mg2+离子含量较少,可适当溶进少量的可溶性钙、镁盐,以使与蒸馏水有明显区别。
水的硬度:以水中溶有Ca2+、Mg2+离子的多少来衡量。
水的硬度是天然水固有的内在特征,不存在没有硬度的天然水。
★国际上对水的硬度的表示方法很不统一。
我国目前以“德国度”表示。
该方法是:将水中的Ca2+、Mg2+离子都看作Ca2+离子,并将其质量折算成CaO 的质量,1L 水中含有10mg CaO 称为1度。
0 – 4 度很软的水4 – 8 度软水8 – 16 度中硬水16 – 30 度硬水30以上最硬水为保证人们身体健康,我国饮用水的硬度统一规定为不超过25度。
2、硬水的分类:由引起硬水的原因不同,硬水可分为:暂时硬水:由钙和镁的碳酸氢盐所引起的硬水硬水永久硬水:由钙的镁的硫酸盐、氯化物等引起的硬水。
★天然水大多同时具有暂时硬度和永久硬度.因此,一般所说水的硬度是泛指上述两种硬度的总和。
3、暂时硬水的性质:由于暂时硬水是由碳酸氢盐所引起的,因而当暂时硬水受热时会分解而得到相应的沉淀如:Ca(HCO3)2 == CaCO3↓ + CO2↑ + H2OMg(HCO3)2 == MgCO3↓ + CO2↑ + H2O但由于氢氧化镁的溶解性比碳酸镁的溶解性要小得多,因而继续加热时,碳酸镁要转化为氢氧化镁:MgCO3 + 2H2O == Mg(OH)2↓ + CO2↑因而长期加热暂时硬水得到的水垢是碳酸钙和氢氧化镁的混合物。