判断复分解反应及其应用
- 格式:doc
- 大小:413.50 KB
- 文档页数:11
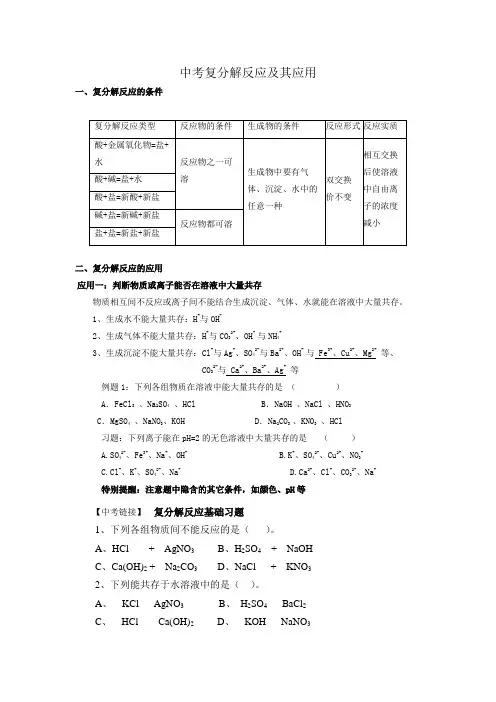
中考复分解反应及其应用一、复分解反应的条件二、复分解反应的应用应用一:判断物质或离子能否在溶液中大量共存物质相互间不反应或离子间不能结合生成沉淀、气体、水就能在溶液中大量共存。
1、生成水不能大量共存:H+与OH-2、生成气体不能大量共存:H+与CO32-、OH- 与NH4+3、生成沉淀不能大量共存:Cl-与Ag+、SO42-与Ba2+、OH- 与 Fe3+、Cu2+、Mg2+等、CO32-与 Ca2+、Ba2+、Ag+等例题1:下列各组物质在溶液中能大量共存的是()A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3C.MgSO4、NaNO3、KOH D.Na2CO3 、KNO3、HCl习题:下列离子能在pH=2的无色溶液中大量共存的是()A.SO42-、Fe3+、Na+、OH-B.K+、SO42-、Cu2+、NO3-C.Cl-、K+、SO42-、Na+D.Ca2+、Cl-、CO32-、Na+特别提醒:注意题中隐含的其它条件,如颜色、pH等【中考链接】复分解反应基础习题1、下列各组物质间不能反应的是()。
A、HCl + AgNO3B、H2SO4+ NaOHC、Ca(OH)2 + Na2CO3D、NaCl + KNO32、下列能共存于水溶液中的是()。
A、KCl AgNO3B、H2SO4BaCl2C、HCl Ca(OH)2D、KOH NaNO33、下列各组物质间,不能发生复分解反应的是()A、碳酸钙和稀盐酸B、氯化铜和稀硫酸C、硝酸钾和氯化钠D、硝酸银和稀盐酸4、下列各组离子在溶液中能大量共存的是()。
A、Ca2+Cl-Na+CO32-B、H+K+NO3-OH-C、H+ Na+SO42- CO32-D、K+Na+NO3-SO42-5、下列各组离子在水中能大量共存的是()A、Cu2+ NO3- Na+OH-B、OH- Na+CO32- H+C、Na+K+CO32- Cl-D、SO42-OH-K+NH4+6、下列各种物质的水溶液混合后不能发生反应的是()。



复分解反应及其应用学习目标:1. 知道复分解反应是有条件的,根据复分解反应的条件判断反应能否发生2. 会书写常见的复分解反应的反应方程式3.能用于解决日常生活相关的一些问题。
核心知识梳理:知识点一:复分解反应1. 复分解反应:两种相互,生成另外两种的反应。
2. 复分解反应的特点:相互,不变。
3. 复分解反应的条件:(1)生成物中必须有或或。
(2)当和;和反应时,反应物必须。
知识点二:常见的复分解反应(1)酸+金属氧化物→盐+H2O(2)酸+碱→盐+H2O(中和反应)(3)酸+盐→新酸+新盐(4)碱+盐→新碱+新盐(5)盐+盐→新盐+新盐知识点三:复分解反应中常见的气体和沉淀1.酸、碱、盐在水中的溶解性口诀:酸全溶,溶碱有四种:钾钠钙钡( )难溶碱:氢氧化铜 ( ) 氢氧化铁 ( ) 氢氧化镁 ( )钾、钠、铵、硝盐全溶氯化物中银不溶氯化银 ( ) ;硫酸盐中钡不溶硫酸钡 ( )碳酸盐中钙和钡碳酸钙()碳酸钡()2.复分解反应中常见沉淀:五白一蓝一红褐白色沉淀:。
蓝色沉淀:。
红褐色沉淀:。
不溶于稀硝酸的白色沉淀是:。
3.复分解反应中常见气体(1)碳酸盐遇酸生成酸性气体。
(2)铵盐与碱溶液生成碱性气体。
聚焦济南直击学考——小组合作学习小组讨论1下列复分解反应能否发生,能反应的写出化学方程式,不反应的说明理由。
(1) CaCO 3+ HCl (2) NH 4NO 3+Ca(OH)2 (3) K 2SO 4+ NaNO 3 (4) Mg(OH)2 + HCl (5) CaCl 2+ AgNO 3 (6) BaCl 2 + NaOH (7) Fe 2O 3 + NaOH (8) Fe 2O 3 + HCl (9)BaSO4 + Na 2CO 3小组讨论2请推断下面各小题中A 、B 、C 分别是什么物质或含有什么离子。
练习:现欲探究一固体混合物A 的成分,已知其中可能含有Mg(OH)2、CuCl 2、NH 4NO 3、 (NH 4)2SO 4、 CuO 五种物质中的两种或多种。


复分解反应的实质和应用一、复分解反应:1、定义:。
2、表达式:。
3、特点:。
4、实质:____________________________________。
5、条件:反应物:。
生成物:_________________________________。
6、溶解性:二、练习:(一)、溶解性的判断:Cu(OH)2MgCl2NH4NO3H2SO4BaCO3Ba(OH)2FeCl3AgNO3CuSO4Na2CO3(二)、判断下列物质在水溶液中能否发生复分解反应?①硝酸钾和氯化钠②硝酸银和氯化钠(三)、能反应的写出方程式,不能反应的说明理由。
1.BaCl2+H2SO4=2.Na2CO3+ 2HCl=3.K2SO4+HCl=4.FeCl3+3NaOH=5.KCl+AgNO3=6.K2SO4+NaNO3=7.Fe(OH)3+3HNO3=8.Ba(OH)2+2HCl=巩固:看看你会了吗?1、判断下列物质在水溶液里能否发生复分解反应:(1)、KNO3+NaCl ( )(2)、KNO3+Na2CO3 ( )(3)、BaCl2+Na2SO4 ( )(4)、FeCl3+NaOH ( )(5)、H2SO4+Zn ( )(6)、CaCO3+HCl ( )宏观:有新物质生成思考:化学反应本质:微观:有新粒子生成问:复分解反应能够发生,我们从微观角度看,新粒子又是怎么生成的呢?例:酸碱中和反应(复分解反应的特例)HCl + NaOH = NaCl + H2O 中和反应的实质:H+ + OH- = H2O练习:请写出下列复分解反应的实质是:FeCl3+3NaOH =Fe(OH)3↓+3NaCl 。
BaCl2+Na2SO4=BaSO4↓+2NaCl 。
Na2CO3+2HCl =2NaCl+H2O+CO2↑。
AgNO3+NaCl =AgCl↓+NaNO3 。
练习2:不能在溶液中大量共存的一组离子是( )(A)、K+、Na+、Mg2+、SO42-(B)、Ca2+、H+、NO3-、Cl-(C)、Mg2+、K+、NO3-、Cl-(D)、H+、SO42-、Ba2+、NO3-练习3:选择适当的化学式填写在横线上(1)__________+Na2CO3=2NaOH+__________+__________(2)BaCl2+__________=BaSO4↓(3)__________+2HCl=__________+_________+CO2↑二、特征离子组合:能相互反应生成水或气体或沉淀的离子组。

复分解反应的应用一、必记基础1. 复分解反应: 化+化化+化2. 复分解反应的类型和条件3. 初中阶段常考的沉淀:白色沉淀:Mg(OH)2、Al(OH)3、CaCO 3、BaCO 3、BaSO 4、AgCl(既不溶于水也不溶于稀硝酸的白色沉淀:BaSO 4、AgCl )蓝色沉淀:Cu(OH)2 红褐色沉淀:Fe(OH)34. 常见有色溶液:Cu 2+:蓝色溶液 Fe 3+:黄色溶液 Fe 2+ : 浅绿色溶液二、复分解反应的应用1. 判断两种化合物是否能发生复分解反应:例:下列各组物质之间,能反应的写出化学方程式:①氯化钠与硝酸银: 。
②氯化钠与硝酸钾: ③氢氧化钠与硝酸: 。
④氢氧化镁和氯化铜:⑤碳酸钡和盐酸: 。
⑥硫酸铵和氢氧化钡:2. 物质间的转化:(1)下列物质间的转化不能由一步反应实现的是( )A CuO →Cu(OH)2B Ca(OH)2→CaCl 2C BaCl 2→Ba(NO 3)2D NaOH →Na 2CO 3(2)下列物质的转变,能通过一步反应实现的是 ( )A Na 2CO 3→NaOHB CaCO 3→Ca(OH)2C NaNO 3→NaC1D FeSO 4→CuSO 4(3)下列物质的转变,不能由一步反应实现的是 ( )A CaO →Ca(OH)2B MgCl 2→Mg(NO 3)2C Na 2SO 4→NaOHD CuO →Cu(OH)2(4)下列物质间的转化能一步反应完成的是( )A Fe 2O 3→Fe(OH)3B Na 2SO 4→NaClC Fe(OH)3→FeCl 3 DCa(OH)2→CaO(5)下列物质的转化,不能由一步反应实现的是 ( )A H 2SO 4→HClB Ca(OH)2→NaOHC CuSO 4→CuD Fe(OH)3→Fe(6)下列物质的转化,不能由一步反应实现的是 ( )ACu →CuCl 2 B Fe 2O 3→Fe C HCl →FeCL 2 D HCl → FeCl 3(7)用锌、氧化锌、碳酸锌、盐酸、氯化铜来制取氯化锌的方法有( )A 二种B 三种C 四种D 五种3. 去除杂质:(1)物理方法除杂: ①溶解过滤; ②结晶例:除去下列物质中所含的少量杂质(括号内为杂质),写出除杂方法:①MnO 2(KCl) ;②CaCl 2(CaCO 3) ; ③KNO 3(NaCl)(2)化学方法除杂:除杂质遵循的原则:①选用的试剂只和杂质反应,且不带入新的杂质; ②杂质与选用的试剂反应生交换成分成的产物要易与被提纯物质分离。

复分解反应的条件及判断
复分解反应是指一种化学反应,其中两种化合物通过交换离子来形成
新的化合物。
在这种反应中,反应物必须符合一定的条件才能进行复
分解反应。
本文将会介绍复分解反应的条件及判断。
一、复分解反应的条件
1. 反应物中必须至少有两种阳离子或两种阴离子。
2. 反应物中必须至少有一种可溶性盐。
3. 反应物中形成的生成物中,必须有至少一种不溶性盐,也就是沉淀。
4. 反应物的可溶性必须大于生成物的可溶性。
5. 反应物的水解度差异大于生成物的水解度差异。
二、复分解反应的判断
1. 反应物状态的改变:反应物状态改变是复分解反应的重要表现之一,较纯净的反应物愈容易发生状态变化。
2. 沉淀的产生:复分解反应中,大部分离子可溶性较好,但生成物会
形成不溶性沉淀,从而导致颜色的变化,这也是复分解反应的标志之一。
3. 电解解离度:复分解反应产生的阳离子和阴离子,其电解离度都应
该比反应物中的离子电解离度小,用电离度比较法可以判断复分解反应是否发生。
4. 杂质对反应的影响:当我们控制好反应条件,但复分解反应始终不发生时,可能是因为加入几分质量的杂质,导致反应受到抑制,不能发生。
以上就是关于复分解反应的条件及判断的介绍,复分解反应在实验上有着重要的应用,通过了解复分解反应的条件和判断,将有助于我们更好地理解这一化学反应的基本原理。


复分解反应的条件及应用教学设计教材和学情分析:《复分解反应的条件及应用》是九年级下册11单元内容,它将酸碱盐的相关知识紧密结合起来,知识点多,关联度大,考题形式多样化,难度较大,在中考中所占的比例是比较大的。
因此,学生在掌握了复分解反应的概念、特点、实质以及反应条件的基础之上,还要会灵活运用,从而克服畏难情绪。
教学重难点:重点:复分解反应的概念、特点、实质、反应条件;难点:复分解反应的综合应用。
教学目标:1.巩固复分解反应的概念、特点、实质;2.了解复分解反应的反应条件;3.会运用复分解反应解决相关问题,培养勤于思考的科学习惯;4.通过复分解反应的特点、条件及应用的学习,让学生懂得从生活走进化学,从化学走向社会的观念。
教学方法:讲授法、讨论法、小组合作法、角色扮演法教学过程:【考点3】判断离子(物质)是否共存:例3:下列各组离子在水溶液中能大量共存的是__________(填字母)。
A.H+、Cu2+、OH-、SO2-4B.B.H+、Ca2+、Cl-、HCO-3C.Ag+、Mg2+、NO-3、Cl-D.D.Al3+、Fe3+、Cl-、NO-3E.Na+、NH+4、SO2-4、OH-F. F.Zn2+、NH+4、NO-3、SO2-4提问:判断离子物质是否共存的方法是什么?教师点播:解题关键……【考点4】除杂问题例4:除去下列括号中的杂质,用化学方程式表示:NaCl(Na2CO3)NaCl(MgCl2)NaOH(Na2CO3)HNO3(H2SO4)提问并讨论:正确的除杂试剂和操作方法是什么?提问:除杂问题解题的技巧是什么?。
复分解反应的类型及用途归纳复分解反应:两种化合物相互交换成分,生成另外两种化合物的反应,叫复分解反应。
AB+CD=AD+CB 反应的条件:生成物中要有气体、沉淀或水生成。
学习复分解反应时,大家往往觉得混乱,理不出头绪,其实,这类反应也有其自身的规律,掌握其类型和注意事项,问题便迎刃而解,初中常见复分解反应类型及用途如下:1、酸+金属氧化物——盐+水如Fe2O3+ 6HCl= 2 FeCl3+3H2O 3H2SO4 + Fe2O3 = Fe2(SO4 )3+ 3H2O(以上两个反应说明:HCl和H2SO4可用于除铁锈)2HCl + CuO = CuCl2 + H2O H2SO4 + CuO=CuSO4+ H2O(以上两个反应都可用于除去Cu粉中混有少量的CuO)2HNO3 + ZnO = Zn(NO3)2 + H2O 2HCl + CaO =CaCl2 + H2O2、酸+碱——盐+水(中和反应)如HCl + NaOH=NaCl+ H2O 2HNO3+Mg(OH)2=Mg(NO3)2 +2 H2O2HCl +Cu(OH)2 = CuCl2+ 2H2O 3 H2SO4 +2Fe(OH)3=Fe2(SO4 )3+ 6H2O3HCl +Al(OH)3 =AlCl3 +3H2O (用Al(OH)3治疗胃酸过多的原理)3、酸+盐――新酸+新盐如HCl + AgNO3=AgCl↓ + HNO3 (用于:检验Cl-;除去HNO3中的HCl)H2SO4+ BaCl2 = BaSO4↓+ 2HCl (用于:检验SO42-;除去HCl中的H2SO4)2HCl + Na2CO3 = 2NaCl +CO2↑+ H2O (用于:a、灭火器反应;b、检验CO32-;c、检验NaOH是否变质(Na2CO3);d、除去NaCl中的Na2CO3)2HCl + CaCO3 = CaCl2+CO2↑+ H2O(用于:a、实验室制CO2;b、除去盛石灰水瓶壁上的白色固体(CaCO3);c、证明CaO中是否含有未完全分解的CaCO3;d、食用墨鱼骨粉(含有CaCO3)补钙的原理)4、碱+盐——新碱+新盐注:反应物必须都溶于水,生成物中必有一种是沉淀或生成氨气如2NaOH + CuSO4 = Cu(OH)2↓+Na2SO4 (现象:蓝色沉淀)3NaOH + FeCl3= Fe(OH)3↓+3NaCl (现象:红褐色沉淀)Ca(OH)2+ Na2CO3= CaCO3 ↓ +2 NaOH(工业制NaOH原理;检验NaOH是否变质(Na2CO3))(NH4)2SO4+2NaOH=Na2SO4+2H2O+NH3↑ (用碱来检验氨态氮肥)5、盐a+盐b——新盐c+新盐d注:反应物必须都溶于水, 生成物中必有一种是沉淀.如NaCl + AgNO3 = AgCl↓+ NaNO3(用于:除去NaNO3中的NaCl)Na2SO4+ BaCl2 = BaSO4↓+2 NaCl(用于:除去NaNO3中的Na2SO4)Na2CO3+ BaCl2 = BaCO3↓2 NaCl(用于:除去NaCl中的Na2CO3)注意;碱+非金属氧化物——盐+水,不属于复分解反应。
复分解反应发生条件及其应用一、复分解反应的条件看生成物是否有沉淀析出、或有气体放出,或有水生成。
例如:1、有沉淀生成:⑴Na2CO3溶液和石灰水反应,生成CaCO3沉淀,同时得到NaOH溶液。
Na2CO3 + Ca(OH)2 = CaCO3↓ + 2NaOH⑵硝酸银溶液能与氯化物的溶液反应,生成不溶于稀硝酸的白色氯化银沉淀。
利用这一反应可以检验溶液中的Cl-离子。
AgNO3 + NaCl = AgCl ↓ + NaNO3⑶氯化钡溶液与硫酸或硫酸盐溶液反应,得到不溶于稀盐酸(或稀硝酸)的硫酸钡(白色)沉淀。
利用这一反应可以检验溶液中的SO42-离子。
BaCl2 + K2SO4 = BaSO4↓+ 2KCl2、有气体放出:碳酸钠溶液和盐酸反应,放出CO2气体,利用这一反应可以检验碳酸盐。
NaCO3 + 2HCl = 2NaCl + 2H2O + CO2↑3、有水生成:盐酸和氢氧化钠溶液发生中和反应,有水生成。
NaOH + HCl = NaCl + H2O二、复分解反应的常见类型:1、酸+碱──盐+水2、酸+盐──新酸+新盐3、碱+盐──新碱+新盐4、盐+盐──新盐+新盐5、酸+金属氧化物──盐+水三、复分解反应的应用应用一:判断物质能否在溶液中共存物质相互间不反应就能在溶液中大量共存。
比如:H+与CO32-、OH-不能共存,OH- 与NH4+、H+、Fe3+、Cu2+不能共存,Ag+与Cl-、OH-不能共存,Ba2+与CO32-、SO42-不能共存。
例题:下列各组物质在溶液中能大量共存的是()A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3C.MgSO4、NaNO3、KOH D.Na2CO3 、KNO3、HCl【分析】此类题目可用排除法来选择。
B组中NaOH和HNO3可以反应,C组中MgSO4和KOH可以反应,D组中Na2CO3 和HCl可以反应,故选A。
应用二、除杂除杂质遵循的原则:选用的试剂只和杂质反应,且不带入新杂质。
1、判断下列复分解反应能否发生,能反应的写出方程式,不能反应的说明理由1、氢氧化钠溶液和硫酸钾溶液2、氢氧化钾溶液和硝酸铜溶液3、硫酸钠溶液和氯化钡溶液4、氯化钠溶液和硝酸银溶液5、硝酸钠溶液和硫酸化钡溶液6、氢氧化钾溶液和稀硫酸7、硝酸钾溶液和氯化钠溶液8、碳酸钠溶液和硝酸钾溶液9、氯化铁溶液和氢氧化钠溶液10、碳酸钙和稀盐酸应用一:判断物质或离子能否在溶液中大量共存物质相互间不反应或离子间不能结合生成沉淀、气体、水就能在溶液中大量共存。
1、生成水不能大量共存:H+与OH-2、生成气体不能大量共存:H+与CO32-、OH- 与NH4+3、生成沉淀不能大量共存:Cl-与Ag+、SO42-与Ba2+、OH- 与Fe3+、Cu2+、Mg2+等、CO32-与Ca2+、Ba2+、Ag+等例题1:下列各组物质在溶液中能大量共存的是()A.FeCl3、Na2SO4、HCl B.NaOH 、NaCl 、HNO3C.MgSO4、NaNO3、KOH D.Na2CO3 、KNO3、HCl特别提醒:注意题中隐含的其它条件,如颜色、pH等【中考链接】1、【08年宿迁】下列离子能在pH=2的无色溶液中大量共存的是()、Fe3+、Na+、OH-+、SO42-、Cu2+、NO3-、K+、SO42-、Na++、Cl-、CO32-、Na+2、【08年苏州】下列各组离子在水溶液中能大量共存的是()+、Ca2+、CO32-、OH- +、SO42-、Cl-、OH-+、H+、Cl-、OH- +、NH4+、NO3-、OH-3、【08年揭阳】下列各组物质,能共同存在于水溶液中的是()、Na2SO4、Ca(OH)2、CuSO4、NaNO3、BaCl2、K2SO4、K2CO3、NaNO3应用二、除杂除杂的方法:①根据溶解性②化学试剂法:将杂质变成气体或沉淀化学试剂法除杂质遵循的原则:选用的试剂只和杂质反应,且不带入新杂质。
例题2:选用何种试剂除去NaNO3溶液中混有的少量Ba(NO3)2杂质【分析】Ba(NO3)2和NaNO3 相比较真正的杂质是Ba2+,只需加入一种试剂既能除去Ba2+,又不带入新的杂质,它就是碳酸钠或者硫酸钠。
例题3:要除去下列四种物质中的少量杂质(括号内的物质为杂质)甲:CaCO3 (Na2CO3) 乙:NaOH (Na2CO3) 丙:KCl (KHCO3) 丁:炭粉(CuO)可选用的试剂及操作方法有:①加适量盐酸,搅拌,过滤;②加适量水,搅拌,过滤;③加适量盐酸,蒸发;④溶解,加适量石灰水,过滤,蒸发。
下列组合正确的是( )(A)甲②,乙④(B)乙③,丙①(C)丙①,丁②(D)丁①,丙③【中考链接】1、【08南通】除去下列物质中所含少量杂质的方法正确的是()2、【08大庆】下表中,除去物质所含杂质的方法正确的是()3、方法均正确的是()D KCl 溶液 氯化钙溶液 加入氯化钙溶液充分反应后过滤例题4:某溶液中存在Mg 2+、Ag +、Ba 2+三种金属离子,现用NaOH 、Na 2CO 3、NaCI 三种溶液使它们分别沉淀并分离出来,要求每次只加一种溶液,滤出一种沉淀,所加溶液顺序正确的是( )(A)Na 2CO 3、NaCI 、NaOH (B)NaOH 、NaCI 、Na 2CO 3(C)NaCI 、NaOH 、 Na 2CO 3 (D)NaCI 、Na 2CO 3、NaOH【中考链接】1、【08黄石】下列物质间的转化只有加入酸才能一步实现的是 ( )→ZnSO 4 →CuCl 2 →CO 2 →BaSO 42、【08青岛】下列各组物质能按照关系图(→表示反应一步完成)相互转化的是 ( )A B C D XNaOH Ca (OH )2 Fe 2O 3 Cu YNaNO 3 CaCl 2 Fe CuO Z Na 2SO 4 CaCO 3 FeCl 2Cu (OH )2 3..A .P →P 2O 5B .CaCO 3→COC .Fe →FeCl 2D .CuO →CuSO 44、【08南通】下列物质的转化能实现的是 ( )HCl Na2CO 3 (OH)2 NaOH Ba(NO 3)2应用四、物质的鉴别例题4:不用其它试剂,用最简捷的方法鉴别①NaOH ② MgSO 4 ③Ba (NO 3)2 ④FeCl 3 ⑤KCl 五种溶液,则被鉴别出来的物质的正确顺序是【分析】此类题目常常有两种解题方法:①从有特殊颜色的物质着手打开解题的入手。
②从和其它物质发生反应的现象最多的物质着手。
本题通过观察可选用方法①,首先通过颜色鉴别出④FeCl 3,继而用FeCl 3鉴别出①NaOH ,然后用NaOH 鉴别出MgSO 4,最后用MgSO 4鉴别出Ba(NO 3)2 。
+NaCl +BaCl 2 +NaOH +BaCO 3【中考链接】1、【06江西】下列各组物质,只用组内溶液相互混合的方法就能鉴别的是( )A .K 2SO 4、BaCl 2、NaNO 3、NaClB .K 2SO 4、BaCl 2、Na 2CO 3、HClC .KOH 、Na 2SO 4、CuSO 4、MgCl 2D .KCl 、AgNO 3、KNO 3、HCl2、【07镇江】现有四组物质的溶液,仅用酚酞试液及同组物质之间相互反应就能鉴别出来的是 ( )A .NaOH Ba (OH )2 HClB .NaOH HCl NaClC .NaOH H C1 HNO 3D .H 2SO 4 NaCl Na 2SO 43、【07泰州】下列各组物质,只需用组内溶液相互混合,就能鉴别出来的是 ( )A .K 2SO 4、BaCl 2、NaNO 3、NaClB .HCl 、Na 2CO 3、BaCl 2、Na 2SO 4C .KOH 、Na 2SO 4、CuSO 4、HClD .KCl 、AgNO 3、KNO 3、NaCl应用五、物质间的推断例题5:a 、b 、c 、d 可能是Na 2CO 3、AgNO 3、BaCl 2、HCl 四种溶液中各一种,把它们两两混合后产生如下现象, a 、b 、c 、d 依次是( ) (A )Na 2CO 3、AgNO 3、HCl 、BaCl 2 (B )AgNO 3、Na 2CO 3、BaCl 2 、HCl(C )HCl 、AgNO 3、BaCl 2、Na 2CO 3(D )BaCl 2、HCl 、Na 2CO 3、AgNO 3【中考链接】 1、右图是常见酸、碱、盐之间的相互转化关系。
(1)写出图中相应物质的化学式:酸 、碱 。
(2)写出图中反应②和④的化学方程式:②④(3)总结化学反应的规律是我们学习化学的方法之一。
请根据上图总结出酸、碱、盐相互反应的规律(写2点) 、 。
2、已知某固体粉末是由NaCl 、Ba(NO 3)2、CuSO 4、Na 2SO 4、Na 2CO 3中的一种或几种组成,取这种粉末加足量的水,振荡后呈浑浊,再加稀盐酸,沉淀不溶解,过滤后得无色滤液,取滤液并滴加AgNO 3溶液产生白色沉淀,对原固体粉末的判断正确的是( )A.可能含CuSO 4和Na 2CO 3a b c d a 一 白↓ 一 ↑ b 白↓ 一 白↓ 白↓ c 白↓白↓B.一定含NaCl,可能含Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3、CuSO 4C.一定含NaCl 、Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3,可能含CuSO 4D.可能含NaCl,一定含Ba(NO 3)2、Na 2SO 4,一定不含Na 2CO 3、CuSO 43、在我州经济大开发的进程中,要坚持开发与环保并重。
某化学课外活动小组在调查一化工厂时发现该厂有甲、乙两个车间,排出的废水澄清透明,经分析分别含有三种不同的离子,共有K +、Ba 2+、Cu 2+、OH -、NO 3-、CO 32- 六种离子。
(1)将甲、乙两车间的废水按适当的比例混合,可以变废为宝,既能使废水中的Ba 2+、Cu 2+、OH -、CO 32- 等离子转化为沉淀除去,又可以用上层清液来浇灌农田。
清液中含有的溶质主要是 (填写物质的化学式)。
(2)已知甲车间废水明显呈碱性,则乙车间废水中含有的阴离子是__________________。
(3)根据以上溶解性表判断,Cu(NO 3)2和Ba(OH)2溶液 (填“能”或“不能”)发生复分解反应。
若能反应写出化学方程式;若不能反应写出理由: 。
4、如图,A 、B 、C 、D 、E 各代表铁、水、二氧化碳、硫酸铜溶液、 氢氧化钡溶液中的一种物质。
常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B 的相对分子质量大于D 。
请填空:(1)写出下列物质的化学式:A ,B ,D 。
(2)相连环物质间发生的反应,没有涉及的基本反应类型是______________________。
5.不用另加其他试剂,用最简捷的方法来鉴别下列五种溶液:①KOH ,②Ba NO ()32,③FeCl 3,④NaCl ,⑤MgSO 4,则被鉴别出来的五种物质的先后顺序是( )A. ③①⑤②④B. ①⑤②④③C. ③①⑤④②D. ⑤②①③④6..现有甲、乙两种溶液,共含有8种离子,分别为H +、Ag +、K +、Ba 2+、OH -、Cl -、NO 3-和CO 32-,且两种溶液里所含的离子各不相同。
已知向甲溶液里滴入紫色石蕊试液,溶液变成蓝色,说明甲溶液呈 (填“酸性”、“碱性”或“中性”),那么乙溶液里含有的4种离子是(填离子符号) 。
7.有一固体混合物,可能含有K 2CO 3、K 2SO 4、CuSO 4、CaCl 2、KNO 3等物质中的一种或几种,将混合物溶于水,得无色溶液,当滴入硝酸钡溶液时,有白色沉淀产生,再加足量的稀硝酸沉淀部分溶解,则该混合物中一定含有____________一定不含有_______________可能含有_____________.练习:一、共存问题1、分别将下列各组物质同时加到水中,能大量共存的是( )、AgNO3、Na2SO4、NaCl、Na2CO3、KNO3、NaOH 、NaCl、KOH2、下列各组物质,能共同存于水溶液中的是( )、Na2SO4、Ca(OH)2、CuSO4、NaNO3、BaCl2、K2SO4、K2CO3、NaNO33、下列各组离子在水溶液中能大量共存的是( )+、Ca2+、CO32—、OH- +、SO42—Cl—、OH-+、H+、Cl—、OH—+、NH4+、NO3-、OH—4、下列离子能在pH=2的无色溶液中大量共存的是( )、Fe3+、Na+、OH-+、SO42-、Cu2+、NO3-、K+、SO42-、Na++、Cl-、CO32-、Na+二、无色透明溶液的判断1、、下列能形成无色透明溶液的一组是()、Na2SO4、Ca(OH)2、CuSO4、NaNO3、BaCl2、KNO3、NaCl、KNO32、分别将下列各组物质同时加到水中,得到无色、透明溶液的是( )A.HNO3、NaCl、K2SO4B.KCl、NaOH、CuSO4C.BaCl2、NaOH、H2SO4D.FeCl3、Na2SO4、KCl3、下列能形成无色透明溶液的一组是()、Na2SO4、Ca(OH)2、CuSO4、NaNO3、BaCl2、KNO3、NaCl、KNO3三、鉴别题1、用一种试剂一次就能将澄清石灰水、氢氧化钠溶液、稀盐酸三种无色溶液区别开来的是( )A.无色酚酞试液B.二氧化碳气体C.碳酸钠溶液D.氯化钡溶液2、、加水能鉴别碳酸钠、碳酸钙、氢氧化钠吗3、现有两瓶失去标签的白色固体,分别是碳酸钠和氢氧化钠。