肿瘤个体化治疗靶标检测
- 格式:ppt
- 大小:8.72 MB
- 文档页数:137

分子病理在肿瘤个体化医疗发展中的地位和作用随着肿瘤个体化医疗的发展,分子病理在其中扮演着重要的角色。
分子病理学是一门研究疾病分子机制的学科,通过研究肿瘤细胞中的分子变化来辅助临床诊断、治疗和预后评估。
下面将就分子病理在肿瘤个体化医疗发展中的地位和作用进行详细阐述。
1. 诊断的重要支撑分子病理的一个主要作用是在疾病诊断中发挥支撑作用。
传统的疾病诊断主要依赖组织形态学和免疫组化等方法,但对于一些肿瘤类型诊断存在困难和歧义。
分子病理学可以通过检测肿瘤细胞内蛋白质、基因、DNA、RNA等分子水平的变化,来准确地鉴别肿瘤类型。
比如在诊断乳腺癌时,HER2基因扩增状态可以通过分子遗传学检测进行确诊。
又如在诊断结直肠癌时,微卫星不稳定性(MSI)是一种常见的遗传变异形式,在病理诊断中进行MSI检测可以更加准确地确定肿瘤的类型。
2. 预后评估的指示器除了在诊断中的应用,分子病理在肿瘤预后评估中也扮演着重要角色。
分子病理指标具有更高的特异性和灵敏度,可以更加准确地评估肿瘤的预后。
一些分子生物学指标,如EGFR基因突变状态是预后评估的重要指示器。
在肺癌治疗中,EGFR突变与预后密切相关,EGFR基因突变的肺癌患者较不突变的患者预后更好。
此外,分子病理学还可以通过分析肿瘤的分子生物学特征,预测肿瘤对不同治疗方法的敏感性和抗药性状况,从而为个体化治疗方案的制定提供支持。
3. 治疗的个体化指导分子病理学的另一个重要作用是在癌症治疗中指导个体化治疗。
肿瘤细胞的分子遗传学变异以及不同变异对药物反应的影响,表明肿瘤治疗必须根据每个患者的具体情况制定个体化的治疗方案。
分子病理检测可以检测药物靶标基因的表达情况,帮助医生确定最佳治疗方案进行个体化治疗。
例如,肿瘤细胞中部分患者存在BRAF基因点突变,针对突变可使用BRAF抑制剂治疗,治疗效果更佳。
此外,分子遗传学检测还可以评估肿瘤对免疫治疗的反应性,为免疫治疗方案制定提供支持。
总之,分子病理在肿瘤个体化医疗中的地位和作用不断彰显。



ddpcr临床应用ddpcr(droplet digital PCR)技术在临床诊断中的应用越来越广泛。
ddpcr是一种高度敏感且准确的分子生物学技术,可以精准定量靶标DNA或RNA的拷贝数目,有助于快速、准确地检测疾病标志物,对疾病诊断、监测和治疗评估具有重要意义。
一、ddpcr技术原理ddpcr技术是在传统PCR技术的基础上发展而来的,其原理是将PCR反应体系分成数万个微小的水滴,每个水滴内包含微量的DNA模板和必需的PCR反应物。
通过荧光探针或SYBR Green等探针标记的方法,可以区分阳性和阴性的PCR反应,从而实现精确计数。
二、ddpcr在临床诊断中的应用1. 突变检测ddpcr可以有效检测肿瘤相关基因的突变情况,包括BRAF、KRAS、EGFR等,为肿瘤个体化治疗提供依据。
通过ddpcr技术,可以快速、灵敏地筛查出突变相关的治疗靶点,为临床医生制定个性化治疗方案提供帮助。
2. 微量RNA检测ddpcr技术对微量RNA(miRNA)的检测非常敏感,可以在临床样本中准确检测到微量miRNA的表达水平。
由于miRNA在多种疾病的发生和发展中发挥着重要作用,因此ddpcr在miRNA的研究和临床诊断中具有不可替代的优势。
3. 液体活检液体活检是近年来备受关注的诊断技术,通过检测血液或其他生物体液中的游离DNA或RNA,可以实现无创、实时监测疾病的变化。
ddpcr技术的高灵敏度和准确性,为液体活检提供了有力的支持,使其在肿瘤早期诊断、监测疗效等方面发挥重要作用。
4. 微生物检测ddpcr技术还可以应用于微生物的检测领域,快速、准确地鉴定病原微生物,为感染性疾病的诊断和治疗提供重要依据。
在医院感染控制、食品安全监测等方面,ddpcr均有广阔的应用前景。
三、ddpcr技术的优势和发展方向ddpcr技术相比传统的real-time PCR技术,在灵敏度、准确性和线性范围等方面均具有优势,尤其适用于检测稀有突变或低拷贝的靶标。

肿瘤个体化治疗检测技术指南(试行)-标准化文件发布号:(9456-EUATWK-MWUB-WUNN-INNUL-DDQTY-KII肿瘤个体化治疗检测技术指南(试行)前言肿瘤的个体化治疗基因检测已在临床广泛应用,实现肿瘤个体化用药基因检测标准化和规范化,是一项意义重大的紧迫任务。
本指南从诊断项目的科学性、医学实验室检测方法的准入、样本采集至检测报告发出的检测流程、实验室质量保证体系四个方面展开了相关论述,使临床医生能够了解所开展检测项目的临床目的、理解检测结果的临床意义及对治疗的作用;医学实验室为患者或临床医护人员提供及时、准确的检验报告,并为其提供与报告相关的咨询服务。
检测技术的标准化和实验室准入及质量保证对临床和医学实验室提出了具体的要求,以最大程度的保证检测结果的准确性。
本指南是参考现行相关的法规和标准以及当前认知水平下制定的,随着法规和标准的不断完善,以及肿瘤个体化治疗靶点基因的不断发现,本技术规范相关内容也将进行适时调整。
本指南起草单位:中国医学科学院肿瘤医院分子肿瘤学国家重点实验室、苏州生物医药创新中心,经国家卫生计生委个体化医学检测技术专家委员会、中国抗癌协会相关专业委员会、中华医学会检验医学分会、中华医学会肿瘤学分会的专家修订。
本指南起草人:詹启敏、曾益新、王珏、姬云、钱海利、李晓燕、孙石磊目录1. 本指南使用范围 (1)2. 简介 (1)3. 标准术语和基因突变命名 (1)3.1标准术语 (1)3.2 基因突变命名 (2)3.3 参考序列 (2)3.4 各类变异 (3)4. 分析前质量保证 (6)4.1 样本类型及获取 (6)4.2 采样质量的评价 (7)4.3 样本采集中的防污染 (8)4.4 样本运送和保存 (8)5.分析中质量保证 (9)5.1 实验室设计要求 (9)5.2 检测方法 (9)5.3 DNA提取方法与质量控制 (17)5.4 RNA提取方法与质量控制 (18)5.5 试剂的选择、储存及使用注意事项 (18)5.6 核酸扩增质量控制 (19)5.7 设备维护和校准 (19)5.8 人员培训 (20)5.9 方法的性能验证 (20)6. 分析后质量保证 (22)6.1 检测结果的记录 (22)6.2 失控结果的记录与分析 (22)6.3 报告及解释 (22)6.4 记录保留 (23)6.5 检测后基因咨询 (23)6.6 样本(及核酸)保留与处理 (23)6.7 检测与临床数据收集与分析 (24)7. 肿瘤个体化医学检测的质量保证 (24)7.1 标准操作程序 (24)7.2 质控品 (24)7.3 室内质量控制 (25)7.4 室间质量评价 (26)7.5 PCR污染控制 (26)附录A:常见的检测项目 (28)A.1 基因突变检测项目 (28)A.2 基因表达检测项目 (39)A.3融合基因检测项目 (43)A.4 基因甲基化检测项目 (45)参考文献: (48)1. 本指南使用范围本指南由国家卫生计生委个体化医学检测技术专家委员会制定,是国家卫生计生委个体化医学检测指南的重要内容,旨在为临床分子检测实验室进行肿瘤个体化用药基因的检测提供指导。

肿瘤靶区名词解释《肿瘤靶区名词解释》肿瘤靶区是指在肿瘤细胞中表达的特定分子或结构,这些分子或结构可以作为靶标,用于指导肿瘤治疗的选择或监测治疗效果。
了解肿瘤靶区的概念和特点对于个体化治疗的设计和实施至关重要。
1. 靶区(Target)在肿瘤学中,靶区是指疾病过程中特定的分子或结构,可以通过特定的靶向药物或治疗策略来影响它们的功能或表达,从而达到治疗肿瘤的目的。
靶区可以是细胞表面的受体、信号通路分子、调控蛋白等。
2. 靶向疗法(Targeted Therapy)靶向疗法是指使用靶向药物作用于肿瘤靶区的一种治疗策略。
与传统的化疗药物相比,靶向疗法可以更精准地选择靶区进行干预,从而减少对正常组织的损伤,并提供更好的治疗效果。
靶向疗法适用于特定的肿瘤类型,需要通过分子生物学或遗传学检测来确定是否适用。
3. 靶标检测(Targeted Testing)靶标检测是指通过检测肿瘤组织或血液中相关基因或蛋白的表达水平,来确定肿瘤是否具备相应的靶区,从而指导靶向疗法的治疗方案。
靶标检测可以通过分子诊断技术,如基因测序、蛋白芯片等方法获得。
4. 个体化治疗(Personalized Medicine)个体化治疗是根据患者的个体特征和肿瘤分子学特征,设计和实施的针对性治疗策略。
个体化治疗的核心是根据病人的基因型、表型和环境因素,为其选择最佳治疗方案,以提高治疗效果和减少不良反应的风险。
5. 靶向药物耐药性(Drug Resistance)靶向药物耐药性是指肿瘤细胞对靶向药物的反应降低或消失的状态。
耐药性是肿瘤治疗中的一个重要问题,其发生机制复杂多样,与靶区本身的变异、信号通路的自适应等因素相关。
研究靶向药物耐药性机制有助于寻找新的治疗策略和提高个体化治疗的效果。
综上所述,《肿瘤靶区名词解释》对于理解和应用肿瘤靶区的概念及相关术语至关重要。
通过了解肿瘤靶区,我们可以更好地指导个体化治疗的设计和执行,提高肿瘤治疗的精准性和疗效。

恶性肿瘤的靶向治疗个体化药物的疗效评估恶性肿瘤是一种严重威胁人类健康的疾病,传统的治疗方法通常包括手术切除、放射治疗和化学治疗。
然而,针对恶性肿瘤的个体化靶向治疗药物的出现,正为患者带来新的希望。
靶向治疗是基于肿瘤细胞与正常细胞在分子水平上的差异,通过干扰异常信号传导通路,对恶性肿瘤进行精准治疗的一种方法。
个体化药物疗效评估的意义在于为患者选择最合适的,对其肿瘤有最佳疗效的靶向药物。
为了评估靶向治疗个体化药物的疗效,需要进行一系列的实验和临床试验。
首先,通过体外细胞实验,可以评估药物对肿瘤细胞的抑制作用。
在体外实验中,研究人员将恶性肿瘤细胞培养于含有不同剂量靶向药物的培养基中,观察药物对细胞的影响,包括细胞增殖、凋亡和转移能力等指标。
这些实验可以初步判断药物对肿瘤细胞的作用程度。
接下来,需要进行动物模型实验。
研究人员会选用与患者的肿瘤类型相似的小鼠模型,并将其注射相应的肿瘤细胞。
随后,将药物通过不同的给药途径(如口服、注射等)给予小鼠,并观察肿瘤的发展情况、体重变化以及整体的生存率等指标。
这些动物实验可以更加真实地模拟人体内的情况,评估药物对肿瘤的控制效果。
除了实验室内的研究,还需要进行临床试验。
这是将药物应用于患者身上的关键一步。
临床试验通过招募一定数量的患者,在治疗前后进行各项指标的监测和评估。
例如,观察患者肿瘤的体积变化、血液中肿瘤标志物的浓度变化以及患者的生存状况等。
通过与传统治疗组进行对比,可以评估靶向治疗个体化药物的疗效。
而在评估靶向治疗个体化药物的疗效时,还需要考虑到患者的基因组特征。
个体化药物评估的关键在于根据患者的遗传背景,选择具体靶向药物。
通过对患者样本的基因测序,可以了解肿瘤相关的基因变异情况,进而判定哪些靶向药物更适合该患者。
基因组学的应用使得靶向治疗的个体化药物评估更加精准和可靠。
总而言之,恶性肿瘤的靶向治疗个体化药物的疗效评估至关重要。
通过体外细胞实验、动物模型实验以及临床试验的综合评估,可以判断个体化药物对肿瘤的疗效。

肿瘤分子诊断与个体化治疗《2012中国肿瘤登记年报》披露,全国每年新发肿瘤病例估计约为312万例,平均每天8550人,全国每分钟有6人被诊断为恶性肿瘤。
我国居民一生罹患癌症的概率为22%。
据统计,全国肿瘤发病率为285.91/10万,发病率无论男女,城市均高于农村。
从年龄段上看,40岁以上年龄组发病率快速升高,80岁年龄组达到最高,城市和农村变化趋势基本相同。
目前,全国恶性肿瘤死亡第1位仍是肺癌,其次为肝癌、胃癌、食管癌和结直肠癌,前10位恶性肿瘤占全部恶性肿瘤84.27%。
男性中发生的主要癌症包括肺癌、肝癌、胃癌、食管癌和结直肠癌;女性中发生的主要癌症包括肺癌、胃癌、肝癌、结直肠癌和乳腺癌。
死亡率最高者男女均为肺癌。
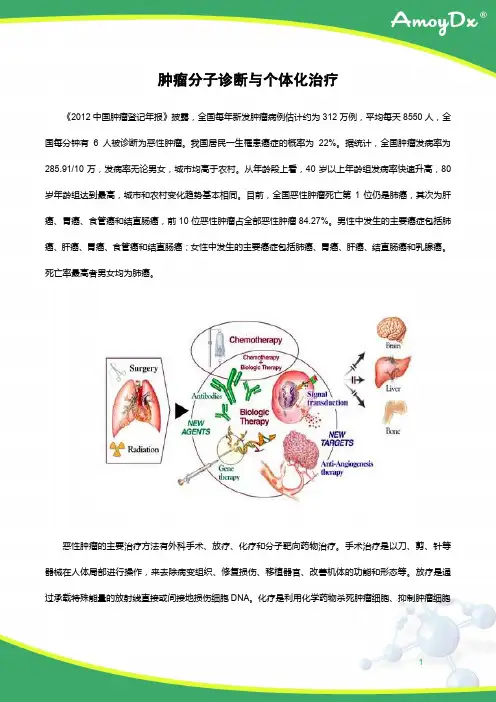
恶性肿瘤的主要治疗方法有外科手术、放疗、化疗和分子靶向药物治疗。
手术治疗是以刀、剪、针等器械在人体局部进行操作,来去除病变组织、修复损伤、移植器官、改善机体的功能和形态等。
放疗是通过承载特殊能量的放射线直接或间接地损伤细胞DNA。
化疗是利用化学药物杀死肿瘤细胞、抑制肿瘤细胞生长繁殖或促进肿瘤细胞分化的一种治疗。
目前,化疗在肿瘤临床治疗中约占70%,特别是对于失去手术指征的晚期癌症病人,化疗更是主要甚至唯一的治疗手段。
随着人类基因组学、药物基因组学及肿瘤分子生物学研究的不断深入和发展,发现了一些关键的蛋白分子,从而以它们为靶点研制出一些分子靶向抗肿瘤药物。
与传统的细胞毒抗肿瘤药不同,它们是特异地作用于与肿瘤发生、扩散、转移相关的蛋白小分子,可以抑制肿瘤细胞增殖。
并且,以其毒副小,选择性高,安全性大、可口服等优点正逐渐成为癌症治疗的主流趋势。
尽管各种治疗手段对于癌症都有一定的抑制效果,但越来越多的临床数据显示,对于同一分期、同一病理类型的患者,即使采用相同的治疗方案,其疗效(如生存期)也存在明显差异,我们将这种差异称为个体化差异。
随着人类基因组计划的完成,人们逐渐意识到:同一类型肿瘤的细胞分子生物学差异可能是导致疾病个体化差异的原因所在。


肿瘤个体化治疗检测技术指南(总40页)-CAL-FENGHAI.-(YICAI)-Company One1-CAL-本页仅作为文档封面,使用请直接删除肿瘤个体化治疗检测技术指南(试行)前言肿瘤的个体化治疗基因检测已在临床广泛应用,实现肿瘤个体化用药基因检测标准化和规范化,是一项意义重大的紧迫任务。
本指南从诊断项目的科学性、医学实验室检测方法的准入、样本采集至检测报告发出的检测流程、实验室质量保证体系四个方面展开了相关论述,使临床医生能够了解所开展检测项目的临床目的、理解检测结果的临床意义及对治疗的作用;医学实验室为患者或临床医护人员提供及时、准确的检验报告,并为其提供与报告相关的咨询服务。
检测技术的标准化和实验室准入及质量保证对临床和医学实验室提出了具体的要求,以最大程度的保证检测结果的准确性。
本指南是参考现行相关的法规和标准以及当前认知水平下制定的,随着法规和标准的不断完善,以及肿瘤个体化治疗靶点基因的不断发现,本技术规范相关内容也将进行适时调整。
本指南起草单位:中国医学科学院肿瘤医院分子肿瘤学国家重点实验室、苏州生物医药创新中心,经国家卫生计生委个体化医学检测技术专家委员会、中国抗癌协会相关专业委员会、中华医学会检验医学分会、中华医学会肿瘤学分会的专家修订。
本指南起草人:詹启敏、曾益新、王珏、姬云、钱海利、李晓燕、孙石磊目录1. 本指南使用范围.................................. 错误!未指定书签。
2. 简介............................................ 错误!未指定书签。
3. 标准术语和基因突变命名.......................... 错误!未指定书签。
3.1标准术语.................................................... 错误!未指定书签。
3.2 基因突变命名 ............................................... 错误!未指定书签。
MCTL 肿瘤分病种的特异性多靶点自体免疫细胞个体化治疗技
术系统
博海生物经过十多年坚持不懈的努力,筛选出各种不同肿瘤的特异性抗原表位肽300 余种,建立了肿瘤分病种(不同类型肿瘤)的特异性DC 集群(多种)靶标技术系统。
制备的特异性多靶点的CTL,已经应用于抗肿瘤临床研究和治疗。
是当今最符合免疫学理论的技术,开创了特异性细胞免疫治疗技术的先河。
不久的将来随着博海生物靶标芯片的上市,将通过提前检测肿瘤患者的有效靶点,为其私人定制只适合患者个体的有效靶标,实现真正的个体化治疗,这一技术的应用将成为肿瘤患者最理想的绿色治疗方法并引领肿瘤分病种靶向治疗进入个体化时代。
肿瘤个体化治疗检测技术指南(试行)前言肿瘤的个体化治疗基因检测已在临床广泛应用,实现肿瘤个体化用药基因检测标准化和规范化,是一项意义重大的紧迫任务。
本指南从诊断项目的科学性、医学实验室检测方法的准入、样本采集至检测报告发出的检测流程、实验室质量保证体系四个方面展开了相关论述,使临床医生能够了解所开展检测项目的临床目的、理解检测结果的临床意义及对治疗的作用;医学实验室为患者或临床医护人员提供及时、准确的检验报告,并为其提供与报告相关的咨询服务。
检测技术的标准化和实验室准入及质量保证对临床和医学实验室提出了具体的要求,以最大程度的保证检测结果的准确性。
本指南是参考现行相关的法规和标准以及当前认知水平下制定的,随着法规和标准的不断完善,以及肿瘤个体化治疗靶点基因的不断发现,本技术规范相关内容也将进行适时调整。
本指南起草单位:中国医学科学院肿瘤医院分子肿瘤学国家重点实验室、苏州生物医药创新中心,经国家卫生计生委个体化医学检测技术专家委员会、中国抗癌协会相关专业委员会、中华医学会检验医学分会、中华医学会肿瘤学分会的专家修订。
本指南起草人:詹启敏、曾益新、王珏、姬云、钱海利、李晓燕、孙石磊目录肿瘤个体化治疗检测技术指南 (1)(试行)前言 (1)1. 本指南使用范围 (3)2. 简介 (3)3. 标准术语和基因突变命名 (3)标准术语 (3)基因突变命名 (4)参考序列 (4)各类变异 (5)4. 分析前质量保证 (7)样本类型及获取 (7)采样质量的评价 (8)样本采集中的防污染 (9)样本运送和保存 (9)5.分析中质量保证 (9)实验室设计要求 (9)检测方法 (10)DNA提取方法与质量控制 (16)RNA提取方法与质量控制 (17)试剂的选择、储存及使用注意事项 (18)核酸扩增质量控制 (18)人员培训 (19)方法的性能验证 (19)6. 分析后质量保证 (21)检测结果的记录 (21)失控结果的记录与分析 (21)报告及解释 (21)记录保留 (22)检测后基因咨询 (22)样本(及核酸)保留与处理 (22)检测与临床数据收集与分析 (22)7. 肿瘤个体化治疗检测的质量保证 (23)标准操作程序 (23)质控品 (23)室内质量控制 (24)室间质量评价 (25)PCR污染控制 (25)附录A:常见的检测项目 (26)基因突变检测项目 (26)A.1.1 EGFR基因突变检测 (26)A.1.2 KRAS基因突变检测 (27)A.1.3 BRAF基因突变检测 (29)A.1.4 C-KIT基因突变检测 (31)A.1.5 PDGFRA基因 (34)基因表达检测项目 (35)融合基因检测项目 (38)A.3.1 EML4-ALK融合基因检测项目 (38)基因甲基化检测项目 (40)A.4.1 MGMT基因甲基化检测 (40)1. 本指南使用范围本指南由国家卫生计生委个体化医学检测技术专家委员会制定,是国家卫生计生委个体化医学检测指南的重要内容,旨在为临床分子检测实验室进行肿瘤个体化用药基因的检测提供指导。
药物治疗策略与个体化治疗的研究随着医学科技的不断进步,药物治疗策略和个体化治疗在临床应用中扮演着重要的角色。
本文将探讨药物治疗策略与个体化治疗的研究进展和应用价值。
一、药物治疗策略的研究药物治疗策略的研究旨在优化药物的应用方式和剂量选择,以提高治疗效果和减少不良反应。
其中,以下几种策略备受关注:1.1 药物联合治疗药物联合治疗是指将两个或多个药物同时应用于患者,以达到更好的治疗效果。
例如,抗生素联合应用可有效预防细菌耐药性的发展,并提高治疗成功率。
同时,药物联合治疗也能够减少单一药物所引起的不良反应,提高患者的生活质量。
1.2 个体化用药个体化用药是根据患者的个体差异和病情特点,为其设计出最适合的药物治疗方案。
通过基因测序、代谢功能检测等手段,可以获得患者与药物相互作用的信息,进而进行药物剂量的调整和选择。
这种个体化的治疗方法能够提高药物疗效,降低不良反应的风险。
1.3 药物剂型的改进药物剂型的改进是指通过研发新的药物给药形式,以提高药物的生物利用度和控释效果。
例如,传统的口服药物剂型可能会受到胃酸的破坏,而延缓释放剂型则可以减缓药物的血药浓度曲线,提高药物的疗效和患者的依从性。
二、个体化治疗的研究个体化治疗是根据患者的遗传背景、生理状态和疾病特点,为其制定出最适合的治疗方案。
具体而言,个体化治疗涵盖以下几个方面的研究:2.1 靶向治疗靶向治疗是指根据患者肿瘤的具体变异情况,选择特定的靶标药物进行治疗。
通过分子靶向药物的应用,可以抑制肿瘤细胞的生长和扩散,从而提高治疗效果。
例如,HER2阳性乳腺癌患者可以接受HER2抗体药物治疗,有效延长患者的生存期。
2.2 基因检测基因检测是通过检测患者的基因变异情况,为其提供个体化的治疗方案。
例如,在肺癌治疗中,EGFR基因突变阳性的患者可以接受靶向药物治疗,而含有ALK变异的患者可以选择ALK抑制剂进行治疗。
这种个体化治疗方法能够提高治疗效果和生活质量。
2.3 肿瘤免疫治疗肿瘤免疫治疗是指通过激活患者自身的免疫系统来抗击肿瘤细胞。