工艺用水日常监测管理规程
- 格式:doc
- 大小:53.00 KB
- 文档页数:3

1.目的加强对工艺用水质量的管理,确保工艺用水的制备和使用不对医疗器械产品质量造成影响。
2.范围适用于本公司工艺用水的制备、检测、使用和设备维护。
3.职责3.1.设备工程部负责工艺用水设备的维修。
3.2.生产部负责工艺用水的制备、使用及设备保养与维护。
3.3.质保部3.3.1.负责工艺用水的取样、检测。
3.3.2.监督本规程的执行情况。
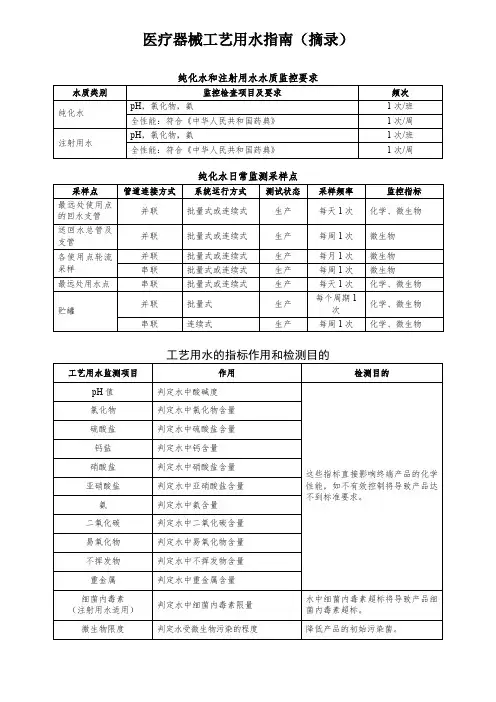
4.规程4.1.定义工艺用水是医疗器械产品实现过程中使用或接触的水的总称,以饮用水为源水,主要包括符合《中华人民共和国药典》规定的纯化水、注射用水和灭菌注射用水,还包括体外诊断试剂用纯化水、血液透析及相关治疗用水、分析实验室用水等。
工艺用水主要用于:可作为产品的组成成分;可用于试剂的配制;可用于零部件、半成品或外协件、成品、包装材料的清洁;可用于产品的检验;可用于洁净环境的清洁;可用于洁净室(区)内直接接触产品的工装、工位器具、设施设备的清洁;可用于洁净室(区)内工作服及人员的清洁等。
4.2.工艺用水的分类根据《无菌医疗器具生产管理规范》YY0033-2000以及我公司生产的产品需要,我公司的工艺用水分为饮用水和纯化水两种。
4.3.工艺用水的水质要求4.3.1.饮用水应符合《生活饮用水卫生标准》GB5749-2006的要求。
4.3.2.纯化水应符合《中国药典》(2015版)中纯化水的有关规定。
4.4.工艺用水的用途(具体见产品工艺规程)4.4.1.饮用水:非洁净区所有生产工序用水、制备纯化水的水源。
4.4.2.纯化水:洁净区内设备、工装、工位器具、工作服的清洗;清洗液、消毒液和试剂的配制用水。
4.5.工艺用水的制备或来源4.5.1.饮用水:直接取自城市自来水供水管网。
4.5.2.纯化水:以饮用水为原水,经过二级反渗透方法去除水中杂质、离子、悬浮物等后得到的符合标准要求的水。
4.6.工艺用水设备要求4.6.1.工艺用水处理设备及其输送系统的设计、安装和维护应能确保生产用水达到设定的质量标准。

工艺用水质量监控管理规程目的:建立一个生产用水质量监控管理规程依据:国家药品监督管理局《药品生产质量管理规范》应用范围:生产班组配制用水及各种设备的清洗用水责任人:制水岗操作工、化验员内容:1.水源:饮用水每年由卫生防疫站检测一次。
3.纯化水系统监控3.1.制水工序操作工每隔2小时检测一次性状(无色澄清液体,无臭;无味)及电导率(检测点为总送和三个回水口),当性状或电导率不符合规定要求时,则停止出水。
3.2.QC对储罐每周全检一次,送水总管、回水管每周检测一次微生物。
3.3.经QC检验合格后,发放检验合格报告单给制水岗。
如检验不合格,及时通知制水班组停止制水。
3.4.纯化水制备48小时后未使用完,由制水岗将剩余的水全部放掉。
4.注射用水系统监控4.1.制水工序操作工每隔一小时检测一次性状(无色澄明液体,无臭;无味)及电导率,当性状或电导率不符合规定要求时,则停止出水。
4.2.注射用水采用现用现制备的原则。
制备后由QC人员到生产线的注射用水使用点进行取样检验(化验项目:化测、细菌内毒素、总有机碳、电导率),检验合格后,通知制水岗并将检验报告发放给生产车间。
如检验不合格,及时通知制水班组停止供水。
4.3.注射用水制备后80℃以上保温储存,65℃以上保温循环。
4.4.生产线停产不到一个月时,注射用水继续制水,循环10分钟后由QC对总送水口每周检测一次微生物。
4.5.生产线停产一个月以上,注射用水停止制水,再开工前连续做21天验证(化验项目:化测、细菌内毒素、微生物),验证合格后方可进行生产。
4.6.注射用水制备后循环24小时未使用完,由制水岗将剩余的水全部放掉。

工艺用水管理制度一、总则为了加强对工艺用水的管理,减少水资源浪费,提高水资源利用率,保护环境,根据国家相关法律法规,制定本管理制度。
二、适用范围本管理制度适用于工艺用水的管理,包括采水、利用和排放等环节。
三、管理责任1. 工艺用水管理委员会设立工艺用水管理委员会,负责制定和组织实施工艺用水管理制度,并定期对工艺用水管理做出评估和改进。
2. 工艺用水管理人员各部门应根据需要设立工艺用水管理岗位,负责日常的工艺用水管理工作,包括水资源的采集、利用和排放等。
3. 全员参与全体员工都应当认识到工艺用水的重要性,积极参与工艺用水的管理工作。
四、工艺用水管理制度1. 工艺用水采集管理(1)采水许可对于需要采集地下水或其他水资源的企业,应事先向当地相关部门申请采水许可。
(2)水源保护对采集地下水或其他水资源的企业,应制定水源保护措施,遵守环保法规,防止水源受到污染。
2. 工艺用水利用管理(1)合理利用企业应倡导合理利用工艺用水,优化水资源的利用方式,提高水资源利用效率。
(2)节水措施对于水资源利用频繁的企业,应当采取相应的节水措施,包括使用节水设备、开展节水宣传等。
3. 工艺用水排放管理(1)排放标准企业排放的工艺用水应当符合国家相关排放标准,不得污染环境。
(2)排放监测企业应当定期对工艺用水排放进行监测,确保排放水质符合相关标准。
4. 废水处理对于产生的废水,企业应当按照要求进行处理,降低废水对环境的影响。
五、监督检查1. 定期检查工艺用水管理委员会应当定期对工艺用水管理工作进行检查,发现问题及时整改。
2. 外部监督企业应当接受相关环保部门的监督和检查,如发现问题需及时整改。
六、奖惩措施1. 奖励制度对于在工艺用水管理中表现突出的员工和部门,应当给予相应的奖励。
2. 处罚制度对于违反工艺用水管理规定的行为,应当给予相应的处罚,包括警告、罚款等。
七、培训教育企业应当定期开展工艺用水管理培训,提高员工对工艺用水管理的认识和技能。

工艺用水管理制度1.目的建立工艺用水日常监测和使用管理程序,确保工艺用水水质符合生产工艺要求。
2.范围适用于公司内部的饮用水、纯化水和注射用水的管理。
3.职责3.1.生产部:负责工艺用水的日常管理。
3.2.质量管理部:负责工艺用水的检测。
4.定义4.1.工艺用水:在医疗器械生产过程中,根据不同的工序及质量要求,所用的不同要求的水的总称。
4.2.饮用水:符合 GB5749-2006《生活饮用水卫生标准》。
4.3.纯化水:饮用水经蒸馏法、离子交换法、反渗透法或其他适宜的方法制得的制药用水,不含任何添加剂。
4.4.注射用水:指纯化水经蒸馏所得的水。
5.内容5.1.公司生产及辅助过程中所用工艺用水种类有饮用水、纯化水和注射用水;其主要用途如下:5.1.1.饮用水:主要用于纯化水制水的原水、非洁净区域的清洁,物品的清洗。
5.1.2.纯化水:主要用于与人体组织接触的部件的末道清洗、工位器具末道清洁、与产品质量有关工作台面、生产设备末道清洁、消毒液配制、试剂配制。
5.1.3.注射用水:直接或间接接触心血管系统、淋巴系统或脑脊髓液或药液的无菌医疗器械,末道清洗应使用注射用水;有热原要求并在万级下的局部百级洁净室(区)内进行无菌加工使用的无菌工作服的末道清洗用水应为注射用水。
5.2.纯化水及注射用水应根据生产需要制备,并填写《纯化水设备运行记录》、《注射用水设备运行记录》。
5.3.纯化水及注射用水的清洗消毒和维护保养的制备方法详见《纯化水设备操作规程》、《注射用水设备操作规程》。
5.4.纯化水、注射用水检测,检测频次、内容及方法见《纯化水检测操作规程》、《注射用水检测操作规程》。
5.5.制水设备和贮罐输送管道的材质不得对产品产生污染和影响,安装方式应避免死角盲端,以避免微生物的滋生。
5.6.应当对纯化水制水系统、注射用水制水系统的安装、运行和性能进行验证和确认,确保制水系统持续、稳定生产出符合标准、适合产品生产要求的工艺用水,并保存制水系统验证计划、方案、报告以及再确认等相关技术资料。

工艺用水监控标准管理规程编制/日期:审核/日期:批准/日期:1、目的:建立工艺用水的质量监控规程,保证水处理系统能够连续稳定地生产出质量合格的工艺用水。
2、适用范围:饮用水、纯化水、注射用水。
3、责任者:质量部、生产部、各制水部门对本标准的实施负责。
4、管理规程4.1 取样容器的准备和要求4.1.1 所有的取样容器均需清洁处理:取样用的三角瓶或玻璃瓶应先放置于重铬酸钾硫酸清洁液中浸泡后、再用自来水多次冲洗干净后、最后用注射用水反复冲洗,用牛皮纸扎口或其它适当的包装包好,烘干后备用。
4.1.2 洁净室用水点取样的容器要经过热压灭菌处理后方可带入。
4.1.3 用于盛装做细菌内毒素检查水样的容器,要做除菌除热原处理。
4.2 取样方法4.2.1 每次取样前,必须开启一段时间出水口(放流3~5分钟),将管内部分水放出,冲洗出水口,且保持该流速进行取样。
4.2.2 取样时,用被取样的水质先冲洗容器2~3次,将冲洗液倒出后,再盛装水样。
4.2.3水样取好后要立即封口,防止污染,贴上标识并及时送至QC实验室检测(TOC应立即完成检测)。
4.3 饮用水4.3.1 饮用水来自于乐平市自来水公司提供的饮用水。
4.3.2 取样与检验:每半年由乐平市卫生防疫站取样进行全检,每月质量部按企业内控标准检验一次。
4.3.3 取样量:样品数量为(2500ml+500ml)3000ml。
4.4 纯化水取样4.4.1 取样与检验:纯化水制水工序每运行2小时抽查一次,检测氨、pH、电导率、易氧化物项目。
每周对制水点、总送水、总回水、贮罐取样一次由质量部做全检;其它各用水点每月取样一次检验微生物指标,并确保每周有一个用水点同时检验相关化学指标。
4.4.2 取样量:每点全检1000ml,其中化学指标检验900 ml、微生物指标检验100ml。
4.5 注射用水取样4.5.1 取样与检验:注射用水制水工序每运行2小时抽查一次,检测pH、电导率项目。

1目的明确工艺用水的分类、用途,建立工艺用水质量监测的频次、检验项目、取样点的设置及异常情况的处理,保证工艺用水质量和产品质量,避免工艺用水对药品造成污染。
2范围适用于工厂工艺用水(包括饮用水、纯化水和注射用水)的质量管理。
3责任纯水制备人员、质检部、品保部、设备部对本规程的实施负责。
4内容4.1定义:药品生产过程中使用的水称为工艺用水。
本公司工艺用水包括生活饮用水、纯化水、注射用水。
4.1.1生活饮用水:指经净化、消毒的自来水。
4.1.2纯化水:以符合GB5749-2006生活饮用水卫生标准的自来水为水源,经蒸馏或离子交换或反渗透等处理制得的水。
本公司采用的是二级反渗透装置制备的纯化水。
4.1.3注射用水4.2工艺用水的水质要求与用途见下表4.3水质监控4.3.1对工艺用水的水质要定期检查,由QC负责人指定专门人员进行工艺用水取样和检测,一旦发现异常情况,应立即报告品质保障部和生产部,及时纠偏,确保生产用水符合既定的质量标准。
4.3.2生活饮用水的质量监控说明: 1.生活饮用水由质量检验部每一个月按照公司的《生活饮用水质量标准》全检一次。
2.生活饮用水每半年由品质保障部取样送疾病预防控制中心全检一次。
4.3.3纯化水的质量监控说明:电导率为在线检测,岗位人员应每两个小时观察并记录一次。
4.3.4注射用水的质量监控4.4纠偏措施4.4.1微生物警戒限度和纠偏限度a)警戒限度:指微生物某一污染水平(一般为纠偏限度的一半),监控结果超过它时,表明制药用水系统有偏离正常运行条件的趋势;b)纠偏限度:指微生物污染的某一限度,监控结果超过此限度时,表明制药用水系统已经偏离正常运行条件,应当采取纠偏措施,使系统回到正常的运行状态。
4.4.2纯化水4.4.2.1微生物项目1)纯化水纠偏限度设为100CFU/ml,警戒限度为50CFU/ml。
2)微生物项目监测结果超过警戒限度,应及时通知工程部门加以注意,必要时可采取一定措施;3)微生物项目监测结果超过纠偏限度a.应立即通知生产部各使用点停止用水,并通知工程部门,工程部应检查纯化水运行记录,分析原因,同时由QC人员进行复检;b.若复检仍不合格,则相应的纯化水不得用于生产,并调查原因,采取相应纠偏措施(必要时对水系统进行消毒),直至合格为止;c.微生物限度超标时,密切注意相关批次产品的微生物检验结果,必要时可扩大取样量以供检验。

规范工艺用水的质量监控及使用管理,确保生产用水符合GMP要求,保证药品质量。
2范围适用于本公司饮用水、纯化水、注射用水(含纯蒸汽)的质量管理。
3职责各车间制水岗位、质量管理部、生产制造部遵照执行。
4内容4.1水源饮用水水源:城市生活饮用水供水纯化水水源:饮用水经软化注射用水水源:纯化水纯蒸汽水源:纯化水4.2工艺用水质量标准4.2.1饮用水应符合国家《生活饮用水卫生标准》的要求。
4.2.2纯化水、注射用水(含纯蒸汽)应符合《中华人民共和国药典》的质量标准。
4.3在线检测4.3.1纯化水制水操作人员每2小时检测一次储罐及混床出口或EDI出水口(二、三车间纯化水间)的电导率、酸碱度,每天检测一次总送水口和总回水口的电导率、酸碱度,每周检测一次活性炭过滤器后取样口的余氯,并做记录。
二、三车间纯化水间在线监测原水电导率和温度、一级淡水电导率和温度、二级淡水电导率和温度、EDI出水电阻和温度,储罐总回水电导率。
制水在岗人员每2小时记录一次总回水流量和循环泵运行状况。
4.3.2注射用水a.制水岗位每2小时检测一次储罐及蒸馏水机出口的电导率、pH值,每天检测一次总送水口和总回水口的电导率、pH值,并做记录。
一车间注射用水系统无TOC在线监测,加测易氧化物项,在线监测总回水口的温度;二、三车间注射用水系统在线监测原料水(纯化水)的电导率、温度,蒸馏水机出口的电导率和温度、总回水口的TOC、温度、电导率。
制水在岗人员每2小时记录一次总回水流量和循环泵运行状况。
b.QA在当日用水前检测配液用水点细菌内毒素。
4.3.3纯蒸汽在线监测原料水(纯化水)的电导率,纯蒸汽发生器的电导率和温度。
制水岗位每天开机、关机时各一次检测纯蒸汽冷凝水的易氧化物和pH值。
4.4QC检测4.4.1检测周期4.4.1.1饮用水供水站要每月一次提供饮用水全检合格报告,至少每年送疾病控制中心全检1次。
4.4.1.2纯化水总送水口、总回水口、储罐每周全检一次;各用水点轮流取样,但需保证每个用水点每四周全检不少于一次。
XX制药GMP管理文件一、目的:为规定工艺用水的管理内容和要求,特制定本制度。
二、适用范围:适用于本公司生产用水。
三、责任者:质检员。
四、正文:本公司工艺用水分为饮用水、纯化水和注射用水。
1 饮用水1.1饮用水由赤峰龙泉自来水有限责任公司提供。
1.2每半年由水厂提供《水质检验报告单》复印件一份。
1.3检验结果符合国家标准规定的饮用水,可选择作为本公司生产用水。
1.4在生产过程中如发现水有异常,应立即停止生产,并在3小时内将水样送达元宝山区防疫站,进行检验。
若无问题,方可继续进行生产。
1.5饮用水可作为药材净制时的漂洗、制药用具的粗洗用水,除另有规定外,可作为药材的提取溶剂。
2 纯化水2.1纯化水由公司自制。
2.2公司自制的纯化水由化验室进行日常监测和定期检测,按《中国兽药典2005版》执行。
2.3质检部定期检测取样需在制水器出水1小时后,总出水口、总回水口、生产车间各用水点取样进行全检。
2.4正常工作期间由车间制水员每2小时监测电导率、pH值。
2.5监测的结果正常方可使用,如出现不合格项目,应停止生产,设备进行维护和维修等,直到达到要求为止。
2.6纯化水可作为配制普通药物制剂用的溶剂或试验用水,可作为重要注射液、滴眼剂等灭菌制剂所用药材的提取溶剂,内服、外用制剂配制用溶剂或稀释剂,非灭菌制剂用器具的精洗用水。
也可作非灭菌制剂所用药材的提取溶剂。
纯化水不得用于注射剂的配制与稀释。
2.7纯化水用作溶剂、稀释剂或精洗用水时,一般应临用前制备。
3 注射用水3.1注射用水由公司自制。
3.2公司自制的注射用水由化验室进行定期检测,按《中国兽药典2005版》执行。
3.3质检部定期检测取样需在制水器出水1小时后,总出水口、总回水口、生产车间各用水点取样进行全检。
3.4监测的结果正常方可使用,如出现不合格项目,应停止生产,设备进行维护和维修等,直到达到要求为止。
3.5注射用水可作为配制注射剂的溶剂或稀释剂及注射用容器的精洗,也可作为滴眼剂配制的溶剂。

文件制修订记录1.0目的建立工艺用水使用的管理规程,根据车间工艺用水要求,合理安排生产用水。
2.0范围生产过程各岗位工艺用水。
3.0责任技术开发部、质量管理部监控员、车间主任、车间技术员、操作工4.0内容4.1制药工艺用水包括饮用水、纯化水。
天然水不得作为制药工艺用水。
4.2饮用水:为天然水经净化处理所得的水,其质量符合国家标准GB5749-85《生活饮用水卫生标准》。
饮用水使用范围为:4.2.1制药器具的粗洗用水;4.2.2中药材前处理用水;4.2.3净药材水提用水;4.2.4房间清洁卫生;设备、容器初洗用水;4.2.5制备纯化水水源;4.2.6工作衣洗涤。
4.3纯化水:为饮用水经蒸馏法、离子交换法、反渗透法或其它适宜方法制备的制药用水。
其质量符合中国药典2000年版二部纯化水项下的规定,纯化水不得含任何附加剂。
纯化水的使用范围为:4.3.1非无菌药品配料工艺用水及直接接触药品的设备、器具和包装材料最后一次洗涤用水;设备及容器具精洗;4.3.2口服液的配液;4.3.3生产过程各工序用水,必须根据水质标准及用途项下规定,有检测中心的检验合格报告书方可使用,并将报告书贴于制水岗位生产记录的后面备查。
4.3.3.1按“纯化水监测标准操作规程”,检测中心每周对纯化水按药典项下进行全检,并有检验报告书。
4.3.3.2纯化水岗位每2小时监测一次电导率,并有记录。
4.3.3.3制水岗位的监测记录及检验报告书,月底交车间技术员统一保存。
5.0记录纯化水生产运行记录纯化水管路(储罐)清洗、消毒记录纯化水站设备再生记录纯化水生产监测记录制水系统储罐清洁记录反渗透膜停运保护记录。

工艺用水系统管理规程
目的:保证所用工艺用水质量合格。
范围:生产过程中配料、检验等所用的水,包括饮用水、纯化水。
责任者:制水岗位操作工,岗位操作工。
规程:
1.生产中所用一切工艺用水必须是经检验合格的。
2.工艺用水管不得和非生活用水管网直接连接,并避免穿过垃圾堆或毒物污染
区,保证水的流动。
3.生产中用纯化水的检测根据《纯化水系统操作规程》中的相关内容进行。
4.纯化水储存不得超过24小时。
5.节假日或停产三天以上的,开工前必须取样检查,质量合格后才能使用。
6.每天第一次用水前,应安全开启龙头30秒钟弃去存水。
7.生产中根据工艺规程规定,各工序工艺用水规定如下:
7.1非洁净区地面清洁用水为饮用水,生产用器具初次洗用饮用水,消毒后冲洗用水为纯化水,生产器具使用前清洗用水为纯化水,生产中提取用水为纯化水7.2洁净区用清洁用水及生产用水为纯化水。
7.3生产中用于冷却用水统一为饮用水。
7.4清洁剂与消毒剂的配制用水统一为饮用水。
工艺用水管理制度一、制度目的为了规范企业内部工艺用水的使用和管理,确保工艺生产的安全、高效和环保,订立此工艺用水管理制度。
本制度旨在明确工艺用水的使用标准和管理要求,提升企业管理水平,保障生产运营的顺利进行。
二、适用范围本制度适用于企业内部全部工艺过程中所使用的水,包含但不限于生产、制造、冷却、清洁等环节。
三、管理标准1.工艺用水必需符合相关法律法规和国家标准的要求,如《工业用水质量标准》《工业节水技术规范》等。
2.工艺用水必需经过预处理,实现以下标准要求:–杂质:悬浮物不得超出X毫克/升,沉积物不得超出X毫克/升。
–pH值:应保持在X~X范围内。
–溶解氧:不得低于X毫克/升。
–总硬度:不得超出X毫克/升。
3.工艺用水的循环利用应得到充分推广和应用。
各部门应定期检查和维护循环水设备,确保其良好运行,并对循环水水质进行必需的监测。
4.工艺用水的消耗量应通过节水措施进行合理掌控。
各部门应订立并执行节水方案,通过改进工艺流程、优化设备和加强员工培训等方式,实现工艺用水的节省和高效利用。
5.厂区内的工艺用水设施和设备应依照相关标准进行设计、建设和改造。
定期进行巡检和维护,及时发现和处理设备故障,确保设施和设备的正常运行。
6.工艺用水的储存和运输必需符合安全可靠的要求,避开水质的污染和变质。
7.工艺用水使用过程中应设置明显可见的标识,标明用途和水质要求,以便相关人员正确使用。
8.排放废水必需符合相关环境保护要求,严禁直接将含有有毒有害物质的废水排入周边环境。
四、考核标准1.每个部门应设置特地的工艺用水管理岗位,负责工艺用水的日常监管和管理,保障工艺用水符合管理标准。
2.每季度,对工艺用水进行一次综合性的审核,包含水质检测、设备情形、节水措施执行情况等。
3.每年,组织开展一次工艺用水管理的绩效评估,评估内容包含工艺用水的节省效果、循环利用情况、设施设备维护情况等。
4.对于未实现管理标准的部门,将进行责任追究,依据实在情况进行相应的矫正措施和惩罚。
工艺用水监控管理规程目的:建立工艺用水监控管理规程,以确保生产用水符合工艺要求适用范围:饮用水、纯化水、责任人:质量管理部主任、水系统管理员、检验员内容:2 饮用水2.1 以地下深井水为水源时,水井周围20-30米的范围内不得设置渗水厕所、渗水坑、垃圾堆或废渣堆,不得铺设污水渠道,不得从事破坏深层土层的活动。
2.2 生活饮用水的管网不得与非生活用水的管网直接连接。
2.3 凡与水接触的给水设备管道所用材料均不得污染水质。
2.4 生活饮用水的总给水由质管部每月检查一次性状、PH值、硬度及微生物限度等。
每年委托当地防疫部门全项检一次。
3 纯化水3.1 纯化水必须以饮用水为水源制备。
3.2 取样部位:纯化水贮水罐、总送水口、总回水口。
3.3、检测周期:3.3.1在线监测:纯水站制水人员应对纯化水贮罐、总进水口、总回水口每2小时检测一次,检测项目:酸碱度、电导率。
3.3.2质量管理部应对纯化水贮罐、总送水口、总回水口进行卫生学监控检测,每月不得少于2次,各使用点每月轮流取样一次,进行卫生学监控检测。
3.3.3质量管理部应对纯化水贮罐、总送水口、总回水口每月进行全检一次,合格的及时发放合格报告书;如发现不合格,应发放不合格报告书,并通知制水单位立即整改,直至检测合格。
3.4 纯化水贮罐用不锈钢制作,贮罐必须密闭,排气口应安装孔径为0.22μm 疏水性呼吸器。
3.5 贮存和输送纯化水的设备、管道每两周用臭氧消毒一次,每次60分钟,每个使用点冲洗5分钟;系统正常运行一班后,车间对消毒后的水质进行申验,质管部对水质微生物限度项目进行检验并出具检验报告书。
3.6 纯化水的贮存期限:储存期限为24小时,超期应放掉并清洗容器管道。
3.7 纯化水系统的验证周期(1)纯化水系统新建或改建后必须验证。
检验全部合格后方准许投入使用。
(2)生产使用部门停工一段时间后或送水线路改造后,在开工前应连续做三周的水质检测,检测合格后方可使用。
目的:建立生产工艺用水制备、检测、储存、使用的管理规程。
范围:适用于全公司工艺用水的监护管理。
责任:制水工、生产设备管理人员、QC人员遵守本规程;QA负责监督本规程的实施。
内容:1 本规程所指的工艺用水指纯化水。
2生产中所需纯化水用于生产用容器具、工作服洗涤;原辅料配制以及培养基和化学试剂的配制。
其标准符合中国药典纯化水质量标准。
3生产中纯化水的制备应严格按照制备流程图和纯化水系统标准操作规程操作。
4纯化水在室温下用不锈钢罐密闭贮存,贮存时间不超过24小时。
在输送新鲜用水之前,应将贮罐与管路中存水排净,各使用点使用前至少排放10秒钟。
5纯化水的监控:5.1纯化水设备在开启半个小时之后在总出水口、贮水罐、总回水口和车间取样检测一次,常规检测项目为pH值和电导率,合格后开始送水,每日上午和下午各抽样检验一次,并做好检测记录。
5.2质管部每月对纯化水取样一次按周期检验项目做检测,总出水口总回水口每次都应取样,各使用点轮流取样,但在两个月之内每个使用点至少应取样一次。
5.3新安装的纯化水管道或贮罐应经过钝化后后方可使用。
规定的所有项目检测合格后准许供应和使用,如不合格应立即停止供应或停止使用。
新安装的制水设备投入供水前,应连续制水,由质管部连续三周取样检测,并经验证合格后方可投入使用。
5.4节假日或者生产部门停工一段时间,再开工前应重新取样检测。
6纯化水制备时,操作人员应严格按照标准操作规程操作,特别注意水的流向。
阀门开启与关闭应严格控制,否则会引起管道破裂及柱子漏水。
7 纯化水系统应保持设备清洁,特别是管道没有灰尘、油污,无细菌微生物滋生。
8纯化水在停水罐的保存时间不应超过24小时,纯化水保存于45℃以下不结冰状态。
气温低于0℃时,不宜长时间停机,应经常运转设备,以免冻伤。
9操作人员如遇故障应立即停止造水并报告,避免造成损失。
10纯化水设备的维护、保养每半年进行一次,主要是视情况对过滤系统进行必要的清洁、更换。
工艺用水管理制度
引言
工业生产中的许多工艺都需要用到大量的水资源。
因此,科学合理地管理工艺用水对于保证生产的正常进行、节约资源以及环境保护至关重要。
本文档旨在制定一套完整的工艺用水管理制度,以确保工艺用水的高效利用和合理管理。
一、管理目标
1. 提高工艺用水的利用效率,促进资源节约;
2. 确保工艺用水的质量达到相关标准;
3. 减少对环境的负面影响并确保符合法律法规的要求。
二、管理要求
1. 工艺用水计量与监测
为了实现对工艺用水的有效管理,必须对用水量进行计量和监测。
每个工艺流程都应安装并定期检查工艺用水计量仪表,确保数
据的准确性和可靠性。
对于超出标准用水量的情况,需要进行进一
步的分析和调整。
2. 工艺用水节约措施
为了节约工艺用水,应采取以下措施:
- 定期检查和维护用水设备,确保其正常运行;
- 优化工艺流程,减少用水量;
- 使用高效节水器材和设备;
- 采用循环和回收利用工艺用水的方法;
- 定期开展员工培训,提高节水意识。
3. 工艺用水质量控制
为了确保工艺用水的质量,必须建立相应的监测系统和控制措施:
- 定期对工艺用水进行取样并进行分析,确保水质符合相关标准;
- 对有可能影响工艺用水质量的因素,如水源水质、管网卫生等进行定期检查和维护;。
1.目的:建立工艺用水质量监控标准操作规程,保证原水、工艺用水质量,最终保证产品质量合格。
2.范围:供水站及生产车间用水的检查。
3.责任:生产技术科、质量管理科、设备工程科、中心化验室、供水站负责本规程的实施。
4.内容:本公司的工艺用水按水质可分为饮用水,纯化水。
根据水质不同,生产过程中要求不同的监护规定。
4.1 饮用水:◆水质应符合国家饮用水质量标准(GB 5749-2006)《生活饮用水卫生标准》。
◆饮用水每年送检一次,采样点为原水储罐或水井口。
4.2 纯化水:◆纯化水水源应为合格的饮用水。
◆纯化水参照纯化水的标准每周进行一次全项检验,结果应符合规定,并应有检验记录和检验报告书。
◆如果纯化水系统停运,使用前应对各采样点进行采样,所有检测结果合格后才能使用。
◆ 日常检测:纯化水制备过程中,操作工至少每2小时对电导率、酸碱度检测一次。
检测结果应符合规定,并应有监测记录。
质量保证员不定期抽查。
◆ 定期检测:QC 检验室每周对总进水口、纯化水储罐和总回水口全检一次,其余各用水点每周至少全检两个,一个月内各使用点全部全检完,具体取样点如下:◆ 各水质监测点采样后应在各取样容器上贴上标签,标签内容包括:取样点编码、取样时间、样品种类(饮用水、纯化水)、检测项目、取样人。
采样后应及时送检并确保在8小时内处理样品。
编码规则如下: 20XX XX XX 0X2011100101.4.3 生产工艺用水系统安装竣工使用前应全面验证。
合格后方可使用。
并且在运行一定周期后要进行再验证。
4.4 工艺用水微生物警戒限度和纠偏限度标准及处理措施。
工艺用水管理规程1.目的建立工艺用水的管理标准,确保工艺用水的质量。
2.范围工艺用水的管理。
3.责任制水部门负责人、操作人员。
4. 内容4.1 水质标准及用途4.1.1 饮用水标准:要符合国家饮用水的质量标准。
用途有日常生活用水、药物粗洗、药物粗提,仪器洗涤等。
4.1.2 纯化水标准:参照执行《中国药典》2000年版中纯化水的质量标准。
纯化水用于口服制剂的配液、10万级和30万级药物的溶媒等。
4.2 工艺用水的贮存纯化水应在常温下用不锈钢或无毒耐腐蚀贮罐贮存。
4.3 工艺用水的监控工艺用水应随时监控。
正常连续生产时,采取定期监测的方法进行监控,特殊情况下应先报请质量检验部作全项检验合格,并出具合格的《工艺用水检验报告单》后方可提供生产使用。
4.3.1 正常连续生产使用情况下水质可定期检查、监测,详见下表:4.3.2殊情况系指更新制水设备后,设备大、中修及停产三天以上(含三天)再生产前,或水源受到意外污染而进行了特殊清洁消毒后。
4.3.3不合格水的处理4.3.4如检测水质不合格时,应立即通知各用水点停止使用,并查找原因确定整改方法,直至水质合格。
同时制定预防措施,并由检验处组织生产处各部门对产品拿出处理意见。
4.4纯化水的制备4.4.1 纯化水的制备由制水操作员按纯化水制备操作规程制备水并完成输水任务。
4.4.2 制水操作员在纯化水制备过程中不得擅自离开岗位,应认真负责,按规定每两时检测一次水质(电导率),并做好记录。
发现问题时要立即停止供水,并报告上一级领导。
4.4.3 纯化水的输送由制水操作员按纯化水输送系统操作规程输送。
4.4.4 纯化水制备和输送操作完后应按纯化水系统清洗消毒规程清洁设备和场地。
工艺用水日常监测管理制度
目的:建立工艺用水日常监测管理规程。
范围:适用于全厂工艺用水的监测管理。
责任:制水操作人、QA人员负责实施,QA经理负责管理。
内容:
1.工艺用水主要是指制药生产中配料等工序、原料药的精制、洗涤等工序所用的水。
按水质不同分为饮用水、纯化水、注射用水等。
各工序应根据工艺要求制订各自的用水标准,按规定使用。
2.制药工艺用水要求:
类别用途水质要求
(1)非无菌药品的设备、器具应符合卫生部生活用水
饮用水和包装材料的初洗标准GB5749—2006(2)制备纯水的水源
(1)非无菌药品的配料洗瓶
(2)注射剂、无菌冲洗剂瓶子
初洗
纯化水(3)非无菌原料药的精制应符合企业内控标准及现行版中国(4)制备注射用水的水源,药典标准
(用于配料和原料药精制时,
应控制杂菌数)
注射(1)胶塞、浓稀配罐、玻瓶精洗、容
器具及管道的最终洗涤;应符合企业内控标准及现行版(2)注射剂的配制;中国药典标准
用水
3.工艺用水的制备
3.1饮用水是自来水公司供应的符合饮用水标准的自来水。
3.2纯化水是以饮用水为水源,经蒸馏法、离子交换法,反渗透法后或其他适宜的方法制得供药用的水,不含任何附加剂。
3.3 注射用水以纯化水为水源,经蒸馏法制备的制药用水;水质必须符合《中国药典》
注射用水质量标准。
4.质量保证部QA人员应对生产工艺用水进行质量监控。
4.1一般饮用水需当地环保局或防疫站一年全检一次。
每月对饮用水应按内控标准自
行检测一次。
4.2制水的部门要及时请验。
4.3由QA人员负责每周对纯化水进行取样,并将样品送交质量控制部QC人员进行全
项检测。
4.4工艺用水的检测项目及检测频次:
4.4.1纯化水
每2个小时检测一次:由操作工对总出水口进行电导率、酸碱度检测。
每周一次:由质量保证部对总送水口、总回水口、贮水罐及各使用点取样,送QC 人员全检,按《中国药典》2010年版二部“纯化水”项下项目检验。
细菌、霉菌和酵母菌总数:应符合有关规定。
4.4.2 QA人员每日检查一次制水记录,检查操作工是否按操作规程对水质进行检测。
发现水质异常立即采取措施。
4.4.3注射用水
4.4.3.1水质维护:
A.注射用水系统必须经过验证合格后,方可投入使用,并进行严格的变更控制。
B.注射用水系统正常情况每年进行一次再验证,以确认验证状态是否漂移。
C.注射用水系统操作人员进行定期的清洗、消毒及设备维护等操作。
4.4.3.2水质监测:
A 注射用水日常监测频次及检查项目:
B.质量检验中心将检验结果交质量保证部,并由质量保证部在各用水点贴绿色合格
签,方可使用。
C.检验结果不符合要求,立即执行“偏差管理制度”,由质量保证部会同相关部门
进行调查处理,包括已用于生产的产品、清洗的设备等方面。
D. 岗位检测,由制水工每天取样二次检查PH值、电导率。
4.4.3.3注射用水使用:
注射用水仅限于万级更衣前的洗手,万级区域的洁具、生产工具、设备及厂房的最终清洁,大输液玻瓶和胶塞精洗、配料。
每天生产过程中必须保证注射用水处于65℃以上动态循环。
不循环时应80℃以上保温。
使用人员必须在注射用水检测合格情况下方可使用并在使用前先排放15秒。
并由质量管理主管对使用情况进行监督、检查。
4.5注射用水、纯化水贮水罐、输水管每连续生产一周及停产72小时以上,进行一次纯
蒸汽在线清洗、消毒。
在线清洗消毒方法见“注射用水贮水罐、输水管清洗消毒标准操作程序”和“纯化水贮水罐、输水管清洗消毒标准操作程序”。
4.6 对纯化水和注射用水的微生物限度制定警戒限度和纠偏限度,纯化水大于
30CFU/100ml警戒限;大于50CFU/ml纠偏限;注射用水大于5CFU/100ml警戒限;
大于8CFU/100ml纠偏限。
发现超过纠偏限度的应按《偏差处理标准管理规程》进行偏差调查、分析、评估与处理。
4.7新安装的制水设备投入供水前,应连续制水。
经验证合格后,方准许投入使用。
4.8节假日或生产使用部门停工一段时间后,再开工应取样做全部项目检测。
4.9发生异常情况或不合格应增加检测频次。
5.工艺用水的取样
5.1取样点多选在经常使用的出水口。
5.2取样时按规定的频次,规定时间进行取样。
5.3取样时应注意无菌操作,避免对备取样品的污染。
执行批准的取样管理规程。