抗超氧阴离子自由基及生产超氧阴离子自由基测试盒
- 格式:pdf
- 大小:130.52 KB
- 文档页数:3
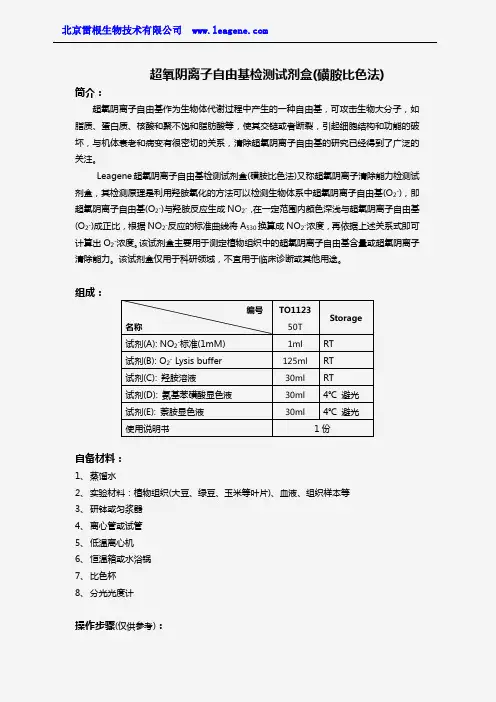
超氧阴离子自由基检测试剂盒(磺胺比色法)简介:超氧阴离子自由基作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,使其交链或者断裂,引起细胞结构和功能的破坏,与机体衰老和病变有很密切的关系,清除超氧阴离子自由基的研究已经得到了广泛的关注。
Leagene 超氧阴离子自由基检测试剂盒(磺胺比色法)又称超氧阴离子清除能力检测试剂盒,其检测原理是利用羟胺氧化的方法可以检测生物体系中超氧阴离子自由基(O 2-),即超氧阴离子自由基(O 2-)与羟胺反应生成NO 2-,在一定范围内颜色深浅与超氧阴离子自由基(O 2-)成正比,根据NO 2-反应的标准曲线将A 530换算成NO 2-浓度,再依据上述关系式即可计算出O 2-浓度。
该试剂盒主要用于测定植物组织中的超氧阴离子自由基含量或超氧阴离子清除能力。
该试剂盒仅用于科研领域,不宜用于临床诊断或其他用途。
组成:自备材料:1、 蒸馏水2、 实验材料:植物组织(大豆、绿豆、玉米等叶片)、血液、组织样本等3、 研钵或匀浆器4、 离心管或试管5、 低温离心机6、 恒温箱或水浴锅7、 比色杯8、 分光光度计操作步骤(仅供参考):编号 名称TO1123 50T Storage试剂(A): NO 2-标准(1mM) 1ml RT 试剂(B): O 2- Lysis buffer 125ml RT 试剂(C): 羟胺溶液30ml RT 试剂(D): 氨基苯磺酸显色液 30ml 4℃ 避光 试剂(E): 萘胺显色液 30ml4℃ 避光 使用说明书1份1、准备样品:①植物样品:取正常或逆境下的新鲜植物组织,清洗干净,擦干,切碎,迅速称取预冷的O2-Lysis buffer后冰浴条件下匀浆或研磨,4℃离心,上清液即为超氧阴离子自由基提取液,4℃保存备用。
②血浆、血清和尿液样品:血浆、血清按照常规方法制备后可以直接用于本试剂盒的测定,4℃保存,用于超氧阴离子自由基的检测。

第1页,共2页超氧阴离子清除能力检测试剂盒说明书可见分光光度法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
货号:BC1410规格:50T/48S 产品内容:提取液:液体50mL×1瓶,4℃保存。
试剂一:液体2mL×1瓶,4℃避光保存。
试剂二:粉剂×1瓶,4℃避光保存。
临用前加8mL蒸馏水充分溶解。
试剂三:液体10mL×1瓶,4℃保存。
试剂四:液体10mL×1瓶,4℃避光保存。
试剂五:液体10mL×1瓶,4℃避光保存。
产品说明:超氧阴离子自由基作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,使其交链或者断裂,引起细胞结构和功能的破坏,与机体衰老和病变有很密切的关系,清除超氧阴离子自由基的研究已经得到了广泛的关注。
AP-TEMED系统产生超氧阴离子,与盐酸羟胺反应生成NO 2-,NO 2-与对氨基苯磺酸和α-萘胺的作用生成红色的偶氮化合物,在530nm处有特征吸收峰,样品对超氧阴离子的清除能力与530nm的吸光值呈负相关。
自备实验用品及仪器:天平、研钵、低温离心机、可见分光光度计/酶标仪、1ml玻璃比色皿、恒温水浴锅。
操作步骤:一、样品处理1.组织:按照质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g,加入1mL提取液)加入提取液,冰浴匀浆后于4℃,10000g离心10min,取上清置于冰上待测。
2.细胞:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后4℃,10000g离心10min,取上清置于冰上待测。
3.培养液或其它液体:直接检测。
4.粉剂药物可配制成相同浓度,比如1mg/mL。
二、测定操作空白管对照管测定管试剂一(μL)404040试剂二(μL)160160H2O(μL)260100充分混匀,25℃反应1min样品(μL)100试剂三(μL)200200200充分混匀,37℃反应30min试剂四(μL)200200200试剂五(μL)200200200充分混匀,37℃显色20min,于1ml玻璃比色皿,以空白管调零,在530nm处测定对照管和测定管的吸光值,分别记为A对照管和A测定管。

超氧阴离子自由基的测定试剂:65 mmol·l-1PBS(磷酸盐缓冲液),10mmol·l-1盐酸羟胺,α-萘胺,乙醚,黄胺,三氯甲烷材料:叶片第一步:称取2 g叶片,加入6ml 65 mmol·l-1 PBS(pH 7.8),冰浴研磨成匀浆,四层纱布过滤,5000×g(4℃)离心10 min。
取1 ml上清液加入0.9 ml上述缓冲液和0.1 ml 10mmol·l-1盐酸羟胺,25 ℃温浴20 min。
然后取0.5 mlα-萘胺,于25℃下反应20 min,最后加入同体积乙醚充分摇动,1 500×g离心5 min,取粉红色水相测定530 nm的OD值。
同时做NO2-标准曲线,将[NO2-]乘以2得[O2-·],结果以O2-·nmol·min-1·mg-1protein 表示。
第二步:实验组空白调零组PBS0.50.5盐酸羟胺0.10.1摇匀,25℃水浴加热10min实验组空白调零组提取液0.50PBS00.5摇匀,37℃水浴加热20min实验组空白调零组黄胺11α-萘胺10.5摇匀,37℃水浴加热20min实验组空白调零组三氯甲烷33↓10000r/min 离心 3min(5000r/min 6min)↓取粉色水相(上层)测定A530A530(NO2¯)=A(实验组)—A(空白调零组)备注:提取液:称取2 g叶片,加入6ml 65 mmol·l-1 PBS(pH 7.8),冰浴研磨成匀浆,四层纱布过滤,5000×g(4℃)离心10 min,收集得到的上清液。

超氧自由基阴离子啥是超氧阴离子?超氧阴离子自由基作为生物体代谢过程中产生的一种自由基,可攻击生物大分子,如脂质、蛋白质、核酸和聚不饱和脂肪酸等,使其交链或者断裂,引起细胞结构和功能的破坏,与机体衰老和病变有很密切的关系,清除超氧阴离子自由基的研究已经得到了广泛的关注。
人体内有一定数量的存在,不发生化学变化对人体无害,但与羟基(-OH)结合后的产物会导致细胞DNA损坏,破坏人类机体功能。
它是怎样产生的?需氧生物体内氧分子作为最重要的电子受体在物质代谢过程中被还原成水:O2+4e→2H2O,如此利用的氧约占组织耗氧总量的95%,其余5%的氧在还原过程中由于接受电子数目不等可以形成多种性质活泼的活性氧。
氧分子受单一电子还原的产物称为超氧阴离子O2+e→O2。
O2是阴离子,又是自由基,性质活泼,具有很强的氧化性和还原性,既是氧化剂,又是还原剂,过量生成可致组织损伤。
在体内主要通过超氧歧化酶清除。
由于超氧阴离子自由基与衰老和各种疾病密切相关,因此测量超氧阴离子自由基的清除能力具有重要意义。
常见的原则如下:1. 邻苯三酚法:在弱碱性条件下,邻苯三酚能发生自氧化反应,生成超氧阴离子,和有色中间产物,该中间产物在320nm 处有一特征吸收峰。
在初试阶段,中间产物的量与时间成线性关系。
当加入超氧阴离子清除剂时,它能迅速与超氧阴离子反应,从而阻止中间产物的积累,使溶液在320nm处光吸收减弱。
故可以通过测定A320值来评价清除剂对超氧阴离子的清除作用。
2. AP-TEMED 系统产生超氧阴离子,与盐酸羟胺反应生成 NO2-,NO2-与对氨基苯磺酸和α-萘胺的作用生成红色的偶氮化合物,在 530nm 处有特征吸收峰,样品对超氧阴离子的清除能力与 530nm 的吸光值呈负相关。
3.模拟体内黄嘌呤与黄嘌呤氧化酶的反应体系,产生超氧阴离子,加入电子传递物质和显色剂,使反应体系呈现紫红色,用分光光度计测定其吸光度。
当该物质为抗超氧阴离子时,能抑制反应,减少超氧阴离子,所以颜色变浅。
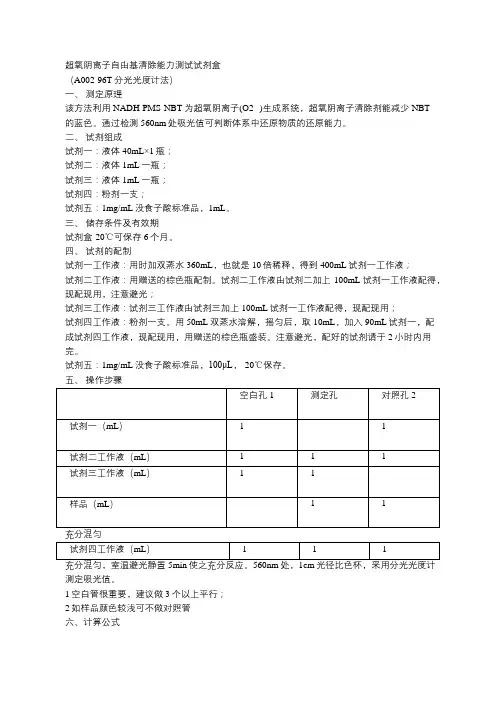
超氧阴离子自由基清除能力测试试剂盒(A002-96T分光光度计法)一、测定原理该方法利用NADH-PMS-NBT为超氧阴离子(O2·-)生成系统,超氧阴离子清除剂能减少NBT的蓝色。
通过检测560nm处吸光值可判断体系中还原物质的还原能力。
二、试剂组成试剂一:液体40mL×1瓶;试剂二:液体1mL一瓶;试剂三:液体1mL一瓶;试剂四:粉剂一支;试剂五:1mg/mL没食子酸标准品,1mL。
三、储存条件及有效期试剂盒-20℃可保存6个月。
四、试剂的配制试剂一工作液:用时加双蒸水360mL,也就是10倍稀释,得到400mL试剂一工作液;试剂二工作液:用赠送的棕色瓶配制。
试剂二工作液由试剂二加上100mL试剂一工作液配得,现配现用,注意避光;试剂三工作液:试剂三工作液由试剂三加上100mL试剂一工作液配得,现配现用;试剂四工作液:粉剂一支。
用50mL双蒸水溶解,摇匀后,取10mL,加入90mL试剂一,配成试剂四工作液,现配现用,用赠送的棕色瓶盛装。
注意避光,配好的试剂请于2小时内用完。
试剂五:1mg/mL没食子酸标准品,100μL,-20℃保存。
五、操作步骤测定吸光值。
1空白管很重要,建议做3个以上平行;2如样品颜色较浅可不做对照管六、计算公式注: 1 如未做对照孔,可以将其视作为0;2 阳性对照求值时将其视作测定孔进行计算即可。
七、注意事项1. 如样品中色素物质不是分析对象,建议先通过SEP C18柱进行脱色处理,处理后样品可不做对照孔;2. 如不确定样品的超氧阴离子自由基清除能力,可先做不同浓度的稀释液进行摸索,并选择适宜浓度进行测定,高浓度下,浓度与清除率间并不线性相关。
3. 试剂四切记避光保存,特别是配制后,且应尽快用完。
建议在做好一切其它准备工作后再配制试剂四应用液。
试剂四正常颜色为黄色,强光照射下,5-10分钟内会变为绿色,随后变为蓝色,变色后试剂不可再用!4. 试剂二、三应用液和样品混匀后再加入试剂四,次序颠倒会导致不显色。
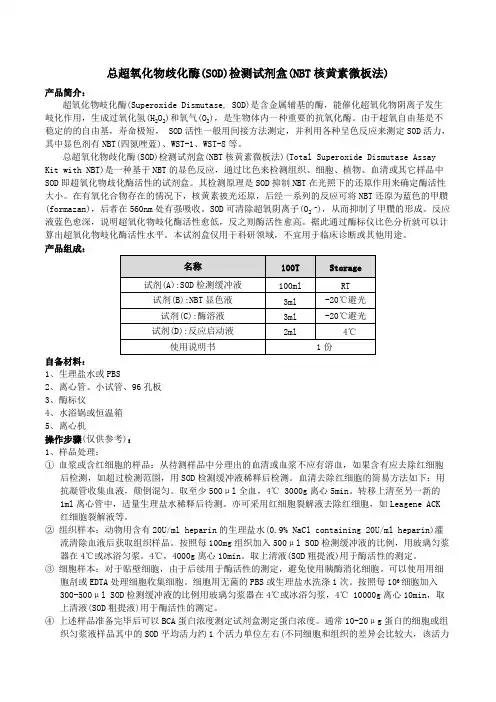

南京建成生物工程研究所价目表南京建成生物工程研究所价目表二○○四年七月一、抗氧化检测试剂及科研试剂:(注:**为新试剂盒)序号产品名称规格单位检测方法售价厂家A001 超氧化物歧化酶(SOD)测试盒100T 盒羟胺法240.00 建成50T 盒羟胺法130.00 建成A003 丙二醛(MDA)测试盒100T 盒TBA法150.00 建成50T 盒TBA法90.00 建成A002 黄嘌呤氧化酶(XOD)测试盒50T 盒比色法130.00 建成A015 总抗氧化能力(T-AOC)测试盒50T 盒比色法120.00 建成25T 盒比色法70.00 建成A018 羟自由基测试盒50T 盒比色法150.00 建成A052 超氧阴离子自由基(O )测试盒50T 盒比色法130.00 建成A044 髓过氧化物酶(MPO)测试盒50T 盒比色法160.00 建成A007 过氧化氢酶(CAT)测试盒紫外分光光度法100T 盒紫外比色法100.00 建成可见光分光光度法100T 盒钼酸铵法100.00 建成A064 过氧化氢(H2O2)测试盒50T 盒比色法50.00 建成A004 谷胱甘肽—S转移酶(GSH—ST)测试盒80T 盒比色法200.00 建成A005 谷胱甘肽—过氧化物酶(GSH—PX)测试盒50T 盒比色法200.00 建成A062 谷胱甘肽-还原酶(GR)测试盒50T 盒比色法200.00 建成A006 还原型谷胱甘肽(GSH)测试盒50T 盒比色法180.00 建成A061 氧化型谷胱甘肽(GSSG) 测试盒50T 盒比色法180.00 建成A063 巯基(-SH)测试盒50T 盒比色法180.00 建成A034 单胺氧化酶(MAO)测试盒50T 盒紫外比色法150.00 建成A012一氧化氮(NO)测试盒(硝酸还原酶法) 50T 盒比色法300.00 建成25T 盒比色法180.00 建成A013 一氧化氮(NO)测试盒(化学法测NO2—)100T 盒比色法150.00 建成A014 -1 一氧化氮合成酶(NOS)测试盒[(T-NOS、iNOS、cNOS)三型同时出结果] 50T 盒比色法480.00 建成25T 盒比色法260.00 建成A014-2 一氧化氮合成酶(NOS)测试盒[总NOS(T-NOS)] 50T 盒比色法350.00 建成25T 盒比色法200.00 建成A019-1 乳酸(LD)测试盒(测全血)50T 盒紫外比色法240.00 建成50T 盒可见光比色法240.00 建成A019-2 乳酸(LD)测试盒(测血清、组织)50T 盒比色法200.00 建成A020 乳酸脱氢酶(LDH)测试盒100T 盒比色法240.00 建成50T 盒比色法130.00 建成A016-1 A TP酶测试盒(组织及细胞膜需高速离心)(可测Na+K+、Ca2+Mg2+ ATPase) 100T 盒比色法240.00 建成50T 盒比色法150.00 建成A016-2 A TP酶测试盒(组织及细胞膜不需高速离心)(可测Na+K+、Ca2+Mg2+ ATPase) 100T 盒比色法300.00 建成50T 盒比色法180.00 建成A057 Cu-A TP酶(Cu-A TPase)测试盒100T 盒比色法300.00 建成50T 盒比色法180.00 建成序号产品名称规格单位检测方法售价厂家A069 氢-钾A TP酶(H+-A TPase)测试盒100T 盒比色法300.00 建成50T 盒比色法180.00 建成A070-1 超微量A TP酶测试盒(可测Na+K+、Ca2+Mg2+ A TPase、总ATPase)200T 盒比色法390.00 建成100T 盒比色法230.00 建成A070-2 超微量A TP酶测试盒(可测总A TPase)100T 盒比色法300.00 建成50T 盒比色法180.00 建成A021 苹果酸脱氢酶测试盒50T 盒紫外比色法面议建成A022 琥珀酸脱氢酶测试盒50T 盒比色法240.00 建成A032 肌酸激酶(CK)测试盒50T 盒比色法180.00 建成A023 胆碱酯酶(CHE)测试盒50T 盒比色法70.00 建成A024 乙酰胆碱酯酶(T-CHE)测试盒50T 盒比色法150.00 建成A025 丁酰胆碱酯酶测试盒50T 盒比色法150.00 建成A027 葡萄糖-6-磷酸脱氢酶(G-6-PD)测试盒50T 盒比色法100.00 建成A031 b-N-乙酰氨基葡萄糖苷酶(NAG)测试盒50T 盒比色法260.00 建成A053 β-葡萄糖醛酸苷酶测试盒50T 盒比色法200.00 建成A055** 红细胞NADH高铁血红蛋白还原酶测试盒50T 盒比色法260.00 建成A059 碱性磷酸酶(AKP)测试盒50T 盒比色法100.00 建成A060 酸性磷酸酶(ACP)测试盒50T 盒比色法130.00 建成A049 前列腺酸性磷酸酶(PACP)测试盒50T 盒比色法180.00 建成A058 抗酒石酸酸性磷酸酶(StrACP)测试盒50T 盒比色法180.00 建成A068 钙调神经磷酸酶(CaN)测试盒25T 盒比色法200.00 建成A072 全血2,3-二磷酸甘油酸(2,3-DPG)测试盒50T 盒比色法面议建成A047 谷氨酰胺合成酶(GS)测试盒50T 盒比色法300.00 建成A048 腺苷脱氨酶(ADA)测试盒50T 盒比色法130.00 建成A073** 谷氨酰胺测试盒50T 盒比色法200.00 建成A074** 谷氨酸测试盒50T 盒比色法260.00 建成A075** 谷氨酰胺、谷氨酸(两种均可测)50T 盒比色法480.00 建成A076** 丙酮酸激酶(PK)测试盒50T 盒比色法面议建成A077** 己糖激酶(HK)测试盒50T 盒比色法面议建成A036 唾液酸(SA)测试盒(带SA标准) 50T 盒比色法200.00 建成A017-1 细胞凋亡测试盒(TdT酶、稀释液、POD)10片盒TUNEL法1450.00 建成A017-2 细胞凋亡测试盒(TdT介导的原位末端切口平移双标记法)(全套)10片盒TUNEL法1850.00 建成A008 维生素E(VE)测试盒50T 盒比色法130.00 建成A009 维生素C(VC)测试盒50T 盒比色法150.00 建成A010 维生素B1(V B1)测试盒50T 盒比色法面议建成A011 维生素B2(V B2)测试盒50T 盒比色法面议建成A026 总氨基酸(T—AA)测试盒80T 盒比色法100.00 建成A030-1 羟脯氨酸测试前处理试剂消化液50T 瓶比色法100.00 建成调PH试剂50T 瓶比色法70.00 建成A030-2 羟脯氨酸(Hyp)测试盒(可测血清、培养液、尿液、心肌、皮肤、软骨、肝脏等等)50T 盒比色法180.00 建成A041 5’-核苷酸酶(5’-NT)测试盒50T 盒比色法150.00 建成A035 D—木糖测试盒50T 盒比色法100.00 建成A056 糖化血红蛋白(GHb)测试盒15T 盒比色法55.00 建成A037 糖化血清蛋白(GSP)测试盒(果糖胺法)(带标准)50T 盒比色法150.00 建成25T 盒比色法80.00 建成A043 肝/肌糖元测试盒50T 盒比色法160.00 建成A038 脂蛋白(a)[LP(a)]测试盒96T 盒ELISA法380.00 建成A054 脂肪酶测试盒50T 盒比色法200.00 建成A067 总脂酶【脂蛋白脂酶(LPL)/肝脂酶(HL)】测试盒100T 盒比色法300.00 建成50T 盒比色法160.00 建成A042 游离脂肪酸(NEFA)测试盒50T 盒比色法160.00 建成A033 脂褐质测试盒50T 盒荧光比色法100.00 建成A039 血清铁测试盒50T 盒比色法100.00 建成A040 总铁结合力(TIBC)测试盒50T 盒比色法180.00 建成A029 铜兰蛋白(CP)测试盒50T 盒比色法150.00 建成A071 微量游离血红蛋白测试盒50T 盒比色法80.00 建成A028 白蛋白测试盒(溴甲酚绿法)100T 盒比色法30.00 建成A045-1 总蛋白定量测试盒(双缩脲法)100T 盒比色法30.00 建成A045-2 总蛋白定量测试盒(考马斯亮兰法)100T 盒比色法30.00 建成A046 蛋白标准品(总蛋白、白蛋白) 1ml 支7.00 建成A050-1 溶菌酶(LZM)测试盒(带标准)30T 盒试管比浊法60.00 建成A050-2 溶菌酶(LZM)测试盒(带标准)30T 盒平板法60.00 建成A050-3 溶菌酶标准品2mg 支6.00 建成A050-4 微球菌粉30mg 支40.00 建成A065 解脲(溶脲)支原体快速培养基(UU培养基)每人份支培养基10.00 建成A066 人型支原体快速培养基每人份支培养基10.00 建成A051-1 肝素溶液10ml 支20.00 建成A051-2 肝素抗凝管10ml 支2.00 建成二、不孕症系列酶免疫试剂:序号产品名称规格单位检测方法售价厂家B001 抗心磷脂抗体测试盒(ACL)IgG类48T 盒ELISA 160.00 建成抗心磷脂抗体测试盒(ACL)IgA类48T 盒ELISA 160.00 建成抗心磷脂抗体测试盒(ACL)IgM类48T 盒ELISA 160.00 建成B002 抗精子抗体测试盒(AsAb)IgG类48T 盒ELISA 160.00 建成抗精子抗体测试盒(AsAb)IgA类48T 盒ELISA 160.00 建成抗精子抗体测试盒(AsAb)IgM类48T 盒ELISA 160.00 建成B003 抗子宫内膜抗体测试盒(EmAb)IgG类48T 盒ELISA 260.00 建成抗子宫内膜抗体测试盒(EmAb)IgA类48T 盒ELISA 260.00 建成抗子宫内膜抗体测试盒(EmAb)IgM类48T 盒ELISA 260.00 建成B004 抗卵巢抗体测试盒(AoAb)IgG类48T 盒ELISA 260.00 建成抗卵巢抗体测试盒(AoAb)IgA类48T 盒ELISA 260.00 建成抗卵巢抗体测试盒(AoAb)IgM类48T 盒ELISA 260.00 建成三、常用试剂:序号产品名称规格单位检测方法售价厂家C001 钾(K)测试盒(带标准)30T 盒比色法(上机)45.00 建成30T 盒比浊法(手工)35.00 建成C002 钠(Na)测试盒(带标准)30T 盒比色法(上机)45.00 建成30T 盒比浊法(手工)35.00 建成C003 氯(Cl)测试盒(带标准)30T 盒比色法(上机)45.00 建成30T 盒比色法(手工)28.00 建成C004 钙(Ca)测试盒(带标准)30T 盒比色法(上机)40.00 建成30T 盒比色法(手工)30.00 建成C006 磷(Pi)测试盒(带标准)100T 套孔雀绿显色39.00 建成A059 碱性磷酸酶(AKP)测试盒50T 盒比色法100.00 建成A060 酸性磷酸酶(ACP)测试盒50T 盒比色法130.00 建成C009 谷丙转氨酶(SGPT)测试盒100T 盒比色法30.00 建成C010 谷草转氨酶(SGOT)测试盒100T 盒比色法30.00 建成C018 总胆红素、直接胆红素测试盒80T 套咖啡因比色法65.00 建成80T 套一步法65.00 建成C017 Υ—谷氨酰转移酶(Υ—GT)测试盒100T 套比色法88.00 建成C020 尿胆红素测试盒50T 套哈里森氏法25.00 建成C033 尿胆原测试盒50T 套25.00 建成C013 尿素氮(BUN)测试盒100T 套脲酶比色法36.00 建成100T 套二乙酰-肟比色法27.00 建成C016 淀粉酶(AMS)测试盒100T 套淀粉一碘比色法39.00 建成C012 尿酸测试盒50T 套比色法40.00 建成C011-1 肌酐(Cr)测试盒(苦味酸法)100T 套比色法(除蛋白)60.00 建成C011-2 肌酐(Cr)测试盒(苦味酸法)100T 套比色法(不除蛋白)40.00 建成C021 血红蛋白稀释液(测试液)5ml 支HICN比色法4.50 建成C022 血红蛋白标准品5ml×4支套比色法12.00 建成C023 血红蛋白校正液250ml 瓶比色法35.00 建成100ml 瓶比色法14.00 建成C024 血小板稀释液(计数液)100ml 瓶8.00 建成C025 白细胞稀释液(计数液)100ml 瓶8.00 建成C037 红细胞稀释液(计数液)100ml 瓶8.00 建成C026 血细胞仪清洗液250ml 瓶25.00 建成C028 CO2结合力测试盒2ml×3×10 套滴定法40.00 建成C034 脑脊液蛋白测试盒50T 盒磺基水杨酸法50.00 建成C038 血沉测试液100ml 瓶10.00 建成C039 嗜酸粒细胞直接计数液40ml×1 瓶50.00 建成C040 网织红细胞计数液8 ml×2 套试管法30.00 建成10 ml×1 瓶玻片法20.00 建成C035-1 尿蛋白定性测试盒100T 盒磺基水杨酸法30.00 建成C035-2 尿蛋白定量测试盒100T 盒CBB法30.00 建成C041 尿糖试剂100ml 瓶班氏法40.00 建成C027 尿粪隐血测试盒100T 套联苯胺法15.00 建成100T 套邻联甲苯胺法15.00 建成A051-1 肝素溶液10ml 支20.00 建成A051-2 肝素抗凝管10ml 支2.00 建成四、染液类序号产品名称规格单位检测方法售价厂家D001 碱性磷酸酶染液50片套染色50.00 建成D002 酸性磷酸酶染液50片套染色50.00 建成D003-1 酸性酯酶染液5.0ml×4 盒染色50.00 建成D003-2 中性酯酶染液5.0ml×4 盒染色50.00 建成D003-3 碱性酯酶染液5.0ml×4 盒染色50.00 建成D003-4 双重酯酶染液5.0ml´4 盒染色60.00 建成D009 快速血细胞染液50ml×2 套染色40.00 建成D004 糖元染液10ml×4 盒染色40.00 建成D005 苏木素染液50ml×1 瓶染色40.00 建成D019 伊红染液100ml×1 套染色50.00 建成D006 H-E染液套染色55.00 建成D007 瑞氏染液50ml×2 套染色40.00 建成D010 瑞氏一姬姆萨复合染液50ml×2 套染色40.00 建成D011 姬姆萨染液套染色30.00 建成D015 巴氏染液(脱落细胞染色)套染色50.00 建成D017 快速H-E组织细胞及脱落细胞染液10ml×4 染色20.00 建成D008 革兰氏染液50ml×4 套染色50.00 建成D012 抗酸染液50ml×2 套染色40.00 建成D013 溴酚兰溶液1.0ml 支染色10.00 建成D014 溴乙淀溶液1.0ml 支染色20.00 建成D016 细胞活性鉴别染液20ml 瓶伊文斯蓝法20.00 建成D018 血管通透性测试染液20ml 瓶美蓝法20.00 建成D020** 过氧化物酶染液5ml 套染色20.00 建成五、各种浓度及PH值的缓冲液:(注: 以下缓冲液PH值、摩尔浓度按客户要求配制。

牛大力总黄酮抗氧化作用的研究曹志方;杨雨辉;郝赫宣;姜亚磊;姚倩;陈涛【摘要】为了研究牛大力总黄酮(Flavonoids from Millettia specisoa Champ,以下简称FMSC)的抗氧化作用,通过制备牛大力总黄酮,分别测定了其体外和体内的抗氧化活性,FMSC的体外抗氧化活性结果表明:FMSC对DPPH·,OH·,O2·自由基有较强的清除能力,其IC50分别为31.50 μg/mL,225.04 μg/mL,115.39 μg/mL;此外,它对金属离子还具有较强的螯合和还原能力;在小鼠体内试验中,与模型组比较,FMSC不仅能降低小鼠血清中的BUN(29.63%)含量和提高T-AOC (58.89%)的活性(P<0.05),而且它还能提高肝组织中的T-SOD (43.99%),CAT(47.33%)和GSH-Px(40.76%)酶的活性和GSH (62.17%)的含量(P<0.05),此外,它还能降低MDA(36.53%)的含量(P<0.05).由此可得出:FMSC在机体内外的抗氧化作用存在差异,其在体外的作用强于其在体内的作用,整体而言,其抗氧化活性较强,且具有多途径和多方面参与抗氧化的特点.【期刊名称】《海南大学学报(自然科学版)》【年(卷),期】2016(034)002【总页数】9页(P161-169)【关键词】牛大力;黄酮;抗氧化;自由基【作者】曹志方;杨雨辉;郝赫宣;姜亚磊;姚倩;陈涛【作者单位】海南大学农学院,海南海口570228;海南省热带动物繁育与疫病研究重点实验室,海南海口570228;海南大学农学院,海南海口570228;海南大学农学院,海南海口570228;海南大学农学院,海南海口570228;海南大学农学院,海南海口570228【正文语种】中文【中图分类】R285.5黄酮类化合物(flavonoids)是一类广泛存在于自然界中,且具有2-苯基色原酮结构的天然化合物,是许多中草药的有效成分.现已发现黄酮化合物有上万种,多以游离或与糖结合成苷的形式存在.黄酮类化合物的种类、含量存在很大差异,因而其药理作用也不尽相同,研究表明,黄酮类化合物的主要药理作用是保护心脑血管、清除自由基、抗氧化、利胆保肝、抗癌、抗菌、抗过敏、抗炎症和抗病毒.近年来,关于黄酮类化合物的抗氧化作用备受关注,并有望将其开发成为天然抗氧化剂,发挥其预防疾病和延缓衰老的作用.牛大力,别名为山莲藕、大力薯等,为豆科崖豆藤属美丽崖豆藤(Millettia specisoa Champ)的干燥根茎.临床上已证明其对腰痛、肾虚带下、风湿性关节炎、腰肌劳损、慢性肝炎、病后体虚有显著疗效.有文献报道,牛大力提取物有较好的抗氧化能力,并推测其可能与黄酮类化合物有关[1];另有研究表明,牛大力生药中总黄酮的含量较高,其提取率高达2.14%[2].但是,到目前为止,尚未见关于牛大力总黄酮抗氧化作用的研究报道,为了深入地研究牛大力的药理作用,本研究通过体内和体外实验的方法评价了牛大力中总黄酮的抗氧化和抗衰老活性, 以期为牛大力天然抗氧化剂和天然保健品的开发提供理论和实验的依据.1.1 实验药品与试剂牛大力,购于海南源安隆大药堂,经海南大学农学院王金花副教授鉴定,其为豆科崖豆藤属植物—美丽崖豆藤的干燥根茎;芦丁标准品(购自阿拉丁公司,D1515108);Vc(Solarbio公司,305D036);DPPH(武汉艾科化学试剂公司,201503101);菲洛嗪(Aladdin公司,L1416039);EDTA-Na(Dojindo公司,DE140);Ve(上海庆安药业集团宿州制药有限公司,141102);D-半乳糖(购自Sigma公司,C1518010);硫酸亚铁,氯化亚铁,氯化铁,三氯乙酸,硝酸铝,亚硝酸钠,氢氧化钠(均为分析纯).1.2 实验动物昆明种小白鼠,SPF级,购于长沙市天勤生物技术有限公司,许可证号 SCXK(湘)2014-0011,实验前分笼预养3 d.1.3 实验测定试剂盒羟基自由基、抗超氧阴离子自由基、总抗氧化能力(Total Antioxidant Capacity,T-AOC)、尿素氮(Blood Urea Nitrogen,BUN)、丙二醛(Malondialdehyde,MDA)、总超氧化物歧化酶(Total Superoxide Dismutase,T-SOD)、谷胱甘肽过氧化物酶(Glutathione Peroxidase,GSH-Px)、还原性谷胱甘肽(Glutathione,GSH)、过氧化氢酶(Catalase,CAT)、一氧化氮合酶(Nitric Oxide Synthase,NOS)分型、考马斯蛋白测定试剂盒,均购自南京建成生物工程研究所.1.4 方法1.4.1 牛大力总黄酮(FMSC)的制备及含量测定牛大力粉碎样品,过80目筛,80 ℃持续烘干6 h,干燥冷却后称取2 kg,加φ=95 %的乙醇溶液(料液比1g ∶20 mL),超声辅助提取3次,每次2.0 h.抽滤后收集所有滤液,加入φ=15 %的三氟乙酸溶液以沉淀蛋白,静置沉淀后再过0.2 μm孔径的滤膜.以w=4 %的氢氧化钠溶液调节滤液pH值至中性.所得滤液经减压浓缩后得到浓缩浸膏,然后再加入少量水分散后,离心(5 000 r/min),收集沉淀.沉淀经适量无水乙醇再次完全溶解后,重复浓缩与析出结晶过程2次.最后所得到的沉淀经低温、冷冻、干燥后即为黄酮试样.以芦丁为标准测出黄酮样品的质量分数为81.24 %.1.4.2 FMSC体外抗氧化活性的测定1.4.2.1 FMSC对DPPH的清除作用反应体系包含2 mL不同浓度的FMSC乙醇溶液和2 mL 0.1 mmol·L-1 的DPPH-乙醇溶液,于暗光处室温放置30 min后,在517 nm波长下测定溶液的吸光度[3].空白校准用乙醇溶液代替DPPH溶液.对照组用乙醇代替试样.相同浓度系列的维生素C(Vc)组作为阳性对照,清除率=(Ac-Ab)/(Ac-A0 )×100%.注:Ab为测定样品的吸光度,Ac为对照组的吸光度,A0为空白校准的吸光度. 1.4.2.2 FMSC对羟基自由基(OH·)的清除作用采用抗羟基自由基试剂盒测定试样清除羟基自由基的能力,空白校准由蒸馏水代替样品和H2O2,吸光度为A0.对照组由蒸馏水替代样品,吸光度为Ac.以相同浓度系列的Vc组为阳性对照,清除率=(Ac-Ab)/(Ac-A0 )×100%.1.4.2.3 FMSC对超氧阴离子(O2-)的清除作用采用抗超氧阴离子自由基测试盒测定试样清除超氧阴离子的能力,空白校准由蒸馏水代替样品和H2O2,吸光度为A0.对照组由蒸馏水替代样品,吸光度为Ac.以相同浓度系列的Vc组为阳性对照,计算出试样对超氧阴离子自由基的影响能力,清除率=(Ac-Ab)/(Ac-A0 )×100%.1.4.2.4 FMSC对金属离子螯合力的测定[4] EDTA-Na对照曲线的绘制:取不同浓度的EDTA-2Na溶液1 mL,加入6.7 mL的水,0.2 mLφ=0.1 %的菲洛嗪和0.1 mLφ=0.35 % 的氯化亚铁,混合均匀后,在562 nm处测定其吸光度值,并用蒸馏水代替样液做空白实验.样品的测定:取1 mL不同浓度的试样,按上述方法测得吸光度,并以蒸馏水代替样品做吸光度值.以相同浓度系列的Vc组作为阳性对照.实验结果以螯合率来表示样品抗氧化程度的大小,螯合率=(A0-A1)/A0×100% ,注:A0表示空白实验的吸光度,A1表示样品的吸光度.同时参照EDTA的螯合率来评价样品螯合率的大小,从而得出样品抗氧化能力的大小.1.4.2.5 FMSC还原力的测定采用铁氰化钾法测定还原能力[5],反应体系包括2.5 mL pH6.6的磷酸盐缓冲液,2.5 mL w=1 %的铁氰化钾溶液,样品液2.5 mL,混合均匀后于50 ℃水浴反应20 min;冷却后加入2.5 mL φ=10 %的三氯乙酸溶液,以3 000 r/min离心10 min;取上清液5 mL,加入1 mL w=0.1 % 的FeCl3溶液和5 mL蒸馏水,混匀,静置5 min后,于700 nm波长下测定其吸光度.测得的吸光度值越高,则表示待测物的还原能力越强.1.4.3 FMSC体内抗氧化活性的研究1.4.3.1 最佳给药方式及最大耐受量(MTD)的确定选取小鼠20 只,随机分为2组,分别采用灌胃和腹腔注射的方式给予高浓FMSC液,每天给药2次,给药量为每10 g体质量0.1 mL,连续10 d,观察小鼠的外观、行为、精神状态、给药部位及死亡情况,比较后确定最佳的给药方式,最后计算出MTD值.1.4.3.2 动物分组、模型制备和给药选取健康的昆明小鼠60只,体重(22.5±1.4) g,随机分为6组,即正常对照组、模型对照组、Ve对照组、FMSC的高、中、低剂量组[0.16 g·(kg·d)-1,0.04 g·(kg·d)-1,0.01 g·(kg·d))-1]建模时,除正常组注射等量生理盐水(每10 g体质量0.1 mL)外,其余各组每天均经腹腔注射D-半乳糖生理盐水[120 mg·(kg·d)-1].连续建模2周后开始给药,根据耐受实验确定所有组均采用腹腔注射给药,正常组和模型组给予等量的生理盐水,持续给药3周.正常饲喂,每2天测定和记录各组平均采食量及小鼠体重1次,同时参考所测定的体重变化,及时调整当天的给药量.1.4.3.3 日常相关项目的记录和后续检测除记录各组小鼠日常采食及体重变化外,每天还应观察小鼠生理、行为和精神状态的变化.持续给药3周后, 于最后一次造模和给药后6 h 称重, 各小鼠摘眼球取血,3 000 r·min-1 离心10 min,分离血清,低温保存备用.将小鼠立即断颈椎处死, 迅速取肝脏、肾脏、胸腺、脾脏,用预冷的生理盐水冲洗,并以滤纸吸干、称重,同时计算各脏器系数,脏器系数=脏器重量(g)/体重(g)×100 %.取血清,按试剂盒说明书分别测定其血清总抗氧化能力和BUN含量;取肝脏,在冰水浴中制备w=10 %的肝匀浆,并按试剂盒说明书分别测定肝脏总蛋白、T-SOD、T-SOD、GSH-Px、CAT和TNOS/iNOS的活性以及GSH和MDA的含量.1.5 统计分析使用SPSS19 .0 统计软件进行统计比较,同时采用单因素方差分析中的LSD方法对组间差异显著性进行多重比较检验.2.1 FMSC的体外抗氧化能力2.1.1 FMSC对DPPH的清除作用DPPH是一种较稳定的自由基, 当反应体系中存在质子供体(如抗氧化剂)时将会被清除,具体表现为溶液的吸光度降低[6].基于这一原理,用清除DPPH 自由基的能力能够评价物质的抗氧化活性.由图1可以看出:牛大力黄酮类提取物对DPPH 自由基具有较高的清除率,质量浓度与清除率呈正相关,FMSC的 IC50值为31.50 μg·mL-1.2.1.2 FMSC对羟基自由基(OH·)的清除作用羟基自由基是一种重要的氧自由基,由氢氧根失去一个电子形成.在人体中如果大量存在羟基自由基,将会杀死红细胞,降解DNA、脂类和多糖等化合物,从而造成许多有害效应,当加入羟基自由基的清除剂后则会明显降低这类危害.因此,抗氧化物质清除羟自由基的能力常被作为评价抗氧化剂抗氧化功效的重要指标[7].从结果可以看出(见图2),FMSC和Vc对OH·自由基有较强的清除作用,随着其质量浓度的增大,其清除作用增强;其IC50值为225.04 μg·mL-1,且当质量浓度高于200 μg·mL-1时,等质量浓度的FMSC的清除能力开始强于Vc的清除能力.2.1.3 FMSC对超氧阴离子(O2-)自由基的清除作用该反应的机理是:通过黄嘌呤与黄嘌呤氧化酶反应产生超氧阴离子自由基,在加入电子传递物质和显色剂后,溶液将显紫红色,此时测得溶液的吸光度与O2-的量成正比关系;而当反应液中存在超氧阴离子自由基抑制剂时,O2-将减少,溶液的吸光度将降低[8].从结果可以看出(见图3),FMSC对超氧阴离子自由基有着较强的清除作用,且同等质量浓度下FMSC清除超氧阴离子自由基的能力强于Vc,FMSC的IC50值为115.39μg·mL-1.2.1.4 FMSC对金属离子的螯合力抗氧化物质通常可以作为金属离子的螯合剂,进而防止金属离子对细胞或组织造成氧化损伤[4],螯合率愈大, 表明抗氧化剂潜在的抗氧化能力就愈强.因此,测定抗氧化剂对金属离子的螯合率就成为评价抗氧化能力常用的方法.由图4可以看出:EDTA-Na 有极强的金属螯合能力,在质量浓度为168 μg·mL-1 时,其螯合率为98.40 % ;FMSC对Fe2+具有较高的螯合率,在其质量浓度为200 μg·mL-1时,FMSC对Fe2+ 的螯合率为89.44 %,相当于EDTA-Na的88.16 %;且在相同质量浓度条件下, FMSC对Fe2+的螯合率始终高于Vc.2.1.5 FMSC对Fe3+的还原力还原力是评价物质抗氧化能力的重要指标之一,抗氧化剂的供电子能力越强则还原力越强, 其抗氧化能力也越强.在实验条件下,越多的Fe3+被还原成Fe2+,溶液的吸光度将越大,则表示抗氧化剂的还原力越强.根据实验结果可知(图5):随质量浓度的提高,FMSC和Vc对Fe3+的还原能力均逐渐增加.2.2 FMSC的体内抗氧化活性2.2.1 最佳给药方式及MTD值2种给药方式的小鼠均未出现死亡的情况,灌胃组的小鼠在连续给药后出现身体消瘦、轻微掉毛、精神萎靡及给药部位(咽喉)炎症;而腹腔注射组的小鼠其精神与活动状态正常,解剖后其腹腔未出现异常.因此确定腹腔注射为最适宜的给药方式,且确定小鼠对注射的最大耐受值为2.24 g·(kg·d)-1.2.2.2 各组小鼠体重的增长情况采用D-半乳糖亚急性中毒法建立衰老动物模型是模仿小鼠自然衰老的方法,D-半乳糖亚急性中毒会严重干扰小鼠正常的糖代谢,进而造成其进一步的代谢紊乱,导致其代谢能力的不稳定或降低,具体表现为生长速度减缓[9].由图6结果可以看出,在正常组中,小鼠的体重保持稳定且呈较快的增长趋势;而与正常组的小鼠比较,长期注射D-半乳糖会明显减缓各组的小鼠的体重增长,且同期体重均偏小;在给予药物处理后,实验组小鼠的生长速度开始恢复(最高达到日增重0.625 g),并逐渐接近正常组水平(最大日增重0.650 g).这表明一定剂量的FMSC能改善致衰老小鼠的生长状况.2.2.3 FMSC对小鼠各脏器系数的影响肝脏是体内主要的代谢器官,过量的活性氧会造成肝脏细胞的氧化损伤,改变细胞的通透性,从而造成肝细胞肿胀.肾脏则具有过滤体内无用或有害代谢产物的功能,血液中过量的活性氧会造成肾细胞的损伤,改变组织结构的通透性[10-11].由结果可知(见图7),与正常组相比, 模型对照组小鼠的肝脏、肾脏系数升高(P <0 .05);而胸腺、脾脏系数降低(P <0 .05).与模型组比较,FMSC药物组小鼠的肝脏、肾脏系数升高(P <0 .05);而胸腺、脾脏系数变化不明显,无统计学意义(P>0 .05),这表明FMSC能够降低D-半乳糖的不完全代谢对肝、肾器官的损伤程度,而与免疫调节无关.2.2.4 FMSC对小鼠血清T-AOC活性及BUN含量的影响血清中总抗氧化能力(T-AOC)可以反映机体非酶抗氧化剂的活性.本实验中,FMSC各剂量组均可提高血清T-AOC 的活性,其中,高剂量组[(15.87±3.02) U·mL-1]显示较高水平[正常组水平为(14.21±2.87) U·mL-1],这表明FMSC能够直接清除体内的ROS,且其抗氧化能力与剂量呈正相关.BUN是蛋白、脂类的代谢产物,与正常组[(167.25±30.82) mg·L-1]比较,模型组小鼠血清中的BUN[(208.85±39.48) mg·L-1]含量明显升高,这表明大剂量的D-半乳糖加剧了模型小鼠体内的脂质过氧化水平;在FMSC中剂量组(155.14 mg·L-1)、高剂量组(146.96 mg·L-1)中小鼠血清中的BUN含量降低,这表明一定剂量的FMSC可减少脂质过氧化产物的生成,其作用与抗脂质过氧化有关.2.2.5 FMSC对小鼠肝脏中清除氧化自由基的抗氧化酶系的影响T-SOD,GSH-Px,CAT是机体自我产生的重要内源性抗氧化剂,又称细胞抗氧化剂[12].T-SOD能特异性地清除O2- ,而GSH-Px和CAT 则能够特异性地清除OH·[13],它们代表了机体中酶抗氧化剂的活性.由图9可知:与正常组比较[每毫克Prot的活性为(127.32±5.17),(68.73±8.50),(41.49±6.91) U],在模型对照组中,小鼠肝脏组织中的T-SOD[每毫克Prot的活性为(84.54±6.70) U]、GSH-Px[每毫克Prot的活性为(43.84±5.83) U]及CAT[每毫克Prot的活性为(33.52±12.31) U)]活性均明显降低(P<0.05),这表明致衰老小鼠的抗氧化能力被抑制.治疗后,阳性对照组和FMSC各剂量组中小鼠肝脏组织中的T-SOD、GSH-Px及CAT活性均有所升高(P<0.05),表明FMSC能够通过增强内源性抗氧化酶的活性来增强机体整体的抗氧化能力.2.2.6 FMSC对小鼠肝组织中的MDA,GSH含量及NOS分型活性的影响MDA是体内脂质过氧化的代谢产物,是评定机体自身脂质过氧化程度的重要指标之一;GSH是GSH-Px酶特异性清除OH·自由基的底物,组织中的GSH含量既反映了机体的健康状态,又反映了清除OH·自由基的能力[14];NOS是调控机体内NO合成的关键酶,NO是一种具有气体分子信使功能的气体自由基,近年来的研究表明,NO具有生物效应双相性,即既具有抗氧化作用,又具有促氧化作用,NO不足或过量均可引起组织损伤[15].由结果可知(图10):与模型组比较,FMSC各剂量组均使MDA降低36.53%(P<0.05);使GSH含量升高62.17%(P<0.05),恢复到正常水平的90.78%;而对NOS分型的活性则无明显改变(P>0.05).MDA降低和GSH恢复到正常水平证实了致衰老小鼠体内的抗氧化能力得到增强,这又进一步证实了FMSC具有显著的抗氧化活性.本实验采取低温提取、析出重结晶、全程无强氧化物质参与的方法,以期提取到更多抗氧化物质,并保证提取物化学性质的稳定,经芦丁标定测得总黄酮样品的纯度大于81.24 %.生物体内的抗氧化作用主要是通过2条途径实现,一是抗氧化物质直接清除自由基;另一个是提高机体内源性抗氧化酶(如T-SOD,GSH-Px,CAT等)的活性[16-17].目前,关于天然提取物抗氧化能力的研究也主要针对这两个方面进行.对DPPH,OH·,O2-自由基的清除和对金属离子的螯合以及还原能力的测定主要是利用了黄酮类物质本身的化学结构(如共轭双键体系,邻苯二酚结构)[18]和特殊的化学基团(如酚羟基)[19]所表现出化学性质,直接通过氧化还原、合成、催化等反应的方式来改变自由基、金属离子的电化学性质,从而起到转化或减弱自由基氧化能力的目的.在本研究中,FMSC对DPPH,OH·,O2-自由基的清除能力、对铁离子的还原力以及对金属离子的螯合能力均表现出较好的抗氧化活性(见图1—5).将黄酮类化合物作为天然的抗氧化活性成分进行研究,不仅要研究它的体外抗氧化能力,更重要的是要研究其在进入体内后是如何参与抗氧化调节和代谢的,它对机体的抗氧化作用能否起到积极作用.本研究在体外部分的结果表明:牛大力总黄酮在整体上具有强的抗氧化活性,而从体内抗氧化部分的结果也发现,FMSC在血清中提升T-AOC的(58.89%)活性要高于阳性对照组(56.67%),这证实了体外抗氧化的结果;牛大力总黄酮对致衰老小鼠的生长情况虽有一定的积极作用,但均弱于阳性对照组;在升高肝组织中T-SOD (43.99%),CAT(47.33%),GSH -Px(40.76%)的酶活性及GSH(62.17%)的含量(P <0.05)和降低MDA(36.53%)的含量(P<0.05)方面,与阳性对照组基本相当,并未表现出在体外实验中的明显抗氧化活性.有文章报道过,一些黄酮类化合物在体外实验中表现出强抗氧化活性,而在体内的抗氧化作用却有所减弱,研究人员推测这可能与黄酮类化合物的体内代谢和作用途径有关[20]而它是否在进入体循环后与结合物和代谢物的性质等影响因素有关,尚无法确定,这尚有待于进一步的研究.。
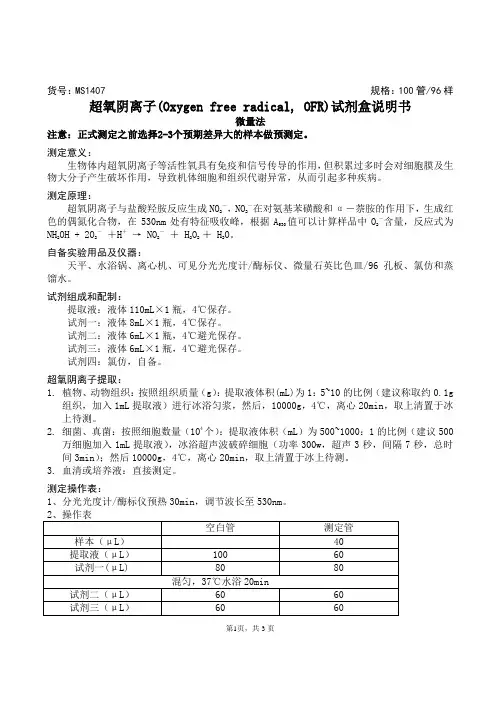
货号:MS1407 规格:100管/96样超氧阴离子(Oxygen free radical, OFR)试剂盒说明书微量法注意:正式测定之前选择2-3个预期差异大的样本做预测定。
测定意义:生物体内超氧阴离子等活性氧具有免疫和信号传导的作用,但积累过多时会对细胞膜及生物大分子产生破坏作用,导致机体细胞和组织代谢异常,从而引起多种疾病。
测定原理:超氧阴离子与盐酸羟胺反应生成NO2-,NO2-在对氨基苯磺酸和α-萘胺的作用下,生成红色的偶氮化合物,在530nm处有特征吸收峰,根据A530值可以计算样品中O2-含量,反应式为NH2OH + 2O2-+H+→ NO2-+ H2O2+ H2O。
自备实验用品及仪器:天平、水浴锅、离心机、可见分光光度计/酶标仪、微量石英比色皿/96孔板、氯仿和蒸馏水。
试剂组成和配制:提取液:液体110mL×1瓶,4℃保存。
试剂一:液体8mL×1瓶,4℃保存。
试剂二:液体6mL×1瓶,4℃避光保存。
试剂三:液体6mL×1瓶,4℃避光保存。
试剂四:氯仿,自备。
超氧阴离子提取:1.植物、动物组织:按照组织质量(g):提取液体积(mL)为1:5~10的比例(建议称取约0.1g组织,加入1mL提取液)进行冰浴匀浆,然后,10000g,4℃,离心20min,取上清置于冰上待测。
2.细菌、真菌:按照细胞数量(104个):提取液体积(mL)为500~1000:1的比例(建议500万细胞加入1mL提取液),冰浴超声波破碎细胞(功率300w,超声3秒,间隔7秒,总时间3min);然后10000g,4℃,离心20min,取上清置于冰上待测。
3.血清或培养液:直接测定。
测定操作表:1、分光光度计/酶标仪预热30min,调节波长至530nm。
第1页,共3页第2页,共3页超氧阴离子含量计算公式:a. 用微量石英比色皿测定的计算公式如下 标准曲线:y=0.0115x-0.0038,R 2=0.9986 1. 组织:(1)按照样本质量计算超氧阴离子含量(μmol/g 鲜重)= (A 530+0.0038)÷0.0115×V 反总÷(V 样÷V 样总×W )×10-3×2= 1.74×(A 530+0.0038)÷W超氧阴离子产生速率(μmol/ g·min)=1.74×(A 530+0.0038)÷W ÷T =0.087×(A 530+0.0038)÷W (2)按照蛋白质浓度计算超氧阴离子含量(μmol/mg prot )= (A 530+0.0038)÷0.0115×V 反总÷(V 样×Cpr)×10-3×2=1.74×(A 530+0.0038)÷Cpr超氧阴离子产生速率(μmol/ mg prot·min)=1.74×(A 530+0.0038)÷Cpr ÷T = 0.087×(A 530+0.0038)÷Cpr 2. 细菌,真菌:超氧阴离子含量(µmol/104 cell )= (A 530+0.0038)÷0.0115× V 反总÷(V 样÷V 样总×细胞数量)×10-3×2= 1.74×(A 530+0.0038)÷细胞数量超氧阴离子产生速率(µmol/mg prot·min)= 1.74×(A 530+0.0038)÷细胞数量÷T= 0.087×(A 530+0.0038)÷细胞数量3. 血清或培养液超氧阴离子 含量(μmol/L )= (A 530+0.0038)÷0.0115 × V 反总÷V 样×2= 1739.13×(A 530+0.0038)超氧阴离子产生速率(μmol/L·min)= 1739.13×(A 530+0.0038) ÷T= 86.96×(A 530+0.0038)V 样总:加入提取液体积,1 mL ; V 反总:反应总体积,0.4mL ;V 样:反应中样品体积,0.04mL ;Cpr :样本蛋白质浓度,mg/mL ;W :样品质量,g ;T :反应时间,20min ;2: 2分子O 2-参与反应生成1分子NO 2-。

抗氧化实验:,1,熊果酸对超氧阴离子自由基(O-2·)的清除实验本实验采用邻苯三酚自氧化法,即采用邻苯三酚自氧化法产生超氧阴离子,生成有色中间产物,吸光度随之增加,使吸光度值与反应时间呈良好的线性关系。
但是加入抗氧化性物质后会对其产生清除作用,从而对其进行抗氧化性能的评价。
取试管,加入不同浓度的熊果酸溶液(5mg/10mL)各50、100、200uL以及200uL Vc 进行阳性对照,同时分别取相同体积的甲醇做对照。
在试管中分别加入50mmol/L,pH8.3K2HPO4-KH2PO4缓冲液4.5mL.在25℃水浴锅保温10min,加入预热至25℃的50mmol/L邻苯三酚的盐酸溶液10uL迅速摇匀,倾入1cm的比色杯中,以缓冲液调零,在325nm处,每隔30s测吸光度1次,连续测定15min。
2熊果酸对羟自由基(·OH)的清除实验(1) 本实验采用Feton体系法产生羟自由基,即:H2O2+Fe2+ OH +H2O+Fe3+。
然后在体系中加入水杨酸捕捉羟自由基并产生有色物质,该物质在510nm处有最大吸收,可以利用该吸光度值来表示羟自由基的含量。
取不同的试管分别加入0.5mg/mL熊果酸标准品各50、100、200uL以及200uL甘露醇作为阳性对照。
再分别加入1mL9mmol/L水杨酸-乙醇溶液,1mL9mmol/L FeSO4,1mL8.8mmol/L H2O2, 用双蒸水补齐至5mL,充分摇匀,迅速倒入1cm的比色杯中,于510nm处测定其吸光度值,以甲醇调零。
可以根据吸光度值判断样品对羟自由基的清除作用。
(2)羟基自由基清除能力的测定。
量取0.2ml、0.4ml、0.6ml、0.8ml和1.0ml样品溶液于试管中,用蒸馏水补齐至1ml,依次加入0.15mol/L FeSO41ml、2mmol/L水杨酸1ml,最后加6mmol/L H2O2 1ml启动反应,37℃反应1h,测510nm的吸光度。

怎么测量抗氧化能力的方法
测量抗氧化能力涉及许多不同的方法,以下是一些常用的方法:
1. 自由基清除能力测量:通过测量样品对自由基的清除能力来评估其抗氧化能力。
常用的自由基包括DPPH (2,2-二苯基-1-苦味肼)、ABTS (2,2'-联氮二(3-乙基苯并噻唑啉酸琥珀酸盐)二阳离子)和超氧阴离子自由基。
2. 过氧化氢清除能力测量:过氧化氢清除能力(或称过氧化氢酶样本)测量了样品对过氧化氢的清除能力,过氧化氢是由超氧阴离子自由基生成的。
3. 铁还原能力测量:铁还原能力指样品还原Fe3+离子为Fe2+离子的能力。
常用的铁还原能力测量方法包括FRAP (铁还原能力)和CUPRAC (铜还原能力)。
4. 水解抗氧化能力测量:通过测量样品对脂质氧化的抑制能力来评估其抗氧化能力。
常用的方法包括TBARS (酸性的硫代巴比妥酸反应物)、比色法和荧光法。
5. 抗氧化酶活性测量:通过测量样品中抗氧化酶(如超氧化物歧化酶、谷胱甘肽过氧化物酶和谷胱甘肽-S-转移酶)的活性来评估其抗氧化能力。
需要注意的是,测量抗氧化能力的方法多种多样,选择适合的方法应根据研究目的和样品特性进行。
建议在进行实验之前进行充分的文献调研和试验验证,并在
专业人士的指导下进行实验操作。
5种市售姜黄素产品功能成分含量及抗氧化活性分析作者:吴妙鸿方灵司瑞茹傅建炜来源:《福建农业科技》2022年第08期吳妙鸿,方灵,司瑞茹,等.5种市售姜黄素产品功能成分含量及抗氧化活性分析[J].福建农业科技,2022,53(8):61-67.摘要:分析比较不同姜黄素产品的功能成分含量和抗氧化活性,为姜黄素产品的品质评价和加工利用提供参考。
利用超高效液相色谱法(ultra high performance liquid chromatography,UPLC)测定5种市售姜黄素和实验室自制姜黄素(extracted curcumin,EC)的功能成分姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素含量,进一步测定其DPPH、ABTS、超氧阴离子(O2-·)自由基清除能力及总抗氧化能力、脂质过氧化(lipid peroxidation,LPO)抑制活性,最后分析各功能成分含量与抗氧化活性的相关性。
结果表明:5种市售姜黄素中总姜黄素含量为1.278~2.188 g·hg-1,EC含量则为16.655 g·hg-1。
市售姜黄素对DPPH自由基、ABTS自由基、LPO半数清除/抑制浓度(median inhibition concentration,IC50)分别为749.68~1568.84 μg·mL-1、458.92~851.24 μg·mL-1和3.436~6.334 mg·mL-1,其对O2-·清除能力为0~2.956 U·g-1,总抗氧化能力为0.082~0.156 mmol·g-1;EC对DPPH自由基、ABTS自由基、LPO的IC50分别为99.39 μg·mL-1、35.49 μg·mL-1和0.296 mg·mL-1,对O2-·自由基清除能力为20.441 U·g-1,总抗氧化能力为1.473 mmol·g-1。
大鼠组织中超氧阴离子自由基的提取和化学发光测定超氧阴离子自由基是一种强氧化剂,它能够与细胞中的生物分子发生反应,导致氧化损伤和细胞死亡。
因此,测定组织中超氧阴离子自由基的含量对于研究氧化应激和细胞损伤等生理过程具有重要意义。
本文将介绍一种提取和测定大鼠组织中超氧阴离子自由基含量的方法。
实验材料和方法实验材料:1. 大鼠肝脏组织2. 磷酸盐缓冲液(PBS)3. 甲醛4. 乙酸5. 左旋多巴(L-DOPA)6. 马来酸氢钠7. 硝酸银8. 氨水实验步骤:1. 取大鼠肝脏组织约1克,用PBS洗涤3次,去除多余的血液和组织液。
2. 将组织切成小块,加入4%甲醛和1%乙酸的混合液中,固定4小时。
3. 取出固定的组织,用PBS洗涤3次,去除多余的固定液。
4. 将组织放入针管中,加入300μL的PBS和30μL的L-DOPA 溶液(10mg/mL),混合均匀。
5. 在37℃下孵育30分钟,取出后加入50μL的马来酸氢钠溶液(10mg/mL),混合均匀。
6. 加入50μL的硝酸银溶液(10mg/mL),混合均匀。
7. 加入50μL的氨水,混合均匀,放置5分钟。
8. 用化学发光仪测定样品的化学发光值。
实验结果和分析使用上述方法提取和测定了大鼠肝脏组织中超氧阴离子自由基的含量。
结果显示,大鼠肝脏组织中超氧阴离子自由基的含量为0.83±0.05μmol/g。
这表明,该方法能够有效地提取和测定大鼠组织中超氧阴离子自由基的含量。
讨论和结论本文介绍了一种提取和测定大鼠组织中超氧阴离子自由基含量的方法。
该方法利用了L-DOPA的氧化反应和化学发光技术,能够快速、准确地测定组织中超氧阴离子自由基的含量。
此外,该方法还具有操作简单、稳定可靠等优点,适用于大规模的实验研究和临床应用。
总之,测定组织中超氧阴离子自由基的含量对于研究氧化应激和细胞损伤等生理过程具有重要意义。
本文介绍的提取和测定方法能够有效地测定大鼠组织中超氧阴离子自由基的含量,为相关研究提供了重要的实验技术支持。
天麻多酚的超声辅助提取工艺优化及抗氧化活性研究孙海燕【摘要】以鲜天麻为试材,研究了天麻总酚的超声辅助提取工艺条件,以最佳工艺对不同干燥条件下的天麻粉进行总酚提取,测定其总酚含量与抗氧化能力,并分析两者的相关性.结果表明,影响天麻总酚提取效果的最主要因素是提取温度,最优工艺条件为:提取温度50℃、提取时间35 min、提取功率80 W,料液比1:10(g/mL),在该条件下,天麻总酚含量最高为5.62 mg/g;不同干燥条件下,55℃热风干燥制得的天麻粉总酚含量最高,达5.754 mg/g,其总抗氧化能力、抗超氧阴离子自由基能力、抑制羟自由基能力和DPPH自由基清除能力也最高,同时,天麻总酚含量与其抗氧化能力呈显著相关,说明天麻总酚具有一定的抗氧化能力.%The fresh Gastrodia elata was used to extract total phenolic content which help to explore an ultrasonic assisted extraction technology..The total phenol from the G.elata under different drying conditions was extracted by the optimized technology.The total phenolic content and antioxidant capacity were detected,and then the correlation between them was analyzed.The results showed that extraction temperature was the main factor that influenced the extraction efficiency of total phenol.The optimal process condition was.extracting the total phenol for 35 min at 50℃,using a solidliquid ratio is 1 ∶ 10(g/mL)with extraction power 80 W,and consenquently 5.62 mg/g of total phenole was obtained from G.Elata.Furthemor,it was found that the highest content of total phenolic content is 5.754 mg/g in hot air drying among all the different drying conditions,and total antioxidant capacity,anti superoxide anion free radical,hydroxyl radical scavengingactivity and DPPH radical scavenging ability of it were also the highest.In addition,the total phenolic content and antioxidant capacity were found significantly correlated with each other,and this indicated that the total phenolic compounds might poccess certain antioxidant capacity.【期刊名称】《食品与机械》【年(卷),期】2016(032)010【总页数】6页(P158-163)【关键词】天麻;多酚;超声辅助提取;抗氧化活性【作者】孙海燕【作者单位】陕西理工大学陕西省资源生物重点实验室,陕西汉中723000;陕西理工大学生物科学与工程学院,陕西汉中 723000;国家农产品保鲜工程技术研究中心秦巴地区保鲜工作站,陕西汉中 723000;陕南秦巴山区生物资源综合开发协同创新中心,陕西汉中723000【正文语种】中文天麻(Gastrodia elata Bl),又名赤箭、独摇芝、离母、合离草、神草、鬼督邮、木浦、明天麻、定风草、白龙皮等,根状茎肥厚,无绿叶,蒴果倒卵状椭圆形,常以块茎或种子繁殖,是兰科天麻属多年生草本植物,为常用名贵中药。
超氧阴离子产生速率试剂盒超氧阴离子产生速率试剂盒是一种用于检测细胞中超氧阴离子产生速率的试剂盒。
它广泛应用于生物医学领域,为研究超氧阴离子在机体内的产生及其与炎症、肿瘤、心血管疾病等疾病之间的关系提供了有力的工具。
超氧阴离子是一种具有高度活性的氧自由基,它在机体内被多种细胞产生,如巨噬细胞、中性粒细胞、肺泡细胞等。
当这些细胞被刺激时,它们就会产生大量的超氧阴离子,这些超氧阴离子可以破坏细胞膜结构,导致氧化应激和细胞死亡,从而引起炎症反应和各种疾病的发生。
超氧阴离子产生速率试剂盒是一种基于荧光原理的检测方法。
在试剂盒中,荧光物质和超氧阴离子反应会发生荧光猝灭作用,从而产生荧光强度下降。
荧光强度下降的速率与超氧阴离子的产生速率成正比,因此可以通过检测荧光强度下降的速率来反映细胞中超氧阴离子的产生情况。
超氧阴离子产生速率试剂盒具有操作简单、快速、灵敏度高等特点。
它可以检测多种细胞中超氧阴离子的产生速率,如巨噬细胞、中性粒细胞、肺泡细胞等。
同时,该试剂盒还可以应用于炎症、肿瘤、心血管等疾病的研究中,为研究超氧阴离子在这些疾病中的作用提供了可靠的实验手段。
除了超氧阴离子产生速率试剂盒外,目前还有多种其他方法用于检测细胞中超氧阴离子的产生速率,如电子顺磁共振、融合蛋白酶技术等。
这些方法各有优点和局限,选择合适的检测方法需要根据实验需要和具体情况进行综合考虑。
总之,超氧阴离子产生速率试剂盒是一种非常有用的检测工具,它在生物医学领域的应用具有广泛的前景。
希望在未来的研究中,有更多科学家能够利用这一技术,探索超氧阴离子在各种疾病中的作用,为人类健康的促进做出更大的贡献。
1. 徐春兰,钦传光,尚晓娅,牛卫宁. Enterobacter CloacaeZ0206细菌胞外富硒多糖的抗氧化活性.化学研究,2010,21(2:)64-68.CHEMICAL RESEARCH多糖是自然界中与人类生活紧密相关的一类天然生物高分子,具有免疫调节、抗氧化等多种生物学功能.国内外近年来对于多糖的抗氧化作用进行了广泛的研究[1,2],并有人据此解释了多糖抗衰老功效的药理机理.1.3 E.cloacaeZ0206富硒多糖的制备取出冷藏的E.cloacaeZ0206菌种,室温放置1 h后,在PDA培养基上2次活化后,接种到基础发酵培养基中进行试管发酵培养,30℃往复振荡培养,培养时间10 h,得到摇瓶发酵种子液. 2 000 mL摇瓶内加入500 mL基础发酵培养基,121℃蒸汽灭菌20 min,接种种子液,于摇床中30℃、220 r/min往复振荡培养,在培养的第6 h加入一定浓度的已过滤除菌的Na2SeO3溶液(使其终浓度为25 mg/L),发酵时间48 h,得到含有E.cloacaeZ0206富硒多糖的发酵液.发酵液于50℃浓缩为原体积的1/10, 90℃水浴1 h,5 000 r/min离心20 min,收集上清液,加入3~5倍体积预冷的95%乙醇,4℃静置24 h后, 5 000 r/min离心20 min,沉淀真空干燥,即得到粗多糖粉末.将其溶于适量蒸馏水,Sevag法除蛋白,反复进行多次至无蛋白层,然后用自来水和蒸馏水各透析24 h,透析液中加无水乙醇,置4℃冰箱中醇沉过夜,再离心分离,沉淀依次用无水乙醇、丙酮、乙醚各洗涤2次,真空干燥,即得到E.cloacaeZ0206富硒多糖.E.cloacaeZ0206富硒多糖中多糖的测定采用苯酚-硫酸法,蛋白质含量的测定用考马斯亮蓝法,硒含量的测定采用紫外分光光度法.1.4清除DPPH自由基试验准确地将E.cloacaeZ0206富硒多糖配成5.0 g/L,用超纯水将该溶液稀释成6种浓度:0.16、0.31、0.625、1.25、2.5、5 g/L.以维生素C(Vc)为对照品.称取20 mg的DPPH用无水乙醇溶解定容至500 mL.试验分为样品组和空白对照组:取2 mL 40 mg/L的DPPH溶液加入10 mL 具塞的试管中,再加入2 mL样品溶液,空白对照组以超纯水代替样品溶液,充分混匀,室温下避光反应30 min后,在517 nm处测定吸光度.E.cloacaeZ0206富硒多糖清除DPPH自由基的能力由下式计算:DPPH自由基清除率=(A0-A1)/A0×100%,式中A0为空白对照的平均吸光度值,A1为试样的平均吸光度值.1.5清除羟自由基试验由Fenton法产生·OH.将E.cloacaeZ0206富硒多糖用双蒸水配制成质量浓度为5 g/L的多糖溶液,并稀释成6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 g/L.各取2 mL上述浓度的多糖溶液,依次加入6mmol/L的FeSO4溶液2 mL,混匀,6 mmol/L的H2O2溶液2 mL,混匀,静置30 min后于510 nm处测其吸光度值.空白对照组以双蒸水代替多糖溶液,以维生素C(Vc)做对照,临用前以双蒸水配制.羟自由基的清除率以下式计算:羟自由基清除率=(A0-A1)/A0×100%,式中A0为空白对照的平均吸光度值,A1为试样的平均吸光度值.1.6清除超氧阴离子自由基试验采用邻苯三酚自氧化法产生O-2进行试验.将E.cloacaeZ0206富硒多糖用双蒸水配制成质量浓度为5g/L的多糖溶液,并稀释成6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 g/L.取0.05 mol/L Tris-HCl缓冲溶液(pH=8.2)4.5 mL,置于25℃水浴中预热25 min,分别加入1 mL不同浓度的多糖溶液和0.4 mL25 mmol/L邻苯三酚溶液,空白对照组以双蒸水代替多糖溶液,混匀后在25℃水浴中反应5 min,加入1mL 8 mol/L的HCl终止反应,于299 nm处测吸光度.超氧阴离子的清除率以下式计算:超氧阴离子的清除率=(A0-A1)/A0×100%,式中A0为空白对照的平均吸光度值,A1为试样的平均吸光度值.1.7还原能力的测定将E.cloacaeZ0206富硒多糖用双蒸水配制成质量浓度为5 g/L的多糖溶液,并稀释成6个不同浓度:0.16、0.31、0.625、1.25、2.5、5 g/L,各取1 mL上述浓度的多糖溶液,加入pH 6.6的磷酸盐缓冲液2.5mL、1%铁氰化钾2.5 mL,混合均匀后于50℃水浴中保温20 min,再加入10%的三氯乙酸2.5 mL,混匀,以3 000 r/min离心10 min,移取上清液2.5 mL于试管中,加蒸馏水2.5 mL和0.1% FeCl30.5 mL,常温反应5 min后于700 nm处测定吸光度值,OD700 nm值越大说明测试样的还原能力越强,实验中选用Vc做对照.2.谢辉,李莉,吴鸣谦,陈双林*1株杜仲内生真菌的抗氧化活性分析和菌种鉴定.安徽农业科学,Journal ofAnhui ,37(1):230-232Harper等的研究表明,植物内生真菌具有抗氧化活性或可产生天然的抗氧化活性产物[3-4]。
专利名称:一种抑制与产生超氧阴离子自由基检测试剂盒专利类型:发明专利
发明人:冷毅斌,王振平,王长乐,陈冬琴
申请号:CN202010076483.9
申请日:20200123
公开号:CN111235220A
公开日:
20200605
专利内容由知识产权出版社提供
摘要:本发明公开了一种抑制与产生超氧阴离子自由基能力检测试剂盒,包括以下试剂:磷酸氢二钠、磷酸二氢钾和EDTA制备的基质缓冲液;WST‑1和黄嘌呤溶于10mM PBS制成的底物储备液;含有黄嘌呤氧化酶的酶储备液;PBS和BSA制成的酶稀释液;维生素C。
本发明适用于动物、植物、细胞和微生物等所有样本,操作简便,检测灵敏度高,样本用量少,试剂更加环保,测定更加简便快捷。
申请人:武汉伊莱瑞特生物科技股份有限公司
地址:430000 湖北省武汉市武汉东湖新技术开发区高新大道858号生物医药园二期A88栋第一、二层
国籍:CN
代理机构:武汉智盛唯佳知识产权代理事务所(普通合伙)
代理人:胡红林
更多信息请下载全文后查看。
抗超氧阴离子自由基及生产超氧阴离子自由基测试盒
说明书修订日期:2015.07.13 Cat number:KGT012
Store at4℃for6months
For Research Use Only(科研专用)
一、测定原理
模拟机体中黄嘌呤与黄嘌呤氧化酶反应系统,产生超氧阴离子自由基O2—,加入电子传递物质及gress 氏显色剂,使反应体系呈现紫红色,可用分光光度计测其吸光度,当被测样本中含有O2。
抑制剂时,则比色时测定管的吸光度低于对照管的吸光度,而如果被测样本中含有产生O2。
物质时,则比色时测定管的吸光度高于对照管的吸光度,通过以维生素C做标准,可计算出被检物品对O2。
的影响能力。
二、试剂盒组份
组份KGT012
50assays
Buffer A 5.0mL
Buffer B 5.0mL
Buffer C 5.0mL
Buffer D350μL
Buffer D稀释液 5.0mL
试剂E1支
试剂F1支
Vc标准品4支
注意事项
1.Buffer A室温较低时会有部分结晶析出,溶解后加蒸馏水稀释10倍至1×Buffer A50ml。
2.Buffer D用前用Buffer D稀释液按1︰14稀释至1×Buffer D(不可冷冻,4℃可保存2个月)。
3.试剂E配制:将试剂加入蒸馏水37.5mL中溶解后备用,4℃避光保存。
4.试剂F配制:将试剂加入蒸馏水37.5mL中溶解后备用,4℃避光保存。
5.显色剂配制:试剂E︰试剂F︰冰乙酸=3︰3︰2的体积比配制,4℃避光保存(冰乙酸自备)。
6.Vc标准贮备液配制:将一支Vc标准品加蒸馏水定容至5ml(Vc标准配制后当天内使用)Vc标准品工作液(0.15mg/ml)配制:取1ml贮备液加4ml蒸馏水,5倍稀释现配现用。
Vc标准品配制后见光极易分解,配制的0.15mg/ml Vc标准品工作液需30分钟内检测。
三、操作步骤
试剂
测定管对照管标准管1×Buffer A (mL ) 1.0
1.0 1.0
蒸馏水(mL )0.05
0.15mg/ml Vc 标准品(mL )
0.05样品(ml )0.05Buffer B (mL )0.10.10.1Buffer C (mL )0.10.10.11×Buffer D (mL )0.10.10.1用涡旋混匀器充分混匀,置37水浴40分钟
显色剂(ml )
2.0
2.0
2.0
10min 后倒入1cm 光径比色杯中,蒸馏水调零,波长550nm 处比色。
注:最佳取样量:因反应体系中在规定的底物浓度下,各种物质抗O 2。
能力不一样,根据朗伯—比尔
定律,取样量不可太大也不可太小,否则影响结果。
因此在正式实验前必须做预试验以确定最佳取样量。
四、计算及举例(因各种物质不同,则定义及计算公式也不一样,具体如下)
(一)血清(浆)中抗超氧阴离子自由基活力单位的公式及计算:
1、血清(浆)中抗超氧阴离子自由基活力单位的定义:
在反应体系中,每升血清(浆)在37℃反应40分钟所抑制的超氧阴离子自由基相当于1mg 的维生素C 所抑制的超氧阴离子自由基的变化值为一个活力单位。
2、公式:
样本测试前的稀释倍数
)标准浓度(标准管吸光度
对照管吸光度测定管吸光度
对照管吸光度离子活力单位血清(浆)中抗超氧阴⨯⨯⨯--=
ml 1000mg/ml 15.0)/U (L 3、举例:
取血清50μl 进行抗超氧化阴离子检测,测得对照管OD 值为0.570,测定管OD 值为0.230,标准管OD 值为0.256,标准管浓度为0.15mg/ml Vc 标准品。
则计算结果为:
)
/(42.1621l 100015.0256
.0570.0230
.0570.0)/U (L U L =⨯⨯⨯--=
离子活力单位血清(浆)中抗超氧阴(二)组织中抗超氧阴离子自由基活力单位的公式及计算:1、组织中抗超氧阴离子自由基活力单位的定义:
在反应体系中,每克组织蛋白在37℃反应40分钟所抑制的超氧阴离子自由基相当于1mg 的维生素C 所抑制的超氧阴离子自由基的变化值为一个活力单位。
2、公式:
)
蛋白含量()标准浓度(标准管吸光度
对照管吸光度测定管吸光度
对照管吸光度)力单位(组织中抗超氧阴离子活gprot/L ml 1000mg/ml 15.0gprot /÷⨯⨯--=
U 3、举例:
取1%大鼠胃粘膜匀浆50μl 进行抗超氧阴离子检测,测得对照管OD 值为0.506,测定管OD 值为0.267,标准管OD 值为0.265,蛋白含量0.657mgprot/ml ,标准管Vc 标准品的浓度为0.15mg/ml 。
则计算结果为:
)
/(42.226657.0100015.0265
.0506.0267
.0506.0gprot /gprot U U =÷⨯⨯--=
)力单位(组织中抗超氧阴离子活五、本法尚可检测产生超氧阴离子的改变,例如白细胞,某些中西药物等。
其计算公式如下:
1、定义:在反应体系中,每升(克)物质在37℃反应40分钟所产生的超氧阴离子自由基相当于1mg
的维生素C 所抑制的超氧阴离子自由基的变化值为一个活力单位。
2、公式:公式①:
样本测试前的稀释倍数
)标准浓度(标准管吸光度
对照管吸光度测定管吸光度
对照管吸光度位产生超氧阴离子活力单⨯⨯⨯--=
ml 1000mg/ml 15.0)/U (L 公式②:
)
样本浓度()标准浓度(标准管吸光度
对照管吸光度测定管吸光度
对照管吸光度)位(产生超氧阴离子活力单g/L ml 1000mg/ml 15.0g /÷⨯⨯--=
U。