化学实验报告单:探究铜的化学性质
- 格式:pdf
- 大小:129.35 KB
- 文档页数:2

世上无难事,只要肯攀登铜的分析化学性质1.铜的氧化还原性质铜的价电子结构为3d104s1。
在它的次外层有18 个电子,由于有较多的电子处于离核较远的外层,所以对原子核的屏蔽效应就较小,相应地原子核的有效核电荷就较多,铜原子对外层s 电子的束缚力也就较强,因而铜是不活泼的金属元素。
铜是变价元素(主要呈现+1 价和+2 价两种价态),因而具有氧化还原性质。
铜的氧化还原性质在分析中的应用十分广泛,可用于分解铜矿石、分析掩蔽铜对其他元素的干扰、用氧化还原法测定铜等等。
例如,铜不能溶于非氧化性的酸中,但利用其氧化还原性质,可用硝酸溶解铜,硝酸使铜氧化并把铜转移到溶液中,同时放出氮的氧化物。
通常采用的测定铜的碘量法也是基于铜的原子价可变的特性。
又如,Cu2+与S2O32-作用。
产生硫化亚铜沉淀,此反应可用于铜与其他元素的分离:在用碘量法测定铜前,为了使铜从试液中分离来,可加入Na2S2O3 使铜沉淀为硫化亚铜析出,经灼烧转为氧化铜,然后用硝酸溶解,用盐酸赶硝酸,最后用碘量法测定铜。
反应如下:2Cu2+ +2S2O32-+2H2O =Cu2S↓+S↓+4H++2SO42-2Cu2+ +2S2O32-=Cu2S↓+ 3SO2↑2.铜的配位性质它的简单离子在水溶液中都以水合配位离子[ Cu(H2O)4]2+的形式存在。
铜离子能与许多具有未共用电子对的配位体(包括无机的和有机的)形成配合物。
铜离子的配合性质,对于比色法测铜、配位滴定法测铜和对铜的分离、富集、掩蔽等,均具有十分重大的意义。
例如:利用Cu2+与CN-反应生成的Cu+的氰配合物[Cu(CN)4]3-,可掩蔽。

铜银锌镉汞实验报告铜银锌镉汞实验报告引言:本次实验旨在研究铜、银、锌、镉和汞这五种金属元素的性质和反应。
通过实验观察和数据分析,我们将探究它们的物理特性、化学性质以及它们在实际应用中的重要性。
一、实验材料和方法1. 实验材料:- 铜片、银片、锌片、镉片、汞片- 硝酸铜溶液、硝酸银溶液、硝酸锌溶液、硝酸镉溶液、硝酸汞溶液- 氯化钠溶液、硝酸钠溶液、氯化铵溶液、硫酸铵溶液- 高锰酸钾溶液、盐酸、氢氧化钠溶液2. 实验方法:- 实验一:铜、银、锌、镉和汞的物理性质测定- 实验二:铜、银、锌、镉和汞的化学性质研究二、实验结果和分析1. 实验一:铜、银、锌、镉和汞的物理性质测定通过测量铜、银、锌、镉和汞的密度、熔点和沸点,我们得到了以下结果: - 铜的密度为8.96 g/cm³,熔点为1083°C,沸点为2567°C。
- 银的密度为10.49 g/cm³,熔点为961.78°C,沸点为2162°C。
- 锌的密度为7.13 g/cm³,熔点为419.53°C,沸点为907°C。
- 镉的密度为8.65 g/cm³,熔点为321.07°C,沸点为767°C。
- 汞的密度为13.55 g/cm³,熔点为-38.83°C,沸点为356.73°C。
通过对比这些数据,我们可以看出不同金属元素的物理性质存在明显的差异。
例如,铜具有较高的密度和熔点,而汞则具有较低的熔点和沸点。
2. 实验二:铜、银、锌、镉和汞的化学性质研究在实验二中,我们研究了铜、银、锌、镉和汞的化学性质。
以下是我们观察到的一些现象和反应:- 铜和硝酸反应产生铜离子和氮氧化物气体。
- 银和盐酸反应生成银离子和氯化银沉淀。
- 锌和硫酸反应生成锌离子和氢气。
- 镉和氯化铵反应生成镉离子和氯化铵沉淀。
- 汞和氯化钠反应生成汞离子和氯化钠沉淀。

第1篇一、实验目的1. 熟悉化学实验的基本操作和注意事项。
2. 掌握化学实验的基本技能,如滴定、过滤、蒸发等。
3. 学习化学实验的基本原理和方法,培养实验操作能力。
4. 培养科学探究精神和严谨的实验态度。
二、实验内容1. 氧气的制取与检验2. 铁的化学性质3. 氢气的制取与检验4. 盐酸和氢氧化钠的中和滴定5. 氯化钠的溶解度测定6. 铜的化学性质7. 铝的化学性质8. 氢氧化铁胶体的制备与性质9. 氢氧化钠溶液的配制10. 硫酸铜溶液的配制三、实验步骤1. 氧气的制取与检验(1)取一定量的过氧化氢溶液,加入少量二氧化锰,用导管将氧气导入集气瓶中。
(2)检验氧气:将带火星的木条伸入集气瓶中,观察木条是否复燃。
2. 铁的化学性质(1)取少量铁粉,加入稀盐酸中,观察铁粉与盐酸的反应。
(2)取少量铁粉,加入硫酸铜溶液中,观察铁粉与硫酸铜的反应。
3. 氢气的制取与检验(1)取一定量的锌粒,加入稀盐酸中,用导管将氢气导入集气瓶中。
(2)检验氢气:将氢气点燃,观察火焰颜色。
4. 盐酸和氢氧化钠的中和滴定(1)用滴定管取一定体积的盐酸溶液,放入锥形瓶中。
(2)用滴定管取一定体积的氢氧化钠溶液,逐滴加入锥形瓶中,观察颜色变化。
(3)记录滴定终点,计算所需氢氧化钠溶液的体积。
5. 氯化钠的溶解度测定(1)取一定量的氯化钠固体,放入烧杯中,加入适量蒸馏水。
(2)用玻璃棒搅拌,观察氯化钠是否完全溶解。
(3)记录溶解度。
6. 铜的化学性质(1)取少量铜片,加入稀硫酸中,观察铜片与稀硫酸的反应。
(2)取少量铜片,加入硝酸银溶液中,观察铜片与硝酸银的反应。
7. 铝的化学性质(1)取少量铝片,加入稀盐酸中,观察铝片与稀盐酸的反应。
(2)取少量铝片,加入氢氧化钠溶液中,观察铝片与氢氧化钠的反应。
8. 氢氧化铁胶体的制备与性质(1)取少量氯化铁溶液,加入蒸馏水中,搅拌。
(2)观察氢氧化铁胶体的颜色和性质。
9. 氢氧化钠溶液的配制(1)称取一定量的氢氧化钠固体,放入烧杯中。

初中化学实验报告单实验名称:醋酸铜的等压加热分解一、实验目的1.了解醋酸铜的化学性质;2.掌握等压加热分解实验方法;3.探究醋酸铜分解产物的性质。
二、实验原理醋酸铜是一种无机化合物,化学式为Cu(CH3COO)2、其晶体十分稳定,在经过加热过程中会发生分解反应,生成醋酸和氧化铜。
分解反应的化学方程式如下所示:2Cu(CH3COO)2→2CuO+4CH3COOH+CO2↑三、实验器材与试剂1.器材:燃气燃烧炉、圆底烧瓶、烧杯、玻璃棒;2.试剂:醋酸铜。
四、实验步骤1.在燃气燃烧炉上搭设好装置,将圆底烧瓶放在燃烧炉上,并加热;2.将适量的醋酸铜粉末放入圆底烧瓶内,用玻璃棒将粉末均匀地摊开;3.加热圆底烧瓶,保持加热的均匀性,不要让粉末集中在一个地方;4.当圆底烧瓶内部产生弱光时,即可停止加热;5.将圆底烧瓶从燃烧炉上取下,冷却至室温;6.将冷却后的圆底烧瓶称重,记录下质量。
五、结果记录与分析根据实验操作步骤所得到的结果记录和其分析,应详细记载实验过程中的各种观察和实验数据。
如实验前后醋酸铜的质量变化、产物形态等,可通过实验前后的质量差来验证反应是否发生。
六、实验结论通过实验,我们可以发现在加热醋酸铜的过程中,醋酸铜经过分解反应产生了醋酸、氧化铜和二氧化碳。
实验结果可以得到实验前后醋酸铜质量的差异,进一步验证了反应是否发生。
七、实验注意事项1.实验过程中要注意安全,避免引发火灾和爆炸;2.加热时避免剧烈震荡或溅出,注意照顾周围环境;3.操作时要戴好眼镜和手套,避免化学物质对身体的伤害;4.加热结束后,离开实验台时,要关闭燃气燃烧炉;5.实验结束后要及时清理实验器材和废弃物。
以上就是本次实验的实验报告单,通过本次实验我们实验了醋酸铜的等压加热分解的过程,并通过实验结果验证了醋酸铜分解产物的性质。
实验过程中我们注意了安全,严格遵守实验操作规程,确保了实验的顺利进行。
通过这次实验,我们对化学实验的操作方法和注意事项有了更深刻的了解,并对醋酸铜的化学性质有了更加直观的认识。

化学铜的化学性质及应用铜是一种常见的有色金属,在古代被广泛用于制造器具、装饰品等。
随着化学技术的发展,人们开始探索铜的化学性质及其应用。
化学铜是指纯度较高的铜,它具有多种独特的化学性质和广泛的应用。
一、化学铜的物理性质化学铜的外观呈现亮铜色,具有良好的延展性和可塑性。
它的密度相对较高,大约为8.96g/cm³。
化学铜的熔点较高,为1083℃,且在高温下不易氧化和蒸发。
二、化学铜的化学性质1、化学铜的氧化性化学铜很容易发生氧化反应,尤其是在高温和潮湿环境下,易形成黑色氧化铜。
氧化铜不仅会破坏化学铜的表面光洁度,还会对其物理性质和化学性质产生影响。
2、化学铜的酸碱性化学铜在酸性环境中易被腐蚀,产生铜离子和氢气,例如:Cu + 2HCl = CuCl2+H2。
在碱性环境中,化学铜会被氢氧根离子腐蚀,如:Cu+2OH- = Cu(OH)2。
3、化学铜的还原性化学铜具有一定的还原性,可以发生多种还原反应。
例如,化学铜和稀硝酸反应可以生成亚硝酸盐和氮气,如:3Cu + 8HNO3 = 3Cu(NO3)2+2NO+4H2O。
化学铜还可以还原银离子和二价铁离子,发生置换反应,如Cu+2AgNO3 = Cu(NO3)2+2Ag。
4、化学铜的络合反应化学铜可以与氨等配体形成络合物,如Cu2+ + 4NH3 =Cu(NH3)42+。
化学铜的络合性质使它在催化剂、电池、纺织品染料和水处理等领域有着广泛的应用。
三、化学铜的应用1、制造电子产品化学铜作为一种优良的导电材料,被广泛应用于电子产品的制造中。
例如,其用于印刷电路板、薄膜电池、集成电路等领域。
化学铜在电子行业中应用的前景很广阔,此类产品的需求量也会持续增长。
2、制造建筑材料化学铜具有很好的耐腐蚀性和美观性,因此在建筑领域有着广泛的应用。
其中着重提到的是铜材料的建筑保温层,在保温和美观性方面都达到了很好的平衡。
同时,建筑业的市场空间巨大,也为铜材料的应用提供了广泛的市场空间。
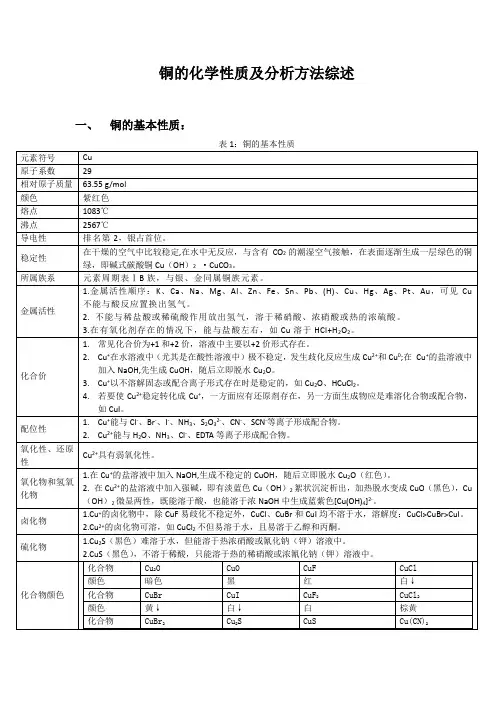
铜的化学性质及分析方法综述一、铜的基本性质:
二、铜的冶炼
表3:黄铜矿的冰铜熔炼法(举例)
表4:铜火法冶炼过程中几种形式铜的含量
三、铜的测定方法
四、碘量法
4.1碘量法的分类
4.2 碘量法测铜的一般分析流程:
一般分析流程:试样分解→分离富集→铜的测定。
表7:碘量法测铜的一般分析流程
基本原理:在弱酸性溶液中,Cu2+能被KI还原成CuI沉淀,同时析出与之计量相当的I2,然后以淀粉为指示剂,用硫代硫酸钠标准滴定溶液滴定释放出来的I2
主要反应:2Cu2++4I-=2CuI+I2; I2+2S2O32-=S4O62-+2I-
实质:氧化还原反应;电极电势正值越大,其氧化能力越强,是氧化剂;电极电势负值越大,
其还原能力越强,是还原剂。
问:电势比E I2/I-高的氧化性物质,可以在一定条件下,用I还原,然后用硫代硫酸钠滴定释放出的碘,但是从电极电位判断,似乎应当是I2氧化Cu+,而事实上却是Cu2+氧化I-,这是为什么?
答:因为生成了溶解度很小的CuI沉淀,使溶液中Cu+的浓度变的很小,因而铜电对的电位显著提高,从而使上述反应得以进行。
4.4碘量法测铜的主要干扰
五、常用碘量法测铜方法的比较
六、例讲(以铜精矿中铜量测定为例)
七、硫代硫酸钠标准溶液的配制和标定要求
八、碘量法连续测定方法的运用
表14:常见几种碘量法连续测定方法。


检测金属的实验报告单实验报告金属的检测实验目的:通过一系列的实验方法,检测金属的性质和特征,包括金属的热导性、电导性和化学性质。
实验器材:1. 金属样品(铜、铁、铝)2. 火柴3. 电池4. 电线5. 试管6. 盐酸7. 高锰酸钾溶液8. 温度计实验步骤:1. 测试金属的热导性:a. 将金属样品(铜、铁、铝)分别取出,并使用火柴将其加热。
b. 观察金属加热后的变化。
2. 测试金属的电导性:a. 使用电线将金属样品(铜、铁、铝)与电池连接。
b. 检测金属与电池连接后是否导通。
3. 测试金属的化学性质:a. 将金属样品(铜、铁、铝)分别放入不同的试管中。
b. 加入盐酸观察金属的反应情况。
c. 加入高锰酸钾溶液观察金属的反应情况。
实验结果:1. 热导性测试:a. 铜样品加热后迅速变热,火柴瞬间燃烧。
b. 铁样品加热后略慢于铜样品,火柴在金属上燃烧。
c. 铝样品加热后变热最慢,火柴无法点燃。
2. 电导性测试:a. 铜样品与电池连接后导通,灯泡亮。
b. 铁样品与电池连接后导通,灯泡亮。
c. 铝样品与电池连接后不导通,灯泡不亮。
3. 化学性质测试:a. 铜样品放入盐酸中,产生气泡,放出挥发性气体。
b. 铁样品放入盐酸中,产生气泡,放出挥发性气体。
c. 铝样品放入盐酸中,产生气泡,放出挥发性气体。
d. 铜、铁、铝样品分别放入高锰酸钾溶液中,没有反应产生。
实验讨论:1. 铜具有良好的热导性和电导性,因此能迅速传热和导电,也容易被酸类腐蚀。
2. 铁具有一定的热导性和电导性,但相对于铜来说较差,也容易被酸类腐蚀。
3. 铝的热导性和电导性都相对较差,且对酸类有较好的防腐能力。
4. 铜、铁、铝在高锰酸钾溶液中没有反应产生,说明金属在该溶液中比较稳定。
实验结论:通过热导性、电导性和化学性质的测试,确定了不同金属的特征和性质:1. 铜具有良好的热导性和电导性,容易被酸类腐蚀。
2. 铁具有一定的热导性和电导性,但相对于铜来说较差,容易被酸类腐蚀。

铜银锌镉汞实验报告
实验目的:通过观察和比较铜、银、锌、镉、汞这五种金属在不同条件下的性质和反应,了解它们的化学特性和应用价值。
实验原理:铜、银、锌、镉和汞都是金属元素,其化学性质不同,会在不同的条件下发生不同的化学反应。
本实验针对这五种金属分别进行了以下实验:
1.铜的性质:将几片铜片放入酸性溶液中,观察铜的腐蚀现象。
铜在酸性溶液中会发生氧化反应,生成二氧化硫和水,在反应过程中铜会逐渐腐蚀而消失。
5.汞的性质:将汞液加热至其汽化并生成蒸气,利用紫外线照射汞蒸气,观察汞的光谱现象。
汞蒸气通过紫外线激发,会发生原子发光和激发发光现象,产生不同波长的光谱线。
实验步骤:
1.铜的实验
将几片铜片放入小烧杯中,加入适量的稀酸性溶液,观察铜的腐蚀现象,记录下变化过程。
实验结果:
1.铜的实验:铜在酸性溶液中发生了氧化反应,逐渐腐蚀而消失。
2.银的实验:银在氧化银溶液中发生了还原反应,生成纯银和氧化物。
5.汞的实验:汞蒸气通过紫外线激发,产生多种不同波长的光谱线。
实验分析:
1.铜、锌、镉作为常见的金属元素,其腐蚀性都比较强,能够在酸性环境下发生氧化反应。
而银和汞的化学性质则较为特殊,银在氧化银溶液中通过还原反应得到纯银,汞的蒸汽能够被紫外线激发产生原子发光和激发发光现象。
2.铜、锌、镉和银都是重要的工业金属元素,广泛应用于化学工业、电子工业、医药工业等领域。
铜、银、锌和镉还可以被用于制作家居饰品、珠宝饰品等日用品。
而汞的应用范围较为狭窄,由于其毒性较大,现在已经很少被使用。

一、实验目的1. 探究铜的化学性质,了解铜与其他物质的反应规律。
2. 培养学生的实验操作技能和观察能力。
3. 提高学生对化学实验的兴趣。
二、实验原理铜是一种金属元素,具有独特的化学性质。
本实验主要探究以下铜的化学性质:1. 铜与酸的反应:铜与稀盐酸、稀硫酸、稀硝酸等酸反应,生成相应的铜盐和氢气或氮氧化物。
2. 铜与盐溶液的反应:铜与硫酸铜溶液、氯化铁溶液等盐溶液反应,发生置换反应。
3. 铜与氧气的反应:铜在加热条件下与氧气反应,生成氧化铜。
三、实验器材1. 仪器:烧杯、试管、酒精灯、镊子、玻璃棒、滴管、滤纸、天平等。
2. 药品:铜片、稀盐酸、稀硫酸、稀硝酸、硫酸铜溶液、氯化铁溶液、氢氧化钠溶液、氧化铜等。
四、实验步骤1. 铜与酸的反应(1)取一小块铜片,放入烧杯中。
(2)向烧杯中加入适量稀盐酸,观察现象。
(3)重复步骤(2),分别加入稀硫酸、稀硝酸,观察现象。
2. 铜与盐溶液的反应(1)取一小块铜片,放入试管中。
(2)向试管中加入适量硫酸铜溶液,观察现象。
(3)取另一小块铜片,放入另一试管中。
(4)向试管中加入适量氯化铁溶液,观察现象。
3. 铜与氧气的反应(1)取一小块铜片,放入烧杯中。
(2)用酒精灯加热烧杯,观察现象。
五、实验现象1. 铜与酸的反应(1)稀盐酸:无明显现象。
(2)稀硫酸:无明显现象。
(3)稀硝酸:铜片表面出现气泡,溶液逐渐变为蓝色。
2. 铜与盐溶液的反应(1)硫酸铜溶液:无明显现象。
(2)氯化铁溶液:铜片表面出现红色固体,溶液逐渐变为浅绿色。
3. 铜与氧气的反应铜片表面逐渐变黑,生成黑色固体。
六、实验结论1. 铜与稀盐酸、稀硫酸不反应,但与稀硝酸反应,生成硝酸铜和氮氧化物。
2. 铜与硫酸铜溶液、氯化铁溶液反应,发生置换反应,生成铜盐和金属。
3. 铜在加热条件下与氧气反应,生成氧化铜。
七、注意事项1. 实验过程中,注意安全,避免发生意外。
2. 实验过程中,严格控制实验条件,确保实验结果的准确性。

验探究是学习化学的基本途径.准备几小片铜片,探究金属铜的化学性质.请你参与下列探究:一、观察与问题:将一小块铜片放在酒精灯火焰上加热片刻,铜片表面变黑.二、假设与预测:假设(1)铜片加热变黑,是因为火焰的黑烟附着在铜片上;假设(2)铜片加热变黑,是因为铜片与氧气发生了化学反应.三、实验与事实:实验(1)用洁净的干布擦一擦铜片上的黑色物质,黑色物质不易被擦去;将铜片放入试管中,用酒精灯对试管加热片刻,铜片也变黑.实验(2)将铜片放入小试管中并塞上橡皮塞,再用酒精灯对试管加热直至铜片变黑.再将移至的另一端加热片刻,铜片不再变黑.四、解释与结论:上述实验(1)证实,假设(1)不正确(“正确”或“不正确”);实验(2)证实,假设(2)正确(“正确”或“不正确”).五、表达与交流:铜片在空气中加热,反应的文字表达式是:铜+氧气加热氧化铜加热.六、拓展与迁移:如果用真空泵抽去装有铜片的试管内的空气,或用氮气充满装有铜片的试管,然后加热,铜片不会(“会”或“不会”)变黑.如果用铝在空气中加热,发生反应的文字表达式是铝+氧气加热氧化铝加热.二、根据空气中各成分的化学性质,提出合理的假设:铜与氧气发生了化学反应;四、根据“实验与事实”,实验(1)用洁净的干布擦一擦铜片上的黑色物质,黑色物质不易被擦去;将铜片放入试管中,用酒精灯对试管加热片刻,铜片也变黑;实验(2)将铜片放入小试管中并塞上橡皮塞,再用酒精灯对试管加热直至铜片变黑.再将移至的另一端加热片刻,铜片不再变黑.可知假设(1)不正确;假设(2)正确;五、铜片在空气中加热,正确书写反应物和生产物:铜+氧气加热氧化铜;六、铜与氧气反应,但不与氮气反应;铝比铜的活动性强,也会和氧气反应生成氧化铝.解答:解:二、空气中氧气较为活泼,提出合理的假设:铜与氧气发生化学反应;四、根据“实验与事实”,实验(1)用洁净的干布擦一擦铜片上的黑色物质,黑色物质不易被擦去;将铜片放入试管中,用酒精灯对试管加热片刻,铜片也变黑;实验(2)将铜片放入小试管中并塞上橡皮塞,再用酒精灯对试管加热直至铜片变黑.再将移至的另一端加热片刻,铜片不再变黑.可证明假设(1)不正确;假设(2)正确;五、铜片在空气中加热,正确书写反应物和生产物:铜+氧气加热氧化铜;六、铜与氧气反应,但不与氮气反应;铝比铜的活动性强,也会和氧气反应生成氧化铝:铝+氧气加热氧化铝.氧气;不正确,正确;铜+氧气加热氧化铜;不会;铝+氧气加热;。
铜银锌镉汞实验报告实验目的,通过实验,了解铜、银、锌、镉、汞的性质和特点,并掌握它们的化学反应规律。
实验原理,铜、银、锌、镉、汞是常见的金属元素,它们在化学反应中具有不同的特性。
在实验中,我们将通过一系列的实验操作,观察它们在不同条件下的化学反应,从而了解它们的性质和特点。
实验步骤:1. 铜的性质实验,将铜片放入盛有盐酸的试管中,观察其化学反应。
2. 银的性质实验,将银粒放入盛有硝酸的试管中,观察其化学反应。
3. 锌的性质实验,将锌粒放入盛有硫酸的试管中,观察其化学反应。
4. 镉的性质实验,将镉粒放入盛有盐酸的试管中,观察其化学反应。
5. 汞的性质实验,将汞放入试管中,观察其性质。
实验结果:1. 铜的性质,铜与盐酸反应生成氢气和蓝绿色的铜盐。
2. 银的性质,银与硝酸反应生成氮氧化物和白色的沉淀。
3. 锌的性质,锌与硫酸反应生成氢气和无色的锌盐。
4. 镉的性质,镉与盐酸反应生成氢气和无色的镉盐。
5. 汞的性质,汞在常温下呈液态,不与常见酸碱反应。
实验结论:通过实验,我们了解到铜、银、锌、镉、汞在不同条件下的化学反应规律。
铜与盐酸反应生成蓝绿色的铜盐,银与硝酸反应生成白色的沉淀,锌与硫酸反应生成无色的锌盐,镉与盐酸反应生成无色的镉盐,而汞在常温下呈液态,不与常见酸碱反应。
这些实验结果有助于我们更深入地了解这些金属元素的性质和特点,为后续的化学研究和应用提供了重要的参考。
实验注意事项:1. 实验过程中要注意安全,避免接触有毒化学品。
2. 实验结束后要及时清理实验器材,保持实验环境整洁。
3. 实验操作要谨慎,避免发生意外。
总结,通过本次实验,我们对铜、银、锌、镉、汞的性质有了更深入的了解,掌握了它们的化学反应规律。
这些知识对于我们深入学习化学知识,提高化学实验操作技能具有重要意义。
希望大家能够在今后的学习和工作中,继续加强对化学知识的学习和实践,为科学研究和技术创新做出更大的贡献。
主族金属实验报告目录1. 铜的性质和用途1.1 物理性质1.2 化学性质1.3 工业用途2. 铁的性质和用途2.1 物理性质2.2 化学性质2.3 工业用途3. 铝的性质和用途3.1 物理性质3.2 化学性质3.3 工业用途感兴趣的读者可以逐个阅读以上内容,也可以选择跳过某些部分,直接阅读自己感兴趣的金属性质和用途部分。
1. 铜的性质和用途1.1 物理性质铜是一种红色金属,具有良好的导电性和导热性。
它的密度约为8.96克/立方厘米,熔点约为1083摄氏度,沸点约为2567摄氏度。
1.2 化学性质铜在空气中会逐渐氧化形成氧化铜,但是在干燥空气中氧化作用并不明显。
铜可以与非金属元素反应形成化合物,例如与氧气反应生成氧化铜。
1.3 工业用途铜是一种重要的工业金属,主要用于制造电线、电缆、电子器件等导电器件。
此外,铜也用于制造铜器、建筑材料、化工设备等。
2. 铁的性质和用途2.1 物理性质铁是一种常见的金属元素,具有银白色的外观。
它的密度约为7.87克/立方厘米,熔点约为1538摄氏度,沸点约为2861摄氏度。
2.2 化学性质铁在空气中容易氧化生成氧化铁,常见的氧化物有Fe2O3和Fe3O4。
铁与一些非金属元素也能发生反应,形成各种化合物。
2.3 工业用途铁是最常见的金属,被广泛用于建筑、机械制造、交通工具制造等领域。
它还是合金的重要成分,如钢铁就是铁与碳的合金。
3. 铝的性质和用途3.1 物理性质铝是一种轻金属,具有银白色的外观。
它的密度约为2.7克/立方厘米,熔点约为660摄氏度,沸点约为2467摄氏度。
3.2 化学性质铝在空气中很稳定,因为表面会生成一层氧化膜使其不易进一步氧化。
铝也能与非金属元素反应形成化合物。
3.3 工业用途铝是一种重要的工业金属,被广泛用于航空航天、汽车制造、建筑等领域。
它具有优良的导热性和耐腐蚀性,逐渐取代了一些传统的金属材料。
一、实验目的1. 探究铜的化学性质。
2. 通过实验验证铜与酸、盐溶液的反应。
二、实验用品1. 铜片2. 稀盐酸3. 硫酸铜溶液4. 硝酸银溶液5. 试管6. 烧杯7. 玻璃棒8. 酒精灯9. 铁片10. 滴管三、实验步骤1. 铜片与稀盐酸反应:a. 取一个试管,加入少量稀盐酸。
b. 将铜片放入试管中,观察现象。
c. 用玻璃棒搅拌,继续观察。
2. 铜片与硫酸铜溶液反应:a. 取一个烧杯,加入少量硫酸铜溶液。
b. 将铜片放入烧杯中,观察现象。
c. 用玻璃棒搅拌,继续观察。
3. 铜片与硝酸银溶液反应:a. 取一个烧杯,加入少量硝酸银溶液。
b. 将铜片放入烧杯中,观察现象。
c. 用玻璃棒搅拌,继续观察。
4. 铜片加热实验:a. 取一个试管,放入铜片。
b. 用酒精灯加热试管,观察现象。
四、实验现象1. 铜片与稀盐酸反应:无明显现象。
2. 铜片与硫酸铜溶液反应:无明显现象。
3. 铜片与硝酸银溶液反应:铜片表面出现银白色固体析出。
4. 铜片加热实验:铜片表面变黑,生成氧化铜。
五、实验结论1. 铜不与稀盐酸反应,说明铜的活动性低于氢。
2. 铜不与硫酸铜溶液反应,说明铜不能置换出硫酸铜溶液中的铜离子。
3. 铜能与硝酸银溶液反应,说明铜的活动性高于银。
4. 铜加热生成氧化铜,说明铜具有氧化性。
六、实验注意事项1. 实验过程中,注意安全,防止烫伤和化学药品中毒。
2. 实验结束后,及时清洗实验器材,避免污染。
七、实验总结本次实验通过观察铜与酸、盐溶液的反应,以及铜加热实验,验证了铜的化学性质。
实验结果表明,铜的活动性低于氢,但不能置换出硫酸铜溶液中的铜离子,而能与硝酸银溶液反应。
此外,铜加热生成氧化铜,说明铜具有氧化性。
本次实验有助于加深对金属化学性质的理解。
铜的化学性质有哪些铜的物理性质是什么(一)铜是不太活泼的重金属元素。
在常温下不与干燥空气中的氧反应。
但加热时能与氧化合成黑色的氧化铜CuO:继续在很高的温度下燃烧就生成红色的氧化亚铜Cu2O,Cu2O有毒。
(二)铜的化学性质有哪些铜是不太活泼的重金属元素。
在常温下不与干燥空气中的氧反应。
但加热时能与氧化合成黑色的氧化铜CuO:继续在很高的温度下燃烧就生成红色的氧化亚铜Cu2O,Cu2O有毒。
铜是一种过渡元素,化学符号Cu,英文copper,原子序数29。
1.与空气的反应(与O2、H2O、CO2反应):在潮湿的空气中放久后,铜表面会慢慢生成一层铜绿(碱式碳酸铜),铜绿可防止金属进一步腐蚀,其组成是可变的。
2.与卤素的反应:铜可与氯气在点燃条件下化合。
3.与氯化铁溶液反应:在电子工业中,常用FeCl3溶液来刻蚀铜,以制造印刷线路。
4、与空气和稀酸反应:在电位序(金属活动性顺序)中,铜族元素都在氢以后,所以不能置换稀酸中的氢。
但当有空气存在时,铜可先被氧化成氧化铜,然后再与酸作用然后缓慢溶于这些稀酸中。
(三)铜的物理性质是什么铜呈紫红色光泽的金属,密度8.92克/立方厘米。
熔点1083.4℃,沸点2567℃。
有很好的延展性。
导热和导电性能较好。
因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
(四)铜的相对原子质量铜(Cu)的相对原子质量是63.5,准确应为:63.546。
铜是一种过渡元素,化学符号Cu,原子序数29。
纯铜是柔软的金属,表面刚切开时为红橙色带金属光泽,单质呈紫红色。
延展性好,导热性和导电性高,因此在电缆和电气、电子元件是最常用的材料,也可用作建筑材料,可以组成众多种合金。
(五)相对原子质量是的计算方法:(1.993e)/12=1.667e千克。
然后再把其它某种原子的实际质量与这个数相比后所得的结果,这个结果的数值就叫做这种原子的相对原子质量。
如氧原子的相对原子质量求法为:(2.657e)/(1.667e)=16(约),即氧原子的相对原子质量约为16,我们在计算时就采用16。
一、实验目的1. 探究铜在酸性、碱性溶液中的溶解性。
2. 探究铜与不同离子的反应。
3. 了解铜在电解池中的溶解过程。
二、实验原理1. 铜在酸性溶液中不与稀硫酸反应,但在硝酸溶液中,铜能与硝酸根离子反应生成硝酸铜、一氧化氮和水。
2. 铜在电解池中,铜片作为阳极,发生氧化反应生成铜离子,阴极上氢离子得到电子生成氢气。
3. 铜与碱石灰反应,生成氨气。
三、实验仪器与试剂1. 仪器:烧杯、试管、酒精灯、铁架台、电源、电极、导线等。
2. 试剂:铜片、稀硫酸、硝酸钠溶液、硝酸、氢氧化钠溶液、氯化铵、氢氧化钙、碱石灰等。
四、实验步骤1. 实验一:探究铜在酸性溶液中的溶解性(1)将铜片放入稀硫酸中,观察现象。
(2)将铜片放入硝酸钠溶液中,观察现象。
2. 实验二:探究铜与不同离子的反应(1)将铜片放入稀硝酸中,观察现象。
(2)将铜片放入氢氧化钠溶液中,观察现象。
3. 实验三:电解铜片(1)将铜片作为阳极,稀硫酸作为电解质溶液,电解池中通电,观察现象。
(2)将铜片作为阴极,稀硫酸作为电解质溶液,电解池中通电,观察现象。
4. 实验四:制取氨气(1)将氯化铵和氢氧化钙混合,加热,观察现象。
(2)将生成的氨气通入碱石灰中,观察现象。
五、实验现象与结果1. 实验一:铜片在稀硫酸中无明显变化,在硝酸钠溶液中无明显变化。
2. 实验二:铜片在稀硝酸中溶解,溶液逐渐变成蓝色;铜片在氢氧化钠溶液中无明显变化。
3. 实验三:电解铜片时,阳极铜片溶解,阴极氢离子得到电子生成氢气。
4. 实验四:氯化铵和氢氧化钙混合加热后,生成氨气,氨气通入碱石灰中,碱石灰变湿。
六、实验结论1. 铜在酸性溶液中不与稀硫酸反应,但在硝酸溶液中,铜能与硝酸根离子反应生成硝酸铜、一氧化氮和水。
2. 铜在电解池中,铜片作为阳极,发生氧化反应生成铜离子,阴极上氢离子得到电子生成氢气。
3. 铜与碱石灰反应,生成氨气。
七、实验讨论1. 实验过程中,铜片在稀硝酸中溶解,说明硝酸具有较强的氧化性。