氯碱工业
- 格式:ppt
- 大小:780.00 KB
- 文档页数:16

氯碱工业定义氯碱工业是指以电解盐水为基础,制取氯气和碱(氢氧化钠或氢氧化钾)的工业过程。
它是现代工业中重要的基础化工行业之一,对国民经济和社会发展起着重要的支撑作用。
在氯碱工业生产过程中,最常用的是用电解法制取氯气、氢气和碱液。
电解法利用电流通过盐水溶液,将其分解为氯气、氢气和氢氧化钠或氢氧化钾。
这一过程中,电解槽是关键设备,由阳极、阴极和电解质组成。
通电后,盐水中的氯离子在阳极上接受电子,在阴极上则生成氢气和氢氧化钠或氢氧化钾。
氯碱工业对国民经济起着重要的支撑作用。
首先,氯气和碱液是众多重要化工产品的主要原料之一,它们广泛应用于冶金、化工、农药、建材等行业,为各行各业的发展提供了稳定的物质基础。
其次,氯碱工业还能够促进能源的合理利用。
在生产过程中,通过氯碱工业废弃物的处理和电解过程中生成的氢气的回收利用,可以实现资源的循环利用,减少对能源和环境的消耗,达到可持续发展的目标。
此外,氯碱工业还能够创造就业机会,改善社会就业状况,提高居民收入水平,促进社会稳定与和谐发展。
然而,氯碱工业也存在一些问题和挑战。
首先,电解法生产氯碱产品需要大量的电能,造成能源的浪费和环境负担,需要加强节能减排工作,提高资源利用效率。
其次,氯碱工业生产过程涉及到盐水资源的消耗和废液的处理问题,需要加强科学管理,合理利用水资源,减少废水排放,保护环境。
此外,氯碱工业还面临市场需求的变化和国际竞争的压力,需要加强技术创新,提高产品质量和附加值,提升竞争力。
为了推动氯碱工业的发展,需要政府、企业和社会各方共同努力。
政府应制定相关政策,加大对氯碱工业的支持力度,鼓励企业进行技术创新,加强环境保护和资源节约工作。
企业应加强自主创新,提高产品质量和附加值,提升竞争力,积极拓展市场。
社会各界应加强宣传教育,提高公众对氯碱工业的认识和理解,形成支持和监督的合力。
总之,氯碱工业作为现代工业的重要组成部分,发挥着重要的支撑作用。
在推动经济发展和改善民生的同时,我们也要关注环境保护和资源利用的问题,共同推动氯碱工业实现可持续发展,为建设美丽中国和实现可持续发展目标做出贡献。


氯碱工业反应原理
氯碱工业是化学工业的一个重要领域,它利用电解法或石灰法等化学反应原理,通过一系列的化学反应过程,生产出氯气、氢气和烧碱等基础化工产品。
以下是氯碱工业中两种主要的反应原理的详细介绍。
1. 电解法
电解法是氯碱工业中最常用的方法之一。
在该方法中,食盐水溶液通过电解反应生成氯气、氢气和烧碱。
这个过程可以分为阳极反应和阴极反应两个步骤。
在阳极反应中,食盐水溶液中的氯化钠被氧化成氯气和氢氧化钠。
这个反应可以用下面的化学方程式表示:
2NaCl + 2H2O →2NaOH + H2 + Cl2
在阴极反应中,食盐水溶液中的水被还原成氢气和氢氧根离子。
这个反应可以用下面的化学方程式表示:
2H2O + 2e-→H2 + 2OH-
通过这两个反应的组合,可以得到氯气、氢气和烧碱等产品。
2. 石灰法
石灰法是另一种氯碱工业的方法。
在该方法中,食盐水溶液与石灰乳反应,生成氯气、氢气和烧碱。
这个过程可以分为两个步骤:石灰乳的制备和食盐水溶液与石灰乳的反应。
石灰乳的制备是将生石灰与水按照一定比例混合,制备出饱和石灰乳。
这个过程可以用下面的化学方程式表示:
CaO + H2O →Ca(OH)2
然后,食盐水溶液与石灰乳混合,发生如下反应:
2NaCl + Ca(OH)2 →2NaOH + CaCl2 + H2O
通过这个反应,可以得到氯气、氢气和烧碱等产品。
需要注意的是,石灰法生成的烧碱浓度较低,通常需要进一步浓缩才能达到商业用途的要求。

氯碱工业名词解释氯碱工业名词解释一、氯碱工业概述氯碱工业是指以氯化钠(食盐)为原料,通过电解法生产氢氧化钠和氯气的一种重要工业部门。
它是化学工业中的基础性行业,广泛应用于冶金、建材、化肥、塑料、医药等领域。
二、电解槽1. 定义:电解槽是进行电解反应的装置,通常由阳极室和阴极室组成。
2. 功能:阳极室中发生氯离子的析出反应,阴极室中发生水分子的还原反应。
3. 结构:通常采用钢制或钛制材料制成,具有耐腐蚀性能。
三、氢氧化钠1. 定义:氢氧化钠是一种无机碱性物质,化学式为NaOH。
2. 生产过程:在电解槽中,通过电解食盐溶液可以得到纯度高的氢氧化钠。
3. 应用领域:广泛用于造纸、纺织、石油加工等行业。
四、氯气1. 定义:氯气是一种黄绿色有刺激性气体,化学式为Cl2。
2. 生产过程:在电解槽中,阳极室发生的反应产生氯气。
3. 应用领域:主要用于制取其他化学物质,如氯化铜、三氯甲烷等。
五、食盐1. 定义:食盐是一种晶体状固体,主要成分为氯化钠(NaCl)。
2. 原料来源:通常从地下盐矿或海水中提取。
3. 应用领域:除了作为电解槽的原料外,还广泛应用于食品加工、腌制、农业等领域。
六、冶金工业1. 定义:冶金工业是指对金属矿石进行提纯和加工的一类工业。
2. 应用领域:在冶金工业中,氢氧化钠可用于金属的浸出和精炼过程。
七、建材工业1. 定义:建材工业是指生产各种建筑材料的行业。
2. 应用领域:氢氧化钠在建材工业中可用于生产玻璃、水泥等材料。
八、化肥工业1. 定义:化肥工业是指生产各类化学肥料的行业。
2. 应用领域:氢氧化钠可用于制造氯化铵等化肥产品。
九、塑料工业1. 定义:塑料工业是指生产各种塑料制品的行业。
2. 应用领域:氯碱工业中的氯气可作为合成聚氯乙烯(PVC)等塑料的原料。
十、医药工业1. 定义:医药工业是指生产药品和医疗器械的行业。
2. 应用领域:氢氧化钠可应用于制造一些药物,如抗酸剂、缓解剂等。

氯碱工业定义氯碱工业是指生产氯气、氢气和氢氧化钠的一类工业。
氯碱工业是现代工业中非常重要的一个部分,它在化工、石油、医药、制革、纺织、造纸、食品等行业中都有广泛的应用。
氯碱工业主要通过电解盐水来生产氯气、氢气和氢氧化钠。
电解盐水的原理是利用电流通过盐水,使得盐水中的氯离子和水分子发生化学反应,产生氯气、氢气和氢氧化钠。
这个过程中,氯离子被氧化成氯气,水分子被还原成氢气和氢氧化钠。
氯碱工业的这种生产方法,既可以实现氯气、氢气和氢氧化钠的连续生产,也可以实现这三种物质的高纯度生产。
氯气是一种具有刺激性气味的黄绿色气体,具有强氧化性。
氯气广泛应用于化工工业中,用于生产氯化烃、氯化铝、氯化钛等化学品。
氯气还可以用于消毒、漂白和净化水源。
此外,氯气还是制备一些有机化合物的重要原料。
氢气是一种无色、无味、无毒的气体,密度比空气小。
氢气具有很高的燃烧热和爆炸极限,因此被广泛应用于气体焊接、气体切割等工业领域。
氢气还可以作为氢源应用于化学合成反应中,例如用于加氢反应、氢化反应等。
氢氧化钠,也称为烧碱,是一种无色、无臭的固体。
氢氧化钠具有很强的碱性,可以与酸反应生成盐和水。
氢氧化钠在化工工业中被广泛应用于制造肥皂、纸张、玻璃、铝等产品。
此外,氢氧化钠还可以用于废水处理、金属清洗等工艺中。
氯碱工业的发展对于现代工业的发展具有重要意义。
氯碱工业的产品广泛应用于各个工业领域,为现代化工生产提供了重要的原料和能源。
通过不断提高生产技术和改进生产工艺,氯碱工业可以实现高效、环保的生产,为经济的可持续发展做出贡献。
氯碱工业是一类重要的工业,通过电解盐水来生产氯气、氢气和氢氧化钠。
氯碱工业的产品广泛应用于化工、石油、医药、制革、纺织、造纸、食品等行业中。
氯碱工业的发展对于现代工业的发展具有重要意义,通过不断提高生产技术和改进生产工艺,可以实现高效、环保的生产,为经济的可持续发展做出贡献。

氯碱工业工艺流程氯碱工业是指以氯、氢、氧为原料生产氯气、氢气、氢氧化钠、氯化钠等产品的一类工业。
氯碱工业的主要工艺流程包括电解氯法和电解氢氧化钠法。
电解氯法是氯碱工业的主要生产方法之一。
首先,将氯化钠(NaCl)溶解在水中,得到氯化钠溶液。
然后,将氯化钠溶液导入电解槽中,电解槽中有一对电极,即阳极和阴极。
通电后,电解槽中的氯化钠溶液开始电解分解。
在电解过程中,阳极上发生氧化反应,生成氯气(Cl2),而阴极上发生还原反应,生成氢气(H2)。
氯气和氢气随着电解过程分别在阳极和阴极处收集。
同时,电解槽中的溶液中的氯化钠逐渐消耗,再生成氢氧化钠(NaOH)。
在阳极处,氧化反应使得氯离子(Cl-)失去电子,变为氯气。
在阴极处,还原反应使得水中的氢离子(H+)接受电子,变为氢气。
氯气和氢气采集后可分别用于制取消毒剂和化学原料。
电解氢氧化钠法是氯碱工业的另一种常用生产方法。
首先,将氯化钠溶解在水中,得到氯化钠溶液。
然后,将氯化钠溶液导入电解槽中,电解槽中有一对电极,即阳极和阴极。
通电后,电解槽中的氯化钠溶液开始电解分解。
在电解过程中,阳极上发生氧化反应,生成氯气(Cl2),而阴极上发生还原反应,生成氢气(H2)。
氯气和氢气随着电解过程分别在阳极和阴极处收集。
与电解氯法不同的是,电解氢氧化钠法在电解槽的中间还额外放入一个隔膜,用于分隔阳极和阴极两侧的溶液。
隔膜的作用是阻止氯离子和氢氧化钠生成的氢氧根离子(OH-)相遇,从而使得电解槽的阳极侧为氯气,阴极侧为氢气。
电解槽中的溶液在电解过程中逐渐消耗,生成氢氧化钠(NaOH)。
氯气和氢气采集后可分别用于制取消毒剂和化学原料。
总结来说,氯碱工业的工艺流程主要包括电解氯法和电解氢氧化钠法。
通过这两种工艺,可以生产出氯气、氢气、氢氧化钠等多种产品,广泛应用于化工、制药、环保等领域。

氯碱工业是一种重要的化学工业,主要涉及氯、碱和氯化物的生产与加工。
这个行业包括了氯气、氢气、氢氧化钠(烧碱)、氯化氢以及其他相关的化学品的生产。
以下是氯碱工业的一些简介:
1.氯气生产:氯气是氯碱工业的关键产品之一。
它广泛应用于水处理、塑料制造、农药生
产等领域。
氯气主要通过电解盐水(氯化钠溶液)来生产。
2.碱生产:氢氧化钠(烧碱)是氯碱工业的另一个重要产品。
它被广泛应用于纸浆和造纸、
玻璃制造、清洁剂和化妆品等行业。
碱的生产主要通过氯碱电解技术来实现。
在这个过程中,通过电解氯化钠溶液分离出氯气和碱液。
3.氯化氢生产:氯化氢是一种有毒气体,但也是氯碱工业的重要副产品。
它常用于制造氯
化物、染料和消毒剂等。
4.其他产品:氯碱工业还涉及其他一些化学品的生产,如次氯酸钠、次氯酸、氯化铝等。
这些化学品在水处理、消毒、纺织和农药等行业中有广泛应用。
氯碱工业对于现代社会的许多领域都具有重要意义。
它提供了许多基础化学品,满足了人们日常生活和工业生产的需求。
然而,由于某些产品的危险性和环境影响,氯碱工业也需要遵守相关的安全和环保标准,并采取适当的措施来减少其对环境和健康的潜在影响。
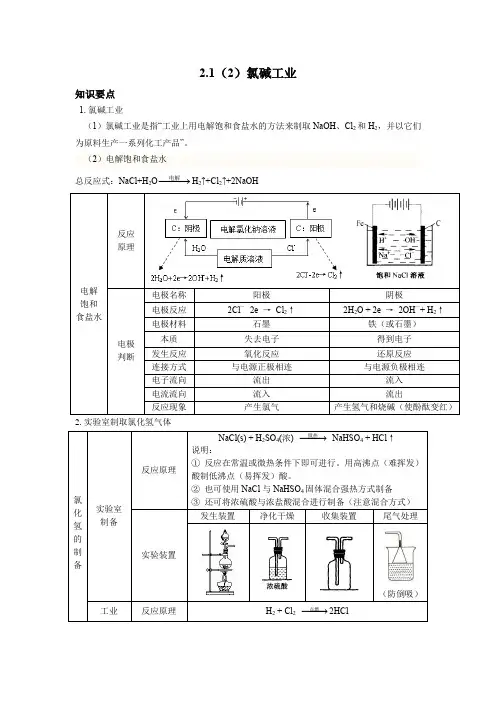
2.1(2)氯碱工业知识要点1.氯碱工业(1)氯碱工业是指“工业上用电解饱和食盐水的方法来制取NaOH 、Cl 2和H 2,并以它们为原料生产一系列化工产品”。
(2)电解饱和食盐水总反应式:NaCl+H 2O −−→−电解H 2↑+Cl 2↑+2NaOH 电解 饱和 食盐水反应原理电极 判断电极名称 阳极 阴极电极反应 2Cl —- 2e → Cl 2↑2H 2O + 2e → 2OH —+ H 2↑电极材料 石墨 铁(或石墨) 本质 失去电子 得到电子 发生反应 氧化反应 还原反应 连接方式 与电源正极相连与电源负极相连电子流向 流出 流入 电流流向 流入 流出反应现象产生氯气产生氢气和烧碱(使酚酞变红)2.实验室制取氯化氢气体氯化氢的制备实验室制备 反应原理NaCl(s) + H 2SO 4(浓) −−→−微热 NaHSO 4 + HCl ↑说明:① 反应在常温或微热条件下即可进行。
用高沸点(难挥发)酸制低沸点(易挥发)酸。
② 也可使用NaCl 与NaHSO 4固体混合强热方式制备③ 还可将浓硫酸与浓盐酸混合进行制备(注意混合方式) 实验装置发生装置净化干燥收集装置尾气处理(防倒吸)工业反应原理H 2 + Cl 2 −−→−点燃2HCl3.电离和电离方程式电解质(酸、碱、盐)在水分子的作用下,离解成自由移动离子的过程称为电离。
电离过程一般用电离方程式表示。
如NaCl→Na++Cl-;HCl→H++Cl-;H2SO4 →2H++SO42-。
例题解析例1.把一张用饱和食盐水与酚酞的混合液浸透了的滤纸放在表面皿上,滤纸的两端用惰性电极跟直流电源的两极直接相连,通电一段时间后发现与滤纸接触的一个电极附近变成了红色,则这个电极与直流电源的_______相连。
简述该电极附近变成红色的原因。
例2.下列各反应中,通常不适用于制取氯化氢气体的是A.氢气在氯气中燃烧B.浓盐酸中滴加浓硫酸C.氯化钠固体与浓硫酸微热D.稀硫酸与氯化钡溶液巩固练习一、单项选择题1.人体胃液是较强的酸性液体,所含的酸主要是()A.碳酸B.盐酸C.硫酸D.醋酸2.烧碱在工业上有广泛的用途,下列不属于烧碱用途的是()A.制皂B.造纸C.精炼石油D.制食盐3.下列关于电解饱和食盐水溶液叙述正确的是()A.电解时在阳极得到氯气,在阴极得到金属钠B.阳极附近的气体呈黄绿色C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性4.能证明氯化氢极易溶于水的实验是()A.溶于水可得盐酸B.使湿润的蓝色石蕊试纸变红C.溶于水时形成喷泉D.与硝酸银溶液生成不溶于硝酸的白色沉淀5.实验室制取下列气体,发生装置可用启普发生器的是()A.HCl B.H2 C.O2D.CO6.如图所示装配仪器,接通直流电源,电解饱和食盐水,则电解一段时间后,在碳棒和铁钉表面都有气体生成,其中碳棒表面生成的气体是()A.Cl2 B.O2 C.H2D.HCl7.下列电离方程式错误的是()A.Na2CO3→2Na++CO32-B.H2SO4 →2H++SO42-C.BaCl2→Ba2++Cl- D.NaCl→Na++Cl-8.在V形管内电解不纯的食盐水时,在某一电极附近出现了浑浊现象,这难溶物主要是()A.碳酸镁B.硫酸钡C.氢氧化镁D.氢氧化钠9.做氯化氢的喷泉实验后,烧瓶内的液体只占烧瓶容积的1/3,其原因可能是()A.HCl气体没有完全溶解B.集气瓶中收集的氯化氢太多C.集气时有空气混入D.胶头滴管挤入烧瓶的水太少10.下列制备氯化氢的方法中可行的是()①硫酸氢钠(s)+KCl(s) (条件是强热) ②浓硫酸滴入浓盐酸中③Cl2+H2(点燃)④浓硫酸+ NaCl+MnO2(条件是加热)A.①②③ B.只有③④ C.只有②③ D.只有①②二、填空题11.在U型管里装入饱和食盐水,滴入几滴酚酞试液,用一根碳棒作阳极,一根铁棒作阴极,把湿润的碘化钾淀粉试纸放在阳极附近。

氯碱工业原理
氯碱工业是指以盐湖、碳酸氢钠和氯化钠为原料,经过电解制备氯气、氢气和氢氧化钠的过程。
在氯碱工业中,通过电解法将氯化钠溶解在水中,经过氯化钠水溶液电解,可以得到氯气、氢气和氢氧化钠。
氯碱工业的原理是基于电解现象。
电解是指用电流将电解质溶液中的阳离子和阴离子分离的一种化学反应。
在氯碱工业中,正极为氯化钠水溶液,负极为铁或金属板。
当通入电流后,氯化钠水溶液中的氯离子向正极移动,而钠离子则向负极移动。
在正极,氯离子接受电子变为氯气,而在负极,水分子接受电子变为氢气。
同时,在电解的过程中,负极还会生成氢氧化钠。
氯碱工业的电解过程一般采用膜电解法或者氯碱法。
膜电解法是指在阳极和阴极之间放置一个特殊的离子选择性透膜,用以分离氯离子和水分子,从而得到纯净的氯气和氢气,并且不会产生氢氧化钠。
氯碱法则是直接在氯化钠水溶液中进行电解,产生氯气、氢气和氢氧化钠。
氯碱工业的产品主要有氯气、氢气和氢氧化钠,这些产品在工农业和日常生活中有着广泛的应用。
氯气是一种常用的消毒剂和漂白剂,广泛应用于水处理、医疗卫生、食品加工和化工生产等领域。
氢气是一种重要的工业气体,用于氢气焊接、燃料电池、气体分析等领域。
氢氧化钠则是一种常用的碱性物质,在化工生产、纺织工业和日常生活中有着广泛的应用,如制造肥皂、去除油脂和清洁剂等。
总的来说,氯碱工业是一种重要的化工工艺,通过电解氯化钠水溶液,可以制备出氯气、氢气和氢氧化钠等产品。
这些产品在各个领域中有着广泛的应用,对于社会的发展和生产的推动起着重要作用。


氯碱工业定义氯碱工业是指以氯气和氢氧化钠(或氯化钠)为原料,通过电解反应生产氯气、氢气和氢氧化钠(或氯化钠)等化学品的工艺过程。
在氯碱工业中,电解池是核心设备,通过电解反应将氯化钠分解成氯气和氢氧化钠。
氯碱工业是一项重要的基础化学工业,它在冶金、化工、环保、医药等多个领域都有广泛的应用。
以下将从氯碱工业的原料、工艺和应用等方面进行介绍。
氯碱工业的原料主要是氯化钠和水。
氯化钠是一种常见的食盐,广泛存在于海水、盐湖和盐矿等地方。
水是氯碱工业生产过程中不可或缺的原料,它用于稀释氯化钠溶液,形成适合电解反应的电解质。
在氯碱工业的工艺过程中,电解池是核心设备。
电解池通常由两个电极和电解质组成。
正极是钛制成的钛网,负极是钢制成的钢网。
电解质是氯化钠和水的混合溶液,通过电解反应,正极释放氧气,负极释放氢气,同时溶液中的氯离子和钠离子结合生成氯气和氢氧化钠。
氯碱工业生产的主要产品是氯气、氢气和氢氧化钠。
氯气是一种重要的化工原料和消毒剂,广泛应用于合成橡胶、塑料和有机化学品等领域。
氢气是一种重要的能源,可用于工业生产和燃料电池等领域。
氢氧化钠(或氯化钠)是一种常用的化学原料,在制造肥皂、玻璃、纸浆和纸张等行业有广泛的应用。
除了上述主要产品外,氯碱工业还能产生一些副产品和中间产品。
例如,氯碱工业生产过程中产生的二氧化钛可以用于制造颜料和涂料;氯碱工业生产过程中产生的氢氧化钙可以用于制造水泥和建筑材料等。
氯碱工业在人类社会的发展中起到了重要的作用。
它不仅满足了人们日常生活中对氯化钠和食盐的需求,还为各个行业提供了重要的化学原料和能源。
然而,氯碱工业也面临着一些环境和安全问题。
例如,氯碱工业生产过程中产生的氯气有毒性,需要采取严格的安全措施进行处理和储存;氯碱工业的废水和废气排放也需要进行处理,以减少对环境的影响。
氯碱工业是一项重要的基础化学工业,它通过电解反应生产氯气、氢气和氢氧化钠等化学品。
氯碱工业的原料是氯化钠和水,电解池是核心设备。
氯碱工业原理的应用1. 简介氯碱工业是指以氯化钠为原料,通过电解产生氯气、氢气和碱液的一种工业生产过程。
氯碱工业具有广泛的应用领域,涵盖了化工、冶金、印染、制药等多个行业。
本文将深入探讨氯碱工业原理的应用。
2. 氯碱工业原理氯碱工业的原理基于电解的原理,通过电解氯化钠溶液,产生氯气、氢气和氢氧化钠。
电解池分为阳极和阴极,当通过外部电源施加电压时,氯化钠会在阳极和阴极之间进行电解反应。
具体反应如下:•阳极反应(氧化反应):–2Cl⁻ → Cl₂ + 2e⁻•阴极反应(还原反应):–2H₂O + 2e⁻ → H₂ + 2OH⁻综合上述两种反应,整个电解反应的方程式如下:•2NaCl + 2H₂O → Cl₂ + H₂ + 2NaOH3. 氯碱工业的应用领域氯碱工业的原理在许多领域都有广泛的应用。
以下是几个主要的应用领域:3.1 化工行业在化工行业中,氯碱工业原理的应用主要体现在以下方面:•氯气消毒:氯气是一种强氧化剂,具有强烈的杀菌和消毒能力。
在水处理、医药、食品加工等领域中可以使用氯气进行消毒。
•氢氧化钠生产:氢氧化钠是一种重要的化工原料,广泛应用于纸浆制造、皮革加工、造纸等领域。
•氯化合物生产:氯碱工业还可以通过进一步反应生产氯化铝、氯化钙、氯化铁等重要化学品。
3.2 冶金行业在冶金行业中,氯碱工业原理的应用主要体现在以下方面:•金属提取:氯碱工业可用于金属的提取过程中,例如提取铝、锑、锡等金属。
3.3 制药行业在制药行业中,氯碱工业原理的应用主要体现在以下方面:•合成药物:氯碱工业可以提供制药工业所需的氢氧化钠,作为药物合成的重要原料。
•清洁剂生产:氯碱工业可以提供氯化钠等原料用于清洁剂的生产。
3.4 印染行业在印染行业中,氯碱工业原理的应用主要体现在以下方面:•漂白剂生产:氯碱工业生产的氯气可以用于制造漂白剂,用于纺织品漂白。
•染料生产:氯碱工业生产的氢氧化钠可以用于染料的合成和调节pH 值。
氯碱工业原理
氯碱工业是指以氯气和碱液为原料,生产氯碱化工产品的一种工业。
氯碱工业是现代化工行业中最重要的基础化工行业之一,它的发展水平直接关系到国民经济的发展水平和国家安全。
氯碱工业是指以氯气和碱液为原料,生产氯碱化工产品的一种工业。
氯碱工业是现代化工行业中最重要的基础化工行业之一,它的发展水平直接关系到国民经济的发展水平和国家安全。
氯碱工业的原理主要包括氯碱电解原理和氯碱法制备原理两大部分。
首先,氯碱电解原理是指通过电解盐水或氯化钠溶液,将其分解成氯气、氢气和氢氧化钠的原理。
在氯碱电解过程中,通过电解池中的电解反应,生成氯气和氢气,同时在阳极上生成氢氧化钠。
这一过程是通过电能的转化,将化学能转化为电能的过程,是氯碱工业生产过程中的核心环节。
其次,氯碱法制备原理是指利用氯气和氢氧化钠直接反应生成次氯酸钠和氢氧化钠的原理。
这一过程是氯碱工业中的重要反应,通过控制反应条件和原料比例,可以高效地制备次氯酸钠和氢氧化
钠,为氯碱工业的产品提供了重要原料。
氯碱工业的原理虽然简单,但在实际生产中需要严格控制各项工艺参数,确保产品质量和生产效率。
在氯碱电解过程中,需要控制电解池的温度、电流密度等参数,以保证产物的纯度和产量。
而在氯碱法制备过程中,需要控制反应温度、压力和原料比例,以获得理想的产物。
总的来说,氯碱工业的原理包括氯碱电解原理和氯碱法制备原理两大部分。
通过对这些原理的深入理解和实践操作,可以实现氯碱工业生产过程的优化和提升,为国民经济的发展和国家安全做出重要贡献。
同时,也需要密切关注环保和安全生产,确保氯碱工业的可持续发展和社会责任。
氯碱工业的名词解释
氯碱工业是指通过电解饱和食盐水来制取烧碱 (氢氧化钠) 和氢气,并以此为原料生产一系列化工产品的工业。
该工业是最基本的化学工业之一,其发展对全球化学工业的壮大和社会发展具有重要意义。
氯碱工业的电解反应式
为:2NaCl+2H2O=2NaOH+Cl2+H2,其中氯气是一种消毒副产物,需要妥善处理。
随着环境保护意识的增强,氯碱工业正在逐渐转型,更加注重节能减排、绿色环保等方面的工作。
中国氯碱工业协会是中国氯碱工业的行业组织,每年定期召开中国国际氯碱会议,旨在促进中外氯碱企业的交流合作,推动世界氯碱产业的可持续发展。
氯碱(电解)工业简介典型工艺:1 氯化钠(食盐)水溶液电解生产氢气、氢氧化钠、氯气。
2 氯化钾水溶液电解生产氯气、氢氧化钾、氢气。
工艺危险特点1 电解食盐水过程中产生的氢气是极易燃烧的气体,氯气是氧化性很强的剧毒气体,两种气体混合极易发生爆炸,当氯气中含氢量达到5%以上,则随时可能在光照或受热情况下发生爆炸。
2 如果盐水中存在铵盐超标,在适当的条件(pH<4.5)下,铵盐和氯作用可生成氯化铵,浓氯化铵溶液与氯还可生成黄色油状三氧化氮。
三氧化氮是一种爆炸性物质,与许多有机物接触或加热至90℃以上以及被撞击、摩擦等,即发生剧烈的分解而爆炸。
3 电解溶液腐蚀性强。
4 液氯的生产、储存、包装、输送、运输过程均可能发生液氯的泄露。
重点监控单元:电解槽、氯气储运单元重点监控工艺参数:1 电解槽内液面2 电解槽内电流和电压3 电解槽进出物料流量4 可燃和有毒气体浓度5 电解槽的温度和压力6 原料中铵含量7 氮气杂质含量(水、氢气、氧气、三氧化氮等)等。
安全控制的基本要求1 电解槽温度、压力、液位、流量报警和联锁2 电解供电整流装置与电解槽供电的报警和联锁3 紧急联锁切断系统4 事故状态下氯气吸收中和系统5 可燃和有毒气体检测报警装置。
一、氯碱工业简介1、氯碱工业简介氯碱工业指的是工业上用电解饱和氯化钠溶液的方法来制取氢氧化钠(NaOH)、氯气(Cl2)和氢气(H2),并以它们为原料生产一系列化工产品,称为氯碱工业。
氯碱工业是最基本的化学工业之一,它的产品除应用于化学工业本身外,还广泛应用于轻工业、纺织工业、冶金工业、石油化学工业以及公用事业。
2、氯碱工业的特点(1)能耗高主要能耗是电能,国内的生产水平为:隔膜法,2580度/t,蒸汽5t;总耗能折合标准煤约为1.815t。
(应努力提高电解槽的电解效率和碱液热能蒸发利用率)(2)氯和碱的平衡电解法制碱得到的烧碱与氯气的产品的质量比为1:0.88,但对二者的需求量随化工产品生产的变化而变化。