无菌检查方法验证告报告
- 格式:doc
- 大小:134.50 KB
- 文档页数:14


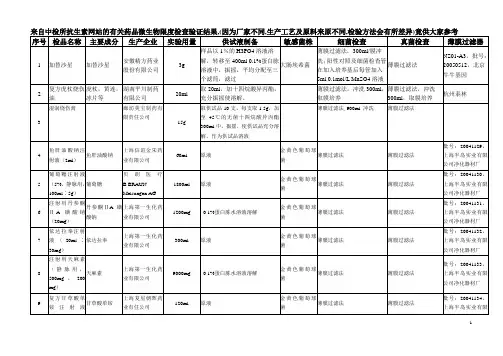

贵州金玖生物有限责任公司验证方案及报告验证方案名称:直接接种无菌检查方法验证验证方案编号:验证完成日期:有效期:验证方案申请人: 日期: 年月日验证方案审核人: 日期: 年月日验证方案审批人: 日期: 年月日1 概述无菌检查法是为了检查药典要求无菌的制剂及其他制品是否无菌而建立的检查法,是作为批准无菌产品放行的检验或监督部门对无菌产品质量监督中的一个重要项目。
它是根据用于实验的培养基中是否有微生物生长来判定样品的无菌性,液体培养基变浑浊一般表明样品受微生物的污染。
基于微生物污染的不均匀性,使无菌检查法结果的可信度受许多因素制约,如抑菌因素、检查法、检验量、检查用的培养基质量、操作环境、无菌技术等。
检验方法的验证是现代质量保证体系中关系到质控技术、方法、手段的科学性、准确性的重要组成部分,是保证检验结果的公正、科学、准确的基础。
2 验证目的对本公司所采用的直接接种无菌检查法进行分析验证,以证明所采用的方法适合于本公司产品的无菌检查。
3 实验原理直接接种法是通过加入一定的抑菌中和剂,以方便而快捷地中和抑菌剂,消除抑菌作用,从而消除抑菌作用对无菌检查的影响。
本实验通过设计对照试验对直接接种法所加入的抑菌剂的中和效果进行验证,从而得出直接接种法无菌检验的有效性。
4 验证范围实用于本公司所采用的直接接种法进行的无菌检验过程验证。
56 职责7 验证内容建立样品组、对照组及菌种活性检查组,接种菌株到指定培养基,培养24~72小时,比较观察菌落的生长状况,得出结论。
8 验证指示物本实验所用菌种为购于贵州食品药品监督管理局标准菌株:大肠埃希菌、金黄色葡萄球菌、白色念球菌及生孢梭菌。
9 实验过程(1)培养基的配制用于大肠埃希菌、金黄色葡萄球菌的营养琼脂培养基用于白色念球菌的改良马丁培养基用于生孢梭菌的流体硫乙醇酸盐培养基(2)供试品的制备术泰舒TM生物多糖冲洗胶液供试品:直接取成品10ml,加pH7.0氯化钠—蛋白胨缓冲液至100ml,混匀,作为供试品。

无菌检查方法验证告报告2015
无菌检查方法验证报告2015
1. 目的
本报告旨在介绍无菌检查方法验证报告2015,该报告是根据企业生产的产品特点,结合国内外相关法规要求,制定的一种无菌检查方法。
2. 范围
本报告适用于企业生产的一系列产品,这些产品都具有相同的特点,需要进行无菌检查。
3. 无菌检查方法验证过程
在本报告中,我们介绍了如何对无菌检查方法进行验证的过程。
首先,我们需要对试验样品进行灭菌处理,然后将其放入无菌环境中进行试验。
在此过程中,我们需要严格控制各种影响因素,以确保试验结果的可靠性。
最后,我们需要对试验结果进行分析和总结,以确定该无菌检查方法的可行性。
4. 结果与分析
在本报告中,我们介绍了无菌检查方法验证的结果。
通过试验,我们发现该无菌检查方法可以有效地检测出产品中的微生物,并且试验结果稳定可靠。
因此,我们可以认为该无菌检查方法可以用于企业的生产过程中。
5. 结论
综上所述,本报告介绍了一种有效的无菌检查方法验证报告2015。
该方法可以有效地检测出产品中的微生物,并且具有较高的可靠性。

无菌检查方法验证报告目录1. 目的 (3)2. 适用范围 (3)3. 接受标准 (3)4. 抽样计划 (3)5. 设备、试剂和菌种信息 (3)6. 试验步骤 (4)7. 供试品检查 (6)8. 结论 (6)9. 再验证周期 (6)10. 附件清单 (6)1.目的支据中国药典2020版无菌检查法的要求,对产品的无菌检查法进行验证,以确定一种无菌检查的方法能有效的消除该产品对微生物的抑制作用,从而证实该方法的有效性和实用性。
2.适用范围适用于本司产品的无菌检查。
3.接受标准与阳性对照比较,含供试液各容器中的试验菌(金黄色葡萄球菌、大肠埃希菌、生孢梭菌、白色念珠菌、枯草芽孢杆菌和黑曲霉)均生长良好,则可照此检查方法和检查条件进行供试品的无菌检查。
如含供试品的任一容器内的试验菌生长微弱、缓慢或不生长,则说明供试品的该检验量在该检验条件下有抑菌作用,需进一步改进检验条件再进行方法验证试验。
4.抽样计划随机抽取灭菌后的样品24份。
具体信息见表一:表一样品信息确认人/日期:复核人/日期:5.设备、试剂和菌种信息5.1设备信息详见表二表二设备信息确认人/日期:复核人/日期:5.2试剂信息详见表三:表三试剂信息确认人/日期:复核人/日期:5.3菌种信息详见表四:表四菌种信息确认人/日期:复核人/日期:5.3.1菌液的制备用接种环取金黄色葡萄球菌、大肠埃希菌、枯草芽孢杆菌的第三代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取生孢梭菌的第三代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取白色念珠菌的第四代培养物用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的菌悬液;用接种环取黑曲霉的第三代培养物,向培养物中加入10mL0.9%无菌氯化钠溶液,将孢子洗脱,转移孢子悬液至无菌试管内,用0.9%无菌氯化钠溶液制成浓度≤100cfu/mL的孢子悬液。
以上操作均在微生物检验室阳性菌室的生物安全柜中进行。

无菌包装封口检验报告一、引言无菌包装是生产和操作过程中对产品进行有效封装和保护的重要环节,封口是无菌包装的最后一道工序。
封口质量的好坏直接影响着无菌包装的有效性和产品的安全性。
本次检验旨在评估无菌包装封口的质量,并提出相应的改进意见。
二、检验方法本次检验采用目视检查法结合一些简单的实验方法。
首先对封口区域进行目视检查,包括封口位置是否正确,封口厚度是否均匀等;其次进行一些简单的实验操作,如将封口部位用手指轻轻揉擦,观察是否有异常现象,然后用红色试剂涂抹在封口区域,观察是否有红色渗漏现象等。
三、检验结果根据检验方法,我们对10个样品进行了封口质量检验。
结果如下:1.目视检查:所有样品的封口位置均正确,无明显偏移。
封口厚度基本均匀,无明显涂布不均或过厚的现象。
2.揉擦实验:将手指轻轻揉擦封口部位,无明显脱落或松动的现象。
3.试剂涂抹实验:红色试剂未渗漏或渗漏现象极微弱,可以忽略不计。
综上所述,10个样品的无菌包装封口质量良好,达到了标准要求。
四、讨论封口是无菌包装的重要一环,好的封口质量可以有效地防止外界微生物的侵入,保证产品的无菌性。
本次检验结果显示样品的封口质量良好,显示出良好的无菌包装生产技术。
然而,封口质量的良好并不代表完全没有问题。
我们可以通过进一步的改进来提高封口质量,如引入更精确的封口设备,确保封口的厚度和涂布均匀一致;增加封口前的清洁和消毒步骤,以减少封口过程中的污染;加强封口工人的培训,提高其技术水平等。
此外,虽然目前的检验结果显示封口质量良好,但仍需要定期进行封口质量检验,以确保长期稳定的无菌包装质量。
五、结论本次检验结果显示10个样品的无菌包装封口质量良好,达到了标准要求。
但仍有改进空间,建议通过引入精确封口设备、增加清洁消毒步骤和加强员工培训等方式提高封口质量。
同时,建议定期进行封口质量检验,以确保无菌包装质量的长期稳定。




注射液无菌检查的方法学验证方案注射液的无菌性是医疗领域中最为重要的质量指标之一。
为了确保注射液的无菌性,需要进行方法学验证方案。
本文将介绍一种常见的注射液无菌检查方法学验证方案,确保验证结果准确可靠。
一、验证目的本验证方案旨在验证注射液无菌性检查的方法学准确性和可靠性。
通过验证,可以确保注射液无菌性检查的结果符合预期,并为其他类似检查提供参考。
二、验证对象本验证方案适用于各类注射液无菌性检查方法,包括但不限于常规培养法、膜过滤法、试管法等。
三、验证步骤1. 制定验证计划:明确验证的目标、方法和时间安排等。
2. 准备样品和试剂:收集需要验证的样品和所需试剂,并确认其质量符合要求。
3. 合理布局实验室:确保实验室环境符合无菌实验要求,避免干扰因素的存在。
4. 实验操作:a) 样品准备:按照标准操作程序,制备样品,确保操作无菌。
b) 检测方法操作:按照所选的检测方法,依次进行实验,确保操作无误。
c) 平行实验:为了验证结果的可重复性,进行平行实验,确保结果一致。
5. 结果分析:根据实验结果进行数据统计和分析,得出结论。
6. 结果确认:将验证结果与预期目标进行比较,确认验证是否合格。
7. 编写验证报告:将整个验证过程、操作方法和结果总结编写成验证报告。
四、验证要求1. 严格遵守无菌技术操作规范。
2. 注射液样品的选择应具有代表性和典型性。
3. 实验室环境应符合无菌要求,避免外界干扰。
4. 检测方法的选择应根据实际情况和需求进行。
5. 实验操作过程要规范、准确,确保每个步骤符合方法要求。
6. 结果分析要科学、客观,数据统计要准确无误。
7. 结果确认应根据验证目标和标准进行判断。
8. 验证报告要详细、完整,包括验证目的、方法、结果和结论等。
五、验证结果分析根据实验结果的分析,可以判断注射液无菌性检查方法是否准确可靠。
如果验证结果符合要求并且与预期目标一致,则说明所选的检查方法具有可靠性和精准性。
如果验证结果与预期目标不一致,则需要进一步分析原因,寻找解决方案。
文件制修订记录1. 概述:无菌检查法系用于检查药典要求无菌的药品、原料、辅料及其他品种是否无菌的一种方法。
本公司的无菌检查只是针对于灭菌注射用水的无菌检查。
灭菌注射用水灭菌工艺采用121℃30min过度杀菌法,按照2005年版《中国药典》的规定,注射剂的无菌检查应采用薄膜过滤法。
制定的《无菌检查法标准操作规程》(SOP4.14.038-B)应经过验证后,才能批准使用。
2. 验证目的:验证所采用的方法和条件是否适合于供试品的无菌检查。
即确认供试品在该检验量、该检验条件下无抑菌活性或其抑菌活性以被充分消除到可以忽略不计。
3. 验证范围:适用于灭菌注射用水无菌检查法的验证。
4. 验证人员及职责质量部负责该验证方案的起草及组织实施;验证小组负责验证方案的审批;质量部参与验证的实施及监督。
5. 文件准备和培训检查验证所需的各类文件资料,应齐全;相关的文件草案是否已具备。
6.1. 无菌检查室空气净化系统已经过验证并合格,仪器安装完成;仪表量器经过校验合格,且在有效期内。
6.2. 供试品:3批,批号:批号:批号:6.3. 培养基及试剂:6.3.1. 试剂试液:氯化钠:临用前配成0.9%浓度的溶液,配制记录见附件1。
冲洗液:0.1%蛋白胨水溶液,配制记录见附件2。
6.3.2. 培养基硫乙醇酸盐流体培养基生产厂家:批号:改良马丁培养基生产厂家:批号:营养肉汤培养基生产厂家:批号:改良马丁琼脂培养基生产厂家:批号:蛋白胨生产厂家:批号:培养基配制记录见附件3。
6.4. 验证用菌株:金黄色葡萄球菌【CMCC(B)26003】铜绿假单胞菌【CMCC(B)10104】枯草芽孢杆菌【CMCC(B)63501】生孢梭菌【CMCC(B)64941】白色念珠菌【CMCC(F)98001】黑曲霉【CMCC(F)98003】购自:各验证用菌种传代记录见附件4。
6.5. 无菌检验仪器及相关设备:压力蒸汽灭菌器型号:生产厂家:校验日期:有效期:生化培养箱(细菌培养)型号:生产厂家:校验日期:有效期:生化培养箱(霉菌培养)型号:生产厂家:校验日期:有效期:7. 验证内容:7.1. 培养基无菌性检查:每批培养基随机取不少于5支,培养14天,应无菌生长。
无菌检查方法的验证无菌检查方法的验证无菌检查方法是为了检查药典要求无菌的制剂及其他制品是否无菌而建立的试验方法,是作为无菌产品批放行的重要依据及药监部门对无菌产品质量监管的一个重要工程。
因此如何确保无菌检查方法的准确可靠至关重要,而检查方法的验证是保证检查结果的公正、科学和准确的根底,因此各个主要国家的GMP或药典都对无菌检查方法的验证提出了严格的要求,2022版中国药典对分析方法验证和检查的要求也有大幅度的提高,同时也是GMP检查中检查的重点和容易发现问题的区域。
验证要求与方法无菌检查方法验证一般分为前验证和再验证两种。
前验证,也称预验证,指在无菌分析方法正式使用前,按照预定验证方案进行的验证。
如果没有充分的理由,任何检查方法必须进行前验证。
再验证,指某一检查方法经过验证并在使用一段时间后进行的,旨在证实已验证状态没有发生飘移而进行的重新验证及对检查方法进行修订、改变时进行的验证。
通常一个无菌产品的检查流程为:首先基于产品的剂型、溶解度等性质,按照药典的要求确定是否需要进行前处理;然后根据产品的特性是否有抑菌性,确定是否需要增加去除产品抑菌性的方法;最后验证整个检查方法中用到的一切及试验过程中的每一个环节包括样品的预处理方式、检查过程、培养条件等均不影响样品中微生物的生长。
这里,验证的重点环节包括:前处理方法直接影响后续步骤的效果和重现性,应是验证的重点。
供试品中抑菌活性的去除是当前验证工作的重点,尤其强调应充分验证供试品本身对微生物生长的影响。
具体的验证方法如下:菌种的选择无菌检查方法验证中通常选择以下6种试验中常用的控制菌的标准菌株,它们分别代表不同类型的菌种:枯草芽孢杆菌 [CMCC(B)63 501]代表药品中常见的污染菌——芽孢杆菌、金黄色葡萄球菌 [CMCC(B)26 003]代表革兰阳性菌、生孢梭菌 [CMCC(B)64 941]代表厌氧菌、大肠埃希菌 [CMCC(B)44 102]代表革兰阴性菌、白色念珠菌 [CMCC(F)98 001]代表酵母菌、黑曲霉菌 [CMCC(F)98 003]代表霉菌。
培养基无菌灌装目录验证方案一、验证目的二、设备概述三、验证小组组成四、验证程序五、验证进度六、验证内容与方法验证报告一、验证实施二、验证结果三、结果分析四、评价五、验证后期工作六、建议验证记录一、培养基灌装验证记录附:1.灭菌后西林瓶、胶塞无菌检测记录2.百级区表面微生物及操作人员手和衣物微生物动态监测记录培养基无菌灌装验证方案无菌灌装(培养基灌装)验证方案一、验证目的:通过培养基无菌灌装试验时已灌装培养基的西林瓶染菌率能否达到规定的合格标准,来确认冻干车间的洁净环境以及进行无菌灌装过程中所采用的各种防止微生物污染的方法和规程的可行性,从而为保证所生产产品的无菌性提供依据。
二、概述:无菌灌装是指由掌握了无菌操作的人员在一个有控制的环境中将经灭菌的无菌药液灌封于灭菌后的容器中,制成无菌药物的过程。
无菌灌装验证,是在与无菌灌装生产过程有关的其他验证,如:洁净厂房、公用系统、灭菌设备(包括蒸汽灭菌柜、隧道式灭菌干燥器、热循环烘箱等)验证合格后,且操作人员熟练掌握了岗位SOP后进行的。
培养基灌装作为无菌灌装的模拟实验,可以直观、方便、准确地反映出无菌灌装过程的污染情况及问题。
三、验证小组的成员:本设备的验证按文件SMP—YZ—0001—01规定组成验证小组,其成员及职责为:组长:全面负责本验证工作。
生产部:负责培养基的灌装操作。
质管部:负责样品的检测工作。
负责验证全过程的监控。
四、验证程序:本验证按文件SMP—XX—XXXX—XX规定的程序进行验证。
五、验证进度:年月日至年月日完成。
六、验证内容与方法:1.验证前须确认项目: 确认人员培训合格,公用系统、工艺用水系统和空调系统、车间设备处于正常运行状态,并提供相关的合格报告。
2.验证方法及过程监测项目:2.1 培养基的准备:培养基名称:胰蛋酶胨大豆肉汤培养基。
在临试验前,按规定配置好所需的液体培养基,并于121℃、20分钟进行灭菌。
2.2 灌装过程:按规程做好无菌灌装前的一切准备工作,开始无菌灌装,每支装量2毫升,每机灌装数量不得少于3000瓶,加塞为半加塞,灌装加塞同步完成后,每盘依次编号入冻干箱,模拟生产状态时压塞,压塞完毕传入轧盖间加铝盖轧盖后交QC培养。
无菌检查方法验证告报告2015
编号:FAL-YZ-003.1
无菌检查方法
验证报告
编制/日期审核/日期
评审会签
姓名部门职务评审意见日期
批准/日期
科技发展有限公司
目录
序号内容页号
1 目的 1
2 范围1
3 依据1
4 职责权限1
5 验证方法2
6 验证结论 5
7 附录 6
无菌检查方法验证报告
1.目的
通过对培养基无菌性检查、灵敏度检查,对产品的无菌检查方法适用性进行试验,证明该方法适用于产品无菌检查日常检测。
2.范围
适用于本公司产品的无菌检查方法的建立和确认。
3.依据
中国药典(2015年版)
GB/T14233.2-2005 医用输液、输血、注射器具检验方法第2部分:生物学实验方法
4. 职责权限
5. 验证方法
实验前的准备a仪器设备
b操作环境
微生物限度检查应在环境洁净度10000 级下的局部洁净度100 级的单向流空
气区域内进行。
检验全过程必须严格遵守无菌操作,防止再污染。
单向流空气区域、工作台面及环境应定期按《医药工业洁净室(区)悬浮粒子、浮游菌和沉降菌的测试方法》的现行国家标准进行洁净度验证。
c稀释液和试剂: PH7.0无菌氯化钠-蛋白胨缓冲液
d器具无菌注射器仪液器 YT-603集菌仪
5.1培养基的适用性检查
无菌检查用的硫乙醇酸盐流体培养基及胰胳大豆胨肉汤培养基等应符合培养基的无菌性检查及灵敏度检查的要求。
本检查可在供试品的无菌检查前或与供试品的无菌检查同时进行。
培养基:硫乙醇酸盐批号20140408 生产厂家:青岛日水生物技术有限公司胰胳大豆胨肉汤培养基批号20151023 生产厂家:青岛尼赛欣合生物技术有限公司
5.1.1无菌性检查:每批培养基随机取不少于 5 支(瓶),培养 14 天,应无菌生长。
5.1.2灵敏度检查
菌种:培养基灵敏度检查所用的菌株传代次数不得超过 5 代(从菌种保存中心
获得的冷冻干燥菌种为第 0 代),试验用菌种应采用适宜的菌种保存技术进行保存,以保证试验菌株的生物学特性。
金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B) 26 003〕
铜绿假单胞菌(Pseudomonas aeruginosa) 〔CMCC(B) 10 104〕
枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63 501〕
生孢梭菌(Clostridium sporogenes)〔CMCC(B) 64 941〕
白色念珠菌(Candida albicans)〔CMCC(F) 98 001〕
黑曲霉(Aspergillus niger) 〔CMCC(F) 98 003〕
5.1.3菌液制备
金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、生孢梭菌、白色念珠菌、黑曲霉微生物培养基质控品,使用前注入1.1ml稀释液充分溶解后,在漩涡混合器上震荡混匀,制成10-100 cfu/0.1ml菌悬液,3-5天内用完。
5.1.4培养基接种取每管装量为12ml 的硫乙醇酸盐流体培养基7支,分别接种小于100 cfu 的金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌各2 支,另1支不接种作为空白对照,培养3 天;取每管装量为9ml的胰胳大豆胨肉汤培养基7支,分别接种小于100 cfu 的枯草芽孢杆菌、白色念珠菌、黑曲霉各2 支,另1 支不接种作为空白对照,培养5 天。
逐日观察结果。
5.1.5结果判定空白对照管应无菌生长,若加菌的培养基管均生长良好,判该培养基的灵敏度检查符合规定。
见附件无菌培养基的适用性检查记录
5.2无菌检查方法验证试验
5.2.1当建立产品的无菌检查法时,应进行方法的验证,以证明所采用的方法适
合于本产品的无菌检查。
若本产品的组分或原检验条件发生改变时,检查方法应重新验证。
验证时,按“中国药典2015版四部1101无菌检查法”的规定进行操作。
对每一试验菌应逐一进行验证。
5.2.2菌种及菌液制备金黄色葡萄球菌、铜绿假单胞菌、生孢梭菌、枯草芽孢杆菌、白色念珠菌、黑曲霉同培养基灵敏度检查。
5.2.3薄膜过滤法
5.2.3.1FAL胶无菌检测:使用YT-603集菌仪,滤膜孔经不大于0.45µm。
A样品组:取1ml医用胶缓慢滴入100ml氯化钠蛋白胨缓冲液中,使其固化成白色胶膜充分冲洗振荡1分钟,制成样品组供试液,取一幅二联式集菌培养器,将样品组供试液平均通过每只集菌培养器过滤,再用100ml氯化钠蛋白胨缓冲液冲洗,然后通过集菌仪每只集菌培养器加入100ml胰胳大豆胨肉汤培养基或硫乙醇酸盐培养基,后每只加入10~100cfu试验菌,做为样品组。
B中和剂对照组:取一幅二联式集菌培养器,将100ml氯化钠蛋白胨缓冲液平均通过每只集菌培养器过滤,然后通过集菌仪每只集菌培养器加入100ml胰胳大豆胨肉汤培养基、或硫乙醇酸盐培养基,后每只加入10~100cfu试验菌,做中和剂对照组。
C阳性对照组(菌液组):取一幅二联式集菌培养器,通过集菌仪每只集菌培养器加入100ml胰胳大豆胨肉汤培养基、或硫乙醇酸盐培养基,后每只加入10~100cfu试验菌,做为阳性对照组。
D阴性对照:另取一幅二联式集菌培养器,通过集菌仪一只通过100ml胰胳大豆胨肉汤培养基,另一只通过100ml硫乙醇酸盐培养基,作为阴性对照。
5.2.3结果判断样品组与中和剂对照组微生物生长浓度相似,表明中和剂的中和方式有效消除了样品的抑菌性(即有效性),如对照组与阳性对照的微生物浓度相似,表明样品预处理,消除样品抑菌性的方法,检测程序和培养条件等均不影响微生物生长(即无毒性)。
阴性对照无菌生长。
否则实验无效。
6.验证结论
通过培养基无菌性检查、培养基灵敏度检查、无菌检查方法验证,结果表明,制定的无菌检查方法适用本公司的产品。
无菌检查方法验证试验记录
编号:ZJ/JL-8.2.4-4-10序号:
样品名称:样品批号:
检测日期:样品数量:
试验方法:依据《中国药典》2015年版四部1101 无菌检查法方法验证试验
□薄膜过滤法□直接接种法
硫乙醇酸盐流体培养基:(30~35℃培养3天)
胰酪大豆胨豆汤培养基:(20~25℃培养5天)
结论:
检验者:复核者:复核日期:
无菌培养基的适用性检查记录
编号:ZJ/JL-8.2.4-4-9
培养基:1.硫乙醇酸盐流体培养基批号:_______________ 检验日期:
2.胰酪大豆胨豆汤培养基批号:_______________ 完成日期:
以上均为符合药典规定的干燥培养基。
一、培养基的无菌性检查
培养温度:硫乙醇酸盐流体培养基℃ 胰酪大豆胨豆汤培养基℃
二、培养基的灵敏度检查
1.菌液制备:
(1)金黄色葡萄球菌新鲜肉汤培养物
[CMCC(B)26003] 第_____代注入1.1ml稀释液充分深解后,在漩涡
混合器上震荡混匀.
至_______含菌量
_______CFU/0.1ml
(2)枯草芽孢杆菌新鲜肉汤培养物1ml
[CMCC(B)63501]第_____代注入1.1ml稀释液充分深解后,
在漩涡混合器上震荡混匀.
至_______含菌量
_______CFU/0.1ml
(3)铜绿假单胞菌新鲜肉汤培养物1ml
[CMCC(B) 10104]第_____代注入1.1ml稀释液充分深解后,
在漩涡混合器上震荡混匀.至_______含菌量
_______CFU/0.1ml
(4)生孢梭菌新鲜硫乙醇酸盐培养物
[CMCC(B)64941]第_____代注入1.1ml稀释液充分深解后,
在漩涡混合器上震荡混匀.
至_______含菌量
_______CFU/0.1ml
(5)白色念珠菌新鲜改良马丁培养物1ml
[CMCC(F)98001]第_____代注入1.1ml稀释液充分深解后,
在漩涡混合器上震荡混匀.
至_______含菌量
_______CFU/0.1ml
(6)黑曲霉新鲜孢子洗脱液1ml [CMCC(F)98003]第_____代注入1.1ml稀释液充分深解后,
在漩涡混合器上震荡混匀.
至_______含菌量
_______CFU/0.1ml
2. 检查结果
细菌培养温度____℃ 3天霉菌及酵母菌培养温度____℃ 5天
注:“+”为生长,“-”为不生长
三、结论:
本品按《中国药典》2015年版四部1101无菌检查法培养基的适用性检查,结果_______________。
检验人:复核人:复核日期:。