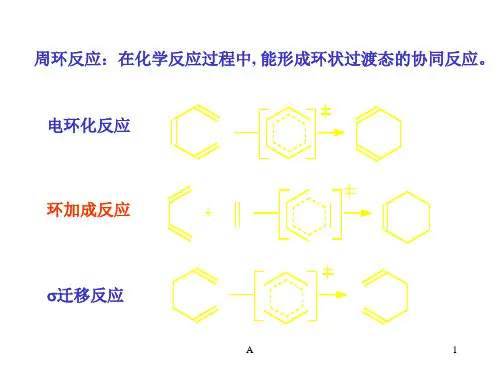
D-A 反应
- 格式:doc
- 大小:148.00 KB
- 文档页数:5

第七章固相反应第七章固相反应固相反应在固体材料的⾼温过程中是⼀个普遍的物理化学现象,⼴义地讲,凡是有固相参与的化学反应都可称为固相反应。
例如固体的热分解、氧化以及固体与固体、固体与液体之间的化学反应等都属于固相反应范畴之内。
但从狭义上,固相反应常指固体与固体间发⽣化学反应⽣成新的固体产物的过程。
Tammann 等很早就研究了CaO 、MgO 、PbO 、CuO 和WO 3的反应,他们分别让两种氧化物的晶⾯彼此接触并加热,发现在接触⾯上⽣成着⾊的钨酸盐化合物,其厚度x 与反应时间t 的关系为C t K x +=ln ,确认了固态物质间可以直接进⾏反应。
因此Tammann 等提出:(1) 固态物质间的反应是直接进⾏的,⽓相或液相没有或不起重要作⽤;(2)固相反应开始温度远低于反应物的熔融温度或系统的低共熔温度,通常相当于⼀种反应物开始呈现显著扩散作⽤的温度,这个温度称为泰曼温度或烧结温度。
对于不同物质的泰曼温度与其熔点(m T )间存在⼀定的关系。
例如,对于⾦属为0.3~0.4m T ;盐类和硅酸盐则分别为0.57m T 和0.8~0.9m T 。
(3)当反应物之⼀存在有多晶转变时,则此转变温度也往往是反应开始变得显著的温度,这⼀规律称为海德华定律。
Tammann 等⼈的观点长期为化学界所接受,但随着⽣产和科学实验的发展,发现许多固相反应的实际速度⽐Tammann 理论计算的结果快得多,⽽且有些反应(例如MoO 3和CaCO 3的反应)即使反应物不直接接触也仍能较强烈地进⾏。
因此,⾦斯特林格等⼈提出,在固相反应中,反应物可转为⽓相或液相,然后通过颗粒外部扩散到另⼀固相的⾮接触表⾯上进⾏反应,表明⽓相或液相也可能对固相反应过程起重要作⽤。
显然这种作⽤取决于反应物的挥发性和体系的低共熔温度。
图7-1描述了物质A 和B 进⾏化学反应⽣成C 的⼀种反应历程:反应⼀开始是反应物颗粒之间的混合接触,并在表⾯发⽣化学反应形成细薄且含⼤量结构缺陷的新相,随后发⽣产物新相的结构调整和晶体⽣长。

第一章习题1化学反应式与化学计量方程有何异同?化学反应式中计量系数与化学计量方程中的计量系数有何关系? ?水溶液流量为10m 3hr -1。
9 反应O 2H N 2NO 2H 222+→+,在恒容下用等摩尔H 2,NO 进行实验,测得以下数据总压/MPa0.0272 0.0326 0.0381 0.0435 0.0543 半衰期/s 265 186 135 104 67求此反应的级数。
10 考虑反应3P A →,其动力学方程为Vn k t n V r A A A d d 1=⋅-=-试推导在恒容下以总压表示的动力学方程。
11 A 和B 在水溶液中进行反应,在25℃下测得下列数据,试确定该反应反2A →R+SA 组分分压与时间关系见下表:t /sec 0 20 40 60 80 100 120 140 160 p A /MPa 0.1 0.096 0.080 0.056 0.032 0.018 0.008 0.004 0.002 试求在100℃,0.1MPa 下,进口物流中包含20%惰性物,A 组份流量为100mol·hr -1,达到95%转化率所需的平推流反应器的体积。
17间歇操作的液相反应A→R,反应速率测定结果列于下表。
欲使反应物浓度由c A0=1.3kmol·m-3降到0.3 kmol·m-3需多少时间?c A/kmol·m-30.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 1.0 1.3 2.0(−r A)/kmol·m-3min-0.1 0.3 0.5 0.6 0.5 0.25 0.10 0.06 0.05 0.045 0.0421c A0=c B0=5mol·m3,动力学方程式为−r A=kc A c B,其中k=100m3kmol-1min-1。
求:(1)反应在平推流反应器中进行时出口转化率为多少?(2)欲用全混流反应器得到相同的出口转化率,反应器体积应多大?(3)若全混流反应器体积V R=0.001m3,可达到的转化率为多少?已知k=1m3kmol-1hr-1,c B0=3kmol·m-3,c A饱和=0.02kmol·m-3,水溶液流量为10m3hr-1。

无机化学常用公式小全1:理想气体状态方程pv=nrt(该公式的各类变体参见第四章)2:实际气体状态方程。
⎢p实+a⎢⎢(v实-nb)=nrt⎢v⎢⎢⎢⎢⎢3:混合气体的分压定律p总=∑pipi=p总gxi=p总4:graham气体蔓延定律=u(b)b(b)=n(b)n(b)或m(b)=m(a)m(a)n(b)m(b)w(b)=vm,x(剂)=n(剂)=n液n质+n剂n(剂)5:质量摩尔浓度,物质的量浓度,质量浓度和摩尔分数则表示方法。
c(b)=n液n质+n剂n(质)6:raoult定律n质+n剂n(质)n剂n(质)p=p*g(x剂)∆p=p*g(x质)=p*k’b=kb(k=p*k’)7:沸点升高公式∆tb=k’∆p=kbb∆tf=k’∆p=kfb8:溶液渗透压公式∏=crt∏v=nrt常用物理量一览表(无论x是什么量)1:∆x=x(终)-x始2:w=-p外g∆v3:(热力学第一定律)∆u=q+w4:恒容反应热(1)∆u=qv(2)qv=-cg∆t(3)qv1∆t1⇒qv1=qv21(推论1)∆t2∆t2m1q1mq=22(推论2)m2∆t1m2∆t25:恒压反应热(1)h=u+pvqp=∆u-w=∆u+p外∆v=(u2-u1)+(p2v2-p1v1)=(u2+p2v2)-(u1+p1v1)=∆h6:qp与qv的关系(1)qp=qv+∆nrt(2)∆rhm=(3)∆rhm=∆rum+∆νrt(备注:左右两边的单位为j·mol-1)7:标准分解成冷的应用领域∆rhm=∑vi∆fh(生成物)-v∆h(∑mifm反应物)θθθ∆rhm=∑vi∆ch(m反应物)-∑vi∆ch(m生成物)(注意反应物与生成物的前后顺序。
)s=klnω(k=1.38⨯10-23jk-1)(注:该公式只在恒温可逆过程中成立)tθθθ∆rsm=∑vis(m生成物)-∑vis(m反应物)10:吉布斯自由能∆ru=q+w体+w非⇒q=∆ru+w体+w非=∆ru+(-p∆v)+w非=∆rh-w非qr=t∆s≥∆rh-w非-(∆h-t∆s)≥-w非-⎢⎢(h2-h1)-(t2s2-t1s1)⎢⎢≥-w非-⎢⎢(h2-t2s2)-(h1-t1s1)⎢⎢≥-w非-[g2-g1]=-∆g≥-w非(g=h-ts)11:标准生成吉布斯自由能∆rgm=∑vi∆fg(生成物)-v∆g(∑ifm反应物)m∆rgm=∆rhm-t∆rsm1:反应平均速率v(a)=2:反应瞬时速率c(a)2-c(a)1t2-t1∆c(a)⎢∆c(a)⎢dc(a)v(a)=lim-⎢=∆t→0∆tdt⎢⎢aa+bb=cc+ddv=k⎢⎢c(a)⎢⎢⎢⎢c(b)⎢⎢(注:k是反应速率常数,m,n称为a,b浓度的幂指数,不一定等于反应系数,三者皆可以通过实验测得。

化学反应速率4个公式1. 平均反应速率(Average Reaction Rate)平均反应速率是指反应物质浓度在一段时间内的平均变化率。
对于一般的反应A+B→C+D,平均反应速率可以表示为:v=Δ[A]/Δt=-Δ[B]/Δt=Δ[C]/Δt=Δ[D]/Δt其中v表示平均反应速率,Δ[A]、Δ[B]、Δ[C]、Δ[D]分别表示反应物A、B和生成物C、D的浓度变化量,Δt表示时间间隔。
该公式表示反应物物质浓度的变化量与时间的比值。
2. 瞬时反应速率(Instantaneous Reaction Rate)瞬时反应速率是指在其中一特定时刻的反应速率。
由于反应速率在反应过程中可能会发生变化,因此瞬时反应速率需要通过微分来进行计算。
对于一般的反应A+B→C+D,瞬时反应速率可以表示为:v = -d[A]/dt = -d[B]/dt = d[C]/dt = d[D]/dt其中v表示瞬时反应速率,d[A]/dt、d[B]/dt、d[C]/dt、d[D]/dt 分别表示反应物A、B和生成物C、D的浓度随时间变化的微分。
该公式表示反应物物质浓度的变化率。
3. 反应速率定律(Rate Law)反应速率定律是描述反应速率与反应物浓度的关系的数学公式。
对于一般的反应A+B→C+D,反应速率定律可以表示为:v=k[A]^m[B]^n其中v表示反应速率,k为反应速率常数,[A]、[B]分别表示反应物A和B的浓度,m和n为反应物浓度的阶数,可以根据实验结果来确定。
4. Arrhenius公式(Arrhenius Equation)Arrhenius公式是描述反应速率与温度的关系的数学公式,可用于计算反应速率常数。
Arrhenius公式可以表示为:k=Ae^(-Ea/RT)其中k为反应速率常数,A为预指数因子,Ea为活化能,R为气体常数,T为反应温度。
该公式表示反应速率常数与温度的关系。
通过测定不同温度下的反应速率常数,可以确定活化能。

平衡常数计算公式平衡常数(Ka)是指在给定条件下,化学反应达到平衡时,反应物和生成物之间浓度的相对关系。
平衡常数的计算公式可以使用两种方法:浓度法和活度法。
一、浓度法1.对于一般的平衡反应:aA+bB⇌cC+dD平衡常数Ka的计算公式为:Ka=[C]c[D]d/[A]a[B]b其中,[A]、[B]、[C]和[D]分别表示反应物A、B和生成物C、D的摩尔浓度。
2.对于涉及气体的平衡反应:aA+bB⇌cC+dD+eE平衡常数Ka的计算公式为:Ka=(PC)c(PD)d(PE)e/(PA)a(PB)b其中,PA、PB、PC、PD和PE分别表示气体反应物A、B和生成物C、D、E的分压。
3.对于涉及溶液的平衡反应:aA+bB⇌cC+dD平衡常数Ka的计算公式为:Ka=[C]c[D]d/[A]a[B]b[H2O]w其中,[H2O]表示反应体系中水的摩尔浓度或活度。
二、活度法活度是一种标量,表示溶液中溶质的有效浓度。
它可以用来描述溶液中分子之间的相互作用。
活度系数(γ)是活度与摩尔浓度之间的比值。
通常情况下,Ka的计算公式可以表示为:K a=γCγD/γAγB其中,γA、γB、γC和γD分别表示溶质A、B和溶质C、D的活度系数。
活度系数的计算涉及理想化和非理想化的溶液行为模型,如Debye-Hückel理论、van Laar方程或Flory-Huggins理论。
这些模型是根据溶质和溶剂之间相互作用的种类和强度来建立的。
总结:平衡常数的计算公式可以使用浓度法或活度法。
浓度法适用于任何类型的反应,包括涉及气体或溶液的反应。
活度法则更精确,适用于非理想溶液的情况。
具体计算中,需要确定参与反应的物质的浓度或活度,并根据反应方程式中的摩尔比例关系,计算各个物质的浓度或活度。

脱氮气的d-a反应
脱氮气的d-a反应可以应用于有机合成中,用于构建含氮杂环
化合物或者其他有机分子。
这种反应通常需要催化剂的存在,以促
进反应的进行。
在实验室条件下,通常会选用适当的试剂和溶剂来
促进这种反应的进行。
从机理上来看,脱氮气的d-a反应可以被描述为亲电加成反应,其中双键上的氮原子作为亲电子试剂与另一个分子中的双键发生反应。
这种反应通常会形成新的碳-碳或碳-氮键,并且会释放出氮气
分子。
总的来说,脱氮气的d-a反应在有机合成中具有重要的应用,
可以用于构建复杂的有机分子结构,同时也为化学研究提供了重要
的反应途径。
在实际应用中,需要考虑反应条件、催化剂选择、试
剂选择等因素,以实现高效、高选择性的反应过程。

1>.美国的著名大学(哈佛、麻省、斯坦佛、普林斯顿等)文理皆必修生化。
<2>.人体基因工程计划:上个世纪的三个计划:曼哈顿、阿波罗、人体基因工程:人类23对染色体(23对DNA分子)测序,几十万个基因,大肠杆菌8000个基因,基因改造(治病),WATSON和CRICK开玩笑,女儿赛过爱因斯坦和玛丽莲梦露,儿子聪明高飞低潜力大无穷的超人。
<3>.诺贝尔奖金(90多万美元,最高荣誉)的分布:化学,医学生理学领域不说独占鳌头也是多抢多占,如蛋白质的螺旋和折迭(化学)、G蛋白、第二信使学说的三代科学家三次获奖,光合作用机制,更不要说核酸领域了(复制、转录、逆转录、RNA复制等中心法则中的内容)不想获得诺贝尔奖的科学家不是好科学家。
今天的考研是为了明天的诺贝尔奖!对映体一个不对称碳原子的取代基在空间里的两种取向是物体与镜像的关系,并且两者不能重叠。
这两种旋光异构体称为对映体。
两个对映体具有程度相同但方向相反的旋光性(D+与L-;D-与L+)和不同的生物活性,其他物理和化学性质完全相同。
含n个C*的化合物,其旋光异构体的数目是2n, 组成2n /2对对映体。
任一旋光化合物都只有一个对映体,它的其他旋光异构体在理、化性质都与之不同,不是对映体的旋光异构体称非对映体。
仅一个手性碳构型不同的非对映体称差向异构体(有几种情况)。
异头物单糖由直链结构变成环状结构后,羰基碳成为新的手性碳(异头碳),导致C1差向异构化,产生两个非对映体,称之。
α、β异头物判断:有2种方式。
见P9-10。
多不饱和脂肪酸家族:分为ω-3和ω-6系列(指离羧基最远的双键到甲基末端3个碳和6个碳)。
如亚油酸和γ-亚麻酸为ω-6系列,而α-亚麻酸为ω-3系列。
人体内二者不能互转!且二者对血脂的影响不同皂化值:皂化1g油脂所需的KOHmg数;碘值:100g油脂卤化时所吸收的碘的克数;乙酰值:中和1g乙酰化物所释放的乙酸所需要的KOHmg数;酸值:中和1g油脂中的游离脂肪酸所需的KOHmg数氨基酸洗脱顺序的判定:氨基酸与树脂的亲合力主要决定于它们之间的静电吸引,其次是氨基酸侧链与树脂聚苯乙烯之间的疏水相互作用;亲和力愈大愈难洗脱!肽的理化性质:①肽键的酰氨氢不解离,肽的酸碱性质主要决定于肽键中的游离末端α-NH2、α-COOH及侧链R基上的可解离基团;②肽中末端α-羧基的pKa值比游离氨基酸的大,末端α-氨基的pKa值比游离氨基酸的小;③游离的α-氨基、α-羧基和R基可发生与氨基酸中相应的类似反应,如茚三酮反应等;④蛋白质部分水解后所得的肽若不发生消旋,则有旋光性,短肽的旋光度约等于组成氨基酸的旋光度之和,较长的肽的旋光度则不是简单加和α角蛋白经充分伸展后可转变成β角蛋白,即β折叠片结构。

化学反应动⼒学练习题1化学反应动⼒学练习题⼀、计算题1.340K 时N 2O 5分解反应有如下实验数据时间0 60 120 180 240 c (N 2O 5)/mol ·L-1求60s 内和120s 到240s 的平均速率。
2.某基元反应A(g)+2B(g)D(g)+E(g),某温度下,将⼀定量的A 和B通⼊⼀定体积的容器中。
(1)当A 和B 各消耗50%时反应速率为起始率的⼏倍(2)在恒温下,将容器的体积减少⼀半时反应速率是起始速率的多少倍3.⼀定温度下反应CO(g)+Cl 2 (g) COCl 2有下列实验数据时间初始速率/mol -1·ls -1CO Cl 2 ×10-2 ×10-3×10-3求(1)反应级数;(2)速率⽅程;(3)速率常数。
4.反应N 2O 52NO 2+21O 2速率常数随温度变化的实验数据如下,求该T/K 273 298 308 318 328 338 k/s -1×10-7 ×10-5 ×10-4 ×10-4 ×10-3 ×10-35.反应CO(CH 2COOH) 2 CH 3COCH 3+2CO 2,在283K 时速率常数k 为 ×10-3 mol ·L -1·min -3,在333K 时速率常数k 为·L -1·min -1。
求303K 时反应的速率常数。
6.密闭容器中进⾏的某基元反应A(g)+2B(g)2C(g)当反应物的起始浓度分别为c A=·L-1,c B=·L-1时的反应速率为·L-1·s-1,若温度不变增⼤反应物浓度,使c A=·L-1,c B=·L-1,此时反应速率多⼤为原来反应速率的多少倍7初始浓度/mol·L-1初始速率/mol·L-1·s-1 c(NO)C(O2)1 2 3×10-2×10-3×10-3(1)写出该反应的速率⽅程式并指出反应级数;(2)计算速率常数;(3)当c(NO)=·L-1,c(O2)= mol·L-1时反应速率是多少8.反应C2H6 →C2H4 + H2,开始阶段反应级数近似为3/2级,910 K时速率常数为dm3/2·。
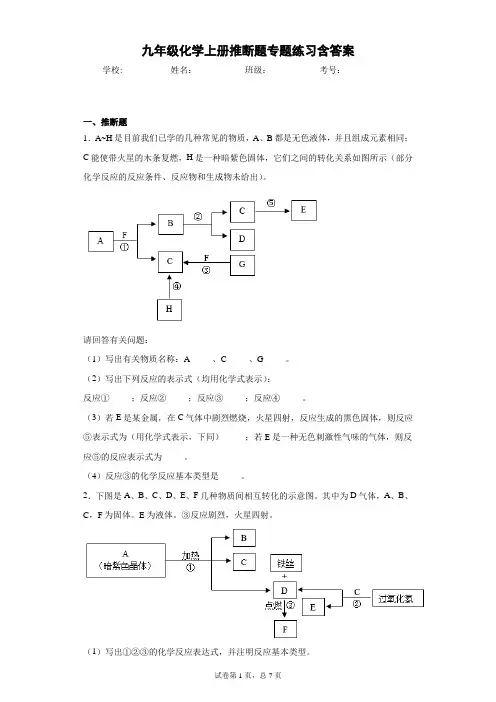
九年级化学上册推断题专题练习含答案学校:___________姓名:___________班级:___________考号:___________一、推断题1.A~H是目前我们已学的几种常见的物质,A、B都是无色液体,并且组成元素相同;C能使带火星的木条复燃,H是一种暗紫色固体,它们之间的转化关系如图所示(部分化学反应的反应条件、反应物和生成物未给出)。
请回答有关问题:(1)写出有关物质名称:A_____、C_____、G_____。
(2)写出下列反应的表示式(均用化学式表示):反应①_____;反应②_____;反应③_____;反应④_____。
(3)若E是某金属,在C气体中剧烈燃烧,火星四射,反应生成的黑色固体,则反应⑤表示式为(用化学式表示,下同)_____;若E是一种无色刺激性气味的气体,则反应⑤的反应表示式为_____。
(4)反应③的化学反应基本类型是_____。
2.下图是A、B、C、D、E、F几种物质间相互转化的示意图。
其中为D气体,A、B、C,F为固体。
E为液体。
③反应剧烈,火星四射。
(1)写出①②③的化学反应表达式,并注明反应基本类型。
①_____(____)②_____(____)③_____(____)(2)实验反应③时,应注意什么?(任写两点)第1点:_____第2点:_____3.图中A-F表示初中化学常见的物质,其中A、B、F为氧化物,A和B的组成元素相同;C、D、E为单质,E与C反应火星四射。
图中“一”表示两端的物质间能发生化学反应:“→”表示物质间存在转化关系;反应条件、部分反应物和生成物已略去。
(1)D的名称为____________。
(2)写出B→C反应的化学方程式________;E和C反应的基本反应类型是________________。
(3)A、B的组成元素相同,但其化学性质不同的原因是_________________。
4.A、B、C为初中化学常见的三种物质。

化学产率计算公式
化学反应的产率是化学反应的一个重要指标,可以反映化学反应的效率。
计算化学反应产率的公式是:
n(有机物)= n(A)- n(B)
化学产率Y%= n(产物)/ n(反应物)× 100%
举例来说,如果一个反应式为 A + B C + D,反应中A,B分别投入1mol,产物C,D分别为2mol和1mol,则化学反应产率计算公式为: n(有机物)= n(A)- n(B)= 1-1= 0
化学产率Y%= n(产物)/ n(反应物)× 100%= (2+1)/(1+1) 100% = 150%
化学反应的产率反映着化学反应的有效性,化学反应有效性的高低直接影响着化学反应的生产效率。
因此,化学反应的产率的计算公式及其计算结果都具有十分重要的应用意义。
化学反应的产率影响因素有很多,其中最主要的影响因素是反应温度、催化剂、反应压力和化学反应类型等。
当这些因素发生变化时,都会使得化学反应的产率有所变化,影响化学反应的有效性。
此外,反应物的浓度也会影响化学反应的产率。
当反应物浓度越高时,能量变化就越大,反应速率就会越慢,从而影响到化学反应的产率。
化学反应的产率也与重金属有关。
例如,有的重金属会影响化学反应的速率,使化学反应的产率发生变化。
这是因为,重金属元素的反应性比其他元素强,会使给定化学反应系统中的元素结合能发生改变,从而影响化学反应的产率。
总之,计算化学反应产率的公式很重要,可以通过公式计算出不同反应的化学反应的产率,从而更好地掌握反应有效性,并及时调整反应条件,以达到最大的生产效率。
狄尔斯—阿德尔反应(Diels—Alder反应)1928年,德国化学家O.Diels(狄尔斯)和他的学生K.Alder(阿尔德)在研究1,3-丁二烯和顺丁烯二酸酐的互相作用时发现了一类反应——共轭二烯烃和某些具有碳碳双键、碳碳叁键的不饱和化合物进行1,4-加成,生成六元环状化合物的反应,这类反应称为Diels-Alder反应,又称双烯合成反应(diene synthesis)。
Diels-Alder反应的反应物分成两部分,一部分提供共轭双烯,称为双烯体,另一部分提供不饱和键,称为亲双烯体。
改变共轭双烯和亲双烯体的结构,可以得到多种类型的化合物,并且许多反应在室温或在溶剂中加热即可进行,产率也比较高,是合成六元环化物的重要方法。
例如:(双烯体)(亲双烯体)1,3-丁二烯和顺丁烯二酸酐反应生成白色固体,该反应可用于鉴别共轭二烯烃。
Diels-Alder反应的应用范围非常广泛,在有机合成中有非常重要的作用。
O.Diels和K.Alder因这一反应的发现共同获得了1950年诺贝尔化学奖。
Diels-Alder反应通式为:(双烯体)(亲双烯体)EDG(electron donating group,给电子基团) EWG(electron withdrawing group,吸电子基团) 1.Diels-Alder反应的特点:(1)Diels-Alder反应是一步完成的,新的σ键和π键的生成和旧的π键的断裂是同步进行的。
反应时,反应物分子彼此靠近互相作用,形成一个环状过渡态,然后逐渐转化为产物分子。
即旧键的断裂和新键的形成是相互协调地在同一步骤中完成的。
具有这种特点的反应称为协同反应(synergistic reaction)。
在协同反应中,没有活性中间体如碳正离子、碳负离子、自由基等产生。
(2)发生Diels-Alder反应的双烯体的两个碳碳双键必须取顺式构象,如:开链共轭双烯同环共轭双烯异环共轭双烯环内外共轭双烯反式的双烯体不能发生Diels-Alder反应,如:空间位阻因素对Diels-Alder反应的影响较大,有些双烯体的两个碳碳双键虽然是顺式构象,但由于1,4位取代基的位阻较大,也不能发生该类反应,如:值得说明的是,双烯体的2,3位有取代基对Diels-Alder反应不形成位阻,合适的取代基还能促使双烯体取顺式构象,此时对反应有利。
生物化学第9章糖代谢生物化学第9章糖代谢第九章糖代谢课外练习题一、名词解释1、糖酵解:在缺氧情况下,葡萄糖分解为乳酸的过程成为糖酵解。
2、糖酵解途径:葡萄糖分解为丙酮酸的过程3、糖有氧氧化:葡萄糖在有氧条件下氧化生成CO2和H2O的反应过程。
4、三羧酸循环:由乙酰CoA与草酰乙酸缩合成柠檬酸开始,经过反复脱氢、脱羧,再生成草酰乙酸的循环反应过程称为三羧酸循环(TAC,或Krebs循环)。
5、糖异生:由非糖化合物转变为葡萄糖或糖原的过程6、糖异生途径:从丙酮酸生成葡萄糖的具体反应过程7、乳酸循环:在肌肉中葡萄糖经糖酵解生成乳酸,乳酸经血液运到肝脏,肝脏将乳酸异生成葡萄糖。
葡萄糖释放进入血液后又被肌肉摄取,这种代谢循环途径成为乳酸循环。
8、糖原:是机体内糖的贮存形式,是可以迅速动用的葡萄糖贮备。
9、糖原合成:由葡萄糖合成糖原的过程10、活性葡萄糖:在葡萄糖合成糖原的过程中,UDPG中的葡萄糖基称为活性葡萄糖。
二、符号辨识1、EMP酵解途径;2、TCA/Krebs环三羧酸循环;3、PPP/HMP磷酸戊糖途径;4、CoA辅酶A;5、G-1-p1-磷酸葡萄糖;6、PEP磷酸烯醇式丙酮酸;三、填空1、将简单的小分子物质转变成复杂的大分子物质的代谢过程被称为(合成)代谢,而将复杂的大分子物质转变成小分子物质的过程则是(分解)代谢。
2、唾液中含有(α淀粉)酶,可水解淀粉中的α-1,4糖苷键。
淀粉消化主要在(小肠)内进行,降解形成寡糖。
3、二糖在酶作用下,能水解成单糖。
主要的二糖酶有(蔗糖)酶、(半乳糖)酶和(麦芽糖)酶。
4、糖在血液中的运输形式是(葡萄糖)。
糖的贮存形式是(糖原)。
5、糖的分解代谢途径包括(糖酵解)、(三羧酸)循环和(磷酸戊糖)途径。
糖的合成代谢途径包括(糖原)的合成以及非糖物质的(糖异生)作用。
6、人体内主要通过(磷酸戊糖)途径生成核糖,它是(核苷酸)的组成成分。
7、由于红细胞没有(线粒体),其能量几乎全部由(糖酵解)途径提供。
“药物效价单位”换算什么是“生物效价单位”?一种计量单位,是针对药物代谢动力学来说的,通常都是单位有效量,咱们把最小有效量做为计量的单位,就有了效价一说。
临床上常见到的以效价单位计量的药物有生物制剂、激素、维生素及部分抗生素类药。
这些药物依中国药典规定,均以其特有的药理效价表示剂量。
多数抗生素以其有效部分的一定重量(1μg)作为1单位。
如链霉素、土霉素、红霉素等均以纯游离碱1.0μg或一定重量作为1单位。
值得注意的是,在制药工业的发展过程中,随着制药工艺的提高,药物的纯度也逐年提高,其生物效价亦随之愈来愈高。
如前文提到的肝素钠,该药研制初期的生物效价,每1.0mg效价相当于125U,1977版中国药典规定肝素钠每1.0mg效价不得少于140U,而1995版药典则定为每1.0mg效价不得少于150U,目前临床把12500U/支的肝素钠视为100mg/支,仍是以肝素钠最初生物效价标准为依据的。
如果按1995版药典以肝素钠1.0mg相当于150U 推算,12500U/支应该相当于83.3mg,而不是100mg/支。
因此,以效价单位标示的药物本身,乃至相互之间的剂量换算没有等量代换的关系,即使是同一类药物的效价定义也不完全相同。
一般药物的重量以克为基本单位、容量以毫升为基本单位。
如1g=1000mg,1L=1000ml,这些计量单位及换算关系很直观,但是有些药物,如生物制剂、抗生素等因纯度不够,以药物的常用重量及容量单位不能表示其药理效价,则以药理作用效价单位表示剂量。
此时如果对药物的“效价单位”和“重量单位”之间的折算概念不清,则可出现给药剂量误差,导致严重的差错。
某些药物,其药物原料中含有一些可存在的杂质,不可能是纯品。
故不能以重量单位准确表示其含量,只能依靠生物检定的方法与标准品进行比较来测定药物的效价剂量。
因此,采用特定的“单位”——“U”来计量。
效价是某种药物达到一定效应时所需的剂量,产生相同效应药品的剂量比较时,所需剂量越小,药物的效价就越高,反之效价就低。
详解维生素单位换算发布:2011-11-07 14:32 |来源:未知|编辑:admin |查看:1506次|相信很多朋友都有这样的疑惑,不管是你在购买维生素的时候,还是在学习维生素知识的时候,你会发现维生素剂量单位有好多种,有的时候你看到的是mg,有的时候你看到的是ug,还有的时候你看到的是IU,为什么维生素的剂量单位有好几种呢?而这些维生素的剂量单位之间应该如何换算呢?今天我们就来给大家详细介绍一下维生素单位换算的方法。
在了解维生素单位换算之前,先让我们认识一下各种维生素的剂量单位符号:"g"、"mg和” ug是质量单位时的三个符号,其中”代表”克:” mg代表”毫克:” ug代表微克,他们之间的换算关系是1g=1000mg,1mg=1000ug,也就是说1克等于1000毫克,1毫克等于1000微克。
这个维生素的单位换算关系仅限于维生素制剂都是以质量为单位的情况下的换算。
有的时候,也会用” MCG来代表微克,这是英文字母” microgram “微克)的英文缩写。
但是微克的国际通用符号是” ug。
“而最让人头痛的是,我们还会经常看到“ IU这个单位,这是什么意思呢?这也是维生素含量的一个表示方法,它是国际单位“ In ternation Un its的缩写。
简单的理解就是,IU是是国际上起统一标准作用的表示某些抗生素、维生素等物质的量的一个药学单位,国际上也经常用IU 来维生素A、D等等营养素的含量。
那么IU和mg等质量单位之间又如何换算呢?这个维生素单位换算有点麻烦,您要仔细看清了。
早期把0.30微克的视黄醇或者0.60微克的3- 胡萝卜素定义为1个国际单位,因为科学家们发现,同等量的视黄醇和3胡萝卜素生理活性并不相同,3胡萝卜素只有视黄醇的一半,后来发现3胡萝卜素吸收率只有视黄醇的三分之一,并且发现3胡萝卜素之外的维生素a原生理活性更低,那么说了这么多,我们想表达的是什么意思呢?主要意思就是说,用国际单位做为维生素a的计量单位的话,会导致植物性的维生素a的营养价值被高估,无法真实的反应维生素a的营养价值。
质量守恒定律的数学表达式嘿呀,同学们,咱来唠唠质量守恒定律的数学表达式。
你想啊,质量守恒定律就是说在一个封闭系统里,物质不管咋反应,质量是不变的。
那这个数学表达式呢,就像一个魔法公式。
在化学反应里,简单来说,如果我们有反应物A和B反应生成了C和D。
我们可以写成这样:aA + bB = cC + dD。
这里的a、b、c、d呢,就是反应方程式里的系数。
这个表达式就是告诉咱,反应前的质量(a乘以A的相对分子质量加上b乘以B的相对分子质量)就等于反应后的质量(c乘以C的相对分子质量加上d乘以D的相对分子质量)。
打个比方,氢气(H₂)和氧气(O₂)反应生成水(H₂O)。
方程式是2H₂ + O₂ = 2H₂O。
这里呢,氢气的相对分子质量是2,氧气是32,水是18。
按照质量守恒定律的数学表达式就是2×2 + 32 = 2×18。
你看,等式两边的质量是相等的呢。
还有哦,在溶液里的反应也一样适用。
比如说氢氧化钠(NaOH)和盐酸(HCl)反应生成氯化钠(NaCl)和水(H₂O),方程式是NaOH + HCl = NaCl + H₂O。
这里反应前氢氧化钠的相对分子质量是40,盐酸是36.5,反应后氯化钠是58.5,水是18。
40 + 36.5 = 58.5+18,质量就是守恒的。
而且这个定律的数学表达式在化学计算里超级有用。
比如说我们要算反应里某种物质的质量,只要知道其他物质的质量和反应方程式,就可以根据这个表达式来算了。
就像我们知道了氢气和氧气反应生成水,要是知道了氢气的质量,就能算出氧气的质量或者生成水的质量。
再比如说,有个反应是碳酸钙(CaCO₃)高温分解成氧化钙(CaO)和二氧化碳(CO₂),方程式是CaCO₃ = CaO+ CO₂↑。
如果我们有100克的碳酸钙分解,根据碳酸钙的相对分子质量是100,氧化钙是56,二氧化碳是44,就可以算出能生成多少氧化钙和二氧化碳。
按照表达式,100克碳酸钙反应,生成56克氧化钙和44克二氧化碳。
狄尔斯–阿尔德反应[编辑]
维基百科,自由的百科全书
(重定向自狄尔斯-阿德尔反应)
跳转至:导航、搜索
RXNO:0000006
(英语:)又叫Diels–Alder反应、双烯加成反应,其中狄尔斯又译作第尔斯–阿尔德又译作阿德尔、阿德耳。
狄尔斯–阿尔德反应是一种有机反应(具体而言是一种环加成反应),共轭双烯与取代烯烃(一般称为亲双烯体)反应生成取代环己烯[1][2][3]。
即使新形成的环之中的一些原子不是碳原子,这个反应也可以继续进行。
一些狄尔斯–阿尔德反应是可逆的,这样的环分解反应叫做逆狄尔斯–阿尔德反应或逆Diels–Alder反应(retro-Diels–Alder)。
1928年德国化学家奥托·迪尔斯和他的学生库尔特·阿尔德首次发现和记载这种新型反应,他们也因此获得1950年的诺贝尔化学奖。
狄尔斯–阿尔德反应用很少能量就可以合成六元环,是有机化学合成反應中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
反应有丰富的立体化学呈现,兼有立体选择性、立体专一性和区域选择性等。
目录
[隐藏]
∙ 1 发现
∙ 2 机理
∙ 3 立体化学
∙ 4 合成中的价值
∙ 5 参见
∙ 6 参考资料
发现[编辑]
本条目没有列出任何参考或来源。
(2012年2月1日)
維基百科所有的內容都應該可供查證。
请协助添加来自可靠来源的引用以改善这篇条目。
无法查证的内容可能被提出
异议而移除。
狄尔斯-阿尔德反应是1928年由德国化学家奥托·迪尔斯(Otto Paul Hermann Diels)和他的学生库尔特·阿尔德(Kurt Alder)发现的,他们因此获得1950年的诺贝尔化学奖。
最早的关于狄尔斯–阿尔德反应的研究可以上溯到1892年。
齐克(Zinke)发现并提出了狄尔斯-阿尔德反应产物四氯环戊二烯酮二聚体的结构;稍后列别捷夫(Lebedev)指出了乙烯基环己烯是丁二烯二聚体的转化关系。
但这两人都没有认识到这些事实背后更深层次的东西。
1906年德国慕尼黑大学研究生阿尔布莱希特(Albrecht)按导师惕勒(Thiele)的要求做环戊二烯与酮类在碱催化下缩合,合成一种染料的实验。
当时他们试图用苯醌替代其他酮做实验,但是苯醌在碱性条件下很容易分解。
实验没有成功。
阿尔布莱希特发现不加碱反应也能进行,但是得到了一个没有颜色的化合物。
阿尔布莱希特提了一个错误的结构解释实验结果。
1920年德国人冯·欧拉(von Euler)和学生约瑟夫(Joseph)研究异戊二烯与苯醌反应产物的结构。
他们正确地提出了狄尔斯–阿尔德产物结构,也提出了反应可能经历的机理。
事实上他们离狄尔斯–阿尔德反应的发现已经非常近了。
但冯·欧拉并没有深入研究下去,因为他的主业是生物化学(后因研究发酵而获诺贝尔奖),对狄尔斯–阿尔德反应的研究纯属娱乐消遣性质的,所以狄尔斯-阿德尔反应再次沉没下去。
1921年,狄尔斯和其研究生巴克(Back)研究偶氮二羧酸二乙酯(半个世纪后因光延反应而在有机合成中大放光芒的试剂)与胺发生的酯变胺的反应,当他们用2-萘胺做反应的时候,根据元素分析,得到的产物是一个加成物而不是期待的取代物。
狄尔斯敏锐地意识到这个反应与十几年前阿尔布莱希特做过的古怪反应的共同之处。
这使他开始以为产物是类似阿尔布莱希特提出的双键加成产物。
狄尔斯很自然地仿造阿尔布莱希特用环戊二烯替代萘胺与偶氮二羧酸乙酯作用,结果又得到第三种加成物。
通过计量加氢实验,狄尔斯发现加成物中只含有一个双键。
如果产物的结构是如阿尔布莱希特提出的,那么势必要有两个双键才对。
这个现象深深地吸引了狄尔斯,他与另一个研究生阿尔德一起提出了正确的双烯加成物的结构。
1928年他们将结果发表。
这标志着狄尔斯-阿德尔反应的正式发现。
在他们的论文两个作者很深远地看到了这个反应对有机合成观念的颠覆作用,他们预言了该反应日后将在天然产物合成领域的重大意义。
当然两人在文章中也透露出地主恶霸的作风。
先是在文章开头把阿尔布莱希特提出的错误结构这件事用很恶毒的语言痛批一顿。
在文章最后又声明两人对该反应有专属权,不允许其他人使用(英译:We explicitly reserve for ourselves the application of the reaction discovered by us to the solution of such problems.)。
当然,科学界不把这些话当回事。
狄尔斯、阿尔德两人后来卷入该反应的发现权纷争中,分散了精力,没能实现他们预言的“在天然产物全合成中的应用”。
1950年,伍德沃德第一个开创了狄尔斯–阿尔德反应在全合成中的应用。
从此以后,合成大师们用睿智的大脑把狄尔斯–阿尔德反应的应用发挥到了炉火纯青的极致。
值得指出的是,在伍德沃德之前,中国化学家庄长恭曾经尝试过用狄尔斯–阿尔德反应来合成甾体化合物,但是由于当时缺乏对狄尔斯–阿尔德反应区域选择性的控制的知识而失败了。
机理[编辑]
这是一个一步完成的协同反应。
没有中间体存在,只有过渡态。
一般条件下是双烯的最高含电子轨道(HOMO)与亲双烯体的最低空轨道(LUMO)相互作用成键。
由于是不涉及离子的协同反应,故普通的酸碱对反应没有影响。
但是路易斯酸可以通过络合作用影响最低空轨道的能级,所以能催化该反应。
立体化学[编辑]
狄尔斯-阿尔德反应有如下规律:
1、区域选择性:反应产物往往以“假邻对位”产物为主。
即若把六元环产物比作苯环,那么环上官能团(假设有两个官能团)之间的相互位置以邻位(如1),或者对位为主(如3)。
2、立体选择性:反应产物以“内型(即5)”为主,即反应主产物是经过“内型”过渡态得到的。
3、立体专一性:加热条件下反应产物以“顺旋”产物为唯一产物;光照条件下以“对旋”产物为唯一产物。
比如以下两个热反应中,产物7、8的相对立体构型都是唯一的,两个烯烃原料原有的官能团A,B,C,D的顺反立体化学关系都在产物中得到忠实地翻译。
合成中的价值[编辑]
由于该反应一次生成两个碳碳键和最多四个相邻的手性中心,所以在合成中很受重视。
如果一个合成设计上使用了狄尔斯–阿尔德反应,则可以大大减少反应步骤,提高了合成的效率。
很多有名的合成大师都擅长运用狄尔斯–阿尔德反应于复杂天然产物的合成,比如罗伯特·伯恩斯·伍德沃德、艾里亚斯·詹姆斯·科里、丹尼谢夫斯基(Danishefsky)都是应用狄尔斯–阿尔德反应方面的高手。
据传伍德沃德在童年的时候就根据凯库勒苯环两种结构的不可辩性预测了狄尔斯–阿尔德反应的存在。
伍德沃德12岁的时候通过驻波士顿的德国外交官获得了一些德文化学期刊。
在其中一期上他读到了狄尔斯和阿尔德发表的文章见证了该反应的发现。
伍德沃德在其一生的合成实践中大量应用狄尔斯–阿尔德反应构建六元环。
伍德沃德于1960年代开始,与刚入哈佛大学做研究的理论化学家罗德·霍夫曼联手,结合大量的实验事实对狄尔斯–阿尔德反应和相关周环反应的立体化学做了透彻的理论研究,最终导致了在当时震撼了整个有机化学界的「分子轨道对称守恒原理」的诞生。
1979年伍德沃德逝世;1981年霍夫曼因该理论而获得当年度诺贝尔化学奖(与日
本人福井谦一分享)。
2004年,有机合成的另一位著名人物科里在伍德沃德逝世20多年后公开宣称伍德沃德剽窃了他思想而创立的对称守恒律。
这一切又使得狄尔斯-阿尔德反应充满了某种宿命的传奇色彩。
科里对狄尔斯–阿尔德反应也有很大的贡献,发明了一种路易斯酸催化的不对称狄尔斯–阿尔德反应。
在其合成前列腺素过程中,科里试图利用环戊二烯做狄尔斯–阿尔德反应来构筑前列腺素的母环,由此发明了不稳定烯酮的替代试剂。
丹尼谢夫斯基则以发明十分有用的“丹尼谢夫斯基双烯”用于狄尔斯–阿尔德反应而最为出名,在其全合成实践中狄尔斯–阿尔德反应也随处可见。
丹尼谢夫斯基双烯9与一个炔酸酯10反应,经酸化后得到一个苯衍生物11。