第14章氮族元素
- 格式:doc
- 大小:32.50 KB
- 文档页数:2




![无机化学[第十四章氮族元素]课程预习](https://uimg.taocdn.com/753880ec5f0e7cd185253620.webp)
第十四章氮族元素知识点归纳一、氮的单质单质氮在常况下是一种无色无味的气体,在标准状况下密度为1.25g/dm3。
工业上生产氮一般是由分馏液态空气在15.2MPa压力下装入钢瓶备用,或做成液氮存在于液瓶中,实验室中制备少量氮气。
N2分子是已知的双原子分子中最稳定的.在高温高压并有催化剂存在的条件下,氮气可以和氢气反应生成氨:二、氦的成键特征N原子价最子层结构为2s2p3,即有3个成单电子和一个孤电子对,在形成化合物时,其成键特征如下:(1)形成离子键N原子有较高的电负性,它同电负性较低的金属形成一些二元氮化物即能够获得部分负电荷而形成N3-离子。
(2)形成共价键N电子同电负性较高的非金属形成化合物时它总是以不同的共价键同其他原子相结合,这些共价键一般有以下几种:三、氮的氢化物1.氨(1)氨的制备氨是氮的最重要化合物之一,在工业上氨的制备是用氮气和氢气在高温高压和催化剂存在下合成的:(2)氨分子的结构在NH3中,氨采取不等性sp3杂化,有一对孤电子对,分子呈三角锥形结构,键角为107。
18’。
这种结构使得NH3分子有较强的极性。
(3)氨的物理性质和化学性质NH3具有相对高的凝固点、溶解热、蒸发热、溶解度和介电常数,氨极易溶于水。
在水中的溶解度比任何气体都大,237K时1 dm3的水能溶解1200dm3的氨。
氨的主要化学性质有:①还原性KH3和NH4+离子中N的氧化价为+3,因此它们在一定条件下只能有失去电子的倾向而显还原性。
常温下,氨在水溶液中能被Cl2,H2O2,KMnO4等氧化。
例如:③加合反应氨中氮原子上的孤电子对能与其他离子或分子形成配位键,结果形成了各种形式的氨合物,氨能与许多金属离子形成氨配合物如[Ag(NH3)2]+。
④弱碱性氨极易溶于水,它在水中主要是形成水合分子,同时在水中只有一部分水合氨分子发生电离作用。
NH3·H2O的K b=1.8×10—5,可与酸发生中和反应.(4)铵盐氨和酸作用可得到相应的铵盐,铵盐一般是无色晶体,易溶于水,而且是强电解质。




第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物3B: 杂化,与2也是一种拟卤离子。
反应类似于卤除浅黄色的一般易溶。
盐,生成沉淀物。
但以氧化性为主,N 不等性杂化,大键中电亚硝酸的分子结构阳离子离子电场较弱一个电子形成第十四章氮族元素§本章摘要§1.氮和氮的化合物单质氮的氢化物氮的含氧化合物2.磷和磷的化合物单质磷的氢化物磷的含氧化合物磷的卤化物和硫化物3.砷、锑、铋单质砷锑铋的氢化物砷、锑、铋的氧化物及其水合物砷、锑、铋的三卤化物砷、锑、铋的硫化物: 由于动力学原因,这种歧化只有在碱中才能成为现实。
PH轨道相互成键,+2°氧化物的性质离子形成可溶性配合物所以分析中常用做为的掩蔽剂D)缩合性链聚多磷酸的通式B)、Array B) 歧化反应的鸡蛋清溶液,使蛋白溶按顺序X第十四章 氮族元素§本章摘要§ 1.氮和氮的化合物单质 氮的氢化物 氮的含氧化合物 2.磷和磷的化合物单质 磷的氢化物 磷的含氧化合物 磷的卤化物和硫化物3.砷、锑、铋单质 砷锑铋的氢化物 砷、锑、铋的氧化物及其水合物 砷、锑、铋的三卤化物 砷、锑、铋的硫化物可与F 2反应有五价化合物生成。
,在碱性介质中而在强酸中,即] =1时,可以氧化,在酸介质中却弱酸,碱性比,若用浓盐酸抑制水解,体系中会有存在,但用水解,溶液中也不会有。
则要在浓盐酸中通入只有在浓盐酸中才会有存在,通入H无.。

武汉大学版无机化学课后习题答案--14氮族元素第十四章 氮族元素1. 用MO 理论讨论N 2和NO 分子中的成键情况,并指出两者键级是多少? 答:N 2 :2222222*222pp p s s KK σππσσ 键级3 NO :1*22222222*222pp p p s s KK πσππσσ 键级2.5。
2.解释下列问题:(1)虽然氮的电负性比磷高,但是磷的化学性质比氮活泼?(2)为什么Bi(V)的氧化能力比同族其他元素强?答:(1) 氮的电负性比P 高,但氮不如P 活泼,这是由俩者单质的结构不同决定的。
N 的半径很小,但N 原子间形成三重键,叁键的键能很高,难以断开,因而N 2很不活泼。
P 原子半径很大,而使P 原子间的p 轨道重叠很小,不能形成多重键。
P-P 单键键能很小,很容易断开。
特别白磷的P-P-P 键角小张力大,更活泼。
(2) Bi(v)的氧化能力比同族其他元素强的多,出现了充满4f、5d,而4f、5d对电子的屏蔽作用较小,而6s具有较大的穿透能力,所以6s电子能级显著降低,不易失去,有“惰性电子对效应”。
失去2 个6s电子的Bi(v 更倾向于得到2个电子形成更稳定的Bi3+。
3.试从分子结构上比较NH3、HN3、N2H4和NH2OH等的酸碱性。
答:NH3结构见书648HN3结构见书658N2H4结构见书655NH2OH结构见书658得出酸性HN3> NH2OH > N2H4> NH3碱性相反。
4.试比较下列化合物的性质:(1)NO-3和NO-2的氧化性;(2)NO2、NO和N2O在空气中和O2反应的情况;(3)N2H4和NH2OH的还原性。
答:(1) 氧化性NO2->NO3-;(2) NO2不与空气反应;NO与空气在常温下即可反应,产生红棕色烟雾。
N2O也不与空气反应。
(3)还原性:N2H4 >NH2OH5.硝酸铵可以有下列两种热分解方式:NH4NO3(s)=NH3(g)+HNO3(g)ΔHθ=171kJ·mol-1NH4NO3(s)= N2O(g)+2 H2O(g) ΔHθ=-23 kJ·mol-1根据热力学的观点,硝酸铵固体按照哪一种方式分解的可能性较大。
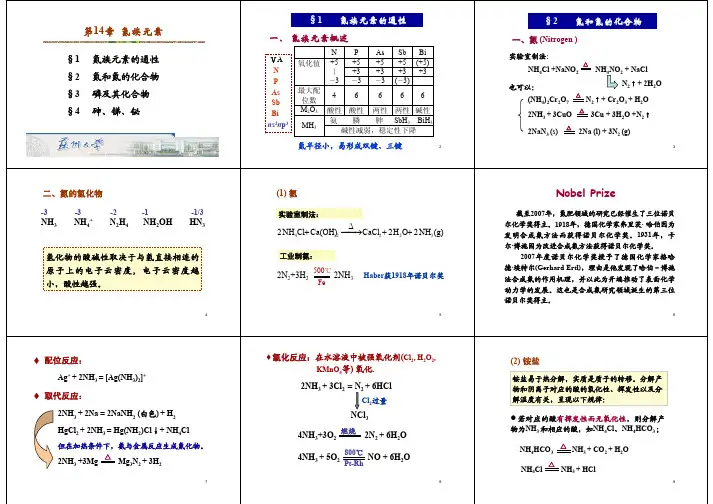
氮族元素§14-1 氮族元素的通性氮族元素:N P As Sb Bi外层电子构型:ns2 np3; 最高氧化数+5,最低为-3。
除N的配位数不超过4外,其它原子的最高配位数为6。
元素电势图:φo A/V1.11-0.231.290.05NO3-0.803NO21.07HNO20.996NO 1.59 N2O 1.77 N2–1.87 NH3OH +1.42 N2H5+1.275NH4+0.940.71HN2O22.65 1.3520.860.496H3PO40.94H4P2O60.38H3PO3–0.499PO2 –0.508 P (-0.1) P2H40.0PH33-0.276 -0.05 -0.063H3AsO40.56HAsO2 0.247As -0.60AsH3Sb2O50.58SbO+0.152Sb-0.51SbH3Bi2O5 1.6 BiO+0.32Bi-0.3BiH3φo B/V-1.160.151.05NO3-0.86 NO20.88 NO2-0.46 NO0.76N2O 0.94 N2–3.04NH2OH 0.73 N2H40.11NH3.H2O0.15N2O22-1.52 0.420.01 -0.14 -0.76 –0.73-1.18PO43- ?H2P2O62-?HPO32-–1.565 H2PO2-–2.05 P (-0.9) P2H4-0.8 PH3-1.12 -0.73 -0.89AsO43--0.68AsO2--0.675As (-1.43)AsH3H3SbO64-(-0.40)SbO2--0.66 Sb (-1.34) SbH3Bi2O4-0.56 Bi2O3-0.46 Bi ?BiH3+5价的化合物在酸性溶液是氧化剂,O5及HNO3均为强氧化剂,但在2碱性溶液中氧化性弱●+3价的化合物中HNO2具明显的氧化性,亚磷酸及其盐为强还原剂,其它元素的+3价化合物为弱还原剂●单质磷在酸、碱性溶液中均歧化,其它单质不歧化●-3价的化合物,除NH3及NH4+为弱还原剂外,其它为强还原剂§14-2 氮和它的化合物一、氮的成键特征和价键结构1. 形成离子键如Li3N、Mg3N2、Ca3N2(极易水解成相应的氢氧化物及NH3)2. 形成共价键(1)SP3不等性杂化,形成三个共价单键。
第十四章 氮族元素
一、选择题
1、下列物质的水解产物中既有酸又有碱的是………………………………………… ( )
(A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 3
2、有关H 3PO 4、H 3PO
3、H 3PO 2不正确的论述是…………………………………( )
(A) 氧化态分别是+5,+3,+1
(B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸
3、下列含氧酸根中,属于环状结构的是……………………………………………… ( )
(A) S O 462
- (B) S O 3102- (C) P O 393
- (D) P O 3105-
4、分子中含d —p 反馈π键的是
(A) HNO 3 ; (B) HNO 2; (C) H 3PO 2; (D)NH 3
5、 下列物质酸性最强的是
(A) N 2H 4 ; (B) NH 2OH ; (C) NH 3 ; (D)HN 3
6、 下列酸中为一元酸的是
(A) H 4P 2O 7 ; (B) H 3PO 2 ; (C) H 3PO 3 ; (D)H 3PO 4
7、与AgNO 3溶液作用观察到白色沉淀的是
(A) Na 3PO 4 ; (B) K 2CrO 4 ; (C) KI ; (D) Na 4P 2O 7
8、下列化合物中,最易生发爆炸反应的是
(A) Pb(NO 3)2 ; (B) Pb(N 3)2 ; (C) PbCO 3 ; (D) K 2CrO 4
9、下列物质均有较强的氧化性,其中最强氧化性与惰性电子对有关的是
(A) K 2Cr 2O 7 ; (B) NaBiO 3 ; (C) (NH 4)2S 2O 8 ; (D) H 5IO 6
10、氨、联氨和羟胺具有的共同性质是
(A) 氨的氧化态相同; (B)具有还原性
(C) 具有氧化性; (D)都是一元弱碱
二、填空题
1、NH 3和PH 3的碱性,前者______________后者;
2、在砷分族的氢氧化物(包括含氧酸盐)中酸性以_____________为最强,碱性__________最强,以____________的还原性最强,以____________的氧化性最强,这说明从砷锑到铋氧化数为________的化合物渐趋稳定。
3、在AlCl 3和SbCl 3溶液中各加入适量Na 2S 溶液,将分别产生__________和_________沉淀,使后者与过量的Na 2S 溶液作用,将生成___________而溶解。
4、在Sn(II)的强碱溶液中加入硝酸铋溶液,发生变化的化学方程式为:
________________________________________________________________。
三、简答题
1、氮、磷、铋都是V A族元素,它们都可以形成氯化物,例如:NCl3、PCl3、PCl5和BiCl3。
试问:
(1) 为什么不存在NCl5及BiCl5而有PCl5?
(2) 请你对比NCl3、PCl3、BiCl3水解反应的差异(指水解机理及水解物性质上差异)。
写出有关反应方程式。
2、.在P4分子中P-P-P键的键角约为多少?说明P4分子在常温下具有高反应活性的原因?
3、通常如何存放金属钠和白磷,为什么?
4、试讨论为什么PCl3的水解产物是H3PO3和HCl,而NCl3的水解产物却是HOCl和NH3?
5、.在Na2HPO4和NaH2PO4溶液中加入AgNO3溶液均析出黄色沉淀?而在PCl5完全水解后的产物中,加入AgNO3只有白色沉淀,而无黄色沉淀,试对上述事实加以说明。