高中化学专题复习 推断题与计算题解题技巧新课标人教版必修1文库
- 格式:pdf
- 大小:1.49 MB
- 文档页数:13

專題推斷題解題技巧推斷題解題技巧:看其顏色,觀其狀態,察其變化。
1. 常見物質の顏色:多數氣體為無色,多數固體化合物為白色,多數溶液為無色。
2. 一些特殊物質の顏色:黑色:MnO2、CuO、Fe3O4、C、FeS(硫化亞鐵)藍色:CuSO4•5H2O、Cu(OH)2、含Cu2+ 溶液、液態固態O2(淡藍色)紅色:Cu(亮紅色)、Fe2O3(紅棕色)、紅磷(暗紅色)黃色:硫磺(單質S)、含Fe3+の溶液(棕黃色)綠色:FeSO4•7H2O、含Fe2+の溶液(淺綠色)、堿式碳酸銅[Cu2(OH)2CO3]紫黑色:KMnO4無色氣體:N2、CO2、CO、O2、H2、CH4有色氣體:Cl2(黃綠色)、NO2(紅棕色)有刺激性氣味の氣體:NH3(此氣體可使濕潤pH試紙變藍色)、SO2、HCl有臭雞蛋氣味:H2S產生酸霧:HCl、HNO33. 常見一些變化の判斷:①白色沉澱且不溶於稀硝酸或酸の物質有:BaSO4、AgCl(就這兩種物質)②藍色沉澱:Cu(OH)2、CuCO3③紅褐色沉澱:Fe(OH)3Fe(OH)2為白色絮狀沉澱,在空氣中很快變成灰綠色沉澱,再變成Fe(OH)3紅褐色沉澱④沉澱能溶於酸並且有氣體(CO2)放出の:不溶の碳酸鹽。
例如CaCO3⑤沉澱能溶於酸但沒氣體放出の:不溶の堿。
例如Cu(OH)24. 燃燒時の主要現象①在氧氣中:硫——藍紫色火焰;鐵——火星四射;木炭——發白光。
②在空氣中:鎂帶——耀眼の白光;紅磷——“白煙”;硫、氫氣——淡藍色火焰;CO、CH4——藍色火焰5、酸和對應の酸性氧化物の聯繫:①酸性氧化物和酸都可跟堿反應生成鹽和水:CO2 + 2NaOH = Na2CO3 + H2O(H2CO3 + 2NaOH = Na2CO3 + 2H2O)SO2 + 2KOH = K2SO3 + H2OH2SO3 + 2KOH = K2SO3 + 2H2OSO3 + 2NaOH = Na2SO4 + H2OH2SO4 + 2NaOH = Na2SO4 + 2H2O②酸性氧化物跟水反應生成對應の酸:(各元素の化合價不變)CO2 + H2O = H2CO3 SO2 + H2O = H2SO3SO3 + H2O = H2SO4 N2O5 + H2O = 2HNO3(說明這些酸性氧化物氣體都能使濕潤pH試紙變紅色)6. 堿和對應の鹼性氧化物の聯繫:①鹼性氧化物和堿都可跟酸反應生成鹽和水:CuO + 2HCl = CuCl2 + H2OCu(OH)2 + 2HCl = CuCl2 + 2H2OCaO + 2HCl = CaCl2 + H2OCa(OH)2 + 2HCl = CaCl2 + 2H2O②鹼性氧化物跟水反應生成對應の堿:(生成の堿一定是可溶於水,否則不能發生此反應)K2O + H2O = 2KOH Na2O +H2O = 2NaOHBaO + H2O = Ba(OH)2 CaO + H2O = Ca(OH)2③不溶性堿加熱會分解出對應の氧化物和水:Mg(OH)2 MgO + H2O Cu(OH)2 CuO + H2O2Fe(OH)3 Fe2O3 + 3H2O 2Al(OH)3 Al2O3 + 3H2O1 某實驗室の廢液中,可能含有氯化鐵、氯化鈉、硫酸鈉、鹽酸、氫氧化鈉、硝酸鋇中の一種或幾種。


高一化学综合推导判断题、综合实验题的解题思路、技巧人教版【本讲教育信息】一. 教学内容:综合推导判断题、综合实验题的解题思路、技巧二. 教学要求:掌握实验判断题、综合题的分析能力和解题技巧。
三. 教学重难点:对于此类题目的突破口的发现。
四. 知识分析:(一)综合推导判断题:要想解好此类综合推导判断题,首先必须先复习好教材中最重要的知识点,并形成完整的知识网络,这是解题的基础。
在此基础上,解综合推导判断题时还要善于找到突破口,以此为契机,运用正推法或逆推法,推导出相关的其他物质,最后进行检查核实,以保证推导正确。
某钠盐A能跟H SO24反应,放出一种有刺激性的有毒的气体B。
气体B通过某液态单质C的水溶液中,此时溶液的橙黄色消失。
向所得到的溶液中加入可溶性钡盐时,则析出不溶于稀硝酸的白色沉淀。
将黄绿色的气体D通入所得到的无色溶液后,溶液又出现了颜色,且形成物质C,试确定(写分子式):A__________,B__________,C__________,D__________。
各步变化的化学方程式为______________________解题思路、技巧:某钠盐能与H SO24反应放出有刺激性有毒的气体B。
则B可能是SO2也可能是Cl2。
但从后边所得到的水溶液加入可溶性钡盐,析出不溶于稀HNO3的白色沉淀是BaSO4可推知气体B只可能是SO2而不可能是Cl2。
B与某液态单质C的水溶液反应,溶液橙黄色消失。
非金属液态单质只有溴一种。
溴单质将SO2氧化,本身被还原而使溶液颜色消失。
黄绿色气体应为Cl2,通入所得到的含有Br-离子的溶液中,Br-离子被氧化成Br2单质而又显现颜色。
由此可知:A为Na SO23,B为SO2,C为Br2,D为Cl2。
答案:A. Na SO 23B. SO 2C. Br 2D. Cl 2Na SO H SO Na SO H O SO 23242422+=++↑2242424222222222Br HCl HBr Cl HCl BaSO BaCl SO H HBrSO H O H Br SO +=++↓=++=++(二)综合实验题:化学是以实验为基础的自然科学。



高一化学推断题的题型及解题技巧推断题是高中化学试题中常见,但却十分重要的一类题型。
该类题目考查知识面广、变化多端、思维量大、综合性强,是考查学生求异思维、发散思维、抽象思维及逻辑推理能力的一类好题。
但学生普遍感觉难度较大,解题时没有把握,倍感头痛。
其实推断题就好比是公安人员侦破案情,要紧抓蛛丝马迹,并以此为突破口,顺腾摸瓜,最终推出答案。
解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征及结构特征),导出结论,最后别忘了把结论代入原题中验证,若“路”走得通则已经成功。
平时,多积累一些“常用”的基础知识,这是解答推断题的看家本领,如(仅列一部分):1、特殊颜色:焰色反应:Na+(黄色)、K+(紫色);含Cu2+的溶液呈蓝色;含Fe3+的溶液呈黄色;CuSO4粉未为白色,蓝色絮状沉淀为Cu(OH)2,红褐色絮状沉淀为Fe(OH)3;不溶于水也不溶于酸的白色沉淀有两种:AgCl和BaSO4。
2、特殊性质:溶与水显碱性的气体是NH3;在空气中能自燃的固体物质是白磷;能使澄清石灰水变浑浊,通入过量又变澄清的气体有CO2(无色无味)和SO2(刺激性气味);7、能使品红溶液褪色,加热又复原的气体是SO2;不溶于水又不溶于酸的沉淀有BaSO4(白色)、AgCl(白色)、CuS(黑色)、PbS(黑色)等;具有漂白性的物质有Cl2、HClO、H2O2、Na2O2、SO2等;有臭鸡蛋气味且能使湿润的醋酸铅试纸变黑的是H2S ;使淀粉变蓝的是I2。
3、特殊反应条件:光照:HClO、HNO3、AgBr、AgI的分解等;MnO2作催化剂:H2O2、KClO3的分解;加热并用V2O5 作催化剂:2SO2+O22SO3等4、特征反应:⑴能与酸反应产生气体的物质:①活拨的金属:Na、Mg、Zn等;②不稳定的弱酸盐:碳酸盐、碳酸氢盐、硫化物、亚硫酸盐等。
⑵能与碱反应产生气体的物质:①单质:Al、Si ;②盐类:铵盐;⑶既能与酸反应又能与碱反应的物质:①单质:Al ;②两性氧化物:Al2O3;⑷能与水反应产生气体的物质:①活拨的金属单质:Na、K等;②非金属单质:F2;③过氧化物:Na2O2等。

第三章图像专题、计算专题、推断专题复习一.选择题:1、把Ba (OH) 2溶液滴入明矶溶液中,使SO/全部转化成BaS04沉淀,此时铝元素的主要存在形式是()A. Al3*B. AI (OH) 3C. Al3*和AI (OH) 3D. AI02_2、把g Na2CO3・10出0和NaHCOj组成的固体混合物溶于水配成100 mL溶液,其中c(Na+)== mol・匚1。
若把等质量的固体混合物加热至恒重,残留固体的质量是( )OA. gB. gC. gD. g3、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为( )。
A. 1:1B. 2:3 C・ 3:2D. 1:6 4、向MgSOq和Al2(SOO3的混合溶液中,逐滴加入NaOH溶液。
下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)5.将14 g铁粉溶于1 L稀硝酸中恰好完全反应,放出NO气体后称量所得溶液,发现比原溶液质量增加8g ,则原溶液中硝酸的浓度为()A. 0. 4m o I ・ L_1B. 0. 6 m o I ・ l_C. m o I • L6.现有200 mL MgCJ和AICI3的混合溶液,其中c(Mg2 + )= mol ・l_7, c(CI ■)= mol・「。
要使镁离子转化成Mg(0H)2,并使M『+和Al'+分离开来,至少需要4 mol • L 1的NaOH 溶液A. 140mLB. 20mLC. 100mL D・ 80 mL7. 甲、乙、丙、丁分别是AI2(S04)3> FeS04>NaOH、BaCI2四种物质中的一种。
若将丁溶液滴入乙溶液中,发现有白色沉淀生成,继续滴A D加则沉淀消失,丁溶液滴入甲溶液中,无明显现象发生。
据此推断丙物质是A. A12 (S04) 3B. NaOHC. BaCI2D. FeS(h8. 向100 mL mol・L_1AICI3溶液中加入金属钠,完全反应,恰好生成只含NaCI 和NaA102的澄清溶液,则加入金属钠的质量是A. gB. gC. g D无法计算9. 把铁片加到1 L 1 mol/L的氯化铁溶液中,当反应后溶液中和Fe"物质的量浓度相等时,铁片减少的质量为( )OA gB gC gD g10. 有镁、铝混合物粉末,将它溶于500mL4mol・「的盐酸里,若要使沉淀质量达到最大值,则需加入2 mol •『的氢氧化钠溶液的体积为( )A. 1000 mLB. 500 mLC. 100 mLD.1500 mL二.非选择题: 门.下列六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,请把下表中各反应的相应图象的序号填入表中。

实用文档专题推断题与计算题解题技巧推断题解题技巧:看其颜色,观其状态,察其变化。
1. 常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2. 一些特殊物质的颜色:黑色:MnO、CuO、FeO、C、FeS(硫化亚铁)4232+ 溶液、液态固态O (淡蓝色)、含OH)Cu 蓝色:CuSO?5HO、Cu(2224红色:Cu(亮红色)、FeO(红棕色)、红磷(暗红色)323+的溶液(棕黄色) S)、含Fe黄色:硫磺(单质2+的溶液(浅绿色)、碱式碳酸铜[Cu(OH)COOFeSO?7H、含Fe] 绿色:34222紫黑色:KMnO 4无色气体:N、CO、CO、O、H、CH 42222有色气体:Cl(黄绿色)、NO(红棕色)22有刺激性气味的气体:NH(此气体可使湿润pH试纸变蓝色)、SO、HCl23有臭鸡蛋气味:HS 2产生酸雾:HCl、HNO 33. 常见一些变化的判断:①白色沉淀且不溶于稀硝酸或酸的物质有:BaSO、AgCl(就这两种物质)4②蓝色沉淀:Cu(OH)、CuCO 32③红褐色沉淀:Fe(OH) 3Fe(OH)为白色絮状沉淀,在空气中很快变成灰绿色沉淀,再变成Fe(OH)红褐32色沉淀大全.实用文档④沉淀能溶于酸并且有气体(CO)放出的:不溶的碳酸盐2⑤沉淀能溶于酸但没气体放出的:不溶的碱4. 燃烧时的主要现象①在氧气中:硫——蓝紫色火焰;铁——火星四射;木炭——发白光。
②在空气中:镁带——耀眼的白光;红磷——“白烟”;硫、氢气——淡蓝色火焰;CO、CH——蓝色火焰45、酸和对应的酸性氧化物的联系:①酸性氧化物和酸都可跟碱反应生成盐和水:CO + 2NaOH = NaCO + HO2232(HCO + 2NaOH = NaCO + 2HO)SO + 2KOH = KSO + HO 222233232HSO + 2KOH = KSO + 2HO 23223SO + 2NaOH = NaSO + HO 2324HSO + 2NaOH =NaSO + 2HO22442②酸性氧化物跟水反应生成对应的酸:(各元素的化合价不变)CO + HO = HCO SO + HO = HSO 32223 222SO + HO = HSO NO + HO = 2HNO3234 2522(说明这些酸性氧化物气体都能使湿润pH试纸变红色)6. 碱和对应的碱性氧化物的联系:①碱性氧化物和碱都可跟酸反应生成盐和水:CuO + 2HCl = CuCl + HO 22Cu(OH) + 2HCl = CuCl + 2HO 222CaO + 2HCl = CaCl + HO22大全.实用文档Ca(OH) + 2HCl = CaCl + 2HO222②碱性氧化物跟水反应生成对应的碱:(生成的碱一定是可溶于水,否则不能发生此反应)KO + HO = 2KOH NaO +HO = 2NaOH 2222 BaO + HO = Ba(OH) CaO + HO = Ca(OH) 2222③不溶性碱加热会分解出对应的氧化物和水:CuO + HO MgO + HMg(OH)O Cu(OH)222 2+ 3HO 2Al(OH) + 3HOFeO Al2Fe(OH)O 3 2323223(二)解计算题:计算题的类型有:①有关质量分数(元素和溶质)的计算②根据化学方程式进行计算③由①和②两种类型混合在一起计算1. 溶液中溶质质量分数的计算×=100%溶质质量分数2. 化合物(纯净物)中某元素质量分数的计算=×某元素质量分数 100%3. 混合物中某化合物的质量分数计算 100%化合物的质量分数=×4. 混合物中某元素质量分数的计算某元素质量分数=× 100%或:某元素质量分数=化合物的质量分数×该元素在化合物中的质量分数大全.实用文档5. 解题技巧)审题:看清题目的要求,已知什么,求什么,有化学方程式的先写出化1(学方程式。
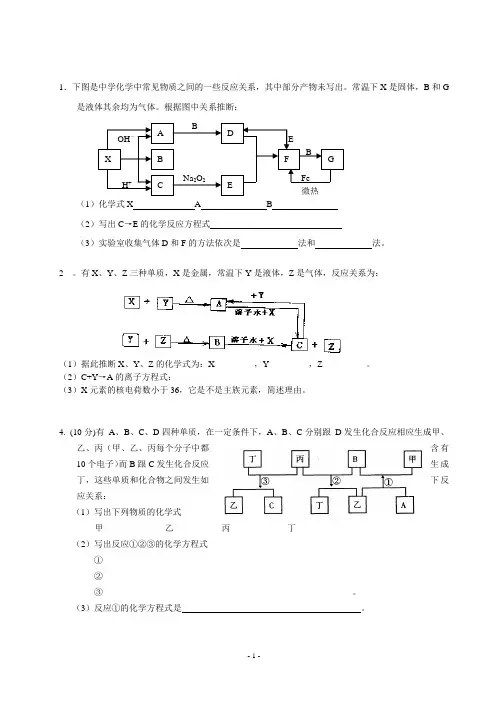
1.下图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。
常温下X 是固体,B 和G是液体其余均为气体。
根据图中关系推断: (1)化学式X A B(2)写出C →E 的化学反应方程式(3)实验室收集气体D 和F 的方法依次是 法和 法。
2 。
有X 、Y 、Z 三种单质,X 是金属,常温下Y 是液体,Z 是气体,反应关系为:(1)据此推断X 、Y 、Z 的化学式为:X_________,Y_________,Z__________。
(2)C+Y →A 的离子方程式:___________________________________________ (3)X 元素的核电荷数小于36,它是不是主族元素,简述理由。
___________________________________________________________________________ ________________________________4. (10分)有 A 、B 、C 、D 四种单质,在一定条件下,A 、B 、C 分别跟 D 发生化合反应相应生成甲、乙、丙(甲、乙、丙每个分子中都含有10个电子)而B 跟C 发生化合反应生成丁,这些单质和化合物之间发生如下反应关系:(1)写出下列物质的化学式甲______________乙___________丙_____________丁_____________ (2)写出反应①②③的化学方程式①____________________________________ ②_________________________________________③_________________________________________________________。
(3)反应①的化学方程式是 。
XOH-H + A B CBNa 2O 2DEFGFe 微热BE5.(14分)A、B、C、是单质,X、Y、Z、H、J、L是化合物,组成B的元素是绿色植物生活所必需的微量元素之一,且B在空气中燃烧可以得到X和J,X和J均为固体,X水解可生成两种碱性物质。

微专题2 元素推断题突破方法元素周期表和元素周期律是高考考查的热点和重点,主要以选择题的形式考查元素在周期表中的位置、结构与性质的关系。
综合分析近几年高考在本章的考查,都是结合原子结构、元素周期表、元素及其化合物知识的综合推断。
一、依据元素原子结构推断元素将原子结构、核外电子排布特征作为元素推断的突破口,是元素推断题的重要类型之一,题目通常以文字叙述或图文结合的形式给出元素原子的核外电子排布、位置关系等关键信息。
解题时可结合短周期元素的原子结构及元素的特殊性质,对元素进行合理的推断。
1.根据核外电子排布的三大规律推断元素 (1)最外层电子数规律 最外层电子数(N ) 3≤N <8 N =1或2N >次外层电子数元素在周期表中的位置第ⅢA 族~第ⅦA 族第ⅠA 族、第ⅡA 族、第Ⅷ族、副族、0族元素氦第二周期(Li 、Be 除外)(2)“阴三、阳四”规律某元素阴离子最外层电子数与次外层电子数相等,该元素位于第三周期;若为阳离子,则位于第四周期。
如S 2-、K +最外层电子数与次外层电子数相等,则S 位于第三周期,K 位于第四周期。
(3)“阴上、阳下”规律电子层结构相同的离子,若电性相同,则位于同周期,若电性不同,则阳离子位于阴离子的下一周期。
如O 2-、F -、Na +、Mg 2+、Al 3+电子层结构相同,则Na 、Mg 、Al 位于O 、F 的下一周期。
2.依据“等电子”粒子进行推断(1)寻找“10电子”粒子和“18电子”粒子的方法 ①“10电子”粒子②“18电子”粒子(2)记忆其他等电子粒子①“14电子”粒子:Si、N2、CO、C2H2等。
②“16电子”粒子:S、O2、C2H4等。
(3)质子数和核外电子数分别相等的两种粒子关系①可以是两种原子,如同位素原子。
②可以是两种分子,如CH4、NH3。
③可以是两种带电荷数相同的阳离子,如N H4+、H3O+。
④可以是两种带电荷数相同的阴离子,如OH-、F-。

推断题一、解无机推断题的解题思路无机推断题的一般解题思路是:迅速浏览整体扫描产生印象寻找突破口注意联系大胆假设全面分析(正推或逆推)验证确认。
解题的关键是仔细审题,依物质的特性或转化特征来确定“突破口...”,顺藤摸瓜,进而完成全部未知物的推断。
一般而言,推断题的思维方法可分四种:一是顺向思维,从已有条件一步步推出未知信息;第二种是逆向思维,从问题往条件上推,作假设;第三种则是从自己找到的突破口进行发散推导。
第四种考生还可同时找到几个突破口,从几条解题线索着手,配合推断。
第五虽然没有明显突破口,但其性质或转化关系像某种物质,这时应大胆假设,带入验证。
推断题最后都要代入检验....其准确性。
二、无机框图题的应对策略及解题方法1.夯实基础:框图题重点考察元素及化合物知识,一般基于中学阶段常见物质与反应,故要熟练掌握一些代表性物质的基本性质:如色、态、味、化学性质等。
同时框图题设计的问题通常围绕化学基本用语,周期表,物质结构等化学基本知识,因此注重基础是求解推断题的前提,避免出现推得出而写不出的现象。
2.抓住特性:所谓抓物质特性,就是在中学化学知识范围内,根据某些物质特有的性质来判断其存在与否的一种方法。
值得一提的是,为了验证结论的正确性,须对结论进行严密的论证和检验,这样才能确保万无一失。
我们可以从以下几个典型特性入手:2.1抓特殊现象:例如,气体燃烧呈苍白色火焰的必为H2和Cl2;向一溶液中滴入碱液,先产生白色沉淀,进而变成灰绿色,最后变为红褐色沉淀,则该溶液中一定含Fe2+;遇空气迅速由无色变为红棕色的气体必为NO等等;使湿红石蕊试纸变蓝的气体为NH3等等。
2.2抓特征反应:考例1已知:①A、B、C、D四种物质均含元素X,有的还可能含有元素Y、Z。
元素X、Y、Z的原子序数依次递增。
②X在A、B、C、D中都不呈现它的最高化合价。
③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。
④化合物D受热催化分解,可制得元素Y的单质。
第一章物质及其变化第一节物质的分类及转化.......................................................................................... - 1 - 第1课时物质的分类.......................................................................................... - 1 -第2课时物质的转化.......................................................................................... - 8 - 第二节离子反应........................................................................................................ - 10 - 第1课时电解质的电离.................................................................................... - 10 -第2课时离子反应............................................................................................ - 14 - 第三节氧化还原反应................................................................................................ - 19 - 第1课时氧化还原反应.................................................................................... - 19 -第2课时氧化剂和还原剂................................................................................ - 24 - 第一节物质的分类及转化第1课时物质的分类1.基础知识一、根据物质的组成和性质分类1.同素异形体(1)定义:由同种元素形成的几种性质不同的单质互称为同素异形体。
新课标高中化学必修①第一章期末复习及练习(人教版)A.知识要点:一、化学实验基本操作1、几种特殊试剂的存放(A)钾、钠在空气中极易氧化,遇水发生剧烈反应,应放在盛有煤油的广口瓶中以隔绝空气。
(B)浓硝酸、硝酸银见光易分解,应保存在棕色细口瓶中,贮放在黑暗而且温度低的地方。
(C)氢氧化钠固体易潮解,应盛放在易于密封的干燥广口瓶中保存;其溶液盛放在无色细口瓶里,瓶口用橡皮塞塞紧,不能用玻璃塞。
2、试纸的使用试纸的种类很多。
常用的有红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉碘化钾试纸和品红试纸等。
(l)在使用试纸检验溶液的性质时,一般先把一小块试纸放在表面皿或玻璃片上,用沾有待测溶液的玻璃棒点试纸的中部,观察颜色的变化,判断溶液的性质。
(2)在使用试纸检验气体的性质时,一般先用蒸馏水把试纸润湿。
粘在玻璃棒的一端,用玻璃棒把试纸放到盛有待测气体的试管口(注意不要接触),观察试纸的颜色变化情况来判断气体的性质。
注意:使用pH试纸不能用蒸馏水润湿。
3、配制一定物质的量浓度的溶液①计算:算出固体溶质的质量或浓溶液的体积。
②称量:用托盘天平称取固体溶质质量或用量筒量取所需液体的体积。
③溶解:将固体或液体溶质倒入烧杯中,加入适量的蒸馏水(约为所配溶液体积的1/6),用玻璃棒搅拌使之溶解,冷却到室温后,将溶液引流注入容量瓶里。
④洗涤(转移):用适量蒸馏水将烧杯及玻璃棒洗涤2-3次,将洗涤液注入容量瓶。
振荡,使溶液混合均匀。
⑤定容:继续往容量瓶中小心地加水,直到液面接近刻度1-2m处,改用胶头滴管加水,使溶液凹面恰好与刻度相切。
把容量瓶盖紧,再振荡摇匀。
4、过滤过滤是将液体和难溶性固体分离开来的方法。
5、蒸发和结晶蒸发是将溶液浓缩、溶剂气化或溶质以晶体析出的方法。
结晶是溶质从溶液中析出晶体的过程,可以用来分离和提纯几种可溶性固体的混合物。
结晶的原理是根据混合物中各成分在某种溶剂里的溶解度的不同,通过蒸发减少溶剂或降低温度使溶解度变小,从而使晶体析出。