大一大二必修课无机化学实验教案
- 格式:docx
- 大小:37.46 KB
- 文档页数:4

标题:大学无机化学教案一、教学目标1. 理解无机化学的基本概念和原理,掌握无机化合物的结构和性质。
2. 熟悉无机化学实验的基本操作和实验方法,提高实验技能。
3. 培养分析问题和解决问题的能力,提高科学思维和创新能力。
二、教学内容1. 无机化学的基本概念和原理:原子结构、元素周期律、化学键、化合物的结构等。
2. 无机化合物的性质:氧化还原反应、酸碱反应、沉淀反应、络合反应等。
3. 无机化学实验:实验基本操作、仪器的使用、实验方法和技巧等。
三、教学方法1. 讲授法:讲解无机化学的基本概念、原理和化合物的性质。
2. 实验法:进行无机化学实验,培养学生的实验技能和科学思维。
3. 讨论法:引导学生分析实验现象,解决问题,提高学生的科学素养。
四、教学安排1. 理论课:共计32课时,每课时45分钟。
2. 实验课:共计16课时,每课时45分钟。
五、教学过程1. 导入:介绍无机化学的定义和重要性,激发学生的学习兴趣。
2. 讲解:讲解无机化学的基本概念、原理和化合物的性质,引导学生理解并掌握。
3. 实验:进行无机化学实验,让学生亲身体验并掌握实验技能。
4. 讨论:分析实验现象,引导学生解决问题,提高学生的科学素养。
5. 总结:总结本节课的主要内容和知识点,布置作业。
六、教学评价1. 课堂讲解:评价学生的理解和掌握程度,通过提问和回答来检查。
2. 实验操作:评价学生的实验技能和实验方法的掌握程度,通过实验报告和实验操作来检查。
3. 作业:评价学生对课堂知识点的理解和掌握程度,通过作业来检查。
七、教学资源1. 教材:选用权威的无机化学教材,如《无机化学》、《无机化学原理》等。
2. 实验仪器:实验室中的仪器和设备,如显微镜、试管、烧杯、滴定仪等。
3. 多媒体教学:利用PPT、视频等教学辅助手段,提高教学效果。
八、教学进度安排1. 第1-4周:讲解无机化学的基本概念和原理。
2. 第5-8周:讲解无机化合物的性质,如氧化还原反应、酸碱反应等。

无机化学实验教案一、实验目的与要求1. 实验目的(1) 掌握无机化学实验的基本操作技能。
(2) 学习常见无机化合物的制备方法。
(3) 培养观察实验现象、分析问题、解决问题的能力。
2. 实验要求(1) 熟悉实验原理和实验步骤。
(2) 准确称量、配制溶液和操作实验仪器。
(3) 记录实验现象和数据,并能进行初步分析。
二、实验原理与材料1. 实验原理(1) 介绍实验涉及的无机化学反应原理。
(2) 解释实验过程中观察到的现象。
2. 实验材料(1) 实验药品:硝酸、硫酸、盐酸等。
(2) 实验仪器:试管、烧杯、滴定管等。
三、实验内容与步骤1. 实验内容(1) 实验一:硝酸银的制备与纯化(2) 实验二:硫酸铜的制备与溶解(3) 实验三:盐酸与碳酸钙的反应(4) 实验四:氢氧化钠的制备与溶解(5) 实验五:硫酸铁的制备与溶解2. 实验步骤(1) 实验一:称量硝酸银固体;配制硝酸溶液;观察硝酸银与硝酸的反应现象。
(2) 实验二:称量硫酸铜固体;配制硫酸溶液;观察硫酸铜的溶解过程。
(3) 实验三:称量碳酸钙固体;配制盐酸溶液;观察碳酸钙与盐酸的反应现象。
(4) 实验四:称量氢氧化钠固体;配制水溶液;观察氢氧化钠的溶解过程。
(5) 实验五:称量硫酸铁固体;配制硫酸溶液;观察硫酸铁的溶解过程。
四、实验注意事项1. 遵守实验室安全规定,佩戴实验服、手套、护目镜等。
2. 操作仪器时要小心谨慎,防止损坏。
3. 准确称量和配制溶液,避免误差。
4. 观察实验现象时要仔细,并及时记录。
五、实验报告与评价1. 实验报告(1) 编写实验报告,包括实验目的、原理、步骤、现象、数据等。
2. 实验评价(1) 评价实验操作的准确性、规范性。
(2) 评价实验结果的可靠性、分析问题的能力。
六、实验六:氢氧化铁的制备与表征1. 实验目的(1) 学习氢氧化铁的制备方法。
(2) 掌握氢氧化铁的表征方法。
2. 实验步骤(1) 称量适量的硫酸铁固体;(2) 配制硫酸溶液;(3) 逐滴加入氢氧化钠溶液,观察氢氧化铁的沉淀现象;(4) 过滤、洗涤、干燥氢氧化铁沉淀;(5) 观察氢氧化铁的颜色、形状等特征;(6) 利用X射线衍射等方法对氢氧化铁进行表征。

课程名称:无机化学实验授课对象:化学专业本科生课时安排:2课时教学目标:1. 让学生掌握无机化学实验的基本操作技能,培养实验操作规范和安全意识。
2. 通过实验,加深对无机化学基本概念和理论的理解,提高分析问题和解决问题的能力。
3. 培养学生的团队协作精神和创新意识。
教学内容:一、实验基本操作1. 实验室安全知识2. 实验仪器使用3. 实验基本操作技能二、实验项目1. 氧化还原滴定实验2. 酸碱滴定实验3. 配位滴定实验实验步骤及要点:一、氧化还原滴定实验1. 实验目的:学习氧化还原滴定的基本原理和方法,测定溶液中还原剂或氧化剂的浓度。
2. 实验原理:利用氧化还原反应,通过滴定剂与被测物质反应,根据反应物的化学计量关系计算出被测物质的浓度。
3. 实验步骤:(1)配制标准溶液:准确称取一定量的氧化剂或还原剂,溶解后定容。
(2)配制待测溶液:准确称取一定量的还原剂或氧化剂,溶解后定容。
(3)滴定实验:用滴定管将标准溶液逐滴加入待测溶液中,观察颜色变化,确定滴定终点。
(4)数据处理:根据反应物的化学计量关系,计算出待测物质的浓度。
二、酸碱滴定实验1. 实验目的:学习酸碱滴定的基本原理和方法,测定溶液中酸或碱的浓度。
2. 实验原理:利用酸碱中和反应,通过滴定剂与被测物质反应,根据反应物的化学计量关系计算出被测物质的浓度。
3. 实验步骤:(1)配制标准溶液:准确称取一定量的酸或碱,溶解后定容。
(2)配制待测溶液:准确称取一定量的酸或碱,溶解后定容。
(3)滴定实验:用滴定管将标准溶液逐滴加入待测溶液中,观察颜色变化,确定滴定终点。
(4)数据处理:根据反应物的化学计量关系,计算出待测物质的浓度。
三、配位滴定实验1. 实验目的:学习配位滴定的基本原理和方法,测定溶液中金属离子的浓度。
2. 实验原理:利用配位反应,通过滴定剂与被测物质反应,根据反应物的化学计量关系计算出被测物质的浓度。
3. 实验步骤:(1)配制标准溶液:准确称取一定量的金属离子,溶解后定容。

无机化学实验教案实验一仪器的洗涤一、实验目的1、熟悉无机化学实验规则和要求2、领取无机化学实验常用仪器,熟悉其名称,规则,了解使用注意事项。
3、学习并练习常用仪器的洗涤和干燥方法二、实验内容与步骤1、对照清单认领仪器,清点装置2、分类洗涤各种仪器三、玻璃仪器的洗涤1、仪器洗涤为了使实验得到正确的结果,实验所用的玻璃仪器必须是洁净的,有些实验还要求是干燥的,所以需对玻璃仪器进行洗涤和干燥。
要根据实验要求、污物性质和玷污的程度选用适宜的洗涤方法。
玻璃仪器的一般洗涤方法有冲洗、刷洗及药剂洗涤等。
对一般沾附的灰尘及可溶性污物可用水冲洗去。
洗涤时先往容器内注入约容积1/3的水,稍用力振荡后把水倒掉,如此反复冲洗数次。
当容器内壁附有不易冲洗掉的污物时,可用毛刷刷洗,通过毛刷对器壁的摩擦去掉污物。
刷洗时需要选用合适的毛刷。
毛刷可按所洗涤的仪器的类型,规格(口径)大小来选择。
洗涤试管和烧瓶时,端头无直立竖毛的秃头毛刷不可使用(为什么?)。
刷洗后,再用水连续振荡数次。
冲洗或刷洗后,必要时还应用蒸馏水淋洗三次。
对于以上两法都洗不去的污物则需要洗涤剂或药剂来洗涤。
对油污或一些有机污物等,可用毛刷蘸取肥皂液或合成洗涤剂或去污粉来刷洗。
对更难洗去的污物或仪器口径较小、管细长不便刷洗时的仪器可用铬酸洗液或王水洗涤,也可针对污物的化学性质选用其他适当的药剂洗涤(例如碱,碱性氧化物,碳酸盐等可用6mol.L-1HCl溶解)。
用铬酸洗液或王水洗涤时,先往仪器内注入少量洗液,使仪器倾斜并慢慢转动,让仪器内壁全部被洗液湿润。
再转入仪器,使洗液在内壁流动,经流动几圈后,把洗液倒回原瓶(不可倒入水池或废液桶,铬酸洗液变暗绿色失效后可另外回收再生使用)。
对玷污严重的仪器可用洗液浸泡一段时间,或者用热洗液洗涤。
用洗液洗涤时,决不允许将毛刷放入洗瓶中!(为什么?)倾出洗液后,再用水冲洗或刷洗,必要时还应用蒸馏水淋洗。
2、洗净标准仪器是否洗净可通过器壁是否挂水珠来检查。

一、教学目标1. 知识目标:(1)了解硫酸铜的制备方法及实验原理;(2)掌握实验操作步骤,熟悉实验仪器的使用;(3)了解硫酸铜的性质及其在生活中的应用。
2. 能力目标:(1)培养学生动手操作能力,提高实验技能;(2)培养学生观察、分析、解决问题的能力;(3)培养学生科学探究精神和团队协作能力。
3. 情感目标:(1)激发学生对无机化学实验的兴趣,培养学生严谨的科学态度;(2)增强学生环保意识,培养学生的社会责任感。
二、教学重点与难点1. 教学重点:(1)硫酸铜的制备方法及实验原理;(2)实验操作步骤;(3)硫酸铜的性质。
2. 教学难点:(1)硫酸铜制备过程中沉淀的分离与提纯;(2)实验操作中的注意事项。
三、教学过程1. 导入新课(1)教师简要介绍硫酸铜的背景知识,激发学生学习兴趣;(2)提问:如何制备硫酸铜?其性质有哪些?2. 实验原理讲解(1)教师讲解硫酸铜的制备方法及实验原理;(2)介绍实验过程中涉及到的化学反应。
3. 实验操作演示(1)教师演示实验操作步骤,强调注意事项;(2)学生观察并记录实验现象。
4. 学生分组实验(1)学生分组进行实验,教师巡回指导;(2)学生填写实验报告,记录实验数据。
5. 实验结果分析与讨论(1)学生汇报实验结果,教师引导学生分析实验数据;(2)讨论硫酸铜的性质及其在生活中的应用。
6. 总结与拓展(1)教师总结本次实验内容,强调实验操作要点;(2)拓展:讨论硫酸铜在其他领域的应用,如农业、工业等。
四、教学评价1. 评价方式:实验报告、实验操作、实验结果分析、课堂表现等;2. 评价标准:实验操作规范、实验数据准确、实验结果分析合理、课堂表现积极等。
五、教学反思1. 教师应关注学生的实验操作过程,确保实验安全;2. 教师应引导学生主动思考,培养其科学探究精神;3. 教师应注重实验结果分析,提高学生的综合能力。
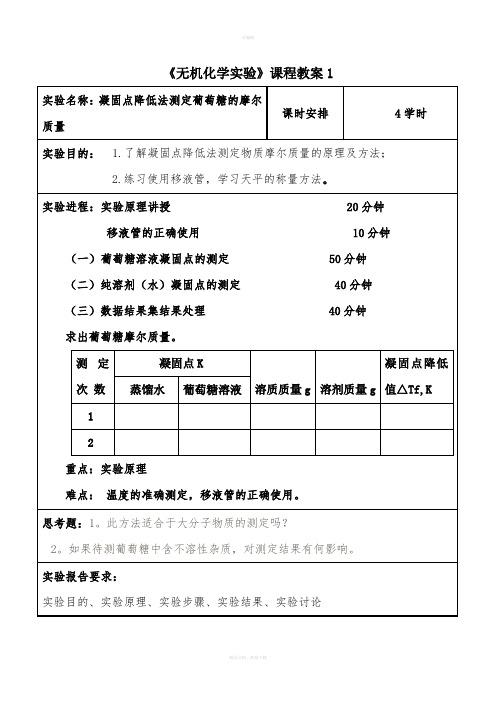
《无机化学实验》课程教案1思考题:1。
此方法适合于大分子物质的测定吗?2。
如果待测葡萄糖中含不溶性杂质,对测定结果有何影响。
《无机化学实验》课程教案2《无机化学实验》课程教案3实验进程:讲解实验原理(10分钟)讲解滴定管的正确使用方法。
(30分钟)滴定管的准备和洗涤。
(20分钟)0.1mol L-1NaOH和HCl溶液的配制(30分钟)酸碱标准溶液浓度的比较(60分钟)数据处理(10分钟)重点:滴定管的正确使用难点:滴定终点的判断,指示剂颜色的观察;滴定的正确操作。
《无机化学实验》课程教案4《无机化学实验》课程教案5《无机化学实验》课程教案6《无机化学实验》课程教案7《无机化学实验》课程教案8《无机化学实验》课程教案9《无机化学实验》课程教案10《无机化学实验》课程教案11《无机化学实验》课程教案12《无机化学实验》课程教案13思考题:常用的离子交换法包括哪几步?2、本实验的实验原理是什么?3、离子交换树脂的再生有何意义《无机化学实验》课程教案14《无机化学实验》课程教案15《无机化学实验》课程教案16《无机化学实验》课程教案17《无机化学实验》课程教案18思考题:1、实验中加入盐酸羟胺的作用是什么?其加入的顺序有什么要求?2、如果被测定的ML n离解度较大,对n值的测定结果有什么影响?《无机化学实验》课程教案19《无机化学实验》课程教案20《无机化学实验》课程教案21《无机化学实验》课程教案22《无机化学实验》课程教案23《无机化学实验》课程教案24.。
课程名称:无机化学实验授课班级:化学专业2022级1班授课教师:李明授课时间: 2023年10月15日实验名称:铜与稀硫酸反应实验一、实验目的1. 理解金属活动性顺序及其在化学反应中的应用。
2. 掌握金属与酸反应的基本原理和实验操作方法。
3. 通过实验观察和分析,加深对化学反应速率和产物的理解。
4. 培养学生的实验操作技能和观察能力。
二、实验原理金属铜与稀硫酸在常温下不发生反应,但在加热条件下,铜与稀硫酸反应生成硫酸铜和氢气。
反应方程式如下:\[ Cu + 2H_2SO_4 \rightarrow CuSO_4 + 2H_2 \]三、实验仪器与试剂1. 仪器:烧杯、酒精灯、试管、玻璃棒、铁架台、导管、集气瓶等。
2. 试剂:铜片、稀硫酸、蒸馏水、氢氧化钠溶液、酚酞指示剂等。
四、实验步骤1. 将铜片清洗干净,用砂纸打磨表面,确保铜片表面光滑。
2. 在试管中加入适量的稀硫酸,放入铜片。
3. 用酒精灯加热试管,观察反应现象。
4. 当看到气泡产生时,将导管插入集气瓶,收集氢气。
5. 用氢氧化钠溶液检测氢气,观察酚酞指示剂的颜色变化。
6. 停止加热,观察铜片表面是否出现硫酸铜。
7. 记录实验数据,包括反应时间、气泡产生速度、氢气体积等。
五、实验观察与记录1. 反应过程中,铜片表面逐渐变黑,产生气泡。
2. 氢气产生速度较快,集气瓶内气体迅速充满。
3. 氢氧化钠溶液检测氢气时,酚酞指示剂变红。
4. 停止加热后,铜片表面出现一层蓝色固体,为硫酸铜。
六、实验分析1. 铜与稀硫酸反应生成硫酸铜和氢气,符合金属活动性顺序。
2. 加热能提高反应速率,加快氢气的产生。
3. 氢氧化钠溶液检测氢气时,酚酞指示剂变红,说明氢气已生成。
4. 铜片表面出现硫酸铜,说明反应已进行。
七、实验总结通过本次实验,学生掌握了金属与酸反应的基本原理和实验操作方法,加深了对化学反应速率和产物的理解。
同时,培养了学生的实验操作技能和观察能力。
八、注意事项1. 实验过程中,注意安全操作,避免烫伤和化学品中毒。
课程名称:无机化学实验授课班级:化学专业授课教师:[教师姓名]授课时间:[具体日期]课时:2课时教学目标:1. 使学生熟悉无机化学实验的基本操作技能,提高实验动手能力。
2. 培养学生严谨、求实的科学态度和良好的实验习惯。
3. 通过实验,使学生掌握无机化学的基本理论和知识。
教学内容:1. 无机化学实验的基本操作技能2. 实验室安全知识3. 实验原理及实验方法教学过程:一、导入新课1. 复习无机化学的基本概念和理论。
2. 引导学生思考无机化学实验的重要性。
二、实验操作技能培训1. 无机化学实验的基本操作技能,如:称量、溶解、过滤、蒸发、浓缩、结晶、干燥等。
2. 实验室安全知识,如:防火、防爆、防毒、防腐蚀等。
三、实验原理及实验方法讲解1. 以实验一为例,讲解实验原理及实验方法。
2. 实验一:氯化钠的提纯实验目的:学习提纯食盐的原理和方法及有关离子的鉴定;掌握溶解、过滤、蒸发、浓缩、结晶、干燥等基本操作。
实验原理:粗食盐中的不溶性杂质(如泥沙等)可通过溶解和过滤的方法除去。
可溶性杂质主要是Ca2+、Mg2+、K+和SO42-离子等,选择适当的试剂使它沉淀而被除去。
实验步骤:1. 在粗盐溶液中加入过量的BaCl2溶液,除去SO42-。
2. 过滤,除去难溶化合物和BaSO4。
3. 在滤液中加入适量的NaOH溶液,除去Mg2+。
4. 再次过滤,除去沉淀的Mg(OH)2。
5. 在滤液中加入适量的KOH溶液,除去Ca2+。
6. 再次过滤,除去沉淀的Ca(OH)2。
7. 将滤液蒸发浓缩,冷却结晶,得到纯净的氯化钠。
四、实验注意事项1. 严格按照实验步骤进行操作。
2. 注意实验过程中的安全,如:防止烫伤、防止腐蚀等。
3. 仔细观察实验现象,及时记录实验数据。
五、课堂小结1. 总结本节课所学内容。
2. 鼓励学生在课后复习实验原理和实验方法。
教学评价:1. 通过实验操作考核,评价学生的实验技能。
2. 通过实验报告的撰写,评价学生的实验态度和实验数据记录的准确性。
大学无机化学教案
教案标题:大学无机化学教案
一、教学目标:
1. 理解无机化学的基本概念和原理
2. 掌握无机化学中常见的化学反应和反应机理
3. 熟悉无机化合物的性质和用途
4. 培养学生的实验操作能力和科学思维能力
二、教学内容:
1. 无机化学基本概念:原子结构、化学键、分子结构等
2. 无机化学反应:酸碱中和、氧化还原、沉淀反应等
3. 无机化合物的性质:酸碱性、溶解性、稳定性等
4. 无机化合物的用途:工业生产、环境保护、生物医药等
三、教学方法:
1. 理论讲解与实例分析相结合,引导学生理解无机化学的基本概念和原理
2. 实验操作与案例分析相结合,培养学生的实验操作能力和科学思维能力
3. 课堂讨论与小组合作相结合,激发学生的学习兴趣和团队合作能力
四、教学过程:
1. 理论讲解:通过PPT、教科书等形式,讲解无机化学的基本概念和原理
2. 实验操作:设计无机化学实验,让学生亲自操作并观察实验现象
3. 案例分析:结合实际应用案例,分析无机化合物的性质和用途
4. 课堂讨论:提出问题,引导学生进行思考和讨论,加深对无机化学知识的理解
五、教学评价:
1. 学生课堂表现:参与度、思考能力、表达能力等
2. 实验报告评定:实验操作技能、数据处理能力、实验总结能力等
3. 期末考试:对学生对无机化学知识的掌握情况进行考核
六、教学反思:
1. 教学方法是否得当,是否能够激发学生的学习兴趣
2. 教学内容是否贴近实际,是否能够培养学生的实际应用能力
3. 教学评价是否客观公正,是否能够全面反映学生的学习情况
以上是一份大学无机化学教案的基本框架,具体教学内容和方法可以根据实际情况进行调整和完善。
大一大二必修课无机化学实验教案实验教学目标:
1. 掌握无机化学实验基本操作技能。
2. 理解无机化学实验原理。
3. 培养实验设计和实验报告撰写能力。
实验一:无机化学实验室基本操作演练
实验目的:熟悉实验室基本操作流程,学习安全实验室实验的注意事项。
实验内容:
1. 实验前的准备工作:实验器材准备、标志和盛装药品(溶液、试剂)的容量、用途及名称标示。
2. 实验室安全知识:化学实验室安全操作规范、安全用电知识、紧急处理措施。
3. 实验室仪器设备:熟悉常用实验室仪器设备的结构、用途和操作方法。
4. 实验基本操作:称量、定容、准确稀释。
5. 实验剂量:计算溶液浓度、体积和质量。
实验二:常见无机化合物的合成与性质测试
实验目的:学习常见无机化合物的合成方法和性质测试方法。
实验内容:
1. 溶液配制与溶液稀释:学会配制指定浓度的溶液并进行稀释。
2. 酸碱中和反应:学习中和反应的反应原理和实验方法。
3. 结晶法:了解晶体的结构和常用的结晶方法,并进行结晶实验。
4. 氧化还原反应:学习氧化还原反应的原理、反应类型和实验方法。
5. 气体制备与收集:学习典型气体的制备和收集方法,并进行实验
验证。
实验三:无机离子的定性分析
实验目的:通过定性反应掌握常见无机离子的实验特征。
实验内容:
1. 制备离子试剂:制备标准的离子试剂溶液。
2. 离子反应:通过反应观察和沉淀形成验证离子的存在。
3. 离子分离:利用化学反应实现离子的分离。
4. 离子鉴定:通过鉴定试剂的特征反应,确定离子的种类。
实验四:无机化合物的定量分析
实验目的:学习常见无机化合物的定量分析方法。
实验内容:
1. 滴定分析:学习滴定反应的原理、操作方法和计算。
2. 母液配制与稀释:计算浓度、制备指定浓度的溶液。
3. 柱层析分析:学习柱层析分离方法、分析方法和结果计算。
4. 光度法:通过分光光度计测定溶液的吸光度,并计算浓度。
5. pH测定:学习pH测定的原理和操作方法。
实验五:无机化合物的理化性质测定
实验目的:通过实验测试学习无机化合物的理化性质。
实验内容:
1. 热力学性质测试:测定无机化合物的热容、热膨胀系数等热力学性质。
2. 光谱学测试:利用紫外可见光谱、红外光谱等测试无机化合物的光谱学性质。
3. 导电性测试:测量无机化合物的电导率,研究其导电性质。
4. 粉末X射线衍射测定:利用X射线衍射测定无机化合物的晶体结构。
实验教学评估方法:
1. 实验报告:要求学生根据实验过程和结果完成实验报告撰写,包括实验目的、原理、步骤、数据处理和实验结果分析等内容。
2. 实验表现评估:根据学生的实验操作、仪器使用和实验数据处理等方面的表现进行评估。
3. 实验考试:结合实验操作和理论知识进行考试,评估学生对实验知识的掌握情况。
在课程学习过程中,学生需要遵守实验室安全规定,严格按照实验教师指导进行实验操作,并及时记录实验数据和观察结果。
通过实验教学,学生将培养实验设计和操作技能,提升无机化学实验能力。