2017.11.27 元素周期表及规律
- 格式:ppt
- 大小:5.06 MB
- 文档页数:25
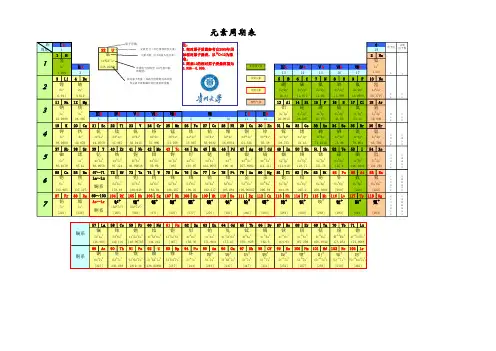
元素周期表中的规律元素周期表中的规律⼀、元素周期表1、周期表结构横⾏——周期:共七个周期,三短三长⼀不完全。
各周期分别有2,8,8,18,18,32,26种元素。
前三个周期为短周期,第四⾄第六这三个周期为长周期,第七周期还没有排满,为不完全周期。
纵⾏——族:七主七副⼀零⼀VIII,共16族,18列。
要记住零族元素的原⼦序数以便迅速由原⼦序数确定元素名称。
周期:⼀⼆三四五六七元素种类:28818183226零族:2He10Ne 18Ar 36Kr54Xe86Rn⼆、元素周期表中元素及其化合物的递变性规律1.原⼦结构与元素周期表的关系电⼦层数= 周期数主族元素最外层电⼦数= 主族序数= 最⾼正化合价由上述关系,就可以由原⼦结构找出元素在周期表中的位置,也可以由位置确定原⼦结构。
2、规律性由此可见,⾦属性最强的元素在周期表的左下⾓即Cs(Fr具有放射性,不考虑),⾮⾦属性最强的元素在右上⾓即F。
对⾓线附近的元素不是典型的⾦属元素或典型的⾮⾦属元素。
3、元素周期表中之最原⼦半径最⼩的原⼦:H原⼦质量最轻的元素:H元素;⾮⾦属性最强的元素:F⾦属性最强的元素:Cs(不考虑Fr)最⾼价氧化物对应⽔化物酸性最强的酸:HClO4最⾼价氧化物对应⽔化物碱性最强的碱:CsOH形成化合物最多的元素:C元素所含元素种类最多的族:ⅢB地壳中含量最⾼的元素:O元素,其次是Si元素地壳中含量最⾼的⾦属元素:Al元素,其次是Fe元素含H质量分数最⾼的⽓态氢化物:CH4与⽔反应最剧烈的⾦属元素:Cs元素与⽔反应最剧烈的⾮⾦属元素:F元素常温下为液态的⾮⾦属单质是Br2,⾦属单质是Hg……4、特殊性在掌握原⼦结构、元素性质的⼀般规律时,还要注意特殊性:⑴原⼦最外层电⼦排布是1—8个电⼦,但第⼀周期是1—2个电⼦⑵同⼀周期原⼦半径由⼤→⼩,但稀有⽓体突然增⼤(严格讲,稀有⽓体中不是原⼦半径⽽是范德华半径)⑶同⼀周期元素主要化合价由+1价到+7价,但F没有+7价,O没有+6价。
一、元素周期表基本排列规律1、原子半径由左到右依次减小,上到下依次增大。
2、元素周期表有7个周期,16个族。
每一个横行叫作一个周期,每一个纵行叫作一个族(VIII族包含三个纵列)。
这7个周期又可分成短周期(1、2、3)、长周期(4、5、6、7)。
3、同一周期内,从左到右,元素核外电子层数相同,最外层电子数依次递增,原子半径递减(零族元素除外)。
失电子能力逐渐减弱,获电子能力逐渐增强,金属性逐渐减弱,非金属性逐渐增强。
4、同一族中,由上而下,最外层电子数相同,核外电子层数逐渐增多,原子半径增大,原子序数递增,元素金属性递增,非金属性递减。
二、电子排布规律最外层电子数为1或2的原子可以是IA族、ⅡA族或副族元素的原子;最外层电子数是3~8的原子一定是主族元素的原子,且最外层电子数等于主族的族序数。
序数差规律(1)同周期相邻主族元素的“序数差”规律①除第ⅡA族和第ⅢA族外,其余同周期相邻元素序数差为1。
②同周期第ⅡA族和第ⅢA族为相邻元素,其原子序数差为:第二、第三周期相差1,第四、第五周期相差11,第六、第七周期相差25。
(2)同主族相邻元素的“序数差”规律①第二、第三周期的同族元素原子序数相差8。
②第三、第四周期的同族元素原子序数相差有两种情况:第IA族和第ⅡA族相差8,其它族相差18。
③第四、第五周期的同族元素原子序数相差18。
④第五、第六周期的同族元素原子序数镧系之前相差18,镧系之后相差32。
⑤第六、第七周期的同族元素原子序数相差32。
三、奇偶差规律元素的原子序数与该元素在周期表中的族序数和该元素的主要化合价的奇偶性一致。
若原子序数为奇数时,主族族序数、元素的主要化合价均为奇数,反之则均为偶数(但要除去N元素,它有多种价态,Cl元素也有ClO2)。
零族元素的原子序数为偶数,其化合价视为0。
四、元素金属性、非金属性的强弱规律(1)金属性(原子失电子)强弱比较①在金属活动性顺序中位置越靠前,金属性越强。

元素周期表的构成和规律一、元素周期表的构成1.元素周期表是一个表格,其中横向称为周期,纵向称为族。
2.周期表中的元素按照原子序数递增排列,原子序数相同的元素位于同一周期。
3.周期表共有7个周期,从第1周期到第7周期,周期数越大,元素的原子序数越大。
4.周期表共有18个族,包括7个主族、7个副族、1个0族和1个第Ⅷ族。
5.主族元素包括第1A到第7A族,副族元素包括第1B到第7B族,0族元素为稀有气体,第Ⅷ族元素为过渡金属。
二、元素周期表的规律1.周期规律:同一周期内,元素的原子半径随着原子序数的增加而减小;元素的金属性随着原子序数的增加而减弱,非金属性随着原子序数的增加而增强。
2.族规律:同一族元素具有相似的化学性质,族数相同的元素具有相同的最外层电子数。
3.电子层数规律:元素周期表中,电子层数等于周期数。
4.价电子规律:元素的价电子数等于其族序数。
5.原子半径规律:同一主族元素,原子半径随着周期数的增加而增大;同一周期元素,原子半径随着族序数的增加而增大。
6.金属性和非金属性规律:同一周期内,金属性随着族序数的增加而减弱,非金属性随着族序数的增加而增强;同一族内,金属性随着周期数的增加而增强,非金属性随着周期数的增加而减弱。
7.化合价规律:主族元素的化合价等于其最外层电子数;副族元素的化合价较为复杂,具有一定的可变性。
三、重要概念1.原子序数:元素在周期表中的序号,等于其核内质子数。
2.电子层:原子中电子分布的层次,等于元素周期表中的周期数。
3.价电子:原子最外层参与化学反应的电子数,等于元素周期表中的族序数。
4.主族元素:周期表中第1A到第7A族和第1B到第7B族的元素。
5.副族元素:周期表中第1B到第7B族的元素(除主族元素外)。
6.过渡金属:周期表中第Ⅷ族的元素。
7.稀有气体:周期表中0族的元素,具有稳定的电子层结构。
元素周期表是化学中的重要工具,通过其构成和规律,我们可以了解元素的性质、预测化学反应等。
化学元素周期表(完整版)
介绍
化学元素周期表是由化学元素按照其原子序数、电子排布和化学性质等规律进行排列的表格。
它是化学研究中的基础工具,用于传达元素的基本信息和特性。
本文档将提供一个完整的化学元素周期表,其内容包括元素的名称、原子序数、原子量、元素符号以及简要的特性说明。
元素列表
(注:上表只列出部分元素,完整版元素周期表可参考其他资源)
结论
元素周期表的完整版包含了大量的元素信息,通过学习元素周期表,可以更好地理解元素的特性和相互关系。
对于化学研究、材料开发和生命科学等领域的学习和实践,元素周期表都起到了重要的指导作用。
非金属氧性化渐性强渐氢化物渐稳定强还原熔氢原子沸化性半点物渐径渐渐熔强渐大稳沸金大定点属最高价氧化物的水合物的酸性渐强渐性最高价氧化物的水合物的碱性渐强大渐强原子半径渐大化合价+1 +2 +3 +4 +5 +6 +7 +6 +6 +6 +2 +2 +3 +4 +5 +6 +7+3 +4 +3 +3 +3 +1 +2 +4 +4 +5 化合价最高正价渐高+3 +2 +2 +2 +3 +4+2 +3+1 +1-4 -3 -2 -11. 元素周期表中元素性质的递变规律2.3.几个规律:①.金属性强弱:单质与水或非氧化性酸反应难易;单质的还原性(或离子的氧化性);M(OH)n的碱性;金属单质间的置换反应;原电池中正负极判断,金属腐蚀难易;非金属性强弱:与氢气反应生成气态氢化物难易;单质的氧化性(或离子的还原性);最高价氧化物的水化物(H n RO m)的酸性强弱;非金属单质间的置换反应。
② .半径比较三规律:阴离子与同周期稀有气体电子层结构相同;阳离子与上周期稀有气体电子层结构相同。
(1)电子层数越多,半径越大(2)电子层数相同,核电荷数越多,半径越小(3)电子层数和核电荷数相同,最外层电子数越多,半径越大③ .元素化合价规律主族最高正价 == 最外层电子数,非金属的负化合价 == 最外层电子数-8,最高正价数和负化合价绝对值之和为8;其代数和分别为:0、2、4、6。
化合物氟元素、氧元素只有负价(-1、-2),但HFO中0为+1价;金属元素只有正价;④. 熔沸点高低的比较:原子晶体>离子晶体>分子晶体⑤. 1-20号元素符号、名称、原子结构、特殊化学性质。
⑥ .电子式的书写原子的电子式离子的电子式:分子或共价化合物电子式离子化合价电子式同周期元素性质的递变规律:同一周期元素(稀有气体元素除外)的原子,从左往右,最外层电子数逐渐增加,原子半径逐渐减小,元素的原子失电子能力逐渐减弱,得电子能力逐渐增强,即元素的金属性逐渐减弱,非金属性逐渐增强第3周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Na > Mg > Al氧化性:Na+< Mg2+< Al3+(相反)与水或酸反应置换出氢的难易程度:Na > Mg > Al易难剧烈不剧烈最高价氧化物对应的水化物的碱性NaOH > Mg(OH)2> Al(OH)3元素原子得电子能力(元素的非金属性)Si < P < S < Cl还原性:P3->S2->Cl-(Si4-不存在) (相反)元素单质的氧化性Si < P < S < Cl2单质与氢气化合的难易程度Si < P < S < Cl2难易气态氢化物的稳定性SiH4< PH3< H2S < HCl最高价氧化物对应的水化物的酸性H4SiO4(或H2SiO3) < H3PO4< H2SO4< HClO4第2周期:元素原子失电子能力(元素的金属性、元素单质的还原性)Li > Be氧化性:Li+< Be2+(相反)与水或酸反应置换出氢的难易程度:Li > Be易较难剧烈较不剧烈最高价氧化物对应的水化物的碱性LiOH > Be(OH)2元素原子得电子能力(元素的非金属性)C < N < O < F还原性:N3->O2->F-(C4-不存在) (相反)元素单质的氧化性C < N2< O2< F2单质与氢气化合的难易程度C < N2< O2< F2难易气态氢化物的稳定性CH4< NH3< H2O < HF最高价氧化物对应的水化物的酸性H2CO3< HNO3同主族元素性质的递变规律:同主族元素从上到下,电子层数依次增多,原子半径逐渐增大,元素的原子失电子能力逐渐增强,得电子能力逐渐减弱即元素的金属性逐渐增强,非金属性逐渐减弱ⅦA族ⅠA族(除氢H外,即碱金属元素)ⅤA族。

(完整版)化学元素周期表的规律总结化学元素周期表的规律总结?比如金属性非金属性等元素周期表中元素及其化合物的递变性规律1 原子半径(1)除第1周期外,其他周期元素(惰性气体元素除外)的原子半径随原子序数的递增而减小;(2)同一族的元素从上到下,随电子层数增多,原子半径增大。
2 元素化合价(1)除第1周期外,同周期从左到右,元素最高正价由碱金属+1递增到+7,非金属元素负价由碳族-4递增到-1(氟无正价,氧无+6价,除外);(2)同一主族的元素的最高正价、负价均相同(3) 所有单质都显零价3 单质的熔点(1)同一周期元素随原子序数的递增,元素组成的金属单质的熔点递增,非金属单质的熔点递减;(2)同一族元素从上到下,元素组成的金属单质的熔点递减,非金属单质的熔点递增4 元素的金属性与非金属性(1)同一周期的元素电子层数相同。
因此随着核电荷数的增加,原子越容易得电子,从左到右金属性递减,非金属性递增;(2)同一主族元素最外层电子数相同,因此随着电子层数的增加,原子越容易失电子,从上到下金属性递增,非金属性递减。
5 最高价氧化物和水化物的酸碱性元素的金属性越强,其最高价氧化物的水化物的碱性越强;元素的非金属性越强,最高价氧化物的水化物的酸性越强。
6 非金属气态氢化物元素非金属性越强,气态氢化物越稳定。
同周期非金属元素的非金属性越强,其气态氢化物水溶液一般酸性越强;同主族非金属元素的非金属性越强,其气态氢化物水溶液的酸性越弱。
7 单质的氧化性、还原性一般元素的金属性越强,其单质的还原性越强,其氧化物的阳离子氧化性越弱;元素的非金属性越强,其单质的氧化性越强,其简单阴离子的还原性越弱。
一、原子半径同一周期(稀有气体除外),从左到右,随着原子序数的递增,元素原子的半径递减;同一族中,从上到下,随着原子序数的递增,元素原子半径递增。
二、主要化合价(最高正化合价和最低负化合价)同一周期中,从左到右,随着原子序数的递增,元素的最高正化合价递增(从+1价到+7价),第一周期除外,第二周期的O、F元素除外;最低负化合价递增(从-4价到-1价)第一周期除外,由于金属元素一般无负化合价,故从ⅣA族开始。


化学元素周期表⼝诀 元素周期表共分18纵⾏,其中第1、2、13、14、15、16、17七个纵⾏依次为ⅠA族、ⅡA族、ⅢA族、ⅣA族、ⅤA族、ⅥA族、ⅦA族(纵⾏序号的个位数与主族序数相等);第3、4、5、6、7、11、12七个纵⾏依次为ⅢB族、ⅣB族、ⅤB族、ⅥB族、ⅦB族、ⅠB族、ⅡB族(纵⾏序号个位数与副族序数相等);第8、9、10三个纵⾏为合称为Ⅷ族;第18纵⾏称为0族。
以下是化学元素周期表⼝诀,欢迎阅读。
化学元素周期表⼝诀 我是氢,我最轻,⽕箭靠我运卫星; 我是氦,我⽆赖,得失电⼦我最菜; 我是锂,密度低,遇⽔遇酸把泡起; 我是铍,耍赖⽪,虽是⾦属难电离; 我是硼,有点红,论起电⼦我很穷; 我是碳,反应慢,既能成链⼜成环; 我是氮,我阻燃,加氢可以合成氨; 我是氧,不⽤想,离开我就憋得慌; 我是氟,最恶毒,抢个电⼦就满⾜; 我是氖,也不赖,通电红光放出来; 我是钠,脾⽓⼤,遇酸遇⽔就⽕⼤; 我是镁,最美,摄影烟花放光辉; 我是铝,常温⾥,浓硫酸⾥把澡洗; 我是硅,⾊⿊灰,信息元件把我堆; 我是磷,害⼈精,剧毒列表有我名; 我是硫,来历久,沉淀⾦属最拿⼿; 我是氯,⾊黄绿,⾦属电⼦我抢去; 我是氩,活性差,霓虹紫光我来发; 我是钾,把⽕加,超氧化物来当家; 我是钙,⾝体爱,⾻头⽛齿我都在; 我是钛,过渡来,航天飞机我来盖; 我是铬,正六铬,酒精过来变绿⾊; 我是锰,价态多,七氧化物爆炸猛; 我是铁,⽤途⼴,不锈钢喊我叫爷; 我是铜,⾊紫红,投⼊硝酸⽓棕红; 我是砷,颜⾊深,三价元素夺你魂; 我是溴,挥发臭,液态⾮⾦我来秀; 我是铷,碱⾦属,沾⽔烟花钾不如; 我是碘,升华烟,遇到淀粉蓝点点; 我是铯,⾦黄⾊,⼊⽔爆炸容器破; 我是钨,⾼温度,⾦属早呜呼; 我是⾦,很稳定,扔进王⽔影⽆形; 我是汞,有剧毒,液态⾦属我为独; 我是铀,浓缩后,造原⼦弹我最⽜; 我是镓,易融化,沸点很⾼难蒸发; 我是铟,软如⾦,轻微放射宜⼩⼼; 我是铊,能脱发,投毒出名看清华; 我是锗,可晶格,红外窗⼝能当壳; 我是硒,补⼈体,⼝服液⾥有⽞机; 我是铅,能储电,⼦弹头⾥也出现。

元素周期表元素周期律知识点总结元素周期表元素周期律知识点总结一、元素周期表★熟记等式:原子序数=核电荷数=质子数=核外电子数1、元素周期表的编排原则:①按照原子序数递增的顺序从左到右排列;②将电子层数相同的元素排成一个横行——周期;③把最外层电子数相同的元素按电子层数递增的顺序从上到下排成纵行——族2、如何精确表示元素在周期表中的位置:周期序数=电子层数;主族序数=最外层电子数口诀:三短三长一不全;七主七副零八族熟记:三个短周期,第一和第七主族和零族的元素符号和名称3、元素金属性和非金属性判断依据:①元素金属性强弱的判断依据:单质跟水或酸起反应置换出氢的难易;元素最高价氧化物的.水化物——氢氧化物的碱性强弱;置换反应。
②元素非金属性强弱的判断依据:单质与氢气生成气态氢化物的难易及气态氢化物的稳定性;最高价氧化物对应的水化物的酸性强弱;置换反应。
4、核素:具有一定数目的质子和一定数目的中子的一种原子。
①质量数==质子数+中子数:a==z+n②同位素:质子数相同而中子数不同的同一元素的不同原子,互称同位素。
(同一元素的各种同位素物理性质不同,化学性质相同)二、元素周期律1、影响原子半径大小的因素:①电子层数:电子层数越多,原子半径越大(最主要因素)②核电荷数:核电荷数增多,吸引力增大,使原子半径有减小的趋向(次要因素)③核外电子数:电子数增多,增加了相互排斥,使原子半径有增大的倾向2、元素的化合价与最外层电子数的关系:最高正价等于最外层电子数(氟氧元素无正价)负化合价数=8—最外层电子数(金属元素无负化合价)3、同主族、同周期元素的结构、性质递变规律:同主族:从上到下,随电子层数的递增,原子半径增大,核对外层电子吸引能力减弱,失电子能力增强,还原性(金属性)逐渐增强,其离子的氧化性减弱。
同周期:左→右,核电荷数——→逐渐增多,最外层电子数——→逐渐增多原子半径——→逐渐减小,得电子能力——→逐渐增强,失电子能力——→逐渐减弱氧化性——→逐渐增强,还原性——→逐渐减弱,气态氢化物稳定性——→逐渐增强最高价氧化物对应水化物酸性——→逐渐增强,碱性——→逐渐减弱化学键含有离子键的化合物就是离子化合物;只含有共价键的化合物才是共价化合物。

元素周期表元素周期律一元素周期表1.原子序数按照元素在周期表中的顺序给元素所编的序号。
原子序数=核电荷数=核外电子数=质子数2.元素周期表的编排原则3.元素周期表的结构(1)周期、族的数目和位置(2)每周期0族元素及其原子序数(1)过渡元素:元素周期表中部从第ⅢB族到第ⅡB族10个纵行共六十多种元素,这些元素都是金属元素。
(2)镧系:元素周期表第六周期中,57号元素镧到71号元素镥共15种元素。
(3)锕系:元素周期表第七周期中,89号元素锕到103号元素铹共15种元素。
(4)超铀元素:在锕系元素中92号元素铀(U)以后的各种元素。
【巧记】横行叫周期,现有一至七,四长三个短,第七尚不满。
纵列称为族,共有十六族,一八依次现①,一零再一遍②。
一纵一个族,Ⅷ族搞特殊,三纵算一族,占去8、9、10。
镧系与锕系,蜗居不如意,十五挤着住,都属ⅢB族。
说明①指ⅠA、ⅡA、ⅢB、ⅣB、ⅤB、ⅥB、ⅦB、Ⅷ;②指ⅠB、ⅡB、ⅢA、ⅣA、ⅤA、ⅥA、ⅦA、0。
二元素周期律及应用1.元素周期律2.主族元素的周期性变化规律(1)根据元素周期表中的位置寻找未知元素(2)预测元素的性质(由递变规律推测)①比较不同主族、不同周期元素的性质如金属性Mg>Al,Ca>Mg,则碱性Mg(OH)2>Al(OH)3,Ca(OH)2>Mg(OH)2(填“>”、“<”或“=”)。
②推测未知元素的某些性质如:已知Ca(OH)2微溶,Mg(OH)2难溶,可推知Be(OH)2难溶;再如:已知卤族元素的性质递变规律,可推知元素砹(At)应为有色固体,与氢难化合,HAt不稳定,水溶液呈酸性,AgAt不溶于水等。
(3)启发人们在一定区域内寻找新物质①半导体元素在金属与非金属分界线附近,如:Si、Ge、Ga等。
②农药中常用元素在右上方,如:F、Cl、S、P、As等。
③催化剂和耐高温,耐腐蚀合金材料主要在过渡元素中找,如:Fe、Ni、Rh、Pt、Pd等。
4.元素金属性、非金属性的比较方法(1)结构比较法最外层电子数越少,电子层数越多,元素金属性越强;最外层电子数越多,电子层数越少,元素非金属性越强。
元素周期表1.化学元素周期表的高清图1.化学元素周期表的高清图1.化学元素周期表的高清图化学元素周期表口诀是什么化学元素周期表口诀是什么按周期分的元素周期表口诀第一周期:氢氦 ---- 侵害第二周期:锂铍硼碳氮氧氟氖 ---- 鲤皮捧碳蛋养福奶第三周期:钠镁铝硅磷硫氯氩 ---- 那美女桂林留绿牙(那美女鬼流露绿牙)第四周期:钾钙钪钛钒铬锰 ---- 嫁改康太反革命铁钴镍铜锌镓锗 ---- 铁姑捏痛新嫁者砷硒溴氪 ---- 生气休克第五周期:铷锶钇锆铌 ---- 如此一告你钼锝钌 ---- 不得了铑钯银镉铟锡锑 ---- 老把银哥印西堤碲碘氙 ---- 地点仙第六周期:铯钡镧铪 ----(彩)色贝(壳)蓝(色)河钽钨铼锇 ---- 但(见)乌(鸦)(引)来鹅铱铂金汞砣铅 ---- 一白巾供它牵铋钋砹氡 ---- 必不爱冬(天)第七周期:钫镭锕 ---- 很简单了~就是---- 防雷啊!按族分的元素周期表口诀主族元素:氢锂钠钾铷铯钫——请李娜加入私访铍镁钙锶钡镭——媲美盖茨被雷硼铝镓铟铊——碰女嫁音他碳硅锗锡铅——探归者西迁氮磷砷锑铋——蛋临身体闭氧硫硒碲钋——养牛西蹄扑氟氯溴碘砹——父女绣点爱氦氖氩氪氙氡——害耐亚克先动元素周期表背诵技巧元素周期表背诵技巧元素符号氢h碳c氮n,氧o硫s氯cl,铝al磷p钠na,铜cu铁fe锌zn,钾k碘i银ag,钨w汞hg金au。
前20号元素hhelibeb(氢氦锂铍硼)cnofne(碳氮氧氟氖)namgalsip(钠镁铝硅磷)sclarkca(硫氯氩钾钙)五个五个背,比较顺口。
化合价一价请驴脚拿银,(一价氢氯钾钠银)二价羊盖美背心。
(二价氧钙镁钡锌)一价钾钠氢氯银,二价氧钙钡镁锌;三铝四硅五价磷,二三铁、二四碳;一至五价都有氮,铜汞二价最常见。
正一铜氢钾钠银,正二铜镁钙钡锌;三铝四硅四六硫,二四五氮三五磷;一五七氯二三铁,二四六七锰为正;碳有正四与正二,再把负价牢记心;负一溴碘与氟氯,负二氧硫三氮磷。
(完整版)元素周期表主要知识点元素周期表一、元素周期表概述1、门捷列夫周期表:按相对原子质量由小到大依次排列,将化学性质相似的元素放在一个纵行,通过分类、归纳制出的第一张元素周期表。
2、现行常用元素周期表⑴周期表的编排原则:①按原子序数递增的顺序从左到右排列②将电子层数相同的元素排成一个横行③把最外层电子数相同的元素(个别例外)按电子层数递增的顺序从上到下排成纵行⑵周期表的结构:七个横行;7个周期[三短(2、8、8)、三长(18、18、32)、一不完全]18个纵行(列),16个族:7个主族(ⅠA~ⅦA);(1、2、13~17列);7个副族(ⅠB~ⅦB);(3~12列)Ⅷ族:3个纵行;(8、9、10列); 零族:稀有气体(18列)周期表中有些族有特殊的名称:第ⅠA族:碱金属元素(不包括氢元素);第ⅦA族:卤族元素0族:稀有气体元素3、元素周期表的结构与原子结构的关系原子序数==核电荷数==质子数==核外电子数; 周期序数==原子的电子层数主族序数==最外层电子数==最高正价数(O、F除外)==价电子数非金属的负价的绝对值==8-主族序数(限ⅣA~ⅦA)4、由原子序数确定元素位置的规律⑴主族元素:周期数==核外电子层数;主族的族序数==最外层电子数⑵确定族序数应先确定是主族还是副族,其方法是采用原子序数逐步减去各周期的元素种数,最后的差值即可确定。
基本公式:原子序数-零族元素的序数(或各周期元素总数)== 差值①对于短周期元素:若差值为0,则为相应周期的零族元素;若0<差值≤7,则元素在下一周期,差值即为主族序数。
差值为1~7时,差值即为族序数,位于Ⅷ族左侧;差值为8、9、10时,为Ⅷ族元素。
差值为11~17时,再减去10所得最后差值,即为Ⅷ族右侧的族序数。
若差值>17,再减14,按同上方法处理。
5、同主族元素上、下相邻元素原子序数推导规律:⑴ⅠA、ⅡA族元素:元素的原子序数==上一周期的元素的原子序数+上一周期的元素总数⑵ⅢA~ⅦA、0族元素:元素的原子序数==上一周期的元素的原子序数+本周期的元素总数二、核素1、质量数:将原子核内所有质子和中子的相对质量取近似整数值相加,所得到的数值叫质量数(Li →Cs)质量数(A )=质子数(Z )+中子数(N )2、核素:具有一定数目质子和一定数目中子的一种原子叫做核素3、同位素:● 质子数相同而中子数不同的同一元素的不同原子互为同位素● 当某种元素具有两种或两种以上天然、稳定的同位素时,无论是在单质还是在化合物里,任意一种同位素在该元素内所占的原子数目百分比都不变4、同素异形体指同种元素形成的不同单质,它们之间互称为同素异性体。
元素周期表元素周期表的排列规律与元素性质的关系元素周期表是一张系统地安排了所有已知化学元素的表格,通常被用于描述元素的物理和化学性质,以及它们之间的关系。
本文将探讨元素周期表的排列规律以及与元素性质之间的关系。
一、元素周期表的排列规律元素周期表的排列是根据元素的原子序数(即元素的原子核中所含质子的个数)从小到大进行的。
它按照一定的规则将元素分组排列,这些规则主要有以下几点:1. 周期:元素周期表按照水平行进行排列,每个水平行称为一个周期。
目前共有七个周期,分别用数字1到7表示。
2. 主族:主族是元素周期表中的垂直列,每个周期表有一组主族元素。
主族元素具有相似的化学性质,因为它们具有相同的电子壳层构造。
3. 副族:副族是周期表中主族元素之外的元素。
它们通常具有与主族元素不同的化学性质。
4. 原子序数:原子序数逐渐增加,从左到右、从上到下地填充元素。
原子序数越大,元素的原子核中的质子数也越多。
二、元素周期表与元素性质的关系元素周期表的排列规律使我们能够推断出元素的一些物理和化学性质。
以下是一些与周期表排列有关的元素性质:1. 周期性:元素周期表的排列使得具有相似化学性质的元素出现在相同的水平行上。
这种周期性使得我们能够预测元素的性质,例如电子配置、原子半径和电负性等。
2. 电子结构:元素周期表的排列反映了元素的电子结构规律。
从左到右,每个周期的元素都会增加一个质子和一个电子,同时填充一个新的能级。
这种排列给出了元素的电子分布模式,有助于我们深入了解元素的性质。
3. 金属和非金属性质:元素周期表中金属和非金属元素之间的分隔线,称为“金属与非金属的界限”,是根据元素的化学性质和反应性来划分的。
金属通常在左侧和中部,而非金属则多分布在右侧。
4. 元素周期表的拓展:随着科学的发展,新的元素被不断发现。
元素周期表通过不断的拓展和扩展,使人们能够更好地了解新发现的元素及其性质。
最近,因为人们发现了新的超重元素而扩展了周期表。
Al3+/Al,-1.66V)。
②铍和铝经浓硝酸处理都表现钝化,而其它碱土金属均易与硝酸反应。
③铍和铝都是两性金属,既能溶于酸也能溶于碱。
④氢氧化物均为两性,而其它碱土金属氢氧化物均为碱性。
⑤BeO和Al2O3都有高熔点和高硬度。
⑥铝和铍的氯化物是共价分子,能通过氯桥键形成双聚分子,易升华、易聚合,易溶于有机溶剂。
3、硼和硅的相似性。
B和Si虽是不同族元素,在周期表中处于相邻族的对角位置,由于离子极化作用相近(Si4+电荷高一些,但半径大;B3+电荷低一些,但半径小),性质上有许多相似之处。
①单质晶体都是高熔点原子晶体;与键强度相关。
②在自然界均以含氧化合物存在。
③卤化物都彻底水解,生成含B─O,Si─O键的化合物(硅酸、硼酸)④都有一系列氢化物,氢化物均有挥发性,不稳定。
⑤含氧酸都是弱酸,含氧酸盐都易水解对角线规则是从有关元素及其化合物的许多性质中总结出来的经验规律;对此可以用离子极化的观点加以粗略的说明。
同一周期最外层电子构型相同的金属离子,从左至右随离子电荷的增加而引起极化作用的增强;同一族电荷相同的金属离子,自上而下随离子半径的增大而使得极化作用减弱。
因此,处于周期表中左上右下对角线位置上的邻近两个元素,由于电荷和半径的影响恰好相反,它们的离子极化作用比较相近,从而使它们的化学性质比较相似。
由此反映出物质的结构与性质之间的内在联系。
三. 周期表中的变化规律(一) 同一元素:r -离子>r原子>r+离子>r2+离子(二) 同一周期1. 短周期:每一个短周期从左到右,有效核电荷依次增大,所以原子半径依次递减.2. 长周期:过渡元素自左至右,电子逐一填入(n-1)d层,而它对核的屏蔽作用较小,所以自左向右半径减小的幅度不如主族元素那么大.3. 内过渡元素:电子填入再次外层的(n-2)f层,由于f电子对核的屏蔽作用更小,使得原子半径由左至右收缩的平均幅度更小.比较短周期和长周期,相邻元素原子半径减小的平均幅度大致是非过渡元素>过渡元素>内过渡元素(~10pm)(~5pm)(<1pm)(三) 同一族1. 主族:同一主族由上而下,原子半径一般是增大的.因为同族元素原子由上而下电子层数增多,所以半径由上至下依次增大.2. 副族:副族元素由上至下,原子半径增大的幅度较小,特别是五,六周期的同族元素原子半径非常接近,这是由于后面要提到的镧系收缩效应所造成的结果.特殊元素集锦1、最活泼的金属元素、最高价氧化物对应的水化物碱性最强的元素、阳离子氧化性最弱的元素是铯(Cs)。