第二章 热力学第一定律
- 格式:doc
- 大小:771.00 KB
- 文档页数:22





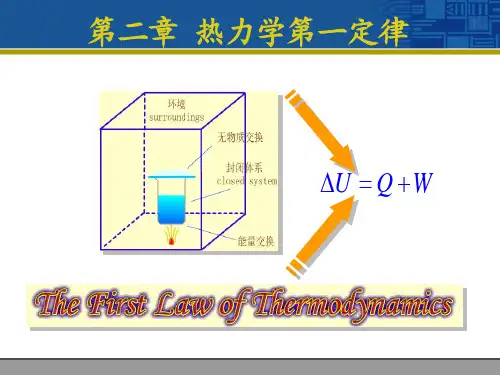
第二章 热力学第一定律第一节 第一定律的实质及热力学能和总能能量守恒与转换定律是自然界的基本规律之一,它指出:自然界中的一切物质都具有能量,能量不可能被创造,也不能被消灭;但能量可以从一种形态转变为另一种形态,且在能量的转化过程中能量总量不变。
热力学第一定律是能量守恒与转换定律在热现象中的应用。
它确定了热力过程中热力系统与外界进行能量交换时,各种形态能量数量上的守恒关系。
一、热力学能热力学能是与物质内部粒子的微观运动和粒子的空间位置有关的能量。
它包括分子移动、转动、粒子震动运动的内动能和分子间由于相互作用力的存在而具有的内位能,故又称内能。
内动能取决于分子热运动,是温度的函数,而内位能取决于分子间的距离,是比体积的函数,即u = f ( T, v )二、总能除热力学能外,工质的总能量还包括工质在参考坐标系中作为一个整体,因有宏观运动速度而具有动能、因有不同高度而具有位能。
前一种能量称之为内部储存能,后两种能量则称之为外部储存能。
我们把内部储存能和外部储存能的总和,即热力学能与宏观运动动能和位能的总和,叫做工质的总储存能,简称总能。
即p k E U E E =++ (2-1)E---总能; U---热力学能; E k ---宏观动能; E p ---宏观位能。
第二节 第一定律的基本能量方程及工质的焓一、焓在有关热力计算总时常有U+pV 出现,为了简化公式和计算,把它定义为焓,用符号H 表示,即H=U+pV (2-2)1kg工质的焓值称为比焓,用h表示,即h=u+pv (2-3)焓的单位是J,比焓的单位是J/kg。
焓是一个状态参数,在任一平衡状态下,u、p和v都有一定得值,因而焓h也有一定的值,而与达到这一状态的路径无关。
当1kg工质通过一定的界面流入热力系统时,储存于它内部的热力学能当然随着也进入到系统中,同时还把从外部功源获得的推动功pv带进了系统。
因此系统中因引进1kg工质而获得的总能量是热力学能与推动功之和(u+pv),即比焓。




第二章热力学第一定律First law of thermodynamics First law of thermodynamics2–1 热力学第一定律的实质2-2 热力学能(内能)和总能2-22–3 热力学第一定律基本表达式2–4 闭口系基本能量方程式252–5 开口系能量方程12–1热力学第一定律的实质一、第一定律的实质能量守恒与转换定律在热现象中的应用。
二、第一定律的表述第定律的表述热是能的一种,机械能变热能,或热能变机械能的时候,他们之间的比值是一定的。
或:热可以变为功,功也可以变为热;一定量的热消失时必定产生相应量的功;消耗一定量的功时,必出现与之相应量的热。
22–2 热力学能(内能)和总能一、热力学能(internal energy)UU chU nu k平移动能U thU k 转动动能振动动能()T f 1),(v T U U =U p —()v T f ,2二、总(储存)能(total stored energy of system)、总(储存)能(o s o ed e e gy o sys e )++热力学能,内部储存能k pk pE U E E e u e e =++=3总能外部储存能宏观动能宏观位能宏观动能与内动能的区别2–3 热力学第一定律基本表达式加入系统的能量总和-热力系统输出的能量总和= 热力系总储存能的增量δW+d EE d Eδi im e δj jm e δQd ττ+τ流入:δδi iQ m e +∑流出:δδjjW m e+∑5内部贮能的增量:d E2–4 闭口系基本能量方程式τ⎡()()21tot δδj j i i Q E e m e m W τ⎤=∆+Σ−Σ+⎣⎦∫闭口系,δ0δ0i j m m ==忽略宏观动能U k 和位能U p ,E U∆=∆δd δδd δQ U W Q U W u wu w=∆+=+=∆+=+q q 第一定律第一解析式—功的基本表达式热7讨论:δd δU W U W =∆+=+δd δQ Q q u wq u w=∆+=+1)对于可逆过程δd d Q U p V=+2)对于循环netnetδd δQ U W QW =+⇒=∫∫∫ 3)对于定量工质吸热与升温关系,还取决于W 的”“+”、“–”、数值大小。

物理化学练习题第二章热力学第一定律一、选择题1、下列叙述中不具状态函数特征的是:()(A)系统状态确定后,状态函数的值也确定(B)系统变化时,状态函数的改变值只由系统的初终态决定(C)经循环过程,状态函数的值不变(D)状态函数均有加和性2、下列叙述中,不具可逆过程特征的是:()(A)过程的每一步都接近平衡态,故进行得无限缓慢(B)沿原途径反向进行时,每一小步系统与环境均能复原(C)过程的初态与终态必定相同(D)过程中,若做功则做最大功,若耗功则耗最小功3、如图,将CuSO4水溶液置于绝热箱中,插入两个铜电极,以蓄电池为电源进行电解,可以看作封闭体系的是:()(A)绝热箱中所有物质(B)两个铜电极(C)蓄电池和铜电极(D) CuSO4水溶液4、在一个绝热刚瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B) Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 05、在下列关于焓的描述中,正确的是()(A)因为ΔH=QP,所以焓是恒压热(B)气体的焓只是温度的函数(C)气体在节流膨胀中,它的焓不改变(D)因为ΔH=ΔU+Δ(PV),所以任何过程都有ΔH>0的结论6、在标准压力下,1mol石墨与氧气反应生成1mol二氧化碳的反应热为Δr H ,下列哪种说法是错误的? ()(A) ΔH 是CO2(g)的标准生成热(B) ΔH =ΔU(C) ΔH 是石墨的燃烧热(D) ΔU <ΔH7、在标准状态下,反应C2H5OH(l)+3O2(g) →2CO2(g)+3H2O(g)的反应焓为Δr H mθ, ΔC p>0, 下列说法中正确的是()(A)Δr H mθ是C2H5OH(l)的标准摩尔燃烧焓(B)Δr H mθ〈0(C)Δr H mθ=ΔrUmθ(D)Δr H mθ不随温度变化而变化8、下面关于标准摩尔生成焓的描述中,不正确的是()(A)生成反应中的单质必须是稳定的相态单质(B)稳态单质的标准摩尔生成焓被定为零(C)生成反应的温度必须是298.15K(D)生成反应中各物质所达到的压力必须是100KPa9、在一个绝热钢瓶中,发生一个放热的分子数增加的化学反应,那么:()(A) Q > 0,W > 0,∆U > 0 (B)Q = 0,W = 0,∆U < 0(C) Q = 0,W = 0,∆U = 0 (D) Q < 0,W > 0,∆U < 010、非理想气体进行绝热自由膨胀时,下述答案中哪一个是错误的? ( )(A) Q=0 (B) W=0 (C) ΔU=0 (D) ΔH=011、下列表示式中正确的是( )(A)恒压过程ΔH=ΔU+pΔV (B)恒压过程ΔH=0(C)恒压过程ΔH=ΔU+VΔp (D)恒容过程ΔH=012、理想气体等温反抗恒外压膨胀,则( )(A)Q>W (B)Q<W (C)Q=W (D)Q=△U13、当理想气体其温度由298K升高到348K,经(1)绝热过程和(2)等压过程,则两过程的()(A)△H1>△H2 W1<W2(B)△H1<△H2 W1>W2(C)△H1=△H2 W1<W2(D)△H1=△H2 W1>W214、当理想气体从298K,2×105Pa 经历(1)绝热可逆膨胀和(2)等温可逆膨胀到1×105Pa时,则( )(A)△H1<△H2 W1>W2(B)△H1>△H2 W1<W2(C)△H1<△H2 W1<W2(D)△H1>△H2 W1>W215、对于封闭体系,在指定始终态间的绝热可逆途径可以有:( )(A) 一条(B) 二条(C) 三条(D) 三条以上16、实际气体绝热恒外压膨胀时,其温度将:( )(A) 升高(B) 降低(C) 不变(D) 不确定17、功的计算公式为W=nC v,m(T2-T1),下列过程中不能用此式的是()(A)理想气体的可逆绝热过程(B)理想气体的绝热恒外压过程(C)实际气体的绝热过程(D)凝聚系统的绝热过程18、凡是在孤立体系中进行的变化,其ΔU和ΔH的值一定是:( )(A) ΔU> 0 , ΔH > 0 (B) ΔU= 0 , ΔH = 0(C) ΔU< 0 , ΔH < 0 (D) ΔU= 0 , ΔH大于、小于或等于零不确定19、一定量的理想气体从同一始态出发,分别经(1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有:( )(A) H1> H2 (B) H1= H2 (C) H1< H2 (D) H1>=H220、将H2(g)与O2以2:1的比例在绝热刚性密闭容器中完全反应,则该过程中应有()(A)ΔT=0 (B)Δp=0 (C)ΔU=0 (D)ΔH=021、刚性绝热箱内发生一化学反应,则反应体系为( )(A)孤立体系(B)敞开体系(C)封闭体系(D)绝热体系22、理想气体可逆绝热膨胀,则下列说法中正确的是( )(A)焓总是不变(B)内能总是增加(C)焓总是增加(D)内能总是减少23、关于等压摩尔热容和等容摩尔热容,下面的说法中不正确的是( )(A)C p,m与C v,m不相等,因等压过程比等容过程系统多作体积功(B)C p,m–C v,m=R既适用于理想气体体系,也适用于实际气体体系(C)C v,m=3/2R适用于单原子理想气体混合物(D)在可逆相变中C p,m和C v,m都为无限大24、下列哪个过程的dT≠0,dH=0?( )(A)理想气体等压过程(B)实际气体等压过程(C)理想气体等容过程(D)实际气体节流膨胀过程25、隔离系统内发生一变化过程,则系统的:(A)热力学能守恒,焓守恒(B)热力学能不一定守恒,焓守恒(C)热力学能守恒,焓不一定守恒(D)热力学能、焓均不一定守恒二、判断题1、体系在某过程中向环境放热,则体系的内能减少。
错2恒温过程的Q一定是零。
()3、经历任意一个循环过程时,系统从环境吸收的热等于系统对外所做的功()对4尽管Q和W都是途径函数,但(Q+W)的数值与途径无关。
()5、由于热力学能是状态函数,则理想气体的状态改变时,其热力学能一定跟着改变()错6、封闭体系经历一个不作其它功的等压过程,其热量只决定于体系的初终态()对7在绝热、密闭、坚固的容器中发生化学反应,△U一定为零,△H不一定为零。
()8不可逆过程就是过程发生后,系统不能再复原的过程。
()9、因△H = Q p所以只有等压过程才有△H。
()都适用。
()10、理想气体,不管是恒压过程,还是恒容过程,公式⎰=HC∆dTp三、计算题1、0.01m3氧气由273K,1MPa经过(1)绝热可逆膨胀(2)对抗外压p=0.1MPa做绝热不可逆膨胀,气体最后压力均为0.1MPa,求两种情况所做的功。
(氧气的C p,m=29.36J·K-1·mol-1)2、10mol的理想气体分别经过下述(a)和(b)两个过程,在673K从 1.8×10-3m3等温膨胀到2.4×10-3m3,试计算其膨胀功W及体系所吸收的热Q。
(a)可逆恒温膨胀;(b)对抗外压为2.026×105Pa的等温膨胀。
3、在298.2K,101325Pa时有0.5molZn与过量稀硫酸反应,生成氢气和硫酸锌,已知此反应放热为7.155×104J,试计算:(1)上述过程中Q,W,ΔU,ΔH 的值;(2)若上述反应在密闭容器中发生,求Q,W,ΔH,ΔU的值。
4、将1kg水过冷到-5℃,在101.325kPa下,加入极少量的冰屑.使过冷水迅速结冰,并使冰与水的混合物的温度迅速升至冰点,冰的熔化热为333.5J ·g -1,0℃至-5℃水的比热为4.238J ·K -1,求结出冰的质量。
5、已知水在100℃时的蒸发热为2259.36J ·g -1,则在100℃时蒸发30g 水,系统的Q ,W ,ΔH ,为多少?6、将1mol 单原子理想气体,在1.013×105Pa 下从298K 加热到373K ,再恒温可逆膨胀至体积增加一倍,最后绝热可逆膨胀至温度为308K ,求全过程的W ,Q ,ΔU ,ΔH 。
7、1molO 2由0.1MPa ,300K 恒压加热到1000K ,求过程的Q 、W 、△U 及△H 。
已知:C p,m (O 2)=(31.64+3.39×10-3T-3.77×10-5T 2)J ·K -1·mol -18、1mol 单原子分子理想气体B ,由300K , 100.0kPa 经一可逆过程到达终态,压力为200.0kPa ,过程的Q =1000.0J , ΔH=2078.5J (1)计算终态的温度、体积及过程的W , ΔU 。
(2)假设气体先经等压可逆过程,然后经等温可逆过程到达终态,此过程的Q,W,ΔU,ΔH 是多少? 9、298K 时,1molCO 与0.5mol 的O 2按下式反应CO+1/2O 2==CO 2,生成1mol 的CO 2,已知:CO 2的C p.m =38.49J ·K ·mol -1;Δf H m ø(CO 2,298K)=-393.5kJ ·mol -1;Δf H m ø(CO ,298K)=-110.45kJ ·mol -1。
求 (1)298K 时,Δr U m ø,Δr H m ø,Q ,W ;(2)若在绝热恒容反应器中进行,求终态最高温度T 2。
10、计算298 K 下,CO(g)和CH 3OH(g)的标准生成焓,并计算反应CO(g)+2H 2(g)=CH 3OH(g)的标准焓变。
已知如下燃烧焓数据:Δc H m $(298 K)(CH 3OH(g))=-763.9 kJ·mol -1 (1)Δc H m $(298 K)(C(s))=-393.5 kJ·mol -1 (2)Δc H m $(298 K)(H 2(g))=-285.8 kJ·mol -1 (3)Δc H m $(298 K)(CO(g))=-283.0 kJ·mol -1 (4)第三章 热力学第二定律一、选择题1、如图,可表示理想气体卡诺循环的示意图是: ( )(A) 图⑴(B)图⑵(C)图⑶(D) 图⑷2、工作在393K和293K的两个大热源间的卡诺热机,其效率约为()(A) 83%(B) 25%(C) 100%(D) 20%3、不可逆循环过程中,体系的熵变值()(A) 大于零(B) 小于零(C)等于零(D)不能确定4、将1 mol 甲苯在101.325 kPa,110 ℃(正常沸点)下与110 ℃的热源接触,使它向真空容器中汽化,完全变成101.325 kPa 下的蒸气。