实验二 热重-差热分析法
- 格式:doc
- 大小:161.00 KB
- 文档页数:4

热分析实验报告(二)引言概述:本文旨在对热分析实验进行详细的报告,旨在介绍实验的目的、方法、结果和讨论。
通过热分析实验,我们可以了解样品的热性能以及固态化学反应的热效应。
本次实验采用差示扫描量热法(DSC)和热重分析法(TGA)来分析样品的热性质和热分解行为。
正文:1. 实验目的1.1 熟悉差示扫描量热法和热重分析法的原理和操作方法1.2 分析样品的热性能,探究可能的相变和热效应1.3 研究样品的热分解行为,了解其稳定性和热稳定性2. 实验方法2.1 样品的制备和处理2.1.1 样品的选择和准备2.1.2 样品的称量和粉碎2.1.3 样品的处理和预处理2.2 差示扫描量热法(DSC)的操作步骤2.2.1 DSC仪器的准备和参数设置2.2.2 样品的装填和测量2.2.3 实验过程的记录和数据处理2.3 热重分析法(TGA)的操作步骤2.3.1 TGA仪器的准备和参数设置 2.3.2 样品的装填和测量2.3.3 实验过程的记录和数据处理3. 实验结果3.1 DSC曲线分析结果3.1.1 样品在升温过程中的热峰分析 3.1.2 样品在降温过程中的热峰分析 3.2 TGA曲线分析结果3.2.1 样品的失重过程分析3.2.2 样品的热分解过程分析3.3 结果的数值分析和对比4. 讨论4.1 样品的热性能分析4.1.1 样品的相变行为和热效应4.1.2 样品的热容量和热传导性能 4.2 样品的热分解行为分析4.2.1 样品的失重过程的解释和分析 4.2.2 样品的热分解动力学分析4.3 结果与理论的对比和讨论5. 结论5.1 通过DSC和TGA分析,我们获得了样品的热性能和热分解行为的有用信息5.2 样品的相变行为和热效应与其化学成分和结构密切相关5.3 样品的热分解行为显示了其热稳定性和可能的降解途径5.4 本实验为今后的相关研究和工业应用提供了有价值的参考依据总结:本文对热分析实验进行了详细的报告,介绍了实验的目的、方法、结果以及讨论。

综合热分析法测定草酸钙【实验目的】(1)掌握热重-差热分析原理和ZCT-A型综合热分析仪的操作方法,了解其应用范围。
(2)对草酸钙进行热重及差热分析,测量化学分解反应过程中的分解温度。
(3)测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。
【实验原理】热分析是物理化学分析的基本方法之一。
综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。
热分析技术种类很多,比较常用的方法有(1)差热法(DTA),(2)热重法(TG)[包括微分热重(DTG)],(3)差示扫描量热法(DSC)。
(1)热重分析热重分析是在程序控制温度下,测量物质质量与温度关系的一种技术。
热重法实验得到的曲线称为热重(TG)曲线。
TG曲线以温度作横坐标,以试样的失重作纵坐标,显示试样的绝对质量随温度的恒定升高而发生的一系列变化。
这些变化表征了试样在不同温度范围内发生的挥发组分的挥发,以及在不同温度范围内发生的分解产物的挥发。
如图1、图2 CaC2O4·H2O的热重曲线,有三个非常明显的失重阶段。
第一个阶段表示水分子的失去,第二个阶段表示CaC2O4分解为CaCO3,第三个阶段表示CaCO3分解为CaO。
当然,CaC2O4·H2O的热失重比较典型,在实际上许多物质的热重曲线很可能是无法如次明了地区分为各个阶段的,甚至会成为一条连续变化地曲线。
这时,测定曲线在各个温度范围内的变化速率就显得格外重要,它是热重曲线的一阶导数,称为微分热重曲线[图1也现示出了CaC2O4·H2O的微分热重曲线(DTG)]。
微分热重曲线能很好地显示这些速率地变化。
图1 CaC2O4·H2O的TG-DSC曲线(文献图)图2 CaC2O4·H2O的TG曲线(文献图)(2)差热分析(DTA)和差示扫描量热分析(DSC)差热分析(DTA)是在试样与参比物处于控制速率下进行加热或冷却地环境中,在相同地温度条件时,记录两者之间地温度差随时间或温度地变化。
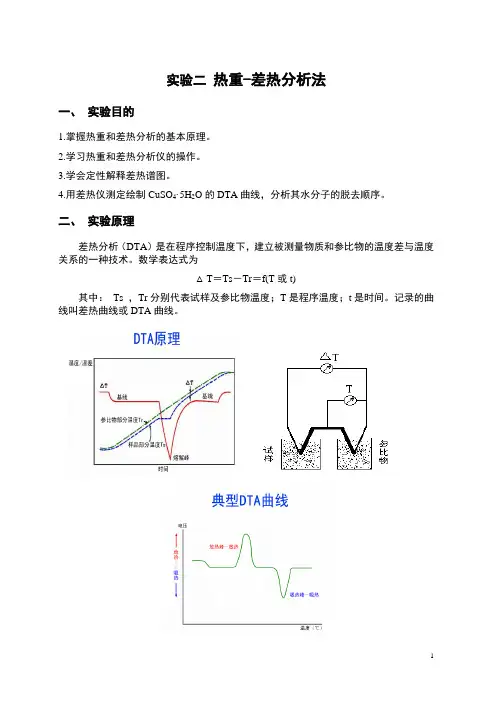
实验二热重-差热分析法一、实验目的1.掌握热重和差热分析的基本原理。
2.学习热重和差热分析仪的操作。
3.学会定性解释差热谱图。
4.用差热仪测定绘制CuSO4·5H2O的DTA曲线,分析其水分子的脱去顺序。
二、实验原理差热分析(DTA)是在程序控制温度下,建立被测量物质和参比物的温度差与温度关系的一种技术。
数学表达式为△T=Ts-Tr=f(T或t)其中:Ts ,Tr分别代表试样及参比物温度;T是程序温度;t是时间。
记录的曲线叫差热曲线或DTA曲线。
本实验以α – Al2O3作为参比物质,记录CuSO4·5H2O的DTA曲线,从而考察其失去五分子结晶水的情况。
物质受热时,发生化学变化,质量也就随之改变,测定物质质量的变化也就随之改变,测定物质质量的变化就可研究其变化过程,热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术,热重法实验得到的曲线称为热重曲线(TG曲线)。
三、实验仪器:差热分析仪由加热炉、试样容器、热电偶、温度控制系统及放大、记录系统等部分组成。
四、实验步骤:1.依次开启稳压电源、工作站、气体流量计、主机(开关均在后面)、电脑,打开氮气瓶,使之压力为0.5MP。
2.打开炉子,手动在左右两个陶瓷杆放入铝坩埚容器,关好炉子,在操作界面上调零,仪器自动扣除了空坩埚的重量。
3.打开炉子取出样品坩埚容器将约5-10mg的样品研成粉末放入铝坩埚容器。
4.打开软件TA-60WS Collection Monitor 点击measure,出现measure parameter,在这里我们可以设置所需要的程序温度,然后点击Start,要我们文件保存在哪里。
5.单击Start。
6.仪器测定结束。
四、结果处理1.仪器结束后,打开软件TA60,找到要保存的结果文件。
2.依次找到重量线,热线,程序升温线。
3.首先从热线中分析出样品的吸热峰和放热峰。
从重量线上分析出样品重量的损失(单击重量线,点击Analysis,出现Weigh loss,然后分析)。

一、实验目的1. 了解热分析的基本原理和方法;2. 掌握热重分析(TG)和差热分析(DTA)的操作方法;3. 通过实验,分析样品的热性质变化,并探讨其与物质结构、组成的关系。
二、实验原理热分析是一种基于物质在加热或冷却过程中物理性质和化学性质变化的测试方法。
主要方法包括热重分析(TG)、差热分析(DTA)、差示扫描量热法(DSC)等。
本实验主要涉及TG和DTA两种方法。
1. 热重分析(TG):在程序控制温度下,测量物质的质量与温度或时间的关系。
通过TG曲线,可以分析样品的热稳定性、分解温度、相变温度等热性质。
2. 差热分析(DTA):在程序控制温度下,比较样品与参比物的温度差。
当样品发生相变、分解等热效应时,其温度差会发生变化,从而得到DTA曲线。
三、实验器材1. 热重分析仪2. 差热分析仪3. 样品支架4. 样品5. 计算机及数据采集软件四、实验操作步骤1. 样品准备:将样品研磨成粉末,过筛,取适量放入样品支架。
2. 热重分析(TG)实验:a. 打开热重分析仪,预热至设定温度;b. 将样品支架放入炉内,设置加热程序;c. 记录样品质量随温度的变化曲线。
3. 差热分析(DTA)实验:a. 打开差热分析仪,预热至设定温度;b. 将样品支架放入炉内,设置加热程序;c. 同时记录样品与参比物的温度差随时间的变化曲线。
4. 数据处理与分析:将实验数据导入计算机,使用数据采集软件进行曲线拟合、峰面积计算等分析。
五、实验结果与分析1. 热重分析(TG)结果:通过TG曲线,可以看出样品在加热过程中质量的变化。
分析样品的分解温度、相变温度等热性质。
2. 差热分析(DTA)结果:通过DTA曲线,可以看出样品在加热过程中温度差的变化。
分析样品的相变温度、分解温度等热性质。
3. 结果比较:对比TG和DTA结果,分析样品的热性质变化,探讨其与物质结构、组成的关系。
六、实验结论通过本次实验,我们掌握了热重分析(TG)和差热分析(DTA)的操作方法,分析了样品的热性质变化,并探讨了其与物质结构、组成的关系。




实验二差热分析一、实验目的1、了解差热分析的原理和差热分析仪的构造,学会操作技术。
2、了解差热分析的基本原理,测定试样结晶度。
3、掌握差热分析仪的使用方法;了解影响差热分析的因素。
二、实验原理:许多物质在加热或冷却过程中,当达到某一温度时,往往会发生熔化、凝固、晶型转化、分解、化合、吸附、脱附等物理或化学变化。
在发生这些变化时伴有焓变,因而产生热效应。
如果我们事先选定一种在温度变化的整个过程中都不会发生任何物理或化学变化,因而没有任何热效应的物质做为参比物,并将它与样品一起置入一个按规定速度逐步升温或降温的电炉中,则当试样发生物理或化学变化时,试样与参比物之间将出现温度差,记录样品及参比物的温度,就可以得到一张差热图。
于是在加热或冷却过程中试样发生的各种物理或化学变化在差热图上都能一一反应出来。
图1是一张理想的差热图。
在差热图中有两条曲线,一条是温度线,它表明温度随时间的变化,一条是差热线,它表明样品与参比物间温度差随时间的变化。
差热线与时间轴平行的线段ab、degh称为基线。
图中bcd和efg为二个差热峰。
它们的方向相反,说明一个是吸热峰、一个是放热峰。
正确判断吸热峰还是放热峰与使用的仪器有关。
差热峰的数目、位置、方向、高度、宽度、对称性和峰面积是我们进行分析的依据。
峰的数目代表在测温范围试样发生物理或化学变化的次数。
峰的位置标志着样品发生变化的温度范围。
峰的方向表明了热效应的正负性。
峰面积则反映热效应的大小。
差热峰有三个转折点:b为峰的起点,c为峰的顶点,d为峰的终点。
我们可以在温度线上找到这三个点的相应温度Tb、TC和Td。
Tb大体上代表了开始起变化的温度,因此常用Tb表征峰的位置。
对于很尖锐的峰也常用TC表示峰的位置。
在实际测定中由于种种原因,差热线的基线往往不与时间轴平行,峰前后的基线也不在一条直线上,差热峰也可能较平坦,因此b、c、d三个转折点不明显,此时,我们可以用作切线的方法来确定转折点温度,如图16-3所示。



差热-热重分析法测定硫酸铜的热分析图谱一、实验目的1.了解差热分析法、热重分析法的基本原理。
2.了解差热热重同步热分析仪的基本构造并掌握使用方法。
3.正确控制实验条件,并学会对热分析谱图进行定性分析和定量处理。
二、实验原理1.差热分析法(Differential Thermal Analysis,DTA)差热分析是在程序控制温度下,测量试样与参比物(一种在测量温度范围内不发生任何热效应的物质)之间的温度差与温度关系的一种技术。
许多物质在加热或冷却过程中会发生熔化、凝固、晶型转变、吸附、脱附等物理转变及分解、化合、氧化还原等化学反应。
这些变化在微观上必将伴随体系焓的改变,从而产生热效应,在宏观上表现为该物质与外界环境之间有温度差。
选择一种对热稳定的物质作为参比物,将其与试样一起置于可按设定速率升温的热分析仪中,分别记录参比物的温度以及试样与参比物间的温度差。
以温差对温度作图就可以得到差热分析曲线,简称DTA曲线。
2. 热重法(Thermogravimetry,TG)热重法是在程序控制温度下,测量物质的质量变化与温度关系的一种技术,其基本原理是热天平。
热天平分为零位法和变位法两种。
变位法,就是根据天平梁的倾斜度与质量变化呈比例的关系,用差动变压器等检知倾斜度,并自动记录。
零位法,是采用差动变压器法、光学法或电触点法测定天平梁的倾斜度,并用螺线管线圈对安装在天平系统中的永久磁铁施加力,使天平梁的倾斜复原。
由于对永久磁铁所施加的力与质量变化呈比例,这个力又与流过螺线管的电流呈比例,因此只要测量并记录电流,便可得到质量变化的曲线,以质量对温度作图就可以得到热重曲线,简称TG曲线。
三、实验用品1.仪器日本SHIMADZU DTG-60差热-热重同步热分析仪(TA-60工作站),镊子,坩埚,研钵。
2.药品参比物:α-AL2O3(A.R,原装进口)试样:CuSO4·5H2O(A.R)四、操作步骤1、熟悉差热-热重同步热分析仪的组成及相应旋钮的作用。
热分析法一、实验目的1. 理解热分析方法的基本原理;2. 了解热分析仪的构造和基本操作。
二、基本原理热分析可以分为热机械、差热和热重三大类。
(1)热机械法包括热机械分析(TMA)与动态热机械分析(DMA),测量材料的膨胀、刚性、阻尼等机械特性与温度、负载和时间的函数关系。
德国耐驰仪器公司另提供专用的热膨胀仪,测量材料在热处理过程中的膨胀或收缩情况,研究软化温度、烧结过程等。
热分析法是在程序控制温度下,精确记录待测物质理化性质与温度的关系,研究其受热过程所发生的晶型转变、熔融、升发、吸附等物理变化和脱水、热分解、氧化、还原等化学变化,用以对该物质进行物理常数、熔点和沸点的确定以及作为鉴别和纯度检查的方法。
(2)差热分析(DSC、DTA)测量材料在线性升降温或恒温条件下由于物理变化(相变、熔融、结晶等)或化学反应(氧化、分解、脱水等)而导致的热焓变化(吸热过程、放热过程)或比热变化。
(3)热重分析(TGA)则是测量上述过程中材料发生的重量变化。
若与差热分析联用则称为同步热分析。
热重法是在程序控制温度下,测量物质重量与温度关系的一种技术。
记录的重量变化对温度的关系曲线即热重曲线。
热重曲线的纵坐标为重量(m),横坐标为温度(T)或时间(t)。
重量基本不变的区段称为平台。
由测量曲线上平台之间的重量差值,可计算出待测物在相应温度范围内所失重量的比例(%)。
本法适用于药物结晶水的测定和贵重药物或在空气中极易氧化药物的干燥失重分析。
三、系统构成1. 主机:珀金埃尔默Diamond TG/DTA热重差热同步分析仪2. 操作控制系统:DELL电脑和Muse软件3. 打印机:HP打印机四、实验步骤1. 系统开机准备(1)接通电源,启动电脑(2)打开氮气钢瓶的阀门(3)打开热重差热同步分析仪主机电源2. 操作步骤(1)运行Muse软件(2)输入样品名称、注释及操作者姓名(3)将装有参比物的坩埚及空坩埚放到热天平上,待稳定后,清零。
差热与热重分析作为常见的物料分析技术,对于物料的热稳定性、热分解过程等方面提供了重要的信息。
本文将从差热与热重分析技术的基本原理、实验流程与数据分析、应用前景等方面进行详细讲解。
一、差热与热重分析的原理差热与热重分析是通过对物料样品升温过程中在不同温度下的热变化进行量化分析,来研究物料稳定性、热分解特性等方面的技术。
其中,差热分析技术主要是通过测量样品与对比样品在同一温度程序下的热力学参数差异来推断样品的热性质;而热重分析则是通过测量样品在升温过程中的质量变化来分析其热分解过程。
两者均能通过对样品在升温过程中的热变化进行量化来获取物料特性信息。
差热与热重分析的实验步骤主要包括样品制备、实验设计、实验操作、数据处理等环节。
其中,样品制备是最重要的一步,样品的性质与制备方式对于实验结果具有重要影响。
实验设计中,需要确定所要研究的参数,包括升温速率、升温程序、取样方式等;实验操作中,需要关注实验过程中的环境条件(如气氛氧化还原程度)以及实验装置的准备与检测。
在数据处理方面,需要根据实验所得数据进行曲线拟合、峰面积积分、峰温浓度计算等操作,以获取样品的热稳定性、热分解过程等信息。
二、差热与热重分析实验流程与数据处理2.1 差热分析流程差热分析技术所用仪器为热差示仪,其基本原理为:将样品和对比样品同时加热,测量两者热力学参数(如焓值、热流量)的差异,通过计算或绘图等方式展现出来,从而推断样品的热性质。
差热分析的操作流程如下:(1)样品制备样品应选取足量、均匀的样品颗粒,并将其粉碎至样品颗粒粒径<200目的要求,并保证样品在升温过程中的稳定性、均匀性。
(2)实验装置准备差热分析中常用的热差示仪一般包括热源、样品、对比样品、检测系统、温度控制系统等组件。
其中热源为差热分析的核心部件,样品、对比样品应储存在专用样品舱内以保证实验精度。
检测系统可选用红外线探测器等手段,温度控制系统则可用PID或脉冲宽度调制等方式进行温度控制。
差热分析与热重分析计划学时:2学时本实验通过DTA研究物质BaCl2.2H2O在加热过程中所发生的物理化学变化,绘制相应曲线,确定其变化的实质。
【实验目的】(1) 掌握DTA热分析仪的原理和实验技术。
(2) 测量化学分解反应过程中的分解温度。
(3) 测量物质在加热过程中所发生的物理化学变化,绘制相应曲线,从而研究材料的反应过程。
【实验原理】热分析是物理化学分析的基本方法之一。
综合热分析研究物质在加热过程中发生相变或其他物理化学变化时所伴随的能量、质量和体积等一系列的变化,可以确定其变化的实质或鉴定矿物。
DSC和DTA研究物质在加热过程中内部能量变化所引起的吸热或放热效应。
1. 差热分析DTA原理差热分析(Differential Thermal Analysis 简称DTA )是指在程序控制温度下,测量物质和参比物之间的温度差与温度(或时间)关系的一种技术。
用数学式表达为△T= Ts—Tr ( T 或t )式中Ts ,Tr ——分别代表试样及参比物温度;T ——程序温度;t ——时间。
试样和参比物的温度差主要取决于试样的温度变化。
DTA 仪由以下几部分组成:(1) 样品支持器。
(2) 程序控温的炉子。
(3) 记录器。
(4) 检测差热电偶产生的热电势的检测器和测量系统。
(5) 气氛控制系统。
若将呈热稳定的已知物质(即参比物)和试样一起放入一个加热系统中,并以线性程序温度对它们加热。
在试样没有发生吸热或放热变化,且与程序温度间不存在温度滞后时,试样和参比物的温度与线性程序温度是一致的。
即Ts—Tr(△T)为零时,两温度线重合,在△T 曲线上则为一条水平基线。
若试样发生放热变化,由于热量不可能从试样瞬间导出,于是试样温度偏离线性升温线,且向高温方向移动。
而参比物的温度始终与程序温度一致,△T >0,在△T 曲线上是一个向上的放热峰。
反之,在试样发生吸热变化时,由于试样不可能从环境瞬间吸收足够的热量,从而使试样温度低于程序温度。
实验二热重-差热分析法
一、实验目的
1.掌握热重和差热分析的基本原理。
2.学习热重和差热分析仪的操作。
3.学会定性解释差热谱图。
4.用差热仪测定绘制CuSO4·5H2O的DTA曲线,分析其水分子的脱去顺序。
二、实验原理
差热分析(DTA)是在程序控制温度下,建立被测量物质和参比物的温度差与温度关系的一种技术。
数学表达式为
△T=Ts-Tr=f(T或t)
其中:Ts ,Tr分别代表试样及参比物温度;T是程序温度;t是时间。
记录的曲线叫差热曲线或DTA曲线。
本实验以α – Al2O3作为参比物质,记录CuSO4·5H2O的DTA曲线,从而考察其失去五分子结晶水的情况。
物质受热时,发生化学变化,质量也就随之改变,测定物质质量的变化也就随之改变,测定物质质量的变化就可研究其变化过程,
热重法(TG)是在程序控制温度下,测量物质质量与温度关系的一种技术,热重法实验得到的曲线称为热重曲线(TG曲线)。
三、实验仪器:
差热分析仪
由加热炉、试样容器、热电偶、温度控制系统及放大、记录系统等部分组成。
四、实验步骤:
1.依次开启稳压电源、工作站、气体流量计、主机(开关均在后面)、电脑,打开氮气瓶,使之压力为0.5MP。
2.打开炉子,手动在左右两个陶瓷杆放入铝坩埚容器,关好炉子,在操作界面上调零,仪器自动扣除了空坩埚的重量。
3.打开炉子取出样品坩埚容器将约5-10mg的样品研成粉末放入铝坩埚容器。
4.打开软件TA-60WS Collection Monitor 点击measure,出现measure parameter,在这里我们可以设置所需要的程序温度,然后点击Start,要我们文件保存在哪里。
5.单击Start。
6.仪器测定结束。
四、结果处理
1.仪器结束后,打开软件TA60,找到要保存的结果文件。
2.依次找到重量线,热线,程序升温线。
3.首先从热线中分析出样品的吸热峰和放热峰。
从重量线上分析出样品重量的损失(单击重量线,点击Analysis,出现Weigh loss,然后分析)。
五、实验结束
依次关掉主机,工作站,气体流量计,稳压电源,电脑。
关掉氮气瓶
六、实验结果与讨论
结果分析:
由DTA曲线可看出CuSO4·5H2O的失水分成三个过程进行的,由峰面积计算得到所占百分比分别为14.530%,14.313%,7.605%,近似于2:2:1.
由此可得出以下结论:
CuSO4·5H2O的五个结晶水受热脱去水不是一步脱去的,而是分三次脱去,第一次脱去两个结晶水第二次脱去两个结晶水,第三次脱去一个结晶水,即脱水顺序按照2:2:1进行。
七、思考题
2.本实验中用的是锂坩埚来做支撑同时做参比,那么本实验对参比物的要求是什么?
3.答:有良好的热稳定性,在整个试验温度范围内不发生任何物理化学变化,不产生任何热效应。
4. 如何辨明反应是吸热还是放热?为什么加热过程中,即使样品没有发生变化,差热曲线仍然会出现较大的漂移?
5.答:当△T=0时是一条水平线;当样品放热,出现峰曲线;当吸热时,则出现方向相反的峰曲线。
因为差热分析是一种动态技术,同时又涉及到热量传递的测量,故影响因素较多。
而样品粒度大小、导热系数、热容、样品量与装填的紧密度都是影响差热曲线的主要因素,所以即使样品没有发生变化,这些因素也有可能导致曲线变化。