厦门大学617无机化学2019年考研专业课真题答案
- 格式:pdf
- 大小:1.05 MB
- 文档页数:12


2019年无机化学A试卷A答案及评分标准一、单项选择题(30分,每题1分)1、B2、B3、D4、B5、A6、B7、B8、C9、D 10、C11、B 12、A 13、D 14、D 15、C 16、C 17、A 18、B 19、B 20、A21、C 22、C 23、B 24、A 25、C 26、D 27、B 28、A 29、A 30、C二、判断题(10分,每题1分)1、×2、√3、√4、×5、×6、×7、√8、×9、×10、√三、简答题(共计35分)1、(7分)(1分)热稳定性次序Na2CO3>SnCO3>BeCO3>(NH4)2CO3> H2CO3。
(1分)Na+:8电子构型,几乎没有极化能力和变形性。
(1分)Sn2+:18+2电子构型,半径较大,极化能力较强。
(1分)Be2+:2电子构型,半径小,电荷高,极化能力极强。
(1分)NH4+:NH3分子与H+离子结构,极化能力在H+离子基础之上大大减弱,但极化能力仍非常强。
(1分)H+:几乎完全裸露的质子核,半径很小,极化能力极强。
(1分)共价键性质按照Na2CO3<SnCO3<BeCO3<(NH4)2CO3< H2CO3的次序依次增强,因而热稳定性依次减弱。
2、(11分)[Cu(CN)4]2-的配离子构型:平面正四边形(或者正方形)(1分)、杂化方式:dsp2(1分)、磁性:顺磁性(1分)。
[Ni(H2O)6]2+的磁性:顺磁性(1分)、磁矩:2.83 B.M.(1分)、d电子结构:(t2g)6(e g)2(2分)、场强类型:弱场(1分)、自旋类型:高自旋(1分)、CFSE=-1.2∆0(-12Dq) (2分)。
3、(9分)在水中的溶解度大小顺序ZnS>CdS>HgS(1分)。
Hg2+、Cd2+、Zn2+,均为18电子构型,极化能力较强(1分);三种离子半径大小Hg2+>Cd2+>Zn2+,尤其Hg2+半径较大,有较大的变形能力(1分),而S2-具有很强的变形能力(1分);因此产生附加极化作用,且附加极化作用的大小HgS>CdS>ZnS(1分),则共价键成分大小HgS>CdS>ZnS(1分),所以在水中的溶解度大小顺序ZnS>CdS>HgS。

《厦门大学839无机化学历年考研真题及答案解析》15/52Ⅱ历年考研真题试卷答案解析厦门大学2010年招收攻读硕士学位研究生入学考试试题答案解析科目代码:839科目名称:无机化学招生专业:海洋化学考生须知:答案必须使用墨(蓝)色墨水(圆珠)笔;不得在试卷(草稿)纸上作答;凡未按规定作答均不予评阅、判分一、(18分)判断下列说法是否正确?说明理由。
(1)主量子数n 为3时有3s ,3p ,3d ,3f 四条轨道。
【考查重点】:这是原子结构内容,考查主量子数、角量子数等。
【答案解析】:这一说法是错误的,主量子数n 为3时有3s ,3p ,3d 共有9个轨道。
(2)氧原子数的2s 轨道的能量与碳原子的2s 轨道的能量相同。
【考查重点】:这是原子结构内容,考查主量子数、角量子数等。
【答案解析】:这一说法是错误的。
虽然都是2s 轨道,但是由于不同原子原子核中质子数是不相同的,核外电子也不相同,因此氧原子和碳原子的2s 轨道能量是不同的。
(3)中心原子的几个原子轨道杂化时,必形成数目的杂化轨道。
【考查重点】:这是分子结构的内容,考查杂化轨道理论。
【答案解析】:这一说法是正确的。
形成的杂化轨道数与参与杂化的原子轨道数目是一样的。
(4)在某温度下,密闭容器中反应222(g)+O (g)2(g)NO NO 达到平衡,当保持温度和体积不变充入惰性气体时,总压将增加,平衡向气体分子数减少即生成2NO 的方向移动。
【考查重点】:这是化学平衡内容,考查加入惰性气体对平衡移动的影响。
【答案解析】:这一说法是错误的。
T 、V 一定时,充入惰性气体,由于体积不变,反应体系中的物质。
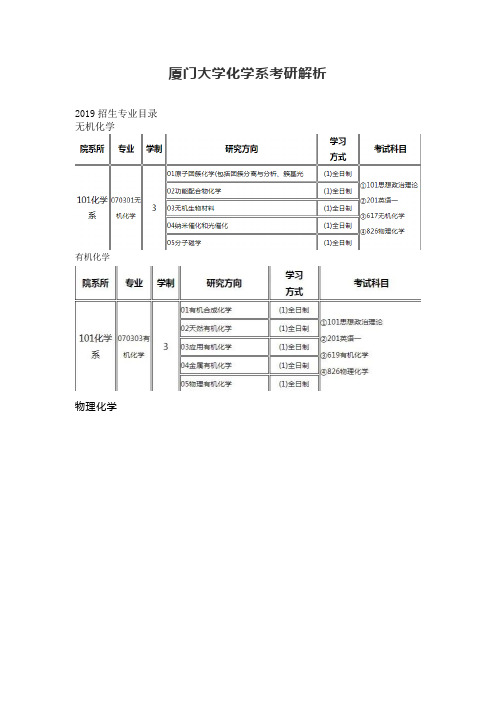
厦门大学化学系考研解析
2019招生专业目录
无机化学
有机化学
物理化学
高分子化学与物理
纳米材料化学
化学生物学
分析化学
招生计划
历年报录比
考试范围
参考2019化学系考试范围
617无机化学:化学原理与无机元素化学
619有机化学:有机化合物的命名、结构与性质、有机化合物的结构分析、有机合成826物理化学:热力学定律(含多组分体系,电化学热力学),化学反应和平衡(含热化学、化学平衡和相平衡),化学动力学(含电化学动力学),胶体与界面
827分析化学(含仪器分析):酸碱反应、沉淀反应、络合反应、氧化还原反应、分子光谱、原子光谱、红外光谱、核磁共振、质谱、色谱、电化学分析、数据分析。

厦门大学2016年招收攻读硕士学位研究生入学考试试题科目代码:617科目名称:基础化学招生专业:化学化工学院、材料科学与工程系、公共卫生学院、药学院各相关专业考生须知:答题必须使用黑(蓝)色墨水(圆珠)笔:不得直接在试题(草稿)纸上作答;凡未按规定作答均不予评阅、判分;责任考生自负。
一、单项选择题(共35题,每题2分,共70分)1.下列关于O22-和O2-的性质的说法中,不正确的是()(A)两种离子都比O2分子稳定性小(B)O22-的键长比O2-键长短(C)O22-是反磁性的,而O2-是顺磁性的(D)O2-的键能比O22-键能大2.多电子原子的能量E由()决定的(A)主量子数n (B)n,l (C)n,m,l (D)l3.在容积可变的密闭容器中通入体积比为2:3的气体A和气体B,在一定条件下发生如下反应:A+3B⇌2C(A、B、C均为气体)当反应达到平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是()A.5:6 B.5:4 C.5:3 D.5:24.0.01mol氯化铬(CrCl3.6H2O)在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为()(A){Cr(H2O)6}Cl3 (B){Cr(H2O)5Cl}Cl2.H2O(C){Cr(H2O)4Cl2}Cl.2H2O (D){Cr(H2O)3Cl3}.3H2O5.根据酸碱的溶剂理论,在液态 SO2体系中的碱是…………………………………()(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl36.在某温度下反应 A + B = C + D Δ H < 0 ,达到平衡后再升高温度,平衡将逆向移动的原因是()A、υ (正) 减小,υ (逆) 增大B、k (正) 减小,k (逆) 增大C、υ (正) 和υ (逆) 都减小D、υ (正) 增加的倍数小于υ (逆) 增加的倍数7.已知 298 K 时反应 H 2O ( l ) →H 2 (g )+21O 2 (g) 的平衡常数 K Θ=2.86×10-42 , 在此温度下H 2O ( l ) 的饱和蒸气压为3.17 kPa ,则反应H 2O (g) HH 2 (g )+21O 2 (g) 在相同温度下的平衡常数 K Θ与下列数据最接近的是 ( )A 、7.0×10-44B 、9.1×10-41C 、4.5×10-42D 、6.8×10-438. 为了防止海轮船体的腐蚀,可在船壳水线以下位置嵌上一定数量的 ( )(A)铜块 (B)铅块 (C)锌块 (D)钠块9.{Ca (EDTA)}2-配离子中,Ca 2+的配位数是 ( )(A)1 (B)2 (C)4 (D)610.在下列碱金属电对M +/ M 中,ϕΘ最小的是 ( )A 、Li +/ LiB 、Na +/ NaC 、K +/ KD 、Rb +/ Rb11..若空气中水蒸气压高于同温度下某种盐浓溶液的蒸气压,则该盐会 ( )A 、风化B 、潮解C 、升华D 、溶解12.CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为 3.0mol.L -1的溶液中Ca 2+可能的最高浓度是A,1.8x10-9mol.L -1CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为3.0mol.L -1的溶液中Ca 2+可能的最高浓度是 ( )A,1.8x10-9mol.L -1 , B,1.8x10-10mol.L -1C,5.9x10-10mol.L -1 D,5.9x10-9mol.L -113. 298 K 下,H 2(g) +21O 2(g) =H 2O(g) m f H ∆= -242 kJ ·mol -1,当温度升高了100 K ,则反应的 m r S ∆值应为…………………………………………………………………… ( )(A) 比升温前大 (B) 比升温前小(C) 和升温前近似 (D) 不变14.叠氮酸的结构是 N 1—N 2—N 3,1、2、3号氮原子采用的杂化类型分别为( )。

北京市联合命题2019年硕士学位研究生入学考试试题(无机化学)√需使用计算器 □不使用计算器一、选择题(每小题 2分,共 30 分)1. 在室温和标准态时,下列反应均为非自发反应,在高温时仍为非自发的是 。
A .Ag 2O(s)→2Ag(s)+21O 2(g);B .N 2O 4(g)→2NO 2(g);C .Fe 2O 3(s)+23C(s)→2Fe(S)+23CO 2(g);D .6C(s)+6H 2O(g)→C 6H 12O 6(s)。
2. 以下列化学式表示的物质的溶度积都相同,其溶解度最大的是 。
A . MX ;B . M 3X ;C . M 2X ;D . MX 2。
3. 常温下,在50ml 0.1 mol/L HAc 溶液中加入等体积的水稀释,对稀释后的水溶液而言,下列叙述正确的是 (已知25o C 时,HAc 的解离常数为1.8×10-5)。
A .HAc 的解离度α增大,溶液pH 值增大;B .HAc 的解离度α减小,溶液pH 值减小;C .HAc 的解离度α增大,溶液pH 值减小;D .HAc 的解离度α增大,HAc 的解离常数增大。
4. NH 3分子和NF 3分子相应键角大小关系正确的是 。
A. ∠HNH >∠FNF ;B. ∠HNH < ∠FNF ;C. ∠HNH =∠FNF ;D. 不能确定。
5. 二氧化铅具有强氧化性的原因是。
A. Pb4+的有效核电荷大;B. Pb2+易形成配离子;C. Pb原子含有惰性电子对;D. Pb2+盐难溶于水。
6.若将N原子的排布式写为1s2,2s2,2p2x ,2p1y,则其违背了。
A.最低能量原理;B.洪特规则;C.泡利不相容原理;D.能量守恒原则。
7. 在实验室中,如何存放白磷。
A. 放在水中;B. 放在CS2中;C. 放在棕色玻璃瓶中;D. 放在棕色塑料瓶中。
8. 下列各电对中,标准电极电势值最大的是。
A.φ ([Ag(CN)2]-/Ag);B.φ ([Ag(NH3)2]+/Ag);C.φ ([Ag(S2O3)2]3-/Ag);D.φ (Ag+/Ag)。
厦门大学2018年招收攻读硕士研究生入学考试试题科目代码:617科目名称:无机化学一、选择题1、下列稀土元素中,能形成氧化数为+2的是:()A.CeB.PrC.TbD.Yb2、下列说法正确的是:()A. B.C.N.O四种元素第一电离能最大的是OB. F.Cl.Br.I四种元素第一亲和能最大的是FC. Fe.CO.Ni.Cu四种元素院子半径最大的是FeD. 与同族的Na相比,Li的原子半径更接近Mg3、下面氧化还原电对的电极电势不随酸度变化的是:()A.NO3--HNO2B.SO4--H2SO3C.Fe(OH)3-Fe(OH)2D.MnO4--MnO42-4、下列离子氧化性最强的是:()A.[CoF6]3-B.[Co(NH3)3]3+C.[Co(CN)6]3-D.Co3+5、BF3通入过量Na2CO3中,得产物:A.HF和H3BO3B.HBF4和B(OH)3C.NaBF4和NaB(OH)4D.HF和B2O36、下列说法错误的是:()A.I2的CCl4溶液中溶质和溶剂分子间只有色散力B.酒精的水溶液中溶质和溶剂分子间三种范德华力和氢键都存在C.CO.HBr.H2O化合物,在各自分子间作用力分布中,取向力最大的是H2OD.CH3Cl的CCl4溶液中溶质和溶剂分子间三种范德华力都存在7、已知4NH3(g)+5O2(g)=4NO(g)+6H2O(l),△rH m=-1170kJ.mol-14NH3+3O2(g)=2N2(g)+6H2O(l),△rH m=-1530kJ.mol-1则NO标准摩尔生成焓为:()A.360 kJ.mol-1B.180 kJ.mol-1C.90 kJ.mol-1D.-180 kJ.mol-18、气相NO2三聚反应的速率定律-d[NO2]/dt=k[NO2]2,会使速率常数发生变化的条件是:()A.将体系总压力加倍B.在反应混合物中加O2气C.反应混合物中加过量NO2D.在CCl4溶液中进行反应9、将K2MnO4转变为KMnO4,以下方法产率高、质量好的是:()A.CO2通入K2MnO4溶液B.用Cl2氧化K2MnO4溶液C.电解氧化K2MnO4溶液D.用HAc酸化K2MnO4溶液10、氢原子电离能为13.6eV,Li2+的电离能为:()。