医疗器械生产企业质量体系考核检查表doc-上
- 格式:doc
- 大小:72.50 KB
- 文档页数:11



医疗器械生产企业质量体系考核检查表上1. 考核背景医疗器械是在医疗保健过程中使用的各种设备、仪器、材料等,其质量直接关系到人们的健康和生命安全。
为了确保医疗器械的质量和安全性,规范的生产企业质量体系是必不可少的。
医疗器械生产企业质量体系考核检查表是一种制度化、标准化的工具,用于评估医疗器械生产企业的质量管理体系是否符合相关法律法规和标准要求。
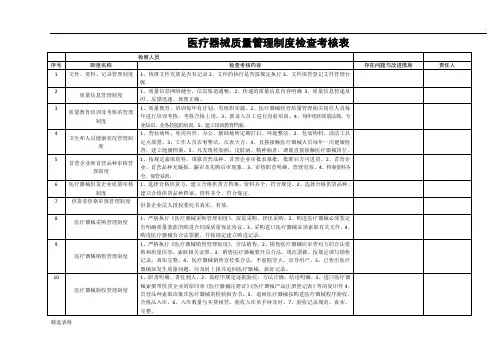
2. 考核内容医疗器械生产企业质量体系考核检查表通常包括以下内容:2.1 企业基本信息企业名称、注册地址、联系方式等基本信息的填写。
2.2 质量管理文件医疗器械生产企业需要制定一系列质量管理文件,如质量手册、程序文件、规范文件等。
检查表会要求企业提供这些文件,并通过审核确认其合规性和有效性。
2.3 质量管理体系文件控制质量管理体系文件的控制主要包括文件的版本控制、变更控制、存档等。
检查表会对企业的文件控制过程进行检查,以确保文件的完整性和可追溯性。
2.4 来料检验检查表会关注企业的来料检验程序和方法,以及供应商质量管理的情况。
来料检验是保证生产过程中使用的原材料和零部件符合要求的重要环节。
2.5 生产过程控制医疗器械生产过程需要进行严格的控制,包括工艺流程控制、设备管理、操作规程等。
检查表会对这些控制措施进行检查,以确保生产过程的可控性和稳定性。
2.6 产品质量控制产品质量控制是医疗器械质量体系的核心,检查表会关注产品质量控制的各个环节,包括检验和测试方法、设备校准、产品标识和追溯等。
2.7 防止非合格品出厂控制医疗器械生产企业需要制定合适的控制措施,以防止非合格品出厂。
检查表会对企业的防止非合格品出厂的控制措施进行检查,并评估其有效性。
2.8 安全事故调查和处理医疗器械生产企业需要建立健全的安全事故调查和处理机制,以及记录和报告机制。
检查表会对企业的安全事故调查和处理情况进行检查,以确保企业能够及时处理事故并采取措施防止再次发生。
3. 检查流程医疗器械生产企业质量体系考核检查一般按照以下流程进行:3.1 企业申请企业向质量监督部门申请质量体系考核,并提交相关资料。

医疗器械生产企业质量体系考核表一、前言医疗器械的质量直接关系到患者的生命健康,因此医疗器械生产企业必须建立和完善有效的质量体系,以确保产品的安全、有效和质量可控。
质量体系考核是对医疗器械生产企业质量管理水平的全面评估,是保障医疗器械质量的重要手段之一。
二、考核目的通过对医疗器械生产企业质量体系的考核,评估企业是否符合相关法规、标准和规范的要求,是否具备持续稳定生产符合质量要求的医疗器械的能力,促进企业不断完善质量管理体系,提高产品质量,保障公众用械安全。
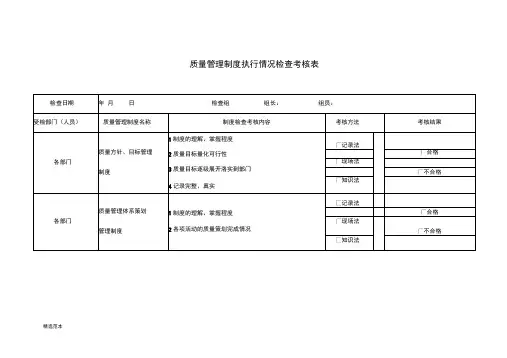
三、考核依据1、《医疗器械监督管理条例》2、《医疗器械生产监督管理办法》3、《医疗器械生产质量管理规范》及相关附录4、相关医疗器械产品注册技术要求和标准四、考核内容(一)机构与人员1、企业是否建立了与生产规模和产品相适应的质量管理机构,明确了各部门和人员的职责和权限。
2、企业负责人是否熟悉医疗器械相关法律法规,对质量工作是否重视。
3、生产、质量、技术等关键岗位人员是否具备相应的专业知识和技能,是否经过培训和考核。
(二)厂房与设施1、生产场地是否整洁、卫生,布局是否合理,是否符合生产工艺和产品要求。
2、厂房是否有足够的空间和设施,满足生产、检验、储存等要求。
3、洁净室(区)的设置、环境控制是否符合规定,是否定期进行监测和维护。
(三)设备1、生产设备是否与生产规模和产品相适应,是否能够正常运行和维护。
2、检验设备是否齐全、准确,是否经过校准和验证。
3、设备的使用、清洁、维护和维修是否有明确的操作规程,并得到有效执行。
(四)文件管理1、是否建立了完善的文件管理体系,包括质量手册、程序文件、作业指导书、记录等。
2、文件的制定、审核、批准、发放、使用、更改、回收和销毁是否符合规定。
3、记录是否真实、完整、准确,可追溯。
(五)设计开发1、是否进行了有效的产品设计开发策划,是否明确了设计开发的输入、输出、评审、验证、确认等环节。
2、设计开发过程中是否进行了风险管理,是否对风险进行了识别、评估和控制。

委托方对受托方医疗器械生产企业质量体系审核检查表(委托生产)
委托企业名称:受托企业名称:
审核地点:委托地址:
产品名称:产品类别:
质量体系审核记录:
注:(1)“相应条款”指《医疗器械生产企业质量体系考核办法》中规定的考核项目的条款。
(2)“重点考核项目”应全部合格。
其它考核项目,不符合项不能超过五项。
(3)委托生产可根据实际情况必要时可对受托方的质量体系进行现场核查,核查委托方的对受托方质量管理体系审查记录的真实性和有效性。
考核人员签字:职务:是否经过ISO13485培训年月日
11。

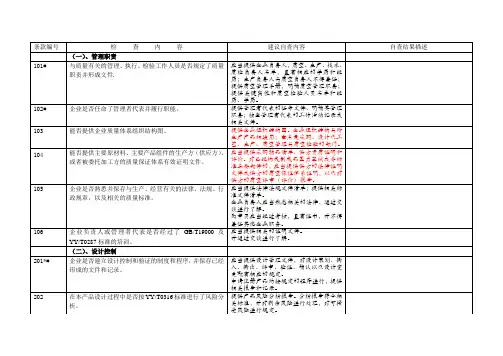
医疗器械质量管理体系考核自查表
为了帮助我市医疗器械生产企业切实开展质量管理体系的内部审核工作,促进企业质量管理的水平不断提高,依据《医疗器械生产企业质量体系考核办法》(局令第22号)及质量管理体系的相关标准制定了本自查表,以供相关生产企业参考使用。
注:
1.本申请表仅供企业申请质量管理体系考核前自查使用,且申报体系考核时无需提交,但可作为现场考核的参考资料。
2.企业应根据申请考核产品的特点和体系运行的情况,切实开展自查工作,并落实改正自查中发现的问题。
3.本自查表中的“检查项目”对应22号令中自查表的项目;“建议自查项目及内容”为建议的自查项目、内容及具体要求,但是并不局限于此。
4.“▲”、“■”对应《医疗器械生产企业质量体系考核办法》(局令第22号)中的重点考核项目。
企业基本情况
医疗器械生产企业质量管理体系考核自查表。
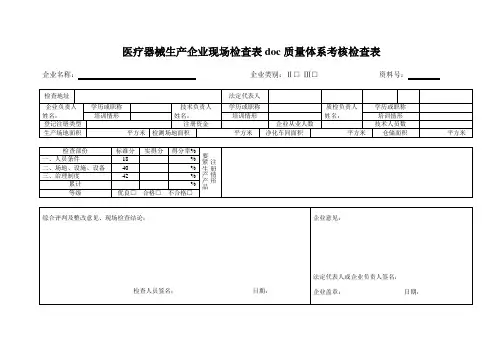
医疗器械生产企业现场检查表doc质量体系考核检查表
企业名称:企业类别:Ⅱ□Ⅲ□资料号:
说明
一、依照《医疗器械监督治理条例》、《医疗器械生产监督治理方法》制定本检查表,本检查表适用于医疗器械生产企业许可证现场检查。
二、医疗器械生产企业的变更及生产企业许可证证后监督可参照本检查表。
三、综合评判分为优良、合格、不合格三种,总分为100分;优良:90~100分,合格:80~89分,不合格:79分以下(含79分)。
四、评判内容分为三部分:人员条件18分;场地、设施、设备40分;治理制度42分。
各部分得分率均应达到80%以上(含80%)。
五、综合评判优良、合格为“现场检查通过”;综合评判不合格为“现场检查不予通过”。
六、得分部分要说明理由或提供证明材料,扣分部分应写明缘故。
七、此表一式二份,一份存档,一份交企业所在区(县)药监分局。
(一)人员条件:18分该项得分得分率
注:”人员要求”的得分为本表的总分乘以评分系数;
评分系数:二类常规产品-1.0;二类无菌(或医用电器)产品-0.75;三类常规产品-0.6; 三类无菌(或医用电器)产品-0.5。
(二)场地、设施和设备:40分该项得分得分率%
注:无菌医疗器械的“场地、设施和设备要求”得分以总分乘评分系数0.5。
治理制度:42分该项得分得分率%
检查人员(签名):____________________________ 企业负责人(签名):年月日。

医疗器械质量管理体系考核自查表
为了帮助我市医疗器械生产企业切实开展质量管理体系的内部审核工作,促进企业质量管理的水平不断提高,依据《医疗器械生产企业质量体系考核办法》(局令第22号)及质量管理体系的相关标准制定了本自查表,以供相关生产企业参考使用。
注:
1.本申请表仅供企业申请质量管理体系考核前自查使用,且申报体系考核时无需提交,但可作为现场考核的参考资料。
2.企业应根据申请考核产品的特点和体系运行的情况,切实开展自查工作,并落实改正自查中发现的问题。
3.本自查表中的“检查项目”对应22号令中自查表的项目;“建议自查项目及内容”为建议的自查项目、内容及具体要求,但是并不局限于此。
4.“▲”、“■”对应《医疗器械生产企业质量体系考核办法》(局令第22号)中的重点考核项目。
企业基本情况。
医疗器械生产企业质量体系考核检查表doc-上
医疗器械生产企业质量体系考核检查表(委托加工)
质量体系考核策划:
企业名称:委托企业名称:
考核地点:委托地址:
产品名称:产品类别:
贯彻GB9706.1产品()一次性使用产品()植入性医疗器械()
产品主要性能指标和安全性能指标
必须具备的测试仪器或装置
质量体系考核记录:
注:(1)“相应条款”指《医疗器械生产企业质量体系考核办法》中规定的考核项目的条款。
(2)“重点考核项目”应全部合格。
其它考核项目,不符合项不能超过五项。
(3)委托加工可根据实际情况必要时可对受托方的质量体系进行现场核查,核查委托方的对受托方质量管理体系审查记录的真实性和有效性。
考核人员签字:年月日。