11-第十一章-酚和醌-中文-2013
- 格式:ppt
- 大小:5.95 MB
- 文档页数:59



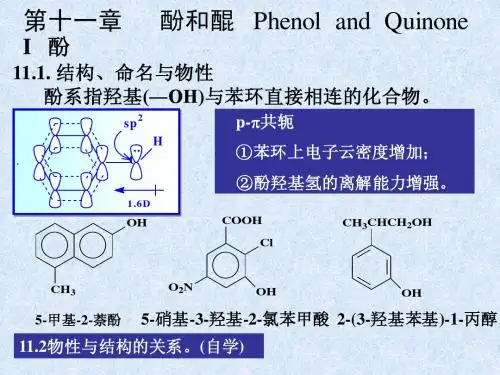

(一) 酚一.酚的分类和命名根据羟基所连芳环的不同,酚类可分为苯酚、萘酚、蒽酚等。
根据羟基的数目,酚类又可分为一元酚、二元酚和多元酚等。
酚的命名是根据羟基所连芳环的名称叫做“某酚”,芳环上的烷基、烷氧基、卤原子、氨基、硝基等作为取代基,若芳环上连有羧基、磺酸基、羰基、氰基等,则酚羟基作为取代基。
例如:1-萘酚 或 α-萘酚 苯酚(石炭酸) 4-乙基苯酚 5-甲氧基-2-溴苯酚2,4,6-三硝基苯酚 3-甲基-4-羟基苯磺酸 1,3,5-苯三酚 1,2,3-苯三酚 (苦味酸) (均苯三酚) (连苯三酚)二.酚的物理性质常温下,除了少数烷基酚为液体外,大多数酚为固体。
由于分子间可以形成氢键,因此酚的沸点都很高。
邻位上有氟、羟基或硝基的酚,分子内可形成氢键,但分子间不能发生缔合,它们的沸点低于其间位和对位异构体。
纯净的酚是无色固体,但因容易被空气中的氧氧化,常含有有色杂质。
酚在常温下微溶于水,加热则溶解度增加。
随着羟基数目增多,酚在水中的溶解度增大。
酚能溶于乙醇、乙醚、苯等有机溶剂。
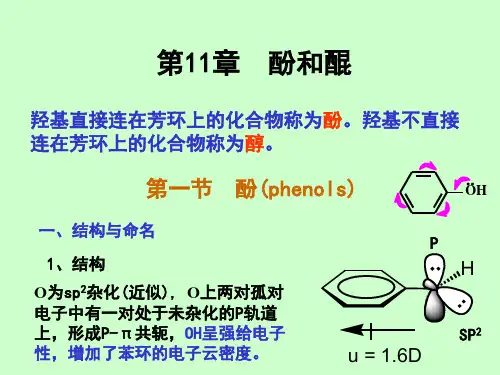
三.酚的化学性质酚和醇具有相同的官能团,但酚羟基直接与苯环相连,氧原子的p 轨道与芳环的π轨道形成p —π共轭体系,导致氧原子的电子云密度降低,使得碳氧键的极性减弱而不易断裂,不能像醇羟基那样发生亲核取代反应或消除反应。
同时,酚羟基中氧原子的电子云密度降低致使氧氢键的极性增加,与醇相比,酚的酸性明显增强。
另外,由于酚羟基的给电子效应,使苯环上的电子云密度增加,芳环上的亲电取代反应更容易进行。
OH OH OH 2H 5OHBrCH 3OOHOHOHNO 2O 2N2SO 3H CH 3HOOHHOOH苯酚中p-π共轭示意图综上所述,酚的主要化学性质可归纳如下:1.酸性酚类化合物呈酸性,大多数酚的pKa 都在10左右,酸性强于水和醇,能与强碱溶液苯酚的酸性比碳酸弱,能溶于碳酸钠溶液,但不能溶于碳酸氢钠溶液,在苯酚钠的溶液中通入二氧化碳能使苯酚游离出来。




第十一章 酚和醌1、(1)间甲苯酚 (2)4-乙基-1,3-苯二酚 (3)2,3-二甲基苯酚 (4)2,4,6-三硝基苯酚 (5)邻甲氧基苯酚 (6)对羟基苯磺酸 (7)1-甲基-2-萘酚 (8)9-蒽酚 (9)1,2,3-苯三酚(10)5-甲基-2-异丙基苯酚 (11)5-硝基-1-萘酚 (12)β-氯蒽醌OH2OH2OCH 2COOHCl OHBrBrOHCOCH 3OH(CH 3)3CC(CH 3)33)3OSO 3NaOSO 3HHO 3SOHO3CH 3OHOH ONOH(1)(2)(3)(4)(5)(6)(7)(8)(9)(10)(11)(12)2、OHCH3+++FeCl 36H+Cl-633 -(1)3、OH CH 3OHCH 3Br+Br 2/H 2O(2)OHCH 3ONaCH 3+NaOH(3)OH CH 3OCOCH 3CH 3+CH 3(4)OH CH 3OCOCH 3CH 3+(CH 3CO)2)O(5)OH CH 3OHCH 32OHCH 3O 2N++HNO 3 (稀)(6)(主)(次)OH CH 3OHCH 3Cl+Cl 2 (过量)(7)OH CH 3OHCH 33HOHCH 3HO 3S++H 2SO 4(浓)(8)(主)(次)OH CH 3OCH 3CH 3ONaCH 3+324(9)OHCH 3OHCH 3HOH 2CONaCH 32OH ++H +OH -或(10)(主)(次)4、① FeCl 3 ② Na5、(1)用氢氧化钠水溶液,苯酚成酚钠溶于水,然后用分液漏斗分离,再酸化。
(2)、(3)、(4)同样可用氢氧化钠水溶液将相应得酚分离出来。
6、在苯酚分子中引入吸电子基可使酸性增强,其中邻、对位的酸性大于间位,所以酸性由大到小的顺序为:2,4-二硝基苯酚 > 对硝基苯酚 > 间硝基苯酚 > 苯酚7、水杨醇不溶于碳酸氢钠溶液而容于氢氧化钠溶液,酸化后又可析出,且与三氯化铁溶液反应显蓝紫色,故可证明分子中含有酚羟基。