植物儿茶酚生物合成及其生理功能的研究
- 格式:docx
- 大小:37.51 KB
- 文档页数:2

多酚的基本生物化学作用机制黄海智;孙玉敬;刘东红;叶兴乾【摘要】植物多酚是一类广泛存在于植物体内的物质,有许多有助于人类健康的效果。
但是,多数的多酚和生物系统间的分子相互作用机制还尚不清楚。
本文综述了几项目前已经确定的潜在作用机制,包括:①非特异性作用,如抗氧化作用与生物膜的作用;②特异性机制,如与酶,转录因子,受体的作用等;此外还介绍了其他的一些机制:如抑制甘油三酯消化吸收,促进肠道有益细菌生长等。
对多酚和细胞成分作用产生的生物学影响的更好理解有助于发展预防和治疗人类疾病的营养学和药理学手段。
%Plant polyphenols, which are widely present in plants, have many functions beneficial to human health. However, the actual molecular interactions mechanism of polyphenols with biological systems remains mostly unclear. This paper reviews on some mechanisms that have been identified, includes:①non specific mechanism, such as antioxidation action and interactions with membranes; ②specific mechanism, such as interactions with enzymes,transcription factors and receptors. Besides, this paper introduces some others mechanisms, such as inhibiting the digestion and absorption of triglyceride; playing as a promoting factors of growth and proliferation for beneficial gut bacteria beneficial gut bacterias growth. The better knowledge on biological effects of polyphenols interactions with cell components will contribute to develop nutritional and pharmacological strategies oriented to prevent and cure human diseases.【期刊名称】《生物技术进展》【年(卷),期】2011(001)005【总页数】9页(P334-341,F0003)【关键词】多酚;抗氧化;生物膜;酶;转录因子【作者】黄海智;孙玉敬;刘东红;叶兴乾【作者单位】浙江大学生物系统与食品科学学院,310058;浙江大学生物系统与食品科学学院,310058;浙江大学生物系统与食品科学学院,310058;浙江大学生物系统与食品科学学院,310058【正文语种】中文【中图分类】Q946.82植物多酚是一类广泛存在于植物体内的物质,是植物的次生代谢产物,主要存在于植物的皮、根、茎、叶和果实中。

基金项目:国家重点研发计划(编号:2021Y F D 1000305);西藏自治区重大专项(编号:X Z 202201Z D 001N );西藏自治区地区科学基金项目(编号:32060532)作者简介:尹小庆,女,西藏自治区农牧科学院农产品开发与食品科学研究所研究实习员,硕士.通信作者:张玉红(1975 ),女,西藏自治区农牧科学院农产品开发与食品科学研究所高级研究员,硕士.E Gm a i l :z h a n g yh 75@126.c o m 收稿日期:2022G11G02㊀㊀改回日期:2023G04G28D O I :10.13652/j .s p jx .1003.5788.2022.80998[文章编号]1003G5788(2023)07G0223G05食用植物酵素中多酚类物质的研究进展R e s e a r c h p r o g r e s s o f p o l y p h e n o l s i ne d i b l e p l a n t e n z ym e s 尹小庆Y I N X i a o Gq i n g ㊀文华英WE N H u a Gy i n g ㊀张玉红Z HA N GY u Gh o n g ㊀白㊀婷B A IT i n g ㊀王姗姗WA N GSh a n Gs h a n (西藏自治区农牧科学院农产品开发与食品科学研究所,西藏拉萨㊀850000)(I n s t i t u t e o f F o o dP r o c e s s i n g ,T i b e tA c a d e m y o f A gr i c u l t u r a l a n dA n i m a l H u s b a n d r y Sc i e n c e s ,L h a s a ,T i b e t 850000,C h i n a )摘要:多酚是食用植物酵素的特征理化指标之一,具有抗氧化㊁减脂和抗肿瘤等功效.文章综述了食用植物酵素产品中多酚类物质的组成㊁影响食用植物酵素多酚物质形成的因素,以及多酚类物质的保健功效,并展望了食用植物酵素多酚类物质进一步的研究方向.关键词:发酵;食用植物酵素;多酚类物质;功能活性A b s t r a c t :P o l y p h e n o li so n eo ft h ec h a r a c t e r i s t i c p h ys i c a la n d c h e m i c a l i n d e x e s o f e d i b l e p l a n t e n z y m e ,w h i c hh a s t h e e f f e c t s o f a n t i Go x i d a t i o n ,r e d u c i n g f a ta n da n t i Gt u m o r .T h i s p a p e rr e v i e w s t h e c o m p o s i t i o no f p o l y p h e n o l s i nf o o d p l a n te n z y m e p r o d u c t s ,t h e f a c t o r sa f f e c t i n g t h ef o r m a t i o no f p o l y p h e n o l s i nf o o d p l a n t e n z y m e p r o d u c t s ,t h eh e a l t h c a r e e f f e c t s o f p o l y p h e n o l s ,a n d t h e f u r t h e r r e s e a r c hd i r e c t i o n s o f p o l y p h e n o l s i n e d i b l e p l a n t e n z y m e s a r e a l s o p r o s pe c t e d .K e y w o r d s :f e r m e n t a t i o n ;e d i b l e p l a n t e n z y m e s ;p o l y p h e n o l s ;f u n c t i o n a l a c t i v i t y以植物为原料,经微生物发酵制得的含有特定生物活性可食用的酵素产品被定义为食用植物酵素,按原料分类可分为谷类㊁果蔬类㊁复合类和药食同源类酵素[1-2].多酚类化合物是指分子结构中苯环上连有若干个羟基的植物成分的总称,包括黄酮类㊁单宁类㊁酚酸类以及花色苷类等,具有抗氧化㊁减脂和抗肿瘤等功效[3-5].作为食用植物酵素的特征理化指标之一,其含量被要求液态不少于0.5m g /g ,半固态不少于0.6m g /g,固态不少于1.4m g /g.人体不能自身合成多酚类物质[6],食用植物酵素已经成为人们摄入外源性多酚类物质的重要来源之一.有研究表明,酵素经过发酵增加了多酚类化合物的种类和含量[7],比如蓝莓花青素在微生物作用下降解后产生酚酸,由蓝莓花青素产生的间苯二酚羧酸增加了26倍,原儿茶酸(来自花青苷)增加了19倍,甲基原儿茶酸(来自豌豆苷)增加了7倍,甲基没食子酸增加了7倍等,而黄酮醇和羟基肉桂酸通常被氧化为醌类,游离黄酮醇的糖基缩醛键上可能发生水解反应,使其在发酵后浓度约增加了4倍[8-9].基于此,文章拟综述食用植物酵素中多酚类物质的组成,影响食用植物酵素多酚物质形成的因素以及多酚类物质的功效等,以期为富含多酚类物质的食用植物酵素产品的质量控制与功效研究提供参考依据.1㊀食用植物酵素中多酚类物质的组成食用植物酵素中的多酚类化合物一方面来源于植物原料本身,一方面来源于发酵过程中酵母㊁醋酸菌㊁乳酸菌等微生物代谢产生,包括黄酮类㊁单宁类㊁酚酸类以及花色苷类等.A n d r e a 等[9]在安第斯蓝莓和酿酒酵母㊁植物乳杆菌发酵后的蓝莓汁提取物中共鉴定309种酚类化合物,包括119种类黄酮㊁145种酚酸和45种原花青素.Ál v a r e z GF e r n án d e z 等[10]在日本葡萄糖杆菌发酵的草莓汁中鉴定出43种非花青素酚类物质,并鉴定出新橙皮糖苷㊁单没食子酸二葡萄糖㊁二氢己内酯己苷㊁羟基阿魏酰基己糖和菊苣酸.除了常见的果蔬原料,药食同源的植物以及鱼腥草㊁绞股蓝等中草药植物因含有独特的多酚类活性物质,被加入到植物酵素的研究之中[11-13].2㊀影响食用植物酵素多酚物质形成的因素㊀㊀食用植物酵素中多酚物质的形成受原料种类㊁发酵微生物㊁发酵时间的影响[14].因此,选好植物原料㊁发酵F O O D &MA C H I N E R Y 第39卷第7期总第261期|2023年7月|菌种和发酵方式能更好地控制食用植物酵素中多酚物质的种类和含量,为根据不同植物原料种类建立酵素标准和规范生产工艺提供依据.2.1㊀原料种类多酚物质在不同原料中差异较大,在不同来源的同一原料中也存在较大差异.魏雪琴等[15]以红枣分别搭配葡萄㊁生姜㊁枸杞经自然发酵制得的红枣酵素㊁葡萄红枣酵素㊁生姜红枣酵素和枸杞红枣酵素中的总多酚含量为2.11~5.70m g/m L,4种酵素总多酚含量差异显著.蓝莓酵素和沙棘酵素在黄酮和黄酮醇生物合成中代谢差异物质最多,其中蓝莓酵素中富含山奈酚㊁山奈素和木犀草素,沙棘酵素中富含3GOG甲基槲皮素[16].H u等[17]购买了不同产地(黑龙江的宜春㊁黑河㊁加格达奇)的蓝莓酵素进行比较研究,结果表明不同产地的蓝莓酵素总酚㊁总黄酮㊁花青素的含量呈显著性差异,其中宜春的蓝莓酵素总酚㊁总黄酮以及花青素含量最低,加格达奇的最高.2.2㊀发酵微生物在微生物的作用下,酚类物质的种类和含量发生了改变,不同菌种发酵产生的酚类物质也有差异.新鲜佛手瓜中含有的芹菜素糖苷戊苷Ⅱ㊁木犀草素7GOG芦丁苷Ⅱ和二甲素7G戊丁苷,在发酵后的佛手瓜酵素中却未检出,且其中的木犀草素㊁芹菜素㊁二甲素和异鼠李素含量增加[18],可能是由于发酵导致高极性偶联糖苷分解转化为了简单的酚类化合物[7].R o n a等[19]通过植物乳杆菌㊁干酪乳杆菌以及两菌混合发酵得到3种樱桃银莓酵素,共检出7种黄酮类化合物和8种酚酸.经植物乳杆菌和干酪乳杆菌共同发酵的樱桃银莓酵素与单独使用植物乳杆菌和干酪乳杆菌发酵的樱桃银莓酵素中多酚物质含量差异显著.具体表现为表儿茶素含量基本不变,其他6种黄酮类化合物含量均显著增加,对香豆酸含量增加,其他酚酸含量均有所下降.然而,经酿酒酵母或德氏环孢菌发酵的草莓酵素中花色苷类多酚化合物含量降低了60%[20].可见,通过筛选㊁复配菌种可定向调节植物酵素中的酚类化合物.2.3㊀发酵时间发酵时间对食用植物酵素中酚类物质也会产生影响.随着发酵时间的延长,沙棘酵素中总黄酮含量呈上升趋势,发酵60d时含量最高(0.57m g/m L)[21].桑葚酵素中黄酮类化合物的变化趋势与之类似,在发酵40d时达到最大值(3.60g/L)[22].蓝莓酵素中锦葵素3GOG吡喃葡萄糖苷㊁丁香酸㊁没食子酸㊁原儿茶酸㊁绿原酸㊁邻苯二酚和表没食子儿茶素含量取决于发酵周期,其中原儿茶酸和儿茶酚的含量随发酵时间的延长而显著增加[23].3㊀食用酵素中多酚类物质的功效3.1㊀抗氧化作用植物多酚可以直接清除体内的自由基,也可以通过调节氧化酶和抗氧化酶活性及金属离子含量间接清除体内的自由基[24].张思等[25]研究了16种市售素食品清除D P P H自由基㊁超氧阴离子自由基㊁羟自由基的能力,结果表明16种酵素食品均具有较强的自由基清除能力,总抗氧化性能是20μg/m L维生素C的1~2倍.在微生物的作用下,植物酵素不仅可以完整保留其天然活性成分且在机体有效释放,发酵后还产生了次级代谢产物,增强原有植物活性成分[26].所以发酵可以显著提高食用植物酵素抗氧化能力,如表1.但是在不同的植物酵素中,体现抗氧化的多酚物质是多样的,途径和机制也存在较大的差异.表1㊀食用植物酵素中多酚类物质体现抗氧化活性的证据T a b l e1㊀E v i d e n c e f o r a n t i o x i d a n t a c t i v i t y o f p o l y p h e n o l s i ne d i b l e p l a n t e n z y m e s 酵素种类多酚物质抗氧化能力的体现芸豆㊁大豆复合发酵液[27]多酚含量变化与酵素A B T S自由基清除能力㊁还原力呈高度正相关性铁皮石斛酵素[28]总黄酮含量变化与酵素A B T S自由基清除能力㊁羟自由基清除率呈正相关性蓝莓酵素[22]酚酸含量变化与超氧化物歧化酶活性㊁D P P H自由基以及烷基自由基的清除率呈正相关归芪参草酵素[12]甘草苷C7位和C4位的酚羟基为活性位点,发生抽氢反应,增加了分子抗氧化活性阿魏酸 C H C H C O O H基团具有吸电子作用, C H C H C O O具有推电子性质,使归芪参草功能酵素抗氧化活性增强佛手瓜酵素[18]芹菜素㊁芹菜苷戊苷Ⅰ㊁芹菜苷Ⅲ㊁芹菜素二糖苷㊁木犀草素㊁木犀草素G7GOG芦丁苷㊁二氢咖啡酸㊁二糖素和异鼠李素等通过减少活性氧的生成和激活先天抗氧化防御系统,保护H e p GG2细胞免受H2O2引起的氧化损伤研究进展A D V A N C E S总第261期|2023年7月|3.2㊀抗肥胖作用肥胖是一种脂肪生长与过度积累,在肝脏㊁肌肉㊁胰腺和大脑等代谢器官中引起炎症,造成胰岛素抵抗和代谢紊乱,且极易诱发各种慢性疾病危害人体健康[29].酚类物质可以通过抑制胰脂肪酶的活性预防和改善肥胖[30],也可以通过调节肠道微生物群和肠道微生物群相关的肠道氧化应激和屏障功能来减少肥胖[31].食用植物酵素中多酚类物质通过阻断脂肪生长与积累,缓解高脂膳食引起的肥胖和高血糖表现出抗肥胖作用,如表2.当然,也不能将植物酵素的功能物质割裂开来,忽视其中多糖等物质通过修护受损的胰岛β细胞㊁恢复胰岛β细胞正常分泌功能等抗肥胖作用[34-35].表2㊀食用植物酵素中多酚类物质体现抗肥胖的证据T a b l e2㊀E v i d e n c e f o r a n t iGo b e s i t y e f f e c t s o f p o l y p h e n o l s i ne d i b l e p l a n t e n z y m e s 模型酵素种类多酚物质抗肥胖的体现高脂膳食肥胖C57B L/6J小鼠模型蓝莓 黑莓发酵液[32]酚类提取物小鼠的脂肪质量百分比㊁平均脂肪细胞直径㊁血浆甘油三脂㊁胆固醇以及空腹血糖值显著降低模拟脂肪细胞和巨噬细胞之间病理相互作用的体外炎症模型黑莓 蓝莓酵素[33]酵素液在3T3GL1脂肪细胞分化过程中,减少细胞内脂肪积累(28.2%),抑制异丙肾上腺素诱导的成熟3T3GL1细胞的脂肪分解(18.6%)混合花青素恢复了T N FGα处理诱导的脂联素钝化基因表达(18.2%),并减少了巨噬细胞条件培养基培养的脂肪细胞的甘油释放(15.9%)3.3㊀抗癌作用多酚物质可以通过调节癌细胞增殖㊁血管生成㊁诱导细胞凋亡㊁抑制癌症的侵袭和转移等方式预防和治疗癌症[36].蓝莓多酚通过诱导细胞凋亡增加了对宫颈癌H e L a细胞的抗增殖活性.当单独使用原儿茶酸㊁儿茶酚和绿原酸或以不同比例混合处理H e L a细胞时,儿茶酚显示出最显著的抗癌活性[23].陆雨等[37]从诺利酵素中分离出16个化合物,并采用M T T法研究化合物的体外抗肿瘤活性,研究结果发现(+)G丁香脂素对H e L a细胞有一定的抑制活性,I C50值为47.12μg/m L.R o n a等[38]分别用植物乳杆菌(L.p l a n t a r u m)㊁干酪乳杆菌(L.c a s e i)以及两者等比例混合发酵的樱桃银莓水提物处理结直肠腺癌S W480细胞,混合发酵樱桃银莓提取物(ȡ25μg/m L)通过诱导细胞周期阻滞S和G2/M阶段,下调细胞周期蛋白及其依赖激酶而增加肿瘤抑制蛋白p27和p53.并且通过下调基质金属蛋白酶G9和P I3K/A K T/m T O R通路,上调T I M PG9和eG钙黏蛋白来发挥其肿瘤抑制作用.相关分析表明,混合发酵的樱桃银莓中的儿茶素㊁表没食子儿茶素㊁表食子儿茶素没食子酸酯㊁柚皮素㊁芦丁㊁槲皮素等多酚物质的含量上升,表现出多方面的抗癌特性.3.4㊀其他作用食用植物酵素中的多酚物质除了上述功效,还有提高免疫力㊁延缓衰老等作用.越橘经植物乳杆菌(L a c t i p l a n t i b a c i l l u s p l a n t a r u m)发酵后获得的越橘酵素能增强细胞的抗氧化活性和免疫调节特性[39],如表3.紫薯酵素中花青素通过乳酸菌(W.c o n f u s a)发酵降解为生物利用度更高的酚酸,从而获得了更高的抗氧化作用.通过紫薯酵素处理的秀丽隐杆线虫,其寿命延长37.5%,随年龄增长而在体内积累的衰老标志物脂褐质㊁丙二醛的含量下降,对耐热性和氧化应激的抵抗力更强.同时,紫薯酵素处理显著上调了线虫中抗衰老基因d a fG16㊁h s pG16.2㊁s i rG2.1㊁s k nG1和s o dG3的m R N A表达,紫薯酵素可以通过胰岛素/I G FG1信号传导㊁s k nG1依赖性和s i rG2.1依赖性途径发挥抗衰老作用[40].表3㊀越橘酵素增强细胞的抗氧化活性和免疫调节特性T a b l e3㊀V a c c i n i u mf l o r i b u n d u mb e r r i e s e n z y m e s e n h a n c e a n t i o x i d a n t a c t i v i t y a n d i mm u n o m o d u l a t o r y p r o p e r t i e s o f c e l l s模型剂量/(μg m L-1)处理时间/h体现人脐静脉内皮细胞1024H2O2诱导的细胞死亡和H2O2诱导的血红素加氧酶G1(H e m eo x y g e n a s eG1,H OG1)基因表达减少巨噬细胞(R AW264.7)1072促进巨噬细胞的生长,增加同一细胞系中诱导型一氧化氮合酶的表达|V o l.39,N o.7尹小庆等:食用植物酵素中多酚类物质的研究进展4㊀展望食用植物酵素中多酚物质种类和含量对酵素的品质和风味有重要的影响,且在清除活性氧自由基㊁抗肥胖㊁抗肿瘤㊁增强人体免疫力和延缓衰老等方面具有巨大潜力.目前,食用植物酵素的多酚物质成分分析及功效特性研究取得了一定的进展,但其具体的功效机制还有待探究完善.未来相关研究应聚焦在挖掘用于食用植物酵素的潜力植物原料,制定相关标准,规范生产工艺以及补充临床数据上.具体为:以药食同源类植物为原料制得的食用植物酵素中多酚类物质解析及功效开发;根据食用植物酵素的种类和发酵条件制定相关标准并规范生产工艺;补充临床试验相关数据,改善以动物或细胞为模型的食用植物酵素中多酚物质的功效及量效关系研究带来的不足.参考文献[1]中国生物发酵产业协会.食用植物酵素:T/CBFIA08003 2017[S].北京:中国标准出版社,2017:2.China Biotech Fermentation Industry Association.Edible plant source jiaosu:T/CBFIA08003 2017[S].Beijing:Standards Press of China,2017:2.[2]KUWAKI S,NAKAJIMA N,TANAKA H,et al.PlantGbased pastefermented by lactic acid bacteria and yeast:Functional analysis and possibility of application to functional foods[J].Biochemistry Insights,2012,5:9G21.[3]KIM S Y,CHA H J,HWANGBO H,et al.Protection against oxidative stressGinduced apoptosis by fermented sea tangle (Laminaria japonica aresch)in osteoblastic Mc3t3GE1cells through activation of Nrf2signaling pathway[J].Foods,2021,10(11):2807.[4]SUGIMOTO M,WATANABE T,TAKAOKA M,et al.AntiGinflammatory effect on colitis and modulation of microbiota by fermented plant extract supplementation[J].Fermentation,2021,7 (2):55.[5]李雪,李俐,王小龙,等.多酚类化合物基于非编码RNA调控发挥抗肿瘤及辐射增敏作用研究进展[J].食品科学,2023,44(5): 222G230.LI X,LI L,WAGN X L,et al.Research progress on antiGtumor andradiosensitization of polyphenols based on nonGcoding RNA regulation[J].Food Science,2023,44(5):222G230.[6]MANDAL S M,CHAKRABORTY D,DEY S.Phenolic acids act as signaling molecules in plantGmicrobe symbioses[J].Plant Signal Behav,2010,5(4):359G368.[7]HUR S J,LEE S Y,KIM Y C,et al.Effect of fermentation on the antioxidant activity in plantGbased foods[J].Food Chemistry,2014, 160:346G356.[8]SINELA A,RAWAT N,MERTZ C,et al.Anthocyanins degradationduring storage of Hibiscus sabdariffa extract and evolution of its degradation products[J].Food Chem,2017,214:234G241.[9]ANDREA C,SUSY P,SARA E A,et al.Detailed investigation ofthe composition and transformations of phenolic compounds in fresh and fermented Vaccinium floribundum berry extracts by highGresolution mass spectrometry and bioinformatics[J].Phytochemical Analysis,2021,33(4):507G516.[10]ÁLVAREZGFERNÁNDEZ M A,HORNEDOGORTEGA R, CEREZO A B,et al.NonGanthocyanin phenolic compounds and antioxidant activity of beverages obtained by gluconic fermentation of strawberry[J].Innov Food Sci Emerg,2014,26:469G481.[11]XU Y N,ZENG L P,XIAO N,et al.Quality enhancement ofDendrobium officinale and banana juice through probiotic fermentation using beneficial lactic acidGproducing bacteria[J].International Journal of Food Engineering,2020,16(8):20190370.[12]胡肖利.归芪参草功能酵素的制备与抗自由基活性的研究[D].兰州:兰州理工大学,2018:45.HU X L.Study on the preparation and antiGfree radical activity of Chinese herbal medicine functional enzyme[D].Lanzhou:Lanzhou University of Technology,2018:45.[13]LI Y Z,LI P,ZHANG Y,et al.Utilization of Gynostemmapentaphyllum and Houttuynia cordata medicinal plants to make Jiaosu:A healthy food[J].CytaGjournal of Food,2022,20(1): 143G148.[14]SEPTEMBREGMALATERRE A,FEMIZE F,POUCHERET P.Fruits and vegetables,as a source of nutritional compounds and phytochemicals:Changes in bioactive compounds during lactic fermentation[J].Food Res Int,2018,104:86G99.[15]魏雪琴,武燕蓉,庞杰.四种红枣酵素品质对比研究[J].中国调味品,2021,46(11):52G56.WEI X Q,WU Y R,LIAO parative study on the quality of four jujube enzymes[J].China Condiment,2021,46(11):52G56.[16]姚沛琳,刘梦茹,杨澳,等.基于非靶向代谢组学的蓝莓酵素和沙棘酵素代谢产物特征比较[J].食品工业科技,2022,43 (19):160G166.YAO P L,LIU M R,YANG A,et parison of metabolite characteristics of blueberry jiaosu and seaGbuckthorn jiaosu based on nonGtargeted metabolomics approach[J].Technology in the Food Industry,2022,43(19):160G166.[17]HU N,LEI M,ZHAO X L,et al.Analysis of the microbialdiversity and characteristics of fermented blueberry beverages from different regions[J].Foods,2020,9(11):1656.[18]SHANG Z X,LI M Q,ZHANG W W.Analysis of phenoliccompounds in pickled chayote and their effects on antioxidant activities and cell protection[J].Food Research International,2022, 157:111325.[19]RONA C M L,HYUN D C,YEONG S W,et al.Fermentation with monoGand mixed cultures of Lactobacillus plantarum and L.casei enhances the phytochemical content and biological activities of cherry silverberry(Elaeagnus multiflora Thunb.)fruit[J].Journal of The Science of Food and Agriculture,2020,100(9):3687G3696.研究进展A D V A N C E S总第261期|2023年7月|[20]YANG W,LIU S,MARSOLGVALL A,et al.Chemical composition, sensory profile and antioxidant capacity of lowGalcohol strawberry beverages fermented with Saccharomyces cerevisiae and Torulaspora delbrueckii[J].LWTGFood Sci Technol,2021, 149:111910.[21]金哲宁,方晟,沙如意,等.沙棘酵素功能成分及其体外抗氧化性能研究[J].食品研究与开发,2020,41(17):20G28.JIN Z N,FANG S,SHA R Y,et al.Study on the functional components and in vitro antioxidant activity of seaGbuckthorn Jiaosu[J].Food Res Dev,2020,41(17):20G28.[22]易媛,赵敏惠,左勇,等.桑葚酵素发酵过程中活性物质与抗氧化能力的相关性研究[J].食品与发酵工业,2022,48(9): 117G122.YI Y,ZHAO M H,ZUO Y,et al.Correlation between active substances and antioxidant capacity during mulberry Jiaosu fermentation[J].Food and Fermentation Industries,2022,48(9): 117G122.[23]RYU J Y,KANG H R,CHO S K.Changes over the fermentationperiod in phenolic compounds and antioxidant and anticancer activities of blueberries fermented by Lactobacillus plantarum[J].J Food Sci,2019,84:2347G2356.[24]马莹莹,姚金彤,张超,等.茶叶籽油酚类化合物抗氧化作用机制研究新进展[J].化学工程师,2018,32(9):47G51.MA Y Y,YAO J T,ZHANG C,et al.New progress in antioxidant action mechanism of tea seed oil phenolic compounds[J].Chemical Engineer,2018,32(9):47G51.[25]张思,王蕾,张志旭,等.16种市售酵素食品功能分析与评价[J].食品与机械,2016,32(9):196G200,224.ZHANG S,WANG L,ZHANG Z X,et al.Functional analysis and evaluation on commercially available enzyme food[J].Food& Machinery,2016,32(9):196G200,224.[26]杨志鹏,周宝琳,刘新利,等.一种具有潜在解酒护肝功能酵素的开发及其生物活性评价[J].食品科技,2019,44(1): 154G159.YANG Z P,ZHOU B L,LIU X L,et al.Development and bioactivity evaluation of an enzyme with potential function of relieving alcoholism and protecting liver[J].Food Technology, 2019,44(1):154G159.[27]李志芳,佐兆杭,王颖,等.芸豆/大豆复合发酵液代谢组分及功能性研究[J].食品与机械,2021,37(11):38G43.LI Z F,ZUO Z H,WANG Y,et al.Studies on metabolites and functions of soyGbased plant fermentation broth[J].Food& Machinery,2021,37(11):38G43.[28]章昱,谭强,曾春晖,等.铁皮石斛叶酵素发酵过程中活性物质及抗氧化性变化研究[J].中国酿造,2022,41(5):188G193.ZHANG Y,TAN Q,ZENG C H,et al.Changes of active substances and antioxidant activity of Dendrobium officinale Jiaosu during fermentation process[J].China Brewing,2022,41 (5):188G193.[29]MARGARET F G,GÖKHAN S H.Inflammatory mechanisms inobesity[J].Chinese Journal of Biochem istry&Molecular Biology, 2011,29:415G445.[30]SERGENT T,VANDERSTRAETEN J,WINAND J,et al.Phenolic compounds and plant extracts as potential natural antiGobesity substances[J].Food Chemistry,2012,135(1):68G73.[31]ZHOU F,LI Y L,ZHANG X,et al.Polyphenols from fu brick teareduce obesity via modulation of gut microbiota and gut microbiotaGrelated intestinal oxidative stress and barrier function [J].Journal of Agricultural and Food Chemistry,2021,69(48): 14530G14543.[32]JOHNSON M H,WALLIIG M,LUNA V D,et al.AlcoholGfree fermented blueberryGblackberry beverage phenolic extract attenuates dietGinduced obesity and blood glucose in C57BL/6J mice[J].J Nutr Biochem,2016,31:45G59.[33]GARCIAGDIAZ D F,JOHNSON M H,DE MEJIA E G.Anthocyanins from fermented berry beverages inhibitin flammationGrelated adiposity response in vitro[J].J Food Sci,2015, 18(4):489G496.[34]唐华丽,夏惠,王锋,等.枸杞多糖作用于2型糖尿病大鼠的血清代谢组学研究[J].食品科学,2017,38(13):160G166.TANG H L,XIA H,WANG F,et al.Serummetabonomics study of type2diabetic rats administrated with Lycium barbarum polysaccharides[J].Food Science,2017,38(13):160G166.[35]王成祥,刘玉霞,常绍鸿,等.马齿苋多糖对幼年糖尿病大鼠糖脂代谢㊁肾功能的影响及其作用机制[J].中国医科大学学报,2021,50(1):46G50,56.WANG C X,LIU Y X,CHANG S H,et al.Effect and mechanism of action of Portulaca oleracea L.polysaccharides on glycolipid metabolism and renal function in juvenile diabetic rats[J].Journal of China Medical University,2021,50(1):46G50,56.[36]SHANMUGAM M K,RANE G,KANCHI M M,et al.Themultifaceted role of curcumin in cancer prevention and treatment [J].Molecules,2015,20(2):2728G2769.[37]陆雨,江石平,孙冬雪,等.诺丽酵素化学成分及其抗肿瘤活性研究[J].中国药学杂志,2018,53(18):1552G1556.LU Y,JIANG S P,SUN D X,et al.Chemical constituents from noni enzyme and their antitumor activities[J].Chinese Journal of Pharmacy,2018,53(18):1552G1556.[38]RONA C M L,HYUN D C,JINGHWAN L,et al.Extracts ofElaeagnus multiflora Thunb.fruit fermented by lactic acid bacteria inhibit SW480human colon adenocarcinoma via induction of cell cycle arrest and suppression of metastatic potential[J]. Journal of Food Science,2020,85(8):2565G2577.[39]MARRACINO L,PUNZO A,SEVERI P,et al.Fermentationofvaccinium floribundum berries with Lactiplantibacillus plantarum reduces oxidative stress in endothelial cells and modulates macrophages function[J].Nutrients,2022,14(8):1560.[40]ZHAO J C,YU J,ZHI Q,et al.AntiGaging effects of the fermentedanthocyanin extracts of purple sweet potato on Caenorhabditis elegans[J].Food&Function,2021,12(24):12647G12658.|V o l.39,N o.7尹小庆等:食用植物酵素中多酚类物质的研究进展。

茶多酚的合成方法茶多酚是一类广泛存在于茶叶中的天然化合物,具有抗氧化、抗癌、降血脂等多种生物活性。
它包含了儿茶素、咖啡因和花青素等多种化合物。
一、化学合成方法:1.通过氧化法合成茶多酚。
这是最常用的合成方法之一、它通常使用儿茶酚作为原料,在适宜的反应条件下,通过氧化剂如氯化铅、氧化铝等,将儿茶酚氧化为茶多酚。
2.利用几类化学试剂将儿茶醛或儿茶酚与非酮杂环上的酮或羧酸酯化合物进行环合反应,生成茶多酚。
这种方法的产率较高,适用于生产大量茶多酚的工业化合成。
3.利用儿茶酚的亲核取代反应合成茶多酚。
这种方法主要是通过在儿茶酚的酚羟基上引入亲核取代基,使儿茶酚中的羟基数增多,从而形成茶多酚。
4.利用铝试剂催化合成茶多酚。
这种方法是通过在反应体系中加入铝试剂,如氯化铝、三丁基铝等,催化儿茶酚与芳香醛等底物反应,合成茶多酚。
二、生物合成方法:1.微生物法合成茶多酚。
利用大肠杆菌、酵母等微生物的代谢途径来合成茶多酚。
通过改变这些微生物的培养条件和基因,提高它们合成茶多酚的能力。
2.植物细胞培养法合成茶多酚。
通过利用植物组织培养技术,培养植物细胞,使其在体外合成茶多酚。
这种方法具有高效率和可控性,并且对环境友好。
总结起来,茶多酚的合成方法有化学合成和生物合成两种。
化学合成方法主要是通过化学试剂在适宜的反应条件下将儿茶酚或其它底物氧化、酯化等反应合成茶多酚。
生物合成方法则是利用微生物或植物细胞来合成茶多酚。
这些方法不仅可以用于实验室研究,也可以应用于工业生产茶多酚。
最终,采用哪种合成方法应根据具体需求、成本和有关方面的考虑来确定。

最新:儿茶酚胺(CA)及其代谢物与儿童相关疾病临床诊断的相关性1、什么是儿茶酚胺?Catecho1amines我们通常指的儿茶酚胺主要包括多巴胺(DA).肾上腺素(E)和去甲肾上腺素(NE),其相应的主要代谢产物分别为3-甲氧基肾上腺素MN以及3-甲氧基去甲肾上腺素(NMN),最终代谢产物为高香草酸(HVA)和香草扁桃酸(VMA)o儿茶酚胺合成与代谢MN)2、儿茶酚胺与儿童健康Chi1drenhea1th2∙1儿茶酚胺与嗜馅细胞瘤及副神经节瘤嗜铭细胞瘤(PCC)和副神经节瘤(PG1)是分别起源于肾上腺髓质或肾上腺外交感神经链的肿瘤,其中PCC占80%-85%,PG1占15%-20%,二者合称为PPG10PPG1可分泌大量儿茶酚胺,引起患者血压升高,并伴有糖、脂代谢异常,造成心、脑、肾等严重并发症。
2018年《中国心血管报告》以及2016年《嗜铭细胞瘤和副神经节瘤诊断治疗的专家共识》指出:中国儿童高血压患病率为14.5%,男生高于女生,儿童高血压患病率随年龄增加呈上升趋势目住院高血压儿童以继发性高血压为主(占52.0%-81.5%),PPG1在儿童高血压患者中患病率可达1.7%oPPG1如能及时、早期获得诊断和治疗,是一种可治愈的继发性高血压病,但PPG1因其症状的多样性和复杂性极容易导致漏诊、误诊,儿茶酚胺及其代谢产物的测定是其定性诊断的主要方法,同时也在手术疗效评估、术后转移的监测中起重要作用。
2016年《嗜馅细胞瘤和副神经节瘤诊断治疗的营家共识》以及2018年《中国高血压防治指南》中推荐PPG1的首选生化检验为"测定血游离MNs或尿MNs,其次可检测血或尿DA、E、NE浓度以帮助进行诊断"。
2.2 儿茶酚胺与神经母细胞瘤神经母细胞瘤(NB)是5岁以下儿童最常见的卢页外实体恶性肿瘤,占因肿瘤致死儿童的15%,因此也被称为“儿童肿瘤之王"。
NB极易发生早期转移,病情发展迅速,因此早发现、早治疗是提高NB生存率的重要手段。

天然产物的结构与活性研究天然产物是指存在于自然界中的各种有机化合物,具有广泛的结构多样性和生物活性。
通过对天然产物的结构与活性进行研究,可以揭示其化学特性、生物学功能以及潜在的药物活性。
本文将讨论天然产物的研究方法、结构分类以及结构与活性之间的关系。
一、天然产物的研究方法1. 地面资源采集与提取天然产物的研究通常需要从地面资源中进行采集和提取工作。
科学家们常常前往世界各地的热带雨林、海洋或者荒野中,采集具有潜在活性的植物、微生物或者动物样品。
然后,通过物理或者化学方法提取出有机化合物,为后续的分离与鉴定工作做准备。
2. 分离与纯化天然产物中的有机化合物种类繁多,而且含量很低。
因此,在研究过程中需要进行分离与纯化工作,以获取纯度较高的化合物。
常用的方法包括柱层析、高效液相色谱和凝胶渗透色谱等。
这些分离技术可以根据化合物的物理性质和化学性质来选择合适的分离方法。
3. 结构鉴定结构鉴定是天然产物研究中至关重要的一步,它可以通过各种分析技术来确定化合物的分子式、结构以及立体化学构型。
常用的鉴定方法包括核磁共振波谱、质谱、红外光谱和紫外光谱等。
这些技术可以为后续的活性研究提供准确的结构信息。
二、天然产物的结构分类天然产物的结构有着极大的多样性,可以分为多种类别。
根据结构特点,天然产物可以分为以下几类:1. 生物碱生物碱是一类含有碱性氮原子的有机化合物,常见于植物和动物体内。
它们具有丰富的生物活性,可用于药物的研发和合成。
典型的生物碱有吗啡、阿托品、可卡因等。
2. 生物肽生物肽是由氨基酸组成的短链肽链,存在于许多生物体内。
它们具有多种生物学功能,包括抗菌、抗肿瘤和免疫调节等。
典型的生物肽包括胰岛素、乳铁蛋白和麦角硫因等。
3. 类固醇类固醇是一类具有四环结构的有机化合物,广泛存在于植物和动物体内。
它们在机体内具有重要的生理功能,参与调节代谢和激素的合成。
典型的类固醇有胆固醇、雄激素和雌激素等。
4. 酚类化合物酚类化合物是以苯环上带有羟基的有机化合物。

儿茶酚胺类结构1. 儿茶酚胺类结构是一类重要的有机化合物,由儿茶酚和胺基结构组成。
这一类化合物在生物体内具有广泛的生理活性和药理活性,对于人体的生理功能和疾病治疗具有重要意义。
2. 儿茶酚胺类结构包括多种化合物,如肾上腺素、去甲肾上腺素、多巴胺等。
这些化合物在人体内起着重要的调节作用,参与了许多生理过程,如神经传递、心血管调节、免疫应答等。
3. 肾上腺素是儿茶酚胺类结构中最为重要的成员之一。
它由肾上腺髓质细胞合成,并通过神经递质释放到血液中起作用。
肾上腺素能够通过与细胞表面的受体结合来调节心血管系统、呼吸系统和代谢系统等功能。
4. 去甲肾上腺素是另一种重要的儿茶酚胺类结构。
它在人体内的含量相对较高,与肾上腺素具有相似的作用,但作用强度较弱。
去甲肾上腺素主要通过与细胞表面的受体结合来调节血压、血糖和能量代谢等生理过程。
5. 多巴胺是儿茶酚胺类结构中另一个重要成员。
它在中枢神经系统中起着重要的调节作用,参与了情绪、动机和运动控制等功能。
多巴胺还参与了一些疾病的发生和发展,如帕金森病和精神分裂症等。
6. 儿茶酚胺类结构在药物领域有着广泛的应用。
许多药物通过调节儿茶酚胺类结构的合成、释放或受体结合来治疗各种疾病。
例如,β受体阻断剂能够通过阻断肾上腺素对β受体的作用来治疗高血压和心脏疾病。
7. 儿茶酚胺类结构在神经系统功能障碍方面具有重要意义。
许多精神障碍和神经系统疾病与儿茶酚胺类结构的异常有关。
研究儿茶酚胺类结构的代谢和调控机制有助于理解这些疾病的发生机制,并为药物治疗提供新的靶点。
8. 儿茶酚胺类结构在免疫系统中也发挥重要作用。
它们参与调节免疫细胞的活性和功能,对于免疫应答的调节至关重要。
一些药物通过作用于儿茶酚胺类结构来调节免疫应答,治疗一些自身免疫性和过敏性疾病。
9. 近年来,对于儿茶酚胺类结构的深入理解为新药物开发提供了新思路。
通过设计和合成具有特定活性、选择性和稳定性的儿茶酚胺类化合物,可以开发出更有效、更安全的药物。

植物单宁细胞研究进展植物单宁是一类重要的天然产物,广泛存在于植物的根、茎、叶、果实等各个部位。
植物单宁具有多种生物活性,包括抗氧化、抗菌、抗炎、抗肿瘤等功能,因此备受人们关注。
随着科学研究的不断深入,人们对植物单宁细胞的研究也取得了显著进展。
本文将对植物单宁细胞的研究进展进行综合性的介绍,以期为相关研究提供参考。
一、植物单宁细胞的结构与组成植物单宁是一类多酚化合物,其结构复杂,由苯丙素或其衍生物聚合而成。
植物单宁分为单体和聚合体两大类,常见的单体有儿茶酚、黄酮、花青素等,而聚合体主要包括原花青素、鞣质等。
植物单宁细胞是指在植物组织中富含植物单宁的细胞。
这些细胞通常具有特殊的结构和功能,包括大型液泡、发达的内质网和叶绿体等。
植物单宁细胞中还含有丰富的鞣质体,这是植物单宁细胞的特征之一。
二、植物单宁细胞的生物合成和调控植物单宁的生物合成与调控是植物单宁细胞研究的重点之一。
植物单宁的生物合成途径主要包括苯丙氨酸途径和萜类途径。
在苯丙氨酸途径中,苯丙氨酸经过一系列酶促反应逐步合成儿茶酚,再通过酶催化反应形成花青素、黄酮和类黄酮等单体化合物。
而在萜类途径中,异戊二烯酸经过多步反应形成原花青素等聚合体。
这些生物合成途径的研究为人们深入了解植物单宁的合成机制提供了重要的理论依据。
植物单宁的生物合成受到多种内外因素的调控。
内因素包括植物内部的激素、基因等,外因素则包括光照、温度、干旱、病虫害等环境因素。
研究表明,植物单宁的生物合成受到内外因素的综合调控,其中植物激素和转录因子等因子在调控植物单宁的合成过程中发挥着重要作用。
进一步研究植物单宁生物合成的调控机制对于植物单宁的利用和生产具有重要意义。
三、植物单宁细胞在植物生长发育中的作用植物单宁细胞在植物的生长发育中发挥着重要的作用。
植物单宁在植物的抗逆性中起到关键的作用。
研究发现,植物在受到外界胁迫时会显著增加植物单宁的合成和积累,从而提高植物对环境胁迫的抵抗能力。
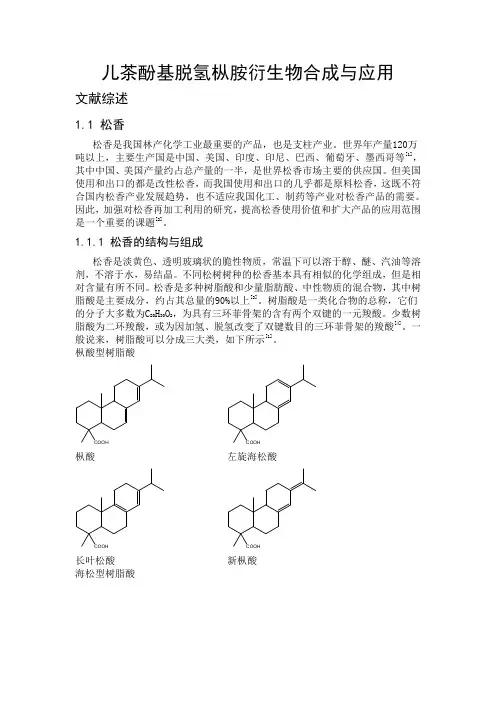
儿茶酚基脱氢枞胺衍生物合成与应用文献综述1.1 松香松香是我国林产化学工业最重要的产品,也是支柱产业。
世界年产量120万吨以上,主要生产国是中国、美国、印度、印尼、巴西、葡萄牙、墨西哥等[1],其中中国、美国产量约占总产量的一半,是世界松香市场主要的供应国。
但美国使用和出口的都是改性松香,而我国使用和出口的几乎都是原料松香,这既不符合国内松香产业发展趋势,也不适应我国化工、制药等产业对松香产品的需要。
因此,加强对松香再加工利用的研究,提高松香使用价值和扩大产品的应用范围是一个重要的课题[2]。
1.1.1 松香的结构与组成松香是淡黄色、透明玻璃状的脆性物质,常温下可以溶于醇、醚、汽油等溶剂,不溶于水,易结晶。
不同松树树种的松香基本具有相似的化学组成,但是相对含量有所不同。
松香是多种树脂酸和少量脂肪酸、中性物质的混合物,其中树脂酸是主要成分,约占其总量的90%以上[3]。
树脂酸是一类化合物的总称,它们的分子大多数为C20H30O2,为具有三环菲骨架的含有两个双键的一元羧酸。
少数树脂酸为二环羧酸,或为因加氢、脱氢改变了双键数目的三环菲骨架的羧酸[4]。
一般说来,树脂酸可以分成三大类,如下所示[1]。
枞酸型树脂酸COOH 枞酸COOH左旋海松酸COOH 长叶松酸COOH 新枞酸海松型树脂酸COOH 海松酸COOH 异海松酸COOH山达海松酸其他COOH 脱氢枞酸COOH 湿地松酸1.1.2 松香在传统工业领域用途[5]松香应用范围非常广,应用方式也非常多,是国民经济不可缺少的化工原料。
(1) 涂料工业普通松香是各种树脂酸的熔融混合物,溶解在有机溶剂中具有快干、成膜、光泽好、透明,并具有一定的硬度、耐磨等特点。
因此,松香在涂料中主要是成膜物质,起保护层作用。
(2) 油墨工业松香在油墨中主要起快干、粘合、乳化、光亮等作用。
油墨生产的关键技术除了复配技术之外,主要也在于松香的质量。
由松香生产的油墨主要使用在塑料印刷和胶印刷,更适宜高速度印刷油墨之用。

植物生长素在植物生长发育中的作用机制植物生长素是一种重要的植物激素,它可以调节植物的生长发育。
在植物生长发育的过程中,植物生长素发挥着重要的作用。
本文将从植物生长素的定义、类型、功能、生物合成和信号转导等方面探究植物生长素在植物生长发育中的作用机制。
一、植物生长素的定义及类型植物生长素是植物所分泌的一类低分子化合物,广泛存在于植物体内,包括了IAA、IBA、2,4-D等多种类型。
其中IAA是最为普遍的植物生长素,被认为是植物主要的内源性生长素。
二、植物生长素的功能1、促进植物生长植物生长素鼓励植物生长。
它在植物体内的作用是高度复杂的,负责许多生长和发育的方面。
它促进生长,特别是纵向生长和细胞分裂。
2、参与植物组织分化和形态形成植物生长素对植物的叶和根的分化和形成有着很大的影响。
它有助于赋予植物多样化的外形、色彩和质感。
它还可以掌控花瓣的形成,影响花器官之间的配合、同步和多产。
三、植物生长素的生物合成由于植物生长素对植物的生长发育起着至关重要的作用,因此植物需要自己合成生长素。
植物生长素的生物合成是由多个途径共同协调完成的,包括三部分:色胺酸(IAA)生物合成途径、儿茶酚酸类别生物合成途径以及反式维生素受体生物合成途径。
四、植物生长素的信号转导植物生长素信号通路是由生长素与生长素受体结合后激活启动,同时可以分为内源性和外源性生长素信号转导。
内源性生长素信号从细胞的中央体网络向外传递。
而外源性生长素的信号集中在植物的旁边,然后沿着细胞膜进入细胞内。
在信号转导过程中,蛋白激酶和蛋白质分解参与其中,它们共同掌控着信号的转导。
植物生长素信号具有极高的选择性,可通过根的某些细胞使它们优先发展,这也是植物能与环境作有针对性地反应的原因之一。
综上所述,植物生长素在植物生长发育中的作用机制非常复杂。
它的存在与功能可以制约植物的身体大小与结构、整合种子的生长、支配植物对环境的反应和有限性。
对植物生长素的研究不断地深化了我们对植物物种生长和进化的认识,它有助于说明植物如何适应与抵御外部环境的恶劣影响,进而为人类为实现更好的农作物种植提供了理论基础和价值指导。

儿茶酚及其衍生物的性质及应用刘蓉瑾【摘要】儿茶酚类化合物普遍存在于自然界,具有多功能性,可参与大多数生化进程.它具有较强的氧化还原性,pH响应性和显著的螯合性;而且儿茶酚中的邻位羟基可通过多种方式与不同材料相互作用,特别是与三价铁离子具有很强的螯合作用.由于儿茶酚类化合物性质的多样性,其可以存在于单分子体系、超分子体系、金属离子络合体系或通过共价键相连的聚合物.儿茶酚的多功能性使其参与多种自然过程,其作用表现在众多方面,从海洋生物的粘附性到对过渡金属的储存均得力于儿茶酚类化合物.由于儿茶酚性质的多样性,引起研究者们的广泛兴趣,近年来对其研究日益增多,旨在制备新型的功能性材料和涂层.%Catechols are found in nature taking part in a remarkably broad scope of biochemical processes and functions. They can establish reversible equilibria at moderate redox potentials and pHs and irreversibly cross-link through complex oxidation mechanisms. Their chelating properties can be greatly exemplified with the binding of Fe3+and the diverse modes of interaction of the vicinal hydroxyl groups with all kinds of surfaces of remarkably different chemical and physical nature. Thanks to this diversity, catechols are found to be present in simple molecular systems, with supramolacular struc-tures, metal ion complexing systems or polymers with covalent bonds. The versatilities, allowed cate-chols to participate in several natural processes and functions that range from the adhesive properties of marine organisms to store some transition metal ions. Therefore, catechol-based systems have in recent years beensubjected to intense research, and aimed at mimicking these natural systems in order to de-velop new functional materials and coatings.【期刊名称】《化学研究》【年(卷),期】2017(028)003【总页数】4页(P391-394)【关键词】儿茶酚基聚合物;3,4-二羟基苯丙氨酸;降解性;配位作用;氧化还原性【作者】刘蓉瑾【作者单位】煤科集团沈阳研究院有限公司,辽宁沈阳110000【正文语种】中文【中图分类】O631.3儿茶酚是一类带有邻羟基的酚类衍生物,在自然界中无处不在. 儿茶酚及其衍生物可作为活性生物质存在于多种环境中,呈现出显著的化学多样性. 设计合成儿茶酚基聚合物可应用于生物医药、分析化学、纳米技术和材料科学等领域,由于其独特的化学性质,为科学研究提供了更多的途径. 儿茶酚环的结构使其具有多功能性. 一方面,儿茶酚可作为一种弱酸具有反应活性,同时,也可作为一种氧化还原剂. 另一方面,邻位二羟基的存在使其可形成配位结构和氢键.根据儿茶酚的功能性,可概括地分为以下几类:1) 通过非共价键与多种基材表面键合,或与其他功能性基团形成共价键;2) 通过聚合或自组装作用形成2D或3D结构;3) 复合体系中,儿茶酚可作为连接位点,起到分子间的连接作用;4) 在特定条件下,含儿茶酚基的分子对外界刺激的响应具有可逆性.虽然其性质良好,但也存在缺点. 尽管从表面上看其反应条件简单、温和,但实际含儿茶酚基的化学反应具有挑战性,其化合物在反应前通常需要经过十分细致的处理.1.1 粘附性粘附性是儿茶酚及其衍生物一个非常重要的性质,其几乎可与任何化学性质的基材表面形成很强的粘附力,即使在玻璃、聚四氟乙烯等表面张力很小的材料表面也能形成较强的附着力. 儿茶酚与基材的作用形式可分为共价键和非共价键. 一些含有胺基或硫醇基团的特殊基材可通过迈克尔加成或席夫碱反应与儿茶酚基聚合物形成共价键. 另一方面,儿茶酚基聚合物还可通过与金属离子配位或螯合、氢键、π-π堆叠等非共价键[1-4]和基材相互作用. 通过对儿茶酚基的含量、附着性质和氧化条件对儿茶酚基聚合物粘附性的影响研究,发现粘附性大致随儿茶酚基的含量增加而成比例增加[5-6]. 与其他涂层材料比,牢固的粘附在有机或疏水材料表面是儿茶酚基聚合物最显著的优势.1.2 金属离子螯合性和氧化还原活性金属离子可与儿茶酚基衍生物中的醌、羧基、胺基和苯酚等多种官能团键合,而且在不同的pH下,金属离子可与不同的官能团键合形成多种络合物. FRONCISZ等报导可通过电子自旋共振光谱(ESR)检测Cu2+与儿茶酚基聚合物的螯合形式[7],结果表明:1) pH<5时,Cu2+与羧基作用形成络合物;2) pH≈7时,Cu2+与酚羟基络合;3) 若pH进一步增加,Cu2+则与3个或4个N原子发生络合.除与金属离子螯合之外,儿茶酚基衍生物还可还原一些惰性金属离子,如Au3+,Ag+,Pt3+等,其氧化还原活性较强,还原条件温和,可作为一种还原剂. 在一定条件下,儿茶酚基先氧化成醌,再触发金属阳离子的还原. 通过X射线衍射图可以看出,在还原过程中,醌的峰强增加,而儿茶酚基的峰强减弱.1.3 化学反应活性儿茶酚类衍生物中含有多个官能团,如氨基、酚羟基、羧基等,可与较多的功能性分子发生化学反应. 聚合物中的儿茶酚基氧化成醌后,可与胺基作用发生席夫碱反应. 当含巯基的分子存在时,则会与儿茶酚基聚合物发生迈克尔加成反应. 而且,儿茶酚基与亲核试剂在水溶液中发生偶合,可保持良好的稳定性,解决了N-羟基琥珀酰亚胺和顺丁烯二酰亚胺与含胺基或巯基的分子偶联时由于水解作用而导致偶联效率降低的问题.1.4 生物相容性和生物降解性生物相容性是判断一种材料是否适合应用于生物医药领域的重要因素. KU等证明儿茶酚基聚合物不会妨碍哺乳动物细胞的生长和繁殖[8]. 同时,许多研究表明含儿茶酚基的涂层可提高细胞在基材上的附着力,并促进其繁殖. 静脉注射儿茶酚基聚合物30 d后,监测实验动物的各项生理指标,结果表明在饮食、运动、消化和神经系统等多方面均未出现异常情况,而且其体重与对照组相比也有所增加. 生物降解性是生物医药领域材料的另一重要性质,外来物质在体内的长期留存必然会引起严重的不良反应. LANGER等对儿茶酚基聚合物的体内降解进行了研究,结果表明8 w后其在体内可完全降解[9]. 除此之外,微生物的存在也可使儿茶酚聚合物降解[10].2.1 生物医药方面的应用由于儿茶酚类衍生物良好的粘附性、生物相容性、生物降解性和化学反应活性,使其可用于制备聚合物膜、水凝胶、功能性支架等多种材料,广泛应用于生物医药领域.2.1.1 细胞的粘附、封装和排列在生物材料的应用中,细胞的保护和固定是非常重要的,同时实现过程也是非常复杂的. 近年来,大量文献报导,利用儿茶酚基聚合物良好的生物相容性,将细胞等生物性物质成功地固定在玻璃、聚苯乙烯、聚二甲基硅氧烷等多种基材上. YANG等在酵母细胞外涂覆一层聚多巴胺,形成壳将其封装在内部,成功实现了细胞在基材上的固定,并且控制了细胞的分裂,防止了细胞受到外界环境的影响[11]. 儿茶酚基聚合物的特殊性质使其可通过光刻法、微流控技术和微触印刷法实现细胞的有效排列,可克服体系成本高、基材受限、操作复杂、稳定性低等缺点.2.1.2 抗菌性应用细菌感染在医药、工业、食品安全等领域产生重要影响,严重威胁人类健康,甚至导致死亡. 抗菌材料的使用是防止细菌感染的有效手段,目前,已报道的抗菌材料主要有金属纳米粒子和半导体材料,虽然其具有较高的抗菌活性,但若实现应用于不同基材的表面仍然是一个挑战. 儿茶酚基聚合物对金属离子的还原性和其在多种基材表面的粘附性,使原位法制备抗菌材料成为可能. MESSERSMITH课题组在聚碳酸酯上涂覆一层儿茶酚基聚合物,并使银纳米粒子和接枝防腐蚀剂的PEG沉积在其表面,制得的复合材料不仅可以起到杀菌作用,而且能够有效防止细菌的附着[12]. MAO等用聚多巴胺修饰棉纤维,并用原位法将银离子还原成银纳米粒子,制备了抗菌性棉纤维[13].2.1.3 药物释放儿茶酚基聚合物囊泡由于良好的水溶性、生物相容性和生物降解性,可作为药物释放材料,而且其空腔和表面均可负载大量药物分子. 疏水抗癌药物可通过乳液模板法预压到囊泡中,模板除去后药物仍可完好地保存,并可通过调节聚合物囊泡的带电状态选择性负载药物,药物负载量与溶液的pH和负载分子的带电性相关.2.2 传感器方面的应用电化学生物传感器由于具有操作简单、敏感性高、选择性好和线性范围宽等优点,迅速发展. 基于多巴和多巴胺等儿茶酚基化合物的粘附性和生物相容性,可为生物分子的高密度固定提供合适的微环境,并可长期保持其生物活性. 因此,众多研究致力于制备高效的儿茶酚基生物传感器.2.2.1 有机分子检测ZHANG等通过电聚合使多巴胺在固定了辣根过氧化酶(HRP)的双层脂质膜上形成聚合物膜,制备了一种可再生传感器,用于快速检测痕量H2O2[14]. 利用儿茶酚基衍生物的氧化还原性和与金属离子的配位作用,可制备金纳米粒子/导电聚合物复合材料检测抗坏血酸,该传感器具有高敏感性、较宽的线性检测范围、长期稳定性和良好的抗干扰能力. 根据这一方法还可制备铂纳米粒子复合材料用于检测尿酸[15]. 在电泳的协助下,这种传感体系可用于同时检测小鼠体内的多巴胺、肾上腺素、去甲肾上腺素和血清素.2.2.2 生物分子检测近年来,许多文献报导儿茶酚基电化学传感器用于生物分子检测,其中一个很重要的方面就是对糖类的检测. GAO等用聚多巴胺修饰的碳纳米管制备了葡萄糖电化学生物传感器[16]. 聚多巴胺涂层不仅可以保护碳纳米管的电子结构,提高其稳定性,还可促进葡萄糖氧化酶与电极之间的电子转移. FU等首次直接使用儿茶酚基聚合物构建了聚合物-酶-金属纳米粒子复合传感体系[17]. 与其他传感器相比,酶被直接封装在聚合物内,避免了与外界的直接接触,提高了传感器的稳定性. 这种传感器可达到微摩尔级检测极限,可有效抗尿酸、抗坏血酸、扑热息痛和谷胱甘肽的干扰,在葡萄糖和半乳糖检测中具有较高的稳定性. 除了使用酶之外,基于葡萄糖与硼酸衍生物、凝集素等物质间的生物相互作用也可实现选择性检测.2.2.3 重金属离子检测WANG等基于胸腺嘧啶-Hg2+-胸腺嘧啶的配位化学作用,用聚多巴胺制备了检测Hg2+的电化学生物传感器[18]. 基于聚多巴胺对金属离子的吸附作用,ZHOU 等用聚多巴胺和Fe3O4制备了具有核壳结构的纳米粒子,用于检测Pb(II)和Ca(II)[19]. 实验证明聚多巴胺涂层可有效吸附铅离子和钙离子,而且可将金属离子还原成金属沉积在电极的表面,导致明显的电流变化,这种方法显示出更高的敏感性、更好的抗干扰能力、低成本和较好的稳定性.2.3 水处理方面的应用由于重金属、合成染料和芳香族化合物等工业污染物严重威胁自然环境和人类健康,对工业废水的净化要求与日俱增,获得一种高效的水净化方法是研究者们努力的方向. 工业中,化学沉淀、吸附、光催化降解和膜过滤等方式均可用于污染物的脱除. 在这些方法中,吸附由于其具有低成本、易操作和无副产物等优点被认为是最有效的方式而广泛应用. 吸附剂需要与污染物存在多个结合位点才能获得较高的吸附率. 儿茶酚基聚合物中存在儿茶酚基、胺基、羧基和苯环等大量官能团,作为吸附剂可提供大量的活性结合位点,通过静电作用、螯合作用、氢键或π-π堆积作用吸附重金属离子和有机污染物. 除活性位点外,表面积也是影响吸附效果的重要因素.将高表面积的石墨烯和多活性位点的儿茶酚基聚合物相结合,必然会获得较高的吸附效率[20].儿茶酚类衍生物可作为活性生物质存在于多种环境中,由于其具有粘附性、化学反应活性、金属离子螯合性、氧化还原活性、生物相容性和降解性等多种理化性质,使得其广泛的应用于功能材料的制备. 设计合成儿茶酚基聚合物可应用于生物医药、分析化学、纳米技术和材料科学等领域,显示了其独特的化学功能,也为科学研究提供了更多的途径. 由于儿茶酚基聚合物的独特性质,使其易于与其他材料相结合,以制备具有特殊功能的聚合物材料. 儿茶酚基聚合物的研究领域必将有一个光明的未来,经过长期的研究,儿茶酚基聚合物将为克服长期以来科学实践中的挑战提供新的途径.【相关文献】[1] SAIZ-POSEU J, FARAUDO J, FIGUERAS A, et al. Switchable self-assembly of a bioinspired alkyl catechol at a solid/liquid interface: Competitive interfacial, noncovalent,and solvent interactions [J]. Chemistry-A European Journal, 2012, 18(10): 3056-3063. [2] WANG L, WANG D, DONG Z, et al. Interface chemistry engineering for stable cycling of reduced GO/SnO2 nanocomposites for lithium ion battery [J]. Nano Letters, 2013, 13(4): 1711-1716.[3] KROGSGAARD M, BEHRENS M A, PEDERSEN J S, et al. Self-healing mussel-inspired multi-pH-responsive hydrogels [J]. Biomacromolecules, 2013, 14(2): 297-301.[4] SED J, SAIZ-POSEU J, BUSQU F, et al. Catechol-based biomimetic functional materials [J]. Advanced Materials, 2013, 25(5): 653-701.[5] LEE B P, CHAO C Y, NUNALEE F N, et al. Rapid gel formation and adhesion in photocurable and biodegradable block copolymers with high DOPA content [J]. Macro-molecules, 2006, 39(5): 1740-1748.[6] GUVENDIREN M, BRASS D A, MESSERSMITH P B, et al. Adhesion of DOPA-functionalized model membranes to hard and soft surfaces [J]. The Journal of Adhesion, 2009, 85(9): 631-645.[7] FRONCISZ W, SARNA T, HYDE J S. Cu2+ probe of metal-ion binding sites in melanin using electron paramagnetic resonance spectroscopy: I. Synthetic melanins [J]. Archives of Biochemistry and Biophysics, 1980, 202(1): 289-303.[8] KU S H, RYU J, HONG S K, et al. General functionalization route for cell adhesion on non-wetting surfaces [J]. Biomaterials, 2010, 31(9): 2535-2541.[9] BETTINGER C J, BRUGGEMAN J P, MISRA A, et al. Biocompatibility of biodegradable semiconducting melanin films for nerve tissue engineering [J]. Biomaterials, 2009, 30(17): 3050-3057.[10] JIA X, MA Z, ZHANG G, et al. Polydopamine film coated controlled-release multielement compound fertilizer based on mussel-inspired chemistry [J]. Journal of Agricultural and Food Chemistry, 2013, 61(12): 2919-2924.[11] YANG S H, KANG S M, LEE K B, et al. Mussel-inspired encapsulation and functionalization of individual yeast cells [J]. Journal of the American Chemical Society, 2011, 133(9): 2795-2797.[12] SILEIKA T S, KIM H D, MANIAK P, et al. Antibacterial performance of polydopamine-modified polymer surfaces containing passive and active components [J]. ACS Applied Materials & Interfaces, 2011, 3(12): 4602-4610.[13] XU H, SHI X, MA H, et al. The preparation and antibacterial effects of dopa-cotton/AgNPs [J]. Applied Surface Science, 2011, 257(15): 6799-6803.[14] ZHENG L, XIONG L, ZHENG D, et al. Bilayer lipid membrane biosensor with enhanced stability for amperometric determination of hydrogen peroxide [J]. Talanta, 2011, 85(1): 43-48.[15] LIN M, HUANG H, LIU Y, et al. High loading of uniformly dispersed Pt nanoparticleson polydopamine coated carbon nanotubes and its application in simultaneous determination of dopamine and uric acid [J]. Nanotechnology, 2013, 24(6): 065501. [16] WANG Y, LIU L, LI M, et al. Multifunctional carbon nanotubes for direct electrochemistry of glucose oxidase and glucose bioassay [J]. Biosensors and Bioelectronics, 2011, 30(1): 107-111.[17] FU Y, LI P, XIE Q, et al. One-pot preparation of polymer-enzyme-metallic nanoparticle composite films for high-performance biosensing of glucose and galactose [J]. Advanced Functional Materials, 2009, 19(11): 1784-1791.[18] WANG G, HUANG H, ZHANG X, et al. Electrically contacted enzyme based on dual hairpin DNA structure and its application for amplified detection of Hg2+ [J]. Biosensors and Bioelectronics, 2012, 35(1): 108-114.[19] SONG Q, LI M, HUANG L, et al. Bifunctional polydopamine@Fe3O4 core-shell nanoparticles for electrochemical determination of lead (II) and cadmium (II) [J]. Analytica Chimica Acta, 2013, 787: 64-70.[20] GAO H, SUN Y, ZHOU J, et al. Mussel-inspired synthesis of polydopamine-functionalized graphene hydrogel as reusable adsorbents for water purification [J]. ACS Applied Materials & Interfaces, 2013, 5(2): 425-432.。
儿茶酚胺合成儿茶酚胺(Catecholamines)是一类重要的生物活性物质,包括肾上腺素(Adrenaline)、去甲肾上腺素(Noradrenaline)和多巴胺(Dopamine)。
这些物质在人体中具有重要的生理功能,参与调节神经传递、血压、心率等多种生理过程。
儿茶酚胺的合成过程涉及多个酶的参与以及多个中间产物的生成。
儿茶酚胺合成的主要途径是通过酪氨酸(Tyrosine)的代谢。
酪氨酸是一种非必需氨基酸,在人体中由酪氨酸羟化酶(Tyrosine Hydroxylase)催化下转化为L-DOPA。
这一反应发生在肾上腺髓质细胞、中枢神经系统中的儿茶酚胺神经元以及其他一些组织中。
酪氨酸羟化酶是儿茶酚胺合成途径的关键酶之一,它需要四氢生物醌(Tetrahydrobiopterin)和氧气作为辅助因子。
酪氨酸羟化酶在肾上腺中的活性较其他组织高,这使得肾上腺成为儿茶酚胺的主要合成地。
L-DOPA继续被芳香酮酸羰基化酶(Aromatic L-amino acid decarboxylase)催化,形成多巴胺。
这一反应发生在多巴胺神经元和其他一些组织中,芳香酮酸羰基化酶是多巴胺合成过程中的另一个关键酶。
多巴胺是中枢神经系统中的一个重要神经递质,也是其他儿茶酚胺的前体。
在儿茶酚胺的合成过程中,多巴胺可以选择性地被多巴胺-β-氧化酶催化为去甲肾上腺素。
多巴胺-β-氧化酶主要存在于肾上腺髓质细胞和其他一些儿茶酚胺能神经元中。
去甲肾上腺素是儿茶酚胺的重要成员之一,它的合成能够通过儿茶酚-O-甲基转移酶(Catechol-O-methyltransferase)进一步转化为肾上腺素。
肾上腺素是儿茶酚胺合成途径的最终产物,它是一种强效的神经递质和荷尔蒙,对人体的生理过程起着重要的调控作用。
肾上腺素的合成过程和去甲肾上腺素类似,主要是通过酚氧化酶(Phenylethanolamine N-methyltransferase)催化去甲肾上腺素的甲基化反应。
壳聚糖儿茶酚在止血方面的研究进展摘要:外伤性大出血是导致休克的主要原因。
院前急救通常是由于意外发生导致的伤者在接受专业医疗设备诊疗前的急救方式。
多学科分析表明,约2.5%的死亡是可以通过在不可控出血刚发生时采用止血药物或介入治疗等方式避免的。
有效控制出血,可将战伤死亡率降低50%,近年来以壳聚糖儿茶酚为材料的止血器材得到重视。
关键词:儿茶酚;止血材料;壳聚糖一、壳聚糖的应用原理壳聚糖是甲壳素经脱乙酰化制成的,而甲壳素是广泛存在于自然界的一种多糖生物高分子化合物,是仅次于植物纤维的一种生物高分子化合物。
最早是由欧吉尔从甲壳纲动物的硬壳中提取的,并命名为甲壳质(又名几丁质),甲壳素自发现以来备受科学家的关注,目前已被广泛应用于医学领域,大量研究表明壳聚糖具有抑制癌症、降血压、降血糖等作用,制成各种相关产品;有实验证明壳聚糖还具有促进创面愈合,减少创面感染等作用,应用于烧伤创面的治疗中;壳聚糖和甲壳素具有促凝血作用,这一作用的机理可能为:壳聚糖与甲壳素表面带有大量电离子,当其与血液接触时,可瞬时吸附血液蛋白于其表面形成一层蛋白膜,这些蛋白包括:血浆白蛋白、纤维蛋白原、凝血酶等,蛋白又可以介导血小板的吸附,从而使这些物质在材料表面通过复杂的聚合反应最终形成血凝块,从而达到止血的目的。
二、壳聚糖类产品目前壳聚糖类止血剂被制成各种剂型,有水剂、水溶胶还有膜剂等,主要是因为出血的部位和出血类型,选择不同的剂型,均有不同程度的止血效果,其中已经得到良好应用而且具有代表性意义的产品有Syvek纱布、RDH绷带和HemCon止血敷料,这三种敷料先后都通过了美国FDA的认证。
其中Hemcon止血敷料设计及应用对象主要是针对于军队,主要应用于阿富汗和伊拉克特种部队。
其主要成分是壳聚糖,以塑料膜作为被衬层,当伤口出血时,根据伤口情况覆盖HemCon敷料,敷料可在出血伤口形成粘附性很高的血凝块,达到止血的目的,这一过程大概需要数分钟时间,而且需要辅助于加压包扎。
生物资源2020,42(6 ):652〜659Biotic Resources综述DOI : 10. 14188/j. ajsh. 2020. 06. 006黑色素形成机理、生物学功能和应用开发的研究进展陈海雁,陈向东,俞黎挪(武汉大学生命科学学院学院,湖北武汉430000)摘要:黑色素(melanin)是一类化学结构极其复杂、非均质的酚类或吲哚类物质聚合体,是自然界中M为丰富的天然色素,广泛存在于各种动物、植物和微生物中根据合成途径和中间代谢产物的不同,黑色素主要可分为为真黑索(eumelanin)、棕黑 素(pheomelanin)、异黑色素(allomelanin)三大类。
其中异黑色素又包括脓黑素(pyomelanin)、1, 8 _二轻基萘(dihydroxyna丨Aalene,DHM)黑色素等基于黑色素的生化功能,它们在1:业、医药、农业中都有广泛用途,是重要的生物资源.木文主要介绍天然黑色素在动植物和微生物中的合成途径、生物学功能以及有潜力的获取方法和应用前景关键词:黑色素;合成途径;酪氨酸酶;提取;应用中图分类号:Q939.97 文献标识码:A 文章编号:2096-3491(2020)06-0652-08B iosynthesis, function and applications of m elaninCHEN Haiyan , CHEN Xiangdong" , YU Lishan(College of Life Sciences, Wuhan University, Wuhan 430000, Hubei, China)Abstract :M elanin is a kind of phenol or indole polymers which is heterogeneous with extremely complex chemical structure . It is the most abundant natural pigment and widely exists in various anim als, plants and microorganisms. The main types of melanin are eum elanin, pheom elanin and allomelanin. A m ong them, allomelanin includes pyomelanin and 1,8-dihydroxynaphthalene (D H N) melanin. Based on the biochemical function, melanin is widely used in industry, medi cine and agriculture as im portant biological resources. This paper focuses on the biosynthesivS and biological function of ncitural melanin in anim als, plants and m icroorganism s as well as the potential acquisition m ethods and applications.Key w ord s:m elanin;biosynthesis;tyrosinase;extraction;application〇引言黑色素(m elanin)是一类化学结构极其复杂、非 均质的酚类或吲哚类物质聚合体,是自然界中最为丰富的天然色素,广泛存在于各种动物、植物和微生物中。
酚类化合物的制备及其生物学效应研究酚类化合物是一类具有苯环结构的化合物,具有广泛的应用和生物学效应。
其中,酚酞、萘酚、联苯酚等化合物被广泛应用于染料、医药、农药等领域。
同时,酚类化合物也是一些药物和化学污染物的主要成分,对人体健康和生态环境造成较大影响。
因此,对酚类化合物的制备及其生物学效应进行研究具有重要意义。
一、酚类化合物的制备1. 酚酞的制备酚酞是一种重要的芳香化合物,广泛应用于染料、医药和杀虫剂等领域。
目前,酚酞的制备主要有以下几种方法:(1)碳酸铵法:将苯甲酸和尿素混合,在加热过程中加入碳酸铵,反应生成酚酞。
(2)气相法:利用氯化铁为催化剂,将苯和二氧化碳在高温下反应,生成酚酞。
(3)还原法:在碱性条件下,利用亚硝基苯和苯酚的氧化还原反应,生成酚酞。
2. 萘酚的制备萘酚是一种重要的芳香化合物,广泛应用于染料、医药和燃料等领域。
目前,萘酚的制备主要有以下几种方法:(1)萘的氢化:利用金属钠作为催化剂,将萘与氢气在高压下反应,生成萘酚。
(2)萘的硝化还原:将萘进行硝化反应,得到硝基萘,在还原的过程中,硝基被还原成氨基,生成萘酚。
(3)乙酰化反应:将萘和醋酸混合,在加热过程中,萘乙酰化生成乙酰萘,再经过还原反应,生成萘酚。
3. 联苯酚的制备联苯酚是一种芳香化合物,广泛应用于医药、化妆品、染料等领域。
目前,联苯酚的制备主要有以下几种方法:(1) Friedel-Crafts重氮化合成法:将氯苯基甲醛与苯胺重氮化生成2-氯-5-联苯酚,再经过重氢化还原,得到联苯酚。
(2)双催化剂催化合成法:将2,4,6-三氯吡啶和2-苯氨基苯在四氢呋喃中反应,生成联苯酚。
(3)双亲核芳香烃合成法:将二苯乙烯和苯酚在氨水存在下加热反应,生成联苯酚。
二、酚类化合物的生物学效应酚类化合物具有广泛的生物学效应,其中一些化合物被广泛应用于医药、农药和杀虫剂等领域。
同时,酚类化合物也是一些药物和化学污染物的主要成分,对人体健康和生态环境造成较大影响。
植物单宁化学全文共四篇示例,供读者参考第一篇示例:植物单宁是一类重要的天然化合物,存在于许多植物中,包括水果、蔬菜、茶叶、红酒等。
植物单宁在植物生长和防御系统中起着重要的作用,被认为具有抗氧化、抗炎、抗癌等多种生物活性。
本文将探讨植物单宁的化学结构、生物学活性和相关研究进展。
一、植物单宁的分类植物单宁是一类多酚化合物,根据它们的生物合成途径和结构特征,可以分为多种类型,常见的包括原花青素、黄酮类单宁、鞣花酸类单宁等。
这些不同类型的植物单宁在植物中起着不同的生理功能和生物学活性。
1. 原花青素原花青素是一类由花青素构成的植物单宁,它们通常呈现为深紫色或蓝色。
原花青素在许多水果和蔬菜中广泛存在,如蓝莓、黑莓、茄子等。
原花青素具有很强的抗氧化活性,能够清除体内的自由基,保护细胞免受氧化损伤。
2. 黄酮类单宁黄酮类单宁是一类含有黄酮结构的植物化合物,常见于茶叶、柑橘、苹果等植物中。
黄酮类单宁具有抗炎、抗癌、抗衰老等多种生物活性,对人体健康具有很好的保护作用。
3. 鞣花酸类单宁鞣花酸类单宁是一类多羟基芳香酸单宁,广泛存在于植物的果实、树皮和叶片中。
鞣花酸类单宁具有收敛作用,具有良好的抗菌、抗病毒和抗氧化活性,可用于药用和食品工业中。
二、植物单宁的生物活性植物单宁作为天然抗氧化剂,具有很强的抗氧化活性,能够清除自由基、抑制氧化反应,保护细胞免受氧化损伤。
植物单宁还具有抗炎、抗癌、抗菌、抗病毒等生物活性,对人体健康具有多种益处。
1. 抗氧化活性植物单宁富含多酚结构,具有较强的还原性和抗氧化活性,能够捕捉体内的自由基,阻止氧化反应的进行,减少氧化应激对细胞的损害,保护细胞健康。
2. 抗炎作用许多研究表明,植物单宁能够抑制炎症反应的发生,减轻炎症症状,降低炎症相关疾病的风险。
植物单宁通过调节炎症途径的信号转导,抑制炎症介质的释放,达到抗炎的效果。
植物单宁被认为具有抗癌活性,可以抑制肿瘤细胞的增殖和转移,诱导肿瘤细胞凋亡,阻断肿瘤的发展。
植物儿茶酚生物合成及其生理功能的研究
儿茶酚是植物体内的一种重要的次生代谢产物,广泛存在于植物的种子、花朵、叶子及果实等部位中。
儿茶酚可以由芳香族氨基酸,如苯丙氨酸和酪氨酸等通过生物合成途径合成。
随着植物基因组学研究的深入以及高通量技术的发展,植物儿茶酚生物合成及其生理功能的研究受到越来越多的重视。
一、植物儿茶酚生物合成的途径及关键酶类
儿茶酚生物合成途径是复杂的,包括从芳香族氨基酸开始,经过多个酶类途径
的协同作用最终合成出儿茶酚。
其中,大多数儿茶酚生物合成途径都涉及到苯丙氨酸和酪氨酸。
苯丙氨酸可以通过苯丙氨酸羟化酶(PAL)、环己烯酰-CoA合酶
(C4H)、肉桂酰-CoA的合成酶(4CL)等多个酶类途径逐步转化成肉桂酸。
而
酪氨酸主要途径包括酪氨酸羟化酶(TyrH)、儿茶酚酸-O-甲基转移酶(OMT)等。
其中,PAL是儿茶酚生物合成途径中的关键酶类之一,它可以催化苯丙氨酸转
化成肉桂酸,这也是其作用于苯丙氨酸途径的第一个反应阶段。
除此之外,TyrH
是另一个比较重要的关键酶类,它可以催化酪氨酸的羟化反应,从而形成L-DOPA,是儿茶酚生物合成途径中的另一个重要关键酶类。
二、植物儿茶酚的生理功能
儿茶酚作为植物次生代谢产物存在于许多植物体内,并发挥着不同的生理作用。
其中,保护植物免受环境压力的影响是重要的生理功能之一。
儿茶酚可以通过靶向性抗氧化作用和仿生作用,保护植物免受严酷的环境胁迫的影响。
同时,儿茶酚还可以作为一种天然的防御物质对抗动物对植物的食害,这种保护作用在各种植物体内都有体现。
此外,儿茶酚还具有抗菌作用,首先可具有干扰细胞膜、细胞壁、细胞膜蛋白、核酸的生物合成等防御机制,进而抑制细菌的生长,一些研究结果表明儿茶酚具有一定的抗菌活性。
此外,儿茶酚的结构中存在酚类羟基,具有良好的抗氧化作用,
能够清除自由基并抵抗氧化应激,从而繁殖发挥着预防癌症、心血管疾病等多种作用。
三、植物儿茶酚的开发利用
随着植物基因组学研究的深入以及高通量技术的发展,人们越来越重视植物儿茶酚的开发和利用。
目前,儿茶酚已被应用于多个领域,例如食品、药品及化妆品行业。
食品行业中,儿茶酚可以被作为天然的着色剂和添加剂添加到许多食品中,例如冰淇淋中的朱古力、咖啡等。
同时,儿茶酚还可以用作黄油、奶酪等的防腐剂。
在药品行业中,由于儿茶酚具有抗氧化、抗癌等多种生理功能,因此已经被开发成为一种新型的治疗癌症、心脑血管疾病的药物。
例如,一些研究表明,儿茶酚能在一定程度上抑制癌细胞的生长和扩散,进而起到一定的治疗作用。
在化妆品行业中,儿茶酚可以被应用于多种化妆品中。
例如,儿茶酚可以被添加到化妆品中作为一种天然的抗菌剂和抗炎剂,从而改善皮肤问题。
总的来说,儿茶酚是一种重要的植物次生代谢产物。
随着植物基因组学研究的深入以及高通量技术的发展,人们对植物儿茶酚生物合成及其生理功能的研究越来越深入。
同时,儿茶酚的开发利用也逐渐成熟,并被广泛应用于食品、药品和化妆品等领域。