有机化学课后习题答案(未校对,可能有错)
- 格式:pdf
- 大小:595.78 KB
- 文档页数:26

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (77)第十三章含硫和含磷有机化合物 (85)第十四章碳水化合物 (88)第十五章氨基酸、多肽与蛋白质 (99)第十六章类脂化合物 (104)第十七章杂环化合物 (113)Fulin 湛师第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H HHCC HH HH或 b.H C H c.H N Hd.H S He.H O NO f.O C H Hg.O POO H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。


有机化学课后习题参考答案
一、选择题
1. 答案:B
解析:选择题的题目解析。
2. 答案:A
解析:选择题的题目解析。
二、填空题
1. 答案:催化剂
解析:填空题的题目解析。
2. 答案:氧化还原
解析:填空题的题目解析。
三、判断题
1. 答案:正确
解析:判断题的题目解析。
2. 答案:错误
解析:判断题的题目解析。
四、解答题
1. 答案:解答内容的答案。
解析:解答题的题目解析。
2. 答案:解答内容的答案。
解析:解答题的题目解析。
五、综合题
答案:综合题的答案。
解析:综合题的题目解析。
六、总结
本文提供了有机化学课后习题的参考答案,包括选择题、填空题、判断题、解答题和综合题等不同类型的题目。
通过学习这些题目的解析,可以帮助读者更好地理解有机化学的相关知识点,并提高解题能力。
希望这些参考答案能够对大家有所帮助。

第一章、绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
1.2NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液是否相同?如将CH 4 及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么?答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na + , K + , Br -, Cl -离子各1mol 。
由于CH 4 与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4 写出下列化合物的Lewis 电子式。
a. C 2H 4b. CH 3Clc. NH 3d. H 2Se. HNO 3f. HCHOg. H 3PO 4h. C 2H 6i. C 2H 2j. H 2SO 4答案:a.C C H H H HCC HH HH或 b.H C H c.H N H Hd.H S H e.H O NOf.O C H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5 下列各化合物哪个有偶极矩?画出其方向。
a. I 2b. CH 2Cl 2c. HBrd. CHCl 3e. CH 3OHf. CH 3OCH 3 答案:b.ClClc.HBrd.He.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键? 答案:电负性 O > S , H 2O 与H 2S 相比,H 2O 有较强的偶极作用及氢键。

目录第一章绪论 0第二章饱与烃 (1)第三章不饱与烃 (4)第四章环烃 (13)第五章旋光异构 (21)第六章卤代烃 (26)第七章波谱法在有机化学中的应用 (30)第八章醇酚醚 (41)第九章醛、酮、醌 (50)第十章羧酸及其衍生物 (61)第十一章取代酸 (68)第十二章含氮化合物 (74)第十三章含硫与含磷有机化合物 (82)第十四章碳水化合物 (85)第十五章氨基酸、多肽与蛋白质 (96)第十六章类脂化合物 (101)第十七章杂环化合物 (109)Fulin 湛师第一章 绪论1、1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1、2 NaCl 与KBr 各1mol 溶于水中所得的溶液与NaBr 及KCl 各1mol 溶于水中所得溶液就是否相同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物就是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中就是以分子状态存在,所以就是两组不同的混合物。
1、3碳原子核外及氢原子核外各有几个电子?它们就是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子就是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H CCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1、4写出下列化合物的Lewis 电子式。
a 、C 2H 4b 、CH 3Clc 、NH 3d 、H 2S e、HNO 3 f 、HCHO g 、H 3PO 4 h 、C 2H 6 i 、C 2H 2 j 、H 2SO 4 答案:a.C C H H H HCC HH HH 或 b.H C H H c.H N H Hd.H S H e.H O NOf.OC H Hg.O P O O H H Hh.H C C HHH H HO P O O H HH或i.H C C Hj.O S O HH OS H H或1、5下列各化合物哪个有偶极矩?画出其方向。


目录第一章绪论.......................................................................................................................................第二章饱和烃...................................................................................................................................第三章不饱和烃...............................................................................................................................第四章环烃.......................................................................................................................................第五章旋光异构...............................................................................................................................第六章卤代烃...................................................................................................................................第七章波谱法在有机化学中的应用...............................................................................................第八章醇酚醚...................................................................................................................................第九章醛、酮、醌...........................................................................................................................第十章羧酸及其衍生物...................................................................................................................第十一章取代酸...............................................................................................................................第十二章含氮化合物.......................................................................................................................第十三章含硫和含磷有机化合物...................................................................................................第十四章碳水化合物.......................................................................................................................第十五章氨基酸、多肽与蛋白质...................................................................................................第十六章类脂化合物.......................................................................................................................第十七章杂环化合物....................................................................................................................... Fulin 湛师第一章绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
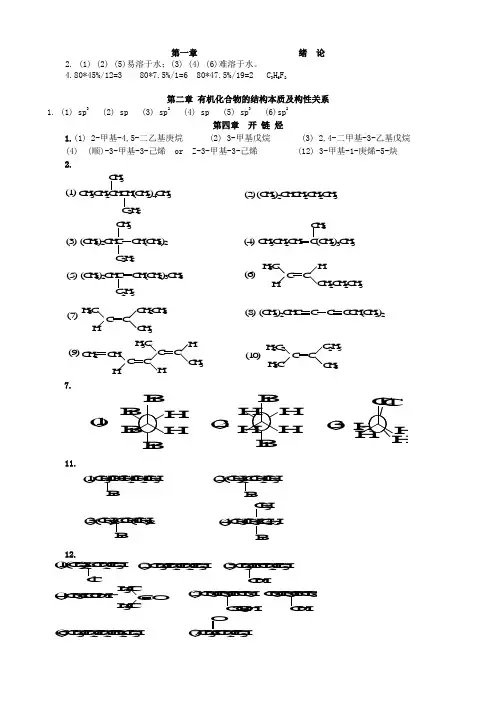
第一章绪论2. (1) (2) (5)易溶于水;(3) (4) (6)难溶于水。
4.80*45%/12=3 80*7.5%/1=6 80*47.5%/19=2 C3H6F2第二章有机化合物的结构本质及构性关系1.(1) sp3 (2) sp (3) sp2 (4) sp (5) sp3 (6)sp2第四章开链烃1.(1) 2-甲基-4,5-二乙基庚烷 (2) 3-甲基戊烷 (3) 2,4-二甲基-3-乙基戊烷(4) (顺)-3-甲基-3-己烯 or Z-3-甲基-3-己烯 (12) 3-甲基-1-庚烯-5-炔2.7.11.12.14. (5) > (3) > (2) > (1) > (4) 即: CH2=CHC +HCH 3 >(CH3)3C + >CH 3CH 2C +HCH 3 >CH 3CH 2CH 2C +H 2> (CH 3)2CHC +H 216. (1)(2)(3)17.21AB.10.(1)CH 3-CH=CH 2−−−−−→−+H /KMnO 4CH 3COOH(2)CH 3-C≡CH+HBr(2mol ) CH 3CBr 2CH 3(3)CH 3-3-C=CH 2−−→−2Br CH 3CBr 2CH 2Br 第四章 环 烃 2.1-戊烯 1-戊炔 戊 烷Br 2/CCl 4室温,避光√ 溴褪色√ 溴褪色× × √灰白色1-丁炔 2-丁炔 丁 烷Br 2/CCl 4 室温,避光√溴褪色 × Ag(NH 3)2+√灰白色↓ × ×1,3-丁二烯 1-己炔 2,3-二甲基丁烷Br 2/CCl 4√ 溴褪色 √ 溴褪色 × Ag(NH 3)2+×√ 灰白色↓C(CH 3)3CH 3(1)(2)(3)3.(1)反式CH 3Br(3)顺式4.C H 3B rC lC l +C l C lC O O HH 3CO 2N (C H 3)3C C O O H(1)(2)(3)(4)(5)(6)(7) B rC 2H 5C 2H 5B r +C H 3C O C H 3(C H 3)2C C H (C H 3)2B r(8) 1molCl 2 / h, 苯/无水AlCl 3N H C O C H 3N O 2C H 3C H 3S O 3H(9) (10)7. (2)有芳香性 10.第六章 旋光异构6-32. (1)× (2)× (3)× (4)√ (5)√ (6)√7.2.66120678.58.18][20+=⨯÷+=⨯=l c Dαα第七章 卤 代 烃2、C l C lC l (2)4、第八章 醇、酚、醚1. (1) 3-甲基-3-戊烯-1-醇 (2) 2-甲基苯酚 (3) 2,5-庚二醇 (4) 4-苯基-2-戊醇 (5) 2-溴-1-丙醇 (6) 1-苯基乙醇(7) 2-硝基-1-萘酚 (8) 3-甲氧基苯甲 (9) 1,2-二乙氧基乙烷(乙二醇二乙醚)(1)(2)3、4. (1) 甲醇 分子间氢键 (6) 邻硝基苯酚 分子内氢键、分子间氢键 5、(1)CH 2IH 3COOH(5)(6)HOOCH 3H(7)6、AgNO 3/乙醇,室温白↓× ×AgNO 3/乙醇,加热白↓×OH+OHBrBr(1)(2)10、OH O ClA B C D第九章醛、酮、醌一、命名下列化合物。

目录第一章绪论 (1)第二章饱和烃 (2)第三章不饱和烃 (6)第四章环烃 (14)第五章旋光异构 (23)第六章卤代烃 (28)第七章波谱法在有机化学中的应用 (33)第八章醇酚醚 (43)第九章醛、酮、醌 (52)第十章羧酸及其衍生物 (63)第十一章取代酸 (71)第十二章含氮化合物 (78)第十三章含硫和含磷有机化合物 (86)第十四章碳水化合物 (89)第十五章氨基酸、多肽与蛋白质 (100)第十六章类脂化合物 (105)第十七章杂环化合物 (114)Fulin 湛师4 4 3 3第一章 绪论1.1 扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:离子键化合物共价键化合物熔沸点 高低溶解度 溶于强极性溶剂溶于弱或非极性溶剂硬度高低1.2 NaCl 与 KBr 各 1mol 溶于水中所得的溶液与 NaBr 及 KCl 各 1mol 溶于水中所得溶液是否相同?如将 CH 4及 CCl 4 各 1mol 混在一起,与 CHCl 3 及 CH 3Cl 各 1mol 的混合物是否相同?为什么?答案:NaCl 与 KBr 各 1mol 与 NaBr 及 KCl 各 1mol 溶于水中所得溶液相同。
因为两者溶液中均为 Na +,K +,Br -, Cl -离子各 1mol 。
由于 CH 与 CCl 及 CHCl 与 CHCl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3 碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷 ( CH 4 )时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624H+11yyyC1s 2s 2p 2p 2p yHxz 2p xxz2p yxxz 2p zz 2sCH 4 中C 中有 4个电子与氢成键 为 SP 3杂化轨道 ,正四面体结构HCH 4 SP 3杂化C HHH1.4 写出下列化合物的 Lewis 电子式。


欧阳学创编目录Fulin 湛师欧阳学创编第一章 绪论1.1扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2 NaCl 同?如将CH 4及CCl 4各1mol 混在一起,与CHCl 3及CH 3Cl 各1mol 的混合物是否相同?为什么? 答案:NaCl 与KBr 各1mol 与NaBr 及KCl 各1mol 溶于水中所得溶液相同。
因为两者溶液中均为Na +,K +,Br -, Cl -离子各1mol 。
由于CH 4与CCl 4及CHCl 3与CH 3Cl 在水中是以分子状态存在,所以是两组不同的混合物。
1.3碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH 4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:C+624HCCH 4中C 中有4个电子与氢成键为SP 3杂化轨道,正四面体结构CH 4SP 3杂化2p y2p z2p x2sH1.4写出下列化合物的Lewis 电子式。
a.C 2H 4b.CH 3Clc.NH 3d.H 2Se.HNO 3f.HCHOg.H 3PO 4h.C 2H 6i.C 2H 2j.H 2SO 4 答案:a.C C H H H HCC HH HH或 b.H C H c.H N H Hd.H S H e.H O NOf.O C H Hg.OP OO H H Hh.H C C HH HO P O O H HH或i.H C C Hj.O S O HH OH H或1.5下列各化合物哪个有偶极矩?画出其方向。
a.I 2b.CH 2Cl 2c.HBrd.CHCl 3e.CH 3OHf.CH 3OCH 3 答案:b.ClClc.HBrd.He.H 3COHH 3COCH 3f.1.6 根据S 与O 的电负性差别,H 2O 与H 2S 相比,哪个有较强的偶极-偶极作用力或氢键? 答案:电负性O>S,H 2O 与H 2S 相比,H 2O 有较强的偶极作用及氢键。
有机化学第五版课后习题答案有机化学是化学科学中的一个重要分支,研究有机化合物的结构、性质、合成和反应机理等。
在学习有机化学的过程中,课后习题是检验学习效果和提高理解能力的重要手段。
本文将针对《有机化学第五版》的课后习题,给出一些答案和解析,帮助读者更好地理解和掌握有机化学知识。
一、反应机理和结构分析题1. 以下化合物的分子式为C5H12O,请给出它们的结构式。
答案:(1)2-甲基丁醇;(2)异戊醇;(3)2-甲基-2-丁醇。
解析:根据分子式C5H12O,可以推测出这是一个醇类化合物。
醇的通式为CnH2n+2O,根据这个规律,我们可以确定它们的结构式。
2. 以下反应中,哪一个是亲核取代反应,哪一个是亲电取代反应?请给出反应机理。
答案:(1)亲核取代反应;(2)亲电取代反应。
解析:亲核取代反应是指亲核试剂攻击亲电中心,形成新的化学键。
亲电取代反应是指亲电试剂攻击亲核中心,形成新的化学键。
根据反应机理和试剂的性质,可以判断出哪个是亲核取代反应,哪个是亲电取代反应。
二、合成题1. 请用适当的试剂合成以下化合物。
答案:(1)苯甲醛:苯基甲醇经过氧化反应得到苯甲醛;(2)苯甲酸:苯基甲醇经过氧化反应得到苯甲酸;(3)苯甲醚:苯基甲醇和H2SO4反应得到苯甲醚。
解析:根据目标化合物的结构和反应条件,可以选择合适的试剂和反应条件进行合成。
合成的关键在于选择适当的反应,根据反应机理进行推导。
三、解析题1. 以下化合物的IR光谱图中,哪一个峰代表羟基的伸缩振动?答案:(2)。
解析:根据IR光谱图的特征峰和波数范围,可以判断出哪个峰代表羟基的伸缩振动。
羟基的伸缩振动一般在3200-3600 cm-1的波数范围内。
2. 以下化合物的NMR光谱图中,哪一个峰代表甲基的化学位移?答案:(3)。
解析:根据NMR光谱图的特征峰和化学位移范围,可以判断出哪个峰代表甲基的化学位移。
甲基的化学位移一般在0-2 ppm的范围内。
四、机理题1. 以下反应的机理是什么?请给出反应步骤和中间体。
有机化学课后习题参考答案第一章、绪论扼要归纳典型的以离子键形成的化合物与以共价键形成的化合物的物理性质。
答案:1.2NaCl与KBr各1mol溶于水中所得的溶液与NaBr及KCl各1mol溶于水中所得溶液是否相同?如将CH4 及CCl4各1mol混在一起,与CHCl3及CH3Cl各1mol的混合物是否相同?为什么?答案:NaCl与KBr各1mol与NaBr及KCl各1mol溶于水中所得溶液相同。
因为两者溶液中均为Na+ , K+ , Br-, Cl-离子各1mol。
由于CH4 与CCl4及CHCl3与CH3Cl在水中是以分子状态存在,所以是两组不同的混合物。
碳原子核外及氢原子核外各有几个电子?它们是怎样分布的?画出它们的轨道形状。
当四个氢原子与一个碳原子结合成甲烷(CH4)时,碳原子核外有几个电子是用来与氢成键的?画出它们的轨道形状及甲烷分子的形状。
答案:写出下列化合物的Lewis电子式。
a. C2H4b. CH3Clc. NH3d. H2Se. HNO3f. HCHOg. H3PO4h. C2H6i. C2H2 j. H2SO4答案:下列各化合物哪个有偶极矩?画出其方向。
a. I2b. CH2Cl2c. HBrd. CHCl3e. CH3OHf. CH3OCH3答案:1.6根据S与O的电负性差别,H2O与H2S相比,哪个有较强的偶极-偶极作用力或氢键?答案:电负性 O > S , H2O与H2S相比,H2O有较强的偶极作用及氢键。
1.7下列分子中那些可以形成氢键?答案:d. CH3NH2e. CH3CH2OH1.8醋酸分子式为CH3COOH,它是否能溶于水?为什么?答案:能溶于水,因为含有C=O和OH两种极性基团,根据相似相容原理,可以溶于极性水。
第二章饱和烃2.1卷心菜叶表面的蜡质中含有29个碳的直链烷烃,写出其分子式。
C29H602.2用系统命名法(如果可能的话,同时用普通命名法)命名下列化合物,并指出(c)和(d) 中各碳原子的级数。
有机化学课后习题答案第一章绪论习题参考答案1. 某化合物的分子量为60,含碳%、含氮%、含氧%,确定该化合物的分子式。
解:① 由各元素的百分含量,根据下列计算求得实验式1:2:133.3:7.6:34.3162.53:17.6:121.40== 该化合物实验式为:CH 2O② 由分子量计算出该化合物的分子式216121260=+?+该化合物的分子式应为实验式的2倍,即:C 2H 4O 22. 在C —H 、C —O 、O —H 、C —Br 、C —N 等共价键中,极性最强的是哪一个?解:由表1-4可以查得上述共价键极性最强的是O —H 键。
3. 将共价键⑴ C —H ⑵ N —H ⑶ F —H ⑷ O —H 按极性由大到小的顺序进行排列。
解:根据电负性顺序F > O > N > C ,可推知共价键的极性顺序为: F —H > O —H > N —H > C —H4. 化合物CH 3Cl 、CH 4、CHBr 3、HCl 、CH 3OCH 3中,哪个是非极性分子?解:CH 4分子为高度对称的正四面体空间结构,4个C —H 的向量之和为零,因此是非极性分子。
5. 指出下列化合物所含官能团的名称和该化合物所属类型。
CH 3OH(2)碳碳三键,炔烃羟基,酚(4)COOH酮基,酮羧基,羧酸(6) CH 3CH 2CHCH 3OH醛基,醛羟基,醇(1) CH 3CH 2C CH(3) CH 3COCH 3(5) CH 3CH 2CHO(7) CH3CH2NH2氨基,胺6. 甲醚(CH3OCH3)分子中,两个O—C键的夹角为°。
甲醚是否为极性分子?若是,用表示偶极矩的方向。
解:氧原子的电负性大于碳原子的电负性,因此O—C键的偶极矩的方向是由碳原子指向氧原子。
甲醚分子的偶极矩是其分子中各个共价键偶极矩的向量之和,甲醚分子中的两个O—C键的夹角为°,显然分子是具有极性的,其偶极矩的方向如下图所示。
第一章1、(1) 有机化合物:含碳化合物(一氧化碳、二氧化碳、碳酸盐、金属碳化物等少数简单含碳化合物除外)或碳氢化合物及其衍生物的总称。
有机物是生命产生的物质基础。
(2)共价键:共价键(covalent boud)是化学键的一种,两个或多个原子共同使用它们的外层电子,在理想情况下达到电子饱和的状态,由此组成比较稳定的化学结构叫做共价键。
(3)同分异构:同分异是一种有相同化学式而有不同原子排列的化合物的异构现象。
(4)杂化:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合,形成一组新的轨道,这个过程叫做轨道的杂化。
(5)偶极矩:正、负电荷中心间的距离r和电荷中心所带电量q的乘积,叫做偶极距μ=rq。
它是一个矢量,化学中方向规定为从正电荷中心指向负电荷中心。
(6)诱导效应:在有机分子中引入一原子或基团后,使分子中成键电子云密度分布发生变化,从而使化学键发生极化的现象,称为诱导效应(Inductive Effects)。
(7)异裂:共价键断裂时,共用电子对完全转移给成键原子中的某个原子,形成了正、负离子,这种断键方式称为异裂。
(8)范德华力:在化学中通常指分子之间的作用力。
(9)键角:分子中两个相邻化学键之间的夹角。
(10) Lewis酸:路易斯酸(Lewis Acid,LA)是指电子接受体,可看作形成配位键的中心体。
(11) 疏水作用:非极性分子间或分子的非极性基团间的吸引力。
导致这些基团在水性环境中的缔合。
(12)官能团:决定有机物性质的原子或原子团称为官能团。
2、(1) H:S:H(2)H:N:HH(3)H:C:HHH (4) H:C:HO(5)H:C:O:C:HH HH(6) H:O:P:O:H:O(7)H:C:C::C:HHHH H(8)H:C:C:O:HO:HH (9)C:H3、具有偶极的分子:(1)两H原子中心指向O原子方向;(2)由H原子指向Br原子;(4)H原子指向三个Cl原子的中心方向;(5)乙基指向羟基方向4、(1)正庚烷;(2)异丁烷;(3)异已烷;(4)新戊烷6、酸:Cu2+ FCl3CH3CN碱: NH3CH3NH2 C2H5OC2H5加合物: CH3COOH CH3OH7、(1) CH3COOH/CH3COO-H3O+/H2O(2) H2SO4/HSO4-CH3OH2+/CH3OH(3) HNO3/NO3-(CH3)3NH+/(CH3)3N8、(2)CH3F > (3) CH3Cl > (4) CH3Br > (5) CH3I > (1) CH49、 单键最长,双键次之,叁键最短,单键中两个原子间的电子云密度小,叁键两个原子间的电子云密度最大,共同的电子把两个原子吸引得最近。
所以说,叁键最短,单键最长,双键处于中间。
10、C5H12OCH3CH2CH2CH2CH2CH3CH2CH2CHCH3CH3CH2CHCH2CH3OHCH3CHCH2CH23CH3CHCHCH3CH3CH3CCH2CH3CH3OHCH2CHCH2CH3 OH3CH3CCH3CH2OHCH311. C8H10N4O2第二章1、(3)> (2) > (1) > (5) > (4)2、链引发Cl2Cl链增长 Cl +CH3CH3CH3CH2+HCl CH3CH2+Cl2CH3CH2Cl+Cl2CH3CH2CH3CH2CH2CH3CH3CH2+Cl CH3CH2Cl2Cl Cl2链终止反应所经历的过渡态:[Cl- H- CH2CH3] [CH3CH2- Cl- Cl】反应所经历的中间体:CH3CH23、2—甲基丁烷较稳定的构象是:(1)3H3HH(2)CHCH3(3)3H3其中(1)和(2)更稳定。
4、(1)CH3Br HCH3BrH(2)CH2CH3H HCH3ClH(3)CHCl CH3BrH HCH2(4) 3(5)2CH3 H35、(1)CH3Br(2)(3)BrBr(4)C ICH3CH36、 (1) H3C3C(CH3)3(2)H3CHH(3)HHHH7、(2) > (1) > (4) > (3)8、(1) 7,7—二甲基三环[2.2.1.02,6]庚烷(2)三环[3.3.1.13,7]癸烷9、(1)Cl(2)CH(CH3)2(3)Br(4)C(CH3)310、CH3CHCH2CH2CH3CH311、该烷烃的分子式为C8H18。
由于只能生成一种一氯产物,说明该烷烃中的18个氢原子是等性的,其结构式为:(CH3)3C3)3。
12、2—甲基—1—溴丙烷的含量为0.6%,2—甲基--2—溴丙烷的含量为99.4%。
第三章1、(1) CH2CHCH2CH3 (2) CH2C(CH3)2(3)H H3CH CH31—丁烯2—甲基—1—丙烯(E)--2—丁烯(4)H3CH HCH3(5) (6)CH3 (z)—2—丁烯环己烷1—甲基环丙烷2、(3)、(4)为共轭化合物;(1)、(3)、(4)有顺反异构。
3、(1)E型(2)E型(3)Z型(4)E型4、(1)沸点:顺—2—丁烯 > 反—2—丁烯,因为顺式的偶极矩大熔点:反式>顺式,因为反式的对称性好,分子排列紧密。
(2)熔点:2—丁炔>1—丁炔,因为2—丁炔对称好,分子排列紧密。
沸点;2—丁炔>1—丁炔,因为末端炔烃具有较低的沸点。
5、CH2CHCHCCH2CH3HC CHHC HCH2CH3H2C(3Z)—1,3—己二烯(3E)--1,3—己二烯H3CC HCHC CCH3HHH3CCHCHC CHCH3H(2E,4Z)—2,4—己二烯(2Z,4E)--2,4—己二烯H3CC H CCHCH2CH3H3CC CCHCH2H3CH(3Z)—2—甲基—1,3戊二烯(3E)--2—甲基1,3戊二烯H 3C CCHH C CH 3CH 2H 3C CC HCH 3HCCH 2(3Z)—3—甲基—1,3戊二烯 (3E )--3—甲基--1,3戊二烯H 2CCHCCH 2CH 2CH 3H 2CCC2CH 3CH32—乙基—1,3—丁二烯 2,3—二甲基—1,3—丁二烯H 2CC HC HC CH 3CH 34—甲基—1,3—戊二烯6、3+> CH 3+>3+> 2+7、生成的主要产物是4—甲基—3—溴环戊烯。
反应机理为自由基取代历程。
8、(1)H 3CC CH 3BrCH 3(2)CH 2ClOH(3) ClCH 2CH 2CCl 3(4) CH 3CH 2CH COCH 3 (5) CH 3C 2CH 3 (6) BrCH 2CH2Br (7)COOH +O(8)CH3Br(9)CH3OH(10)HHCH3(11)(12)O(13)H 3CCN9、化合物的结构式为:反应式:+2H 2Zn 2OHC+OHC CH 2CH CH3CHO10、(1) 第一步用顺丁烯二酸检验,有沉淀生成为1,3—丁二烯;第二步用溴水检验,不褪色者为丁烷;第三步用酸性高锰酸钾溶液检验,褪色者为1—丁烯;余者为甲基环丙烷。
(2)第一步用硝酸银的氨溶液或氯化亚铜的氨溶液检验,有沉淀者为1-戊炔;第二步用溴水检验,不褪色者为环戊烷;第三步用酸性高锰酸钾溶液检验,褪色者为环戊烯。
余者为乙基环丙烷。
11、(1) p-π共轭,σ-p 共轭 (2) p-π共轭,σ-π共轭(3) p-π共轭 (4) π-π共轭, p-π共轭, σ-p 共轭 12、(1)CH 3C CH 3CH 2CH 3CH 3反应为催化加氢,不生成碳正离子反应过程中不会发生碳正离子的重排(2)CH3-C-CH2-CHCH3CH3CH3I不能生成更稳定的碳正离子,反应过程中不会发生谈真理子的重拍(3)CH3-C-CH2CH2BrCH3CH3反应为自由基加成,不生成碳正离子,反应过程中不会发生碳正离子的重排13、 (3)<(1)<(2) 14、(1)+-Cl15、(1)后一个式子是错误,不符合八偶体结构(2)后一个式子是错误,它的未成对电子数目不对(3)正确(4)两个式子间不是单纯的电子转移,原子位置发生了转变 16、17、 A.环丁烷 B.甲基环丙烷 C.1-丁烯 D.2-甲基丙烯 E.F 为顺势和反式2-丁烯 18、19、AC.CH3CHCCH2CH3CH3第四章 1、(2)CCH(3)CH 2Br(4)(5)32、Br3、(1)对叔丁基甲苯 (2)2-硝基-4-氯甲苯 (3)对乙烯基苯甲酸 (4)2,4,6-三硝基甲苯 (5)2——甲基-3-苯基丁烷4、5、CH 2CH CH+CH26、(2)和(7)(1)CHNO2CH2NO2(3)CH3(4)CH3(5)NH2(6)CCl3(7)(8)3 7、8、9、(1)D>E>A>B>C (2)B>D>E>A>C(3)C>A>D>B (4)C>D>B>A10(!)(2)(3)(5)(6)(7)及其对应体,其中(7)采取椅式构象,,cl在e键上,更稳定11、(1)3,6-二甲基-二硝基苯(2)9,10-二溴菲12、13、四甲基苯的异构体有:(1)CH3(2)333(3)3CH3CHCH其中(3)的对称性最好,熔点最高。
14、A33NO 2B C15、(1)(2)(3)25AlCl 3324Cl h rNaOH 醇24ClFeH+/H OBr FeHNO 324(CH 3)2C=CH 216、(1)有 (2)无(3)无 (4)无(5)有 (6)有 17、(1)(2)CH 2CH 318.A 为19.茚茚满第五章1、(1)旋光性:一些物质能使偏振光震动平面旋转的性质称为旋光性(2)右旋,左旋:有的物质能使偏振光振动平面向右旋转称为右旋,有的物质能使偏振光振动平面向左旋转称为左旋。
(3)对映体:互为实物与镜像而不可重叠的一对异构体。
如左旋乳酸与右旋乳酸是一对对映体。
(4)比旋光度:规定旋光管的长度为1dm ,待测物质溶液的浓度为1g/100mL ,在此条件下测得的旋光度叫做该物质的比旋光度。
(5)手性分子:结构上镜像对称而又不能完全重合的分子。
它们不管怎样旋转都不会重合,就像左手和右手那样,称这两种分子具有手性,又叫手性分子。
(6)构型与构象:构型是指具有一定构造的分子中各原子在空间的排列状况。
构象是指在一定的条件下,由于单键的旋转而产生的分子中各原子(或原子团)在空间的不同排布形象。
(7)手性现象:化学分子的实物与其镜像不能重叠的现象。
(8)手性中心:连有四个不同基团的中心碳原子,就可能是手性分子。
它的空间结构可能存在手性,其中心碳原子就是手性中心。