2013高中化学复习知识点深度剖析 专题七 第一节 化学反应速率及其影响因素
- 格式:doc
- 大小:911.50 KB
- 文档页数:19

第二章化学反应速率和化学平衡第一节化学反应速率一. 化学反应速率1.定义: 化学反应速率是用来衡量化学反应进行快慢程度的,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
单位:mol/(L·min)或mol/(L·s)2.计算公式v =Δc /Δt注意:①一般来说,随着化学反应的进行,浓度等外界条件在不断改变,因此在某一段时间内,化学反应的速率也在不断变化。
我们通过上述方法计算得到的速率值是指某一段时间内的平均速率。
在中学阶段只研究平均速率。
②一般不用固体物质或纯液体表示反应速率,因为固体物质或纯液体的浓度为定值。
3.特点(1) .同一反应同一段时间内用不同物质表示化学反应速率时,数值可能不同,但意义一样.(2)同一段时间内用不同物质表示的反应速率比值等于各物质化学方程式中的化学计量数之比。
如反应mA+nB=pC+qD的v (A)∶v (B)∶v (C)∶v (D)=m∶n∶p∶q (3)比较反应速率快慢一般要以同一物质的速率值作为标准来比较二. 化学反应速率的测定化学反应的速率是通过实验来测定的。
包括能够直接观察的某些性质,如释放出气体的体积和体系的压强;也包括必须依靠仪器来测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力等。
在溶液中常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率。
第二节影响化学反应速率的因素一. 影响化学反应速率的因素1.概念:(1)有效碰撞:能够发生化学反应的碰撞.(2)活化分子: 能够发生有效碰撞的分子(3)活化能: 活化分子多出的那部分能量注意: 发生有效碰撞的分子一定是活化分子,而活化分子间的碰撞不一定是有效碰撞; 活化分子间的有效碰撞是发生化学反应的充要条件。
2. 影响化学反应速率的因素分为内因和外因两个方面。
内因是指参加反应的物质本身的性质。
外因是指外界条件如浓度压强温度催化剂等。
影响化学反应速率的决定因素是内因。

化学反应的速率与影响因素知识点化学反应的速率是指反应物消耗或生成产物的速度,是化学反应动力学的重要研究对象。
速率可以受多种因素的影响,包括温度、浓度、催化剂、表面积等。
本文将介绍化学反应速率及其影响因素的相关知识。
一、化学反应速率的定义和表示方法化学反应速率定义为单位时间内反应物消耗量或产物生成量的变化量。
一般表示为ΔC/Δt,其中ΔC是反应物浓度或产物浓度的变化量,Δt是时间的变化量。
二、速率与反应物浓度的关系反应物浓度是影响化学反应速率的重要因素之一。
反应物浓度越高,化学反应发生的可能性越大,反应速率也会增加。
反应速率与反应物浓度之间的关系可以通过速率定律来描述。
速率定律一般表示为r = k[A]^m[B]^n,其中r是反应速率,k是速率常数,[A]和[B]分别是反应物A和B的浓度,m和n是反应物的反应级数。
三、速率与温度的关系温度是影响化学反应速率的另一个重要因素。
根据阿伦尼乌斯方程,速率常数k与温度呈指数关系。
阿伦尼乌斯方程表示为:k = A * e^(-Ea/RT),其中k是速率常数,A是频率因子,Ea是活化能,R是气体常数,T是温度(单位为开尔文)。
根据阿伦尼乌斯方程可知,温度升高会使活化能减小,从而提高反应物的活化能垒,加快反应速率。
四、速率与催化剂的关系催化剂是可以改变化学反应速率的物质,它提供了一个新的反应路径,降低了反应的活化能,从而加快了反应速率。
催化剂对化学反应速率的影响主要有以下两种方式:一是提供新的反应途径,降低反应的活化能垒,使反应更容易发生;二是提供了更多的活性位点,增加了反应发生的机会。
五、速率与表面积的关系固体反应通常发生在反应物和固体催化剂的表面上,反应速率与反应物和催化剂的表面积有关。
表面积越大,提供了更多的反应活性位点,反应速率也会增加。
六、速率与其他因素的关系除了上述因素外,化学反应速率还可以受到其他因素的影响。
例如,溶液中的离子强度、光照条件、压力等都可以对化学反应速率产生影响。

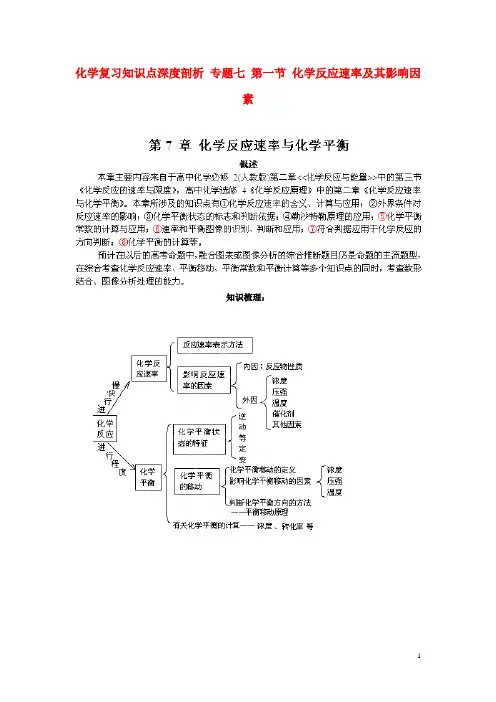
•一、化学反应速率• 1. 化学反应速率(v)•⑴定义:用来衡量化学反应的快慢,单位时间内反应物或生成物的物质的量的变化•⑵表示方法:单位时间内反应浓度的减少或生成物浓度的增加来表示•⑶计算公式:v=Δc/Δt(υ:平均速率,Δc:浓度变化,Δt:时间)单位:mol/(L·s)•⑷影响因素:•①决定因素(内因):反应物的性质(决定因素)•②条件因素(外因):反应所处的条件• 2.※注意:(1)、参加反应的物质为固体和液体,由于压强的变化对浓度几乎无影响,可以认为反应速率不变(2)、惰性气体对于速率的影响①恒温恒容时:充入惰性气体→总压增大,但是各分压不变,各物质浓度不变→反应速率不变②恒温恒体时:充入惰性气体→体积增大→各反应物浓度减小→反应速率减慢二、化学平衡(一)1.定义:化学平衡状态:一定条件下,当一个可逆反应进行到正逆反应速率相等时,更组成成分浓度不再改变,达到表面上静止的一种“平衡”,这就是这个反应所能达到的限度即化学平衡状态。
2、化学平衡的特征逆(研究前提是可逆反应)等(同一物质的正逆反应速率相等)动(动态平衡)定(各物质的浓度与质量分数恒定)变(条件改变,平衡发生变化)3、判断平衡的依据(二)影响化学平衡移动的因素1、浓度对化学平衡移动的影响(1)影响规律:在其他条件不变的情况下,增大反应物的浓度或减少生成物的浓度,都可以使平衡向正方向移动;增大生成物的浓度或减小反应物的浓度,都可以使平衡向逆方向移动(2)增加固体或纯液体的量,由于浓度不变,所以平衡_不移动_(3)在溶液中进行的反应,如果稀释溶液,反应物浓度__减小__,生成物浓度也_减小_, V正_减小__,V逆也_减小__,但是减小的程度不同,总的结果是化学平衡向反应方程式中化学计量数之和_大_的方向移动。
2、温度对化学平衡移动的影响影响规律:在其他条件不变的情况下,温度升高会使化学平衡向着___吸热反应______方向移动,温度降低会使化学平衡向着_放热反应__方向移动。

【知识梳理归纳】、化学反应速率1 .表示方法用单位时间内反应物或生成物的____________ (常用__________________________ )变化来表示,其表达式为:________________ .2. 单位:mol/(L s)或mol/(L m in).3. 同一反应(相同状态的物质)用不同物质表示的反应速率之间的关系如mA(g) + nB(g) === pY(g) + qZ(g),v(A) : v(B) : v(Y) : v(Z) = __________________________ .4. 注意的问题(1) __________________________________________ 化学反应速率是一段时间内的,且无论用反应物还是用生成物表示均取正值.⑵在一定温度下,固体和纯液体物质,改变其用量,不影响反应速率.(3)同一化学反应,相同条件下用不同物质表示的反应速率,其数值可能不同,但表示的意义相同.二、影响化学反应速率的因素1. 化学反应速率理论(1) 有效碰撞反应物分子间能___________________ 的碰撞.发生条件:①发生碰撞的分子具有较高的能量;②分子在一定的方向上发生碰撞.(2) 活化分子化学反应中,能量较高、有可能发生_____________________ 的分子.(3) 活化能活化分子的__________________ 与所有分子的 __________________ 之差.2. 影响化学反应速率的因素(1) 内因(主要因素):反应物本身的________ ,如金属与水反应的速率:N ____ Mg ____ Al.(2) 外因(其他条件不变,改变一个条件)隆化刑斗惟因索对pnr体界加的反甌堀大压劳反能速睾升高沮度■反应連率便用傩化刑.隨改变化学反应連率* *ii•逆反甩速率的改变程度反应菊河的声諏雪.光辐勲、於射线罄殿*起【问题探究】增大反应体系的压强,反应速率是否一定加快?提示:不一定,压强的改变能引起反应物浓度的改变时,反应速率才能发生改变.3 •外界条件对化学反应速率影响的原因分析觀液J®1增大单位时冋冷痒枳内活1牝分了敕内林碰t【自我诊断训练】1某温度下,浓度都是1 mol/L的两种气体X2和丫2,在密闭容器中反应生成气体Z,经过t min后,测得各物质的浓度分别为则该反应的化学方程式可表示为A . 2X2+ 3丫2 2X2Y3C . X2+ 2丫2 2XY22.下列说法正确的是(c(X2)= 0.4 mol/L , C(Y2)= 0.6 mol/L , c(Z) = 0.4 mol/L , ( )B . 3X2+ 2丫2 2X3Y2D . 2X2+ 丫2 2X2Y①参加反应的物质的性质是影响化学反应速率的主要因素的外界条件之一③决定化学反应速率的主要因素是浓度热或加压,或使用催化剂,都可以加快反应速率A .①②B .②③C.③④ D .①④②光是影响某些化学反应速率④不管什么反应,增大浓度或加3. 下列说法中正确的是()A .增大反应物浓度,能增大活化分子百分数,所以反应速率增大B .使用正催化剂,能增大活化分子百分数,所以反应速率增大C.对于任何反应,增大压强都可加快反应速率D .升高温度,只能增大吸热反应的反应速率4. 某温度下,反应H2(g) + 12(g) ^^^2HI(g)正反应为放热反应,在带有活塞的密闭容器中达到平衡.下列说法中正确的是()A .体积不变,升温,正反应速率减小B .温度、压强均不变,充入HI气体,开始时正反应速率增大C .温度不变,压缩气体的体积,平衡不移动,颜色加深D .体积、温度不变,充入氮气后,正反应速率将增大5. 将A、B置于一容积为2 L的密闭容器中,发生如下反应:4A(g) +网对反应进行到4 s末时,测得A为0.5 mol , B为0.4 mol, C为0.2 mol ,(1) 用B、C表示的该反应速率分别为v (B) = ___________ , v (C) = _________ 。

化学反应的速率与影响因素一、化学反应速率的概念化学反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
通常用反应物消失的速率或生成物产生的速率来表示。
二、化学反应速率的影响因素1.反应物浓度:反应物浓度越大,反应速率越快。
因为反应物浓度大,反应物分子之间的碰撞机会增多,从而增加了反应速率。
2.接触面积:固体与液体反应时,固体的接触面积越大,反应速率越快。
例如,煤粉的燃烧比煤块快得多。
3.温度:温度越高,反应速率越快。
因为温度高,分子运动速度快,分子之间的碰撞机会增多,从而增加了反应速率。
4.催化剂:催化剂能改变化学反应速率,有的催化剂能加快反应速率,有的催化剂能减慢反应速率。
5.压强:对于有气体参与的反应,压强越大,反应速率越快。
因为压强增大,气体分子之间的碰撞机会增多,从而增加了反应速率。
三、化学反应速率的测量化学反应速率的测量通常采用定时观察法,即在反应开始后,定时观察反应物消失或生成物产生的数量,然后计算单位时间内反应物消失或生成物产生的数量。
四、化学反应速率的计算化学反应速率可以用反应物的消失速率或生成物的产生速率来表示,通常用mol/L·s或mol/L·min表示。
例如,2H2 + O2 → 2H2O的反应速率可以用氢气或氧气的消失速率来表示。
五、化学反应速率的应用1.控制反应速率:在工业生产中,通过控制反应速率可以优化生产过程,提高产品质量。
2.加速反应:在实验室或工业生产中,通过使用催化剂或提高温度等方法,可以加速反应速率,提高生产效率。
3.减慢反应:在某些情况下,需要减慢反应速率,如在食品保存中,通过降低温度或使用抑制剂等方法,可以减慢食品腐败的速率。
化学反应速率是化学反应中重要的基本概念,影响化学反应速率的因素有反应物浓度、接触面积、温度、催化剂和压强等。
掌握化学反应速率的概念和影响因素,能够帮助我们更好地理解和控制化学反应。
习题及方法:1.习题:某化学反应的速率方程式为:v = k[A][B],其中k为速率常数,[A]和[B]分别为反应物A和B的浓度。

影响化学反应速率的因素【学习目标】1、了解活化能的含义及其对化学反应速率的影响;2、通过实验探究浓度、压强、温度和催化剂对化学反应速率的影响,认识其一般规律;3、认识化学反应速率的调控在生活、生产和科学研究领域中的重要作用。
【要点梳理】要点一、影响化学反应速率的因素参加反应的物质的性质和反应的历程,是决定化学反应速率的主要因素。
对于同一化学反应,外界条件不同,反应速率也不同,其中重要的外界条件为浓度、压强、温度、催化剂等。
有效碰撞理论能较好地解释浓度、压强、温度、催化剂等外界条件对化学反应速率的影响。
1、浓度对化学反应速率的影响①重要结论:当其他条件不变时,增大反应物的浓度,可以增大化学反应速率;减小反应物的浓度,可以减小化学反应速率。
②理论解释:在其他条件不变时,对某一反应来说,活化分子在反应物分子中所占的百分数是一定的。
增大反应物的浓度→活化分子数增多→有效碰撞次数增多→化学反应速率增大。
因此,增大反应物的浓度可以增大化学反应速率。
③几点注意:a .对于纯液体或固体物质,可认为其浓度为“常数”,它们的量的改变不会影响化学反应速率。
b .固体反应物颗粒的大小能影响化学反应速率。
固体颗粒越小,其表面积越大,与其他反应物的接触面积越大,有效碰撞次数越多,所以能增大化学反应速率。
2、压强对化学反应速率的影响①重要结论:对于有气体参加的化学反应来说,当其他条件不变时,增大气体的压强,可以增大化学反应速率;减小气体的压强,可以减小化学反应速率。
②理论解释:在其他条件不变时,增大压强,就是增大了反应物浓度→单位体积内活化分子数增多→有效碰撞次数增多→化学反应速率增大。
因此,增大压强,可以增大化学反应速率。
③几点注意:a .在讨论压强对反应速率的影响时,应区分引起压强改变的原因。
对于气体反应体系,有以下几种情况:Ⅰ.恒温时:增加压强−−−→引起体积缩小−−−→引起浓度增大−−−→引起反应速率增大 Ⅱ.恒容时:充入气体反应物−−−→引起总压增大−−−→引起浓度增大−−−→引起反应速率增大 充入“惰性气体”后总压强增大,各反应物质浓度不变,反应速率不变Ⅲ.恒压时:充入“惰性气体”−−−→引起体积增大−−−→引起各反应物浓度减小−−−→引起反应速率减小 b .由于压强的变化对固体、液体或溶液的体积影响很小,因而对它们浓度改变的影响也很小,可以认为改变压强对它们的反应速率无影响。

高考化学复习——《化学反应速率及其影响因素》知识点复习一、化学反应速率及其影响因素【知识整合】1.化学反应速率(1)概念:通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。
(2)表达式:v=常用单位:mol·L-1·s-1、mol·L-1·min-1。
(3)速率大小判断方法:对同一个反应,用不同物质表示时,数值可能不同,比较的方法是将其换算为同一种物质再进行比较,同时,还要注意其单位是否统一,若单位不统一,要先将单位统一,否则可能会得出错误结论。
①对反应物来说,Δc=c(始)-c(终);对生成物来说,Δc=c(终)-c(始)。
②表示化学反应速率时,要注明具体物质。
同一反应中,用不同的物质表示反应速率时,数值可能不同,但意义相同。
各物质的化学反应速率之比等于反应方程式中的化学计量数(系数)之比。
例如反应:mA(g)+nB(g)pC(g),其速率比为v(A)∶v(B)∶v(C)=m∶n∶p。
③固体和纯液体的浓度视为常数,因此表示化学反应速率时一般不用固体或纯液体来表示。
2.外界条件对反应速率的影响(其他条件不变,改变一个条件)浓度增大反应物的浓度,反应速率增大,反之减小。
压强对于有气体参加的反应,增大压强(反应混合物的浓度增大),反应速率加快,反之减慢。
温度升高温度,反应速率加快,反之减慢。
催化剂使用催化剂,能改变化学反应速率,且正逆反应速率的改变程度相同。
其他因素反应物间的接触面积、光照、放射线辐射、超声波等。
(1)当升高温度或增大压强时,正、逆反应速率都增大,但增大程度不同,取决于反应的热效应和方程式的化学计量数。
(2)当降低温度或减小压强时,正、逆反应速率都降低,但降低程度不同。
(3)温度对吸热方向反应速率影响程度大;压强对体积减小方向反应速率影响程度大。
3.利用有效碰撞理论理解外界条件对化学反应速率的影响【规律方法】关于化学反应速率的两个问题(1)灵活应用“反应速率之比=化学计量数(系数)之比=浓度变化量之比=物质的量变化量之比”这一公式求算化学反应速率,确定物质的化学计量数(系数)、书写化学方程式。

化学反应速率与影响化学反应速率的因素【知识点1】化学反应速率物理意义:用来表示化学反应进行的快慢程度的物理量。
定义:单位时间内浓度的变化量。
表达式:v=ΔC/Δt 单位:mol/L•min 注意:① 化学反应速率的单位由浓度和时间单位决定,时间可以是min 、s 等② 浓度的变化量对于反应物是由反应前减去反应后浓度;对于生成物是由反应后减去反应前浓度。
所以浓度的变化量是正值,速率也为正值。
③ 由于在反应中纯固体和纯液体的浓度是恒定不变的,因此对于有纯液体或纯固体参加的反应一般不用纯液体或纯固体来表示化学反应速率。
④ 化学反应速率是一段时间内的平均速率,而非瞬时速率。
⑤ 用不同反应物或生成物表示同一反应的反应速率时速率值可能不一样。
⑥ 同一反应中各物质的速率之比等于化学计量数之比。
比较化学反应进行的快慢时,应根据系数比转化为同一物质去比较例1、反应4NH 3(g)+5O 2(g)4NO(g)+6H 2O(g)在10L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol ,则此反应的平均速率)(X v (反应物的消耗速率或产物的生成速率)可表示为【 】 A .)mol/(L 0.010)(NH 3s v ⋅= B .)mol/(L 0.001)(O 2s v ⋅= C .)mol/(L 0.001(NO)s v ⋅= D .)mol/(L0.045O)(H 2s v ⋅= 例2、某温度时,在2L 容器中,X 、Y 、Z 三种物质的物质的量随时间变化的曲线如图所示。
由图中数据分析:该反应的化学方程式为_________________。
反应开始至2min ,用Z 表示的平均反应速率为____________。
例3、将气体A 、B 置于容积为为2L 的密闭容器中,发生如下反应:4A(g)+B(g)=2C(g),反应进行到4s 末,测得A 为0.5mol ,B 为0.4mol ,C 为0.2mol 。

化学复习知识点深度剖析专题七第一节化学反应速率及其影响因素知识梳理:第一节化学反应速率及其影响因素考纲解读:基础巩固1.化学反应速率(1)概念:化学反应速率是用_______________________________________________________来表示,通常用______________来表示。
(2)计算公式:_______________(3)ΔC表示__________________;Δt表示____________。
2.对于反应:mA+nB====pC+qD开始时,A的浓度为a mol·L-1,B的浓度为b mol·L-1,反应进行至t1 s时,A消耗了x mol·L-1,则反应速率可计算如下:mA + nB ==== pC + qD起始(t 0 s)时 a mol·L -1 b mol·L -10 0反应(t 1 s)时 (a-x)mol·L -1)(m nx b -mol·L -1 m px mol·L -1m qxmol·L -1则:v(A)=1t t x - mol·L -1·s -1v(B)=_______________________________ v(C)=________________________________ v(D)=________________________________从而可计算出:v(A)∶v(B)∶v(C)∶v(D)=______________。
由此可得出什么规律?对于同一反应,用不同物质表示化学反应速率,其数值是否相等?相互之间有什么关系?2.影响化学反应速率的因素:(1)内因(主要因素):反应物本身的性质,如Na 、Mg 、Al 与水反应的速率由大到小的顺序为: 。
(2)外因(其他条件不变,改变一个条件)实验探究拓展实验:1.“碘钟”实验中,3I-+S2O2-8===I-3+2SO2-4的反应速率可以用I-3与加入淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。

化学反应速率和化学平衡一、 知识纲要化学反应速率及影响速率的因素 化学反应进行的方向化学反应限度——化学平衡、等效平衡及平衡的移动考点一 化学反应速率1. 定义 :通常用单位时间内c或2. 数学表达式及单位: -1v = t,单位为 mol ·L ·min来表示。
- --1。
1 或 mol ·L 1 ·s注意事项: ①化学反应速率指的是平均速率不是瞬时速率②固体或纯液体的浓度视为定值,因此不用固体或纯液体表示反应速率。
③同一反应在同一时间内,用不同物质来表示的反应速率可能不等反应速率之比等于这些物质在化学方程式中的计量系数之比。
④比较速率大小 ,换算成相同的单位。
换算成该物质表示的速率【练 1】对于可逆反应 A(g) + 3B(s)2C(g)+ 2D(g) ,在不同条件下的化学反应速率如下, 其中表示的反应速率最快的是()-1- 1B .v(B) = 1.2 mol A .v(A) = 0.5 mol L · ·min-1- 1D .v(C)= 0.1 molC . v(D) = 0.4 mol L · ·min3. 反应速率的测定-1- 1L · ·s-1- 1L · ·s考点二影响化学反应速率的因素1. 内因 (主要因素 ): 反应物本身的性质。
2. 外因 (其他条件不变,只改变一个条件)3. 从活化分子角度的理论解释①有效碰撞:能发生反应的分子之间的碰撞——活化分子间且取向合适的碰撞②活化分子:能够发生有效碰撞的分子——即:相同温度下,能量高于分子的平均能量的分子③活化能:如图, 表示活化能; 表示 H 。
④项目单位体积内有效化学条件活化能活化分活化分子碰撞反应改变子数百分数次数速率增大浓度增大压强升高温度加催化剂4、惰性气体对反应速率的影响(1)恒容:充入“惰性气体”→总压增大→物质浓度不变 ( 活化分子浓度不变 ) ,反应速率不变。
化学反应速率及影响因素一.化学反应速率的概念及表示方法(见《赢》P59)二.有效碰撞理论1.有效碰撞:本身具有较高能量的分子之间的碰撞。
还要求考虑互相碰撞的分子之间的相对取向和由反应物变成产物的过程中起重要作用的那些中间状态。
2.活化分子:能够发生有效碰撞的分子。
3.活化能:a.概念:活化分子所多出的那部分能量。
b.反应物、生成物的能量与活化能的关系,如右图所示:E1是反应的活化能E2是活化分子变成生成物分子所放出的能量。
E1-E2是反应热。
三.影响化学反应速率的因素1.内因:2.外因:浓度、压强、温度、催化剂等(1)浓度:①原因:增大反应物浓度,该反应的活化能,活化分子百分数,单位体积内活化分子的数目,有效碰撞几率,使反应速率。
(填增大、减小、不变)。
②结论:其他条件不变时,增大反应物的浓度,反应速率;反之,减小反应物的浓度,反应速率。
③适用范围:溶液及气体反应【练习1】用3g块状大理石与30mL 3mol/L盐酸反应制取CO2气,若要增大反应速率,可采取的措施是①再加入30mL 3mol/L盐酸②改用30mL 6mol/L盐酸③改用3g粉末状大理石④加入3gNaCl固体⑤加入30mL 3mol/L NaCl溶液【练习2】一定量的盐酸跟过量的铁粉反应时,为了减缓反应速率而不影响生成H2的总量,可向盐酸中加入适量的()A. CaCO3B. Na2SO4溶液C.KNO3溶液D.水【练习3】见《赢》P60例4及P61〖变式训练2〗(2)压强①原因:对于气体反应来说,增大压强,相当于增大反应物的浓度,该反应的活化能,活化分子百分数,单位体积内活化分子的数目,有效碰撞几率,使反应速率。
(填增大、减小、不变)。
②结论:其他条件不变时,增大压强,反应速率;减小压强,反应速率。
③适用范围:有气体参加或生成的反应【练习4】对于在密闭容器中的反应,,下列条件的改变,对反应速率有何影响?⑴恒温时,缩小容器的体积至原来的1/3⑵恒温时,减小体系的压强⑶维持容器的容积不变,再充入1molN2(或H2)⑷维持容器的容积不变,向容器中充入He(5)维持体系的压强不变,向容器中充入O2(6)维持体系的压强不变,向容器中充入He【练习5】见《赢》P60例5 及〖变式训练3〗(3)温度:①原因:升高温度,一方面,该反应的活化能,活化分子百分数,单位体积内活化分子的数目,有效碰撞几率,使反应速率。
化学反应速率的影响因素和计算一、化学反应速率的概念化学反应速率是指在单位时间内反应物浓度的减少或生成物浓度的增加。
通常用反应物浓度的变化量与时间的比值来表示。
二、化学反应速率的影响因素1.反应物浓度:在其他条件不变的情况下,反应物浓度越大,反应速率越快。
2.温度:温度越高,反应速率越快。
3.压强:对于有气体参与的反应,压强越大,反应速率越快。
4.催化剂:催化剂可以加速反应速率,有些催化剂还能选择性地促进特定反应。
5.反应物接触面积:固体反应物的接触面积越大,反应速率越快。
6.光照:对于某些光敏感反应,光照可以作为引发剂,加快反应速率。
三、化学反应速率的计算1.零级反应:反应速率与反应物浓度无关,速率常数k为常数。
v = k[A]^0 = k2.一级反应:反应速率与反应物浓度成正比,速率常数k与反应物浓度有关。
v = k[A]3.二级反应:反应速率与反应物浓度的平方成正比,速率常数k与反应物浓度有关。
v = k[A]^24.多元反应:根据反应物的个数和反应速率方程,可以得到多元反应的速率方程。
四、实验操作注意事项1.控制变量:在进行反应速率实验时,要控制其他影响因素不变,只改变一个因素进行实验。
2.安全操作:遵守实验室安全规定,使用适当的防护设备。
3.准确测量:使用准确的仪器和设备进行浓度、时间的测量。
4.数据处理:合理处理实验数据,进行误差分析。
化学反应速率受到多种因素的影响,通过实验可以探究不同因素对反应速率的影响。
掌握化学反应速率的计算方法,能够帮助我们更好地理解和应用化学反应。
在实验操作中,要注意安全、准确测量,并进行数据处理和误差分析。
习题及方法:1.习题:某一级反应的速率方程为 v = k[A],若反应物的初始浓度为[A]0 = 2 M,经过3秒后,反应物浓度减少到 [A] = 0.5 M,求该反应的速率常数 k。
解题方法:根据一级反应的速率方程 v = k[A],将初始浓度和时间代入方程,得到 2 = k * 2,经过3秒后的浓度代入方程,得到 0.5 = k * 0.5。
第七章 化学反应速率与化学平衡第一讲 化学反应速率考点1 化学反应速率1.表示方法通常用单位时间内反应物浓度的减少量或生成物浓度的增加量来表示。
2.表达式v =ΔcΔt,单位:mol/(L·s)或mol/(L·min),如密闭容器中,合成氨的反应N 2(g)+3H 2(g)2NH 3(g),开始时c (N 2)=8 mol/L ,2 min 后c (N 2)=4 mol/L ,则用N 2表示该反应的反应速率为 2 mol/(L·min)。
3.与化学计量数的关系对于已知反应m A(g)+n B(g)===p C(g)+q D(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于化学计量数之比,即 v (A)∶v (B)∶v (C)∶v (D)=m ∶n ∶p ∶q 。
考点2 影响反应速率的因素1.内因反应物本身的性质是主要因素,如相同条件下Mg 、Al 与稀盐酸反应的速率大小关系为v (Mg)>v (Al)。
2.外因(只改变一个条件,其他条件不变)3.理论解释——有效碰撞理论 (1)活化分子、活化能、有效碰撞 ①活化分子:能够发生有效碰撞的分子。
②活化能:如图图中:反应的活化能为E1,使用催化剂时的活化能为E3,反应热为E1-E2。
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(2)活化分子、有效碰撞与反应速率的关系考点3化学反应速率影响因素的实验探究在研究影响化学反应速率的因素时,由于外界影响因素较多,故为弄清某个因素的影响,需控制其他因素相同或不变,再进行实验。
因此,常用变量控制思想解决该类问题。
解题策略:(1)确定变量解答这类题目时首先要认真审题,理清影响实验探究结果的因素有哪些。
(2)定多变一在探究时,应该先确定其他的因素不变,只改变一种因素,看这种因素与探究的问题存在怎样的关系;这样确定一种以后,再确定另一种,通过分析每种因素与所探究问题之间的关系,得出所有影响因素与所探究问题之间的关系。
2013化学复习知识点深度剖析专题七化学反应速率与化学平衡化学应用合成氨工业简介(1)原料:空气、水和燃料(包括煤、焦炭、天然气、石油等)(2)主要设备:压缩机、合成塔、分离器(3)原料气(N2、H2)的制备①N2的制备有两种方法②H2的制备使1 mol碳反应共得到2 mol H2,以提高原料的利用率。
除去CO2得纯净的H2。
(4)氨的合成和分离经加压后的N2和H2混合物在合成塔中催化剂(铁触媒)表面反应生成氨。
由于合成氨反应是可逆反应,达平衡时混合物中约含15%左右的氨,为了提高氨的产量,应及时分离出平衡混合物中的NH3,使平衡向右移动。
工业上是让平衡混合物通过冷凝器使氨液化而与未反应的N2、2分离,而N2和H2经过循环压缩机再送入合成塔,这种循环操作过程可提高原料的利用率。
(5)生产流程注意:①原料气在制备过程中,有O2、CO、CO2、水蒸气存在,把它们分离时,不可能把它们全部分开,因此原料气中往往混有少量的O2、CO、CO2、水蒸气和粉尘,这些物质都能使催化剂的活性减弱,甚至失去,这就是催化剂中毒。
②循环使用原料这是化工生产的一个普遍原理,在很多的化工生产中都有应用。
1、工业合成氨的原料什么?来源有哪些?2、工业合成氨包括哪些基本过程?答:工业合成氨主要包括三个基本过程:原料气的制备与净化、氨的合成、氨的分离。
见下面框图。
3、合成氨的原料气为什么要净化?怎样净化?4、氨的合成是一个放热、气体体积缩小的可逆反应,所以温度越低,压强越大,越利于氨的合成,为什么实际操作却在适当的压强和高温条件下进行?5、如何对合成的氨及未反应的原料气进行分离?答:对于从合成塔出来的混合气体,可以先用冷水冷却,使绝大部分氨液化而分离出来;再在较低温度下,用冷冻机使数量不多的氨进一步冷凝分离;分离氨后的混合气体,作为循环原理气,可以再导入合成塔进行氨的合成。
核心考点真题回放1. (2011安徽卷9)电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2 PbCrO4(s)+ 2H+(aq) ΔH< 0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是()1.A解析:正反应是放热反应,升高温度,平衡逆向移动,平衡常数减小,故A图像正确;由方程式知,碱性增强,平衡正向移动,Cr2O72-的转化率增大,故B图不正确;温度升高,正逆反应速率都增大,故C图错;由方程式可知,Pb2+的浓度增大,平衡正向移动,Cr2O72-的转化率增大,其物质的量减小,故D图像也不正确。
化学反应速率的影响因素→ 化学反应速
度的影响因素
化学反应速率的影响因素
简介
化学反应速率是指化学反应中产物生成或反应物消耗的速度。
了解化学反应速率的影响因素对于控制反应速度和提高反应效率是
非常重要的。
影响因素
1. 反应物浓度:反应物浓度越高,反应速率越快。
这是因为较
高浓度的反应物会增加碰撞的频率,从而促进反应的进行。
2. 温度:温度的升高会使反应速率增加。
这是由于温度升高会
增加分子的动能,使分子间碰撞的能量足够大以克服反应的激活能。
3. 催化剂:催化剂是一种能够加速化学反应速率的物质。
催化
剂通过提供一个不同的反应路径,降低了反应的激活能,从而加快
了反应速率。
4. 表面积:反应物的表面积越大,反应速率越快。
这是因为较
大的表面积提供了更多的反应区域,从而增加了反应发生的可能性。
5. 反应物的物理状态:固体反应物的反应速率较慢,液体反应
物的反应速率中等,气体反应物的反应速率较快。
这是由于气体分
子之间的碰撞更频繁和剧烈。
总结
化学反应速率受多个因素的影响,包括反应物浓度、温度、催
化剂、表面积和反应物的物理状态。
了解这些影响因素可以帮助我
们控制反应速率,并提高反应效率。
2013化学复习知识点深度剖析专题七第一节化学反应速率及其影响因素知识梳理:第一节化学反应速率及其影响因素考纲解读:考纲内容要求名师解读1.了解化学反应速率的概念、反应速率的定量表示方法.Ⅰ 1.有关化学反应速率概念的理解及简单计算的考查.2.外界条件对化学反应速率的影响规律的考查.3.联系生产、生活和科学研究,运用化学反应速率解决实际问题.2.了解催化剂在生产、生活和科学研究领域中的重大作用.Ⅰ3.理解外界条件(浓度、温度、压强、催化剂等)对反应速率的影响,认识其一般规律.Ⅱ基础巩固1.化学反应速率(1)概念:化学反应速率是用_______________________________________________________来表示,通常用______________来表示。
(2)计算公式:_______________(3)ΔC表示__________________;Δt表示____________。
2.对于反应:mA+nB====pC+qD开始时,A的浓度为a mol·L-1,B的浓度为b mol·L-1,反应进行至t1 s时,A消耗了x mol·L-1,则反应速率可计算如下:mA + nB ==== pC + qD起始(t 0 s)时 a mol·L -1 b mol·L -10 0反应(t 1 s)时 (a-x)mol·L -1)(mnxb -mol·L -1 m px mol·L -1 mqxmol·L -1则:v(A)=1t t x - mol·L -1·s -1v(B)=_______________________________ v(C)=________________________________ v(D)=________________________________从而可计算出:v(A)∶v(B)∶v(C)∶v(D)=______________。
由此可得出什么规律?对于同一反应,用不同物质表示化学反应速率,其数值是否相等?相互之间有什么关系?2.影响化学反应速率的因素:(1)内因(主要因素):反应物本身的性质,如Na 、Mg 、Al 与水反应的速率由大到小的顺序为: 。
(2)外因(其他条件不变,改变一个条件)实验探究拓展实验:1.“碘钟”实验中,3I-+S2O2-8===I-3+2SO2-4的反应速率可以用I-3与加入淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大。
某探究性学习小组在20 ℃进行实验,得到的数据如下表:实验编号①②③④⑤c(I-)/(mol·L-1) 0.040 0.080 0.080 0.160 0.120c(S2O2-8)/(mol·L-1) 0.040 0.040 0.080 0.020 0.040t/s 88.0 44.0 22.0 44.0 t1(1)该实验的目的是_____________。
(2)显色时间t1=________。
(3)温度对反应速率的影响符合一般规律,若在40 ℃以下进行编号③对应浓度的实验,显色时间t2的范围为( )A.<22.0 s B.22.0 s~44.0 sC.>44.0 s D.数据不足,无法判断(4)通过分析比较表中数据,得到的结论是_____________。
解析(1)据题中提供数据知,该实验的目的是研究c(I-)、c(S2O2-8)浓度的大小对反应速率(反应时间t)的影响。
(2)比较①、②知:c(S2O2-8)不变,c(I-)增大1倍,反应时间为原来的一半,则比较①⑤知:c(S2O2-8)不变,c(I-)增大到原来的3倍,则时间为原来的1/3,即t1=88 s/3=29.3 s。
(3)温度升高反应速率加快,则t2<22.0 s。
(4)综合(1)(2)知反应速率与反应物起始浓度的乘积成正比。
参考答案:(1)研究反应物I-与S2O2-8的浓度对反应速率的影响(2)29.3 s (3)A(4)反应速率与反应物起始浓度的乘积成正比(或显色时间与反应物起始浓度乘积成反比)2.某实验小组在进行双氧水分解的实验时发现:大家取相同体积、不同浓度的双氧水及不同质量的二氧化锰进行的实验,产生气体的速率都不相同,那么过氧化氢分解的最佳催化条件是什么呢?他们决定进行探究.(1)用下列简图,在方框中画出实验装置(含试剂)示意图.(2)小组经过实验,取得如下数据:X0.1 g 0.3 g 0.5 gZY1.5% 223 s 67 s 56 s3.0% 308 s 109 s 98 s4.5% 395 s 149 s 116 s()分析表中数据回答下列问题:①相同浓度的双氧水的分解速率随着二氧化锰用量的增加而________.②从实验效果和“绿色化学”的角度考虑,双氧水的浓度相同时,加入________g的二氧化锰为较佳选择,理由是____________________________________________.③该小组的小茂同学分析上述数据后认为:“当用相同质量的二氧化锰时,双氧水的浓度越小,所需要的时间就越少,亦即其反应速率越快”的结论,你认为是否正确________,理由是_______________________________________________________________________________ _________.(提示:可比较相同体积的3.0%与1.5%的双氧水中所含溶质的倍数大小与二者反应结束所用时间的倍数大小作出比较)3.迷你实验:白花变蓝花【原理】干态下的碘片和锌粉,常温下不易直接化合,加入少量水作催化剂后,立即剧烈反应生成碘化锌并放出大量的热,使未反应的碘升华成紫烟,水受热汽化,空中冷凝成白雾,碘和白纸花上的面粉接触显兰色,于是紫烟造出蓝花。
【准备】铁架台、铁夹、蒸发皿、滴管、锌粉、碘片、浆糊【操作】取一只蒸发皿放入2克锌粉和2克碎碘片,拌和均匀,在蒸发皿的正上方吊一朵白纸花,白纸花上涂以面粉浆糊。
一朵白纸花,现在我要“滴水生紫烟、紫烟造兰花”。
然后用胶头滴管吸取冷水,加一二滴于混合粉上,立即有紫烟和白雾腾空而起,团团彩云都抢着去拥抱白纸花,把白花染成兰花,再熏染一二次,蓝花更加鲜艳、逼真。
练一练:1.写出上述变化过程中原理所涉及的化学方程式__________________。
2. 革命先烈方志敏为我们留下了不朽名作《可爱的中国》,他曾用米汤(内含淀粉)给鲁迅写信来躲过反动派的检查。
聪明的鲁迅先生收到信后,使用何种化学试剂就看清了信中的内容( )A.碘化钾B.碘酒C.溴水D.碘化钾淀粉溶液3.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯、溴、碘三种单质的验证实验。
玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是()①②③④A 黄绿色橙色蓝色白色B 无色橙色紫色白色C 黄绿色橙色蓝色无色D 黄绿色无色紫色白色参考答案:1. Zn+I2=Zn I2(水做催化剂)2.B解析:淀粉溶液遇到碘分子变蓝而显出字迹。
3.A解析:①内的气体是黄绿色的Cl2;②处发生反应,生成NaCl和Br2,其溶液是橙色的;③处发生反应,生成氯化钾和I2,I2遇淀粉变蓝;④处相当于尾气处理,避免氯气污染环境。
无论是NaCl、氢氧化钠还是NaBr都是无色物质,故④处显示棉球的白色。
重点突破一.直击考点:考点一化学反应速率及计算(1).定义:化学反应速率是用来衡量化学反应进行快慢程度的物理量。
通常用用单位时间内反应物浓度的减少或生成物浓度..............的增加来表示。
(2).数学表达式:υ=△C △t(3).单位:mol/(l·s)、mol/(l·min)或mol/(l·h)。
【例1】 反应4NH 3(g )+5O 2(g)4NO(g)+6H 2O(g)在10L 密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45 mol,则此反应的平均速率v (X)(反应物的消耗速率或生成物的生成速率)可表示为( )A.v (NH 3)=0.010 mol·L -1·s -1B.v (O 2)=0.001 mol·L -1·s-1C.v (NO)=0.001 0 mol·L -1·s -1D.v (H 2O)=0.045 mol·L -1·s -1【解析】先求出v (H 2O)。
由题意可得:v (H 2O)=s30L 10mol0.45=0.001 5 mol·L -1·s -1,D 错误。
再根据速率与化学计量数的关系求出v (NH 3)、v (O 2)、v (NO):v (NH 3)=64v (H 2O)=64×0.001 5 mol·L -1·s -1=0.001 0 mol·L -1·s -1 v (O 2)=65v (H 2O)=65×0.001 5 mol·L -1·s -1=0.001 25 mol·L -1·s -1 v (NO)=v (NH 3)=0.001 0 mol·L -1·s -1可见,A 、B 错,C 对。
【答案】C【点评】解答化学反应速率的计算型题目时要找准反应物或生成物浓度的变化量,同时注意容器的体积和变化的时间。
考点二 化学反应速率快慢的比较比较同一化学反应在不同情况下反应速率的快慢,应选用同种物质作标准。
然后利用化学反应速率之比等于化学方程式中各物质的化学计量数之比,求出不同情况下,用同一物质表示的化学反应速率,再进行比较。
【例2】 对于反应A (g )+3B(g)2C(g)+2D(g),在不同情况下测得反应速率如下,其中反应速率最快的是( )A.v (D)=0.4 mol·L -1·s -1B.v (C)=0.5 mol·L -1·s -1C.v (B)=0.6 mol·L -1·s -1D.v (A)=0.15 mol·L -1·s -1考点三影响化学反应速率的因素不同物质化学反应速率相差很大,决定化学反应速率的因素是反应物本身的性质。
在其他条件不变时,增加反应物的浓度、升高体系的温度、使用催化剂,可以增大化学反应速率。
对于有气体反应,在温度、体积一定时,增大压强,可以增大化学反应速率。