卤代烃1氯甲基-溴己烷1二甲基-3氯-5溴环己
- 格式:doc
- 大小:149.50 KB
- 文档页数:5



5-第五章-卤代烃1本章学习要求:掌握卤代烃的分类、命名,卤代烃的亲核取代反应、消除反应、生成Grignard试剂的反应以及Grignard试剂在合成上的应用等;了解各种类型的卤代烃、卤代芳烃在化学活性上的差异。
第五章卤代烃卤代烃:烃分子中的氢原子被卤素原子取代所生成的化合物,总称卤代烃。
卤素原子是卤代烃的官能团,一般表示为:R-X由于卤代烃烃可用作农药、医药、防腐剂、制冷剂等等,与工农业生产和日常生活关系密切,是一类重要的有机化合物。
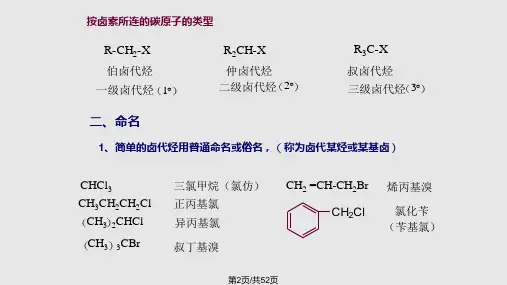
第一节卤代烃的分类和命名一、卤代烃的分类芳香卤代烃(1)根据卤代烃分子中烃基的结构不同:饱和卤代烃不饱和卤代烃(2)根据卤代烃分子中卤素数目不同:(3)根据卤素原子直接相连的碳原子类型的不同:一级卤代烃二级卤代烃三级卤代烃伯卤代烃叔卤代烃仲卤代烃二、卤代烃的命名1、普通命名法甲基氯异丙基溴氯乙烯苄基溴正丙基氯2、系统命名法(1)以烷烃的名称为基础,以卤原子直接相连的碳原子所在的最长碳链为母体,卤原子为取代基,以靠近支链的一端开始编号。
2-甲基-3-氯丁烷4-甲基-2-氯己烷4-甲基-1-氯-2-溴戊烷(2)以烷烃的名称为基础,以卤原子直接相连的碳原子所在的最长碳链为母体,卤原子为取代基,以靠近支链的一端开始编号。
3-溴丁烯5-氯-4-溴- 2-己烯(Z)-3-氯-4-溴-3-己烯(E)-3-甲基-2-溴-2-戊烯(3)对于卤代脂环烃和卤代芳香烃命名,以卤代脂环烃和卤代芳香烃为母体,卤原子为取代基。
1-氯-3-溴环己烷1-甲基-3-氯环己烷2-溴萘当侧链比较长时,即超过3个碳原子以上时,则可以将芳香烃和脂环烃作为取代基。
2-(对氯苯基)-丁烷5-苯基-4-溴-2-己烯or2-(4-氯苯基)-丁烷12-甲基-2-溴丁烷4(E)-3-甲基-4-溴-3-己烯34-甲基-5-氯-1-戊烯23-甲基-1-苯基-4-氯-2-戊烯习题53-甲基-2-苯基-4-溴-3-己烯61-甲基-3-氯-2-溴环己烷第二节卤代烃的性质一、物理性质◎了解卤代烷分子中由于存在C-X极性键使其沸点、相对密度比相应的烷烃高。



卤代烃第⼋章卤代烃卤代烃:烃分⼦中的⼀个或多个氢原⼦被卤素原⼦取代后⽣成的⼀类化合物称为卤代烃,常⽤RX 或ArX 表⽰。
其中,卤素原⼦为官能团。
第⼀节卤代烃的分类与命名⼀、卤代烃的分类与命名1.根据卤代烃分⼦中所含卤原⼦的种类可分为:氟卤代烃、氯卤代烃、溴卤代烃和碘卤代烃。
2. 根据卤代烃分⼦中所含卤原⼦数⽬的不同可分为:⼀卤代烃和多卤代烃。
3.根据卤代烃分⼦中烃基结构的不同可分为:饱和卤代烃卤代脂肪烃不饱和卤代烃卤代烃卤代脂环烃卤代环烃卤代芳⾹烃⼆、卤代烃的命名1.习惯命名法普通命名法是根据卤原⼦所连的烃基的名称将其命名为“某烃基卤”例如:丙烯基氯烯丙基氯环⼰基溴叔丁基溴苄基氯(或氯化苄)2.系统命名法系统命名法是把卤代烃看作烃的卤素衍⽣物,即以烃为母体,卤原⼦只作为取代基。
例如:饱和卤代烃(卤代烷烃) CHF 2Cl卤代脂肪烃2-甲基-6-溴-4-碘庚烷⼆氟氯甲烷不饱和卤代烃(Z )-3,5-⼆甲基-4-⼄基-1-氯-3-⼰烯 5-⼄基-7-溴-2-庚炔卤原⼦直接连在环上时:环为母体,卤原⼦为取代基。
卤代环烃 1-甲基-2-氯苯(或邻氯甲苯) 4-甲基-5-溴环⼰烯卤原⼦连在环的侧链时:环和卤原⼦为取代基,侧链烃为母体。
CH 2CHCl CH 3CH 2CH 2Cl CH 2Br CH 3Cl CH 3CH CHCl CH 2CHCH 2ClCH 3CBr CH 3CH 3CH 2Cl Br CH 3Cl 123456Br CH 312456CH 3CHCH 2CHCH 2CHBr CH 331234567CH 3C CCH 2CHCH 2CH 3CH 2CH 2Br1234567C C CH 2CH 2Cl CH 3(CH 3)2CH CH 3CH 2123456环⼰基⼀溴甲烷苯⼆氯甲烷 2-环⼰基-4-碘戊烷第⼆节卤代烃的制法⼀、烷烃的卤代具有烯丙基型的化合物,在⾼温下可发⽣α-氢卤代反应,⽣成烯丙基型卤代烃。


第七章卤代烃相转移催化反应邻基效应思考题P235 习题7.1 用普通命名法命名下列各化合物,并指出它们属于伯、仲、叔卤代烷中的哪一种。
(1) (CH3)3CCH2Cl (2) CH3CH2CHFCH3(3) CH2=CHCH2Br解:(1) 新戊基氯(伯卤代烷) (2) 仲丁基氟(仲卤代烷) (3) 烯丙基氯(伯卤代烷) 习题7.2 用系统命名法命名下列各化合物,或写出结构式。
(1)CH3CHCHCH2CHCH3CH3CH3Cl2,3-二甲基-5-氯己烷(2)CH3CHCH2C CHCH3CH3ClClCl2-甲基-3,3,5-三氯己烷(3) BrCH2CH2CHCH2CH2CH3C2H53-乙基 -1-溴己烷(4) CH3CH2CHCH2CH3CH2Cl3-氯甲基戊烷(5) Cl1-环戊基-2-氯乙烷或 氯乙基环戊烷(6)CH3Cl1-甲基-1-氯环己烷(7) CH3CH3CH2Cl1,1-二甲基-2-氯甲基环戊烷(8)Cl1-氯双环[2.2.1]庚烷(9)CH 3CH CH 2CH 2BrCH 3异戊基溴 (10)CH 3CH 2CH 2CH 3H Br(R)-2-溴戊烷P236 习题7.3 命名下列各化合物:(1) Cl 2CHCH=CH 23,3-二氯-1-丙烯(2) CH 3CHCH=CHCH 3Cl4-氯-2-戊烯(3)CH 3Br1-甲基-4-溴-2-环戊烯(4)BrCl 1-氯-4-溴苯(5)CH=CHCH 2CH 2Br 1-苯-4-溴-1-丁烯(6)CH 2CH=CH 2ClBr2-氯-4-溴烯丙基苯3-(2-氯-4-溴苯基)-1-丙烯P236 习题7.4 写出下列各化合物的构造式或结构式:(1)4-溴-1-丁烯-3-炔CH 2=CH C CBr(2) 反-1,2-二氯-1,2-二苯乙烯C=C Cl ClPhPh(3)对氯叔丁苯ClC(CH 3)3(4)-溴 代乙苯CHCH 3BrP239 习题7.5 试预测下列各对化合物哪一个沸点较高。

《卤代烃》讲义一、卤代烃的定义和分类卤代烃是烃分子中的氢原子被卤素原子取代后的产物。
常见的卤素原子包括氟(F)、氯(Cl)、溴(Br)、碘(I)。
根据分子中卤素原子的种类,卤代烃可以分为氟代烃、氯代烃、溴代烃和碘代烃。
按照卤代烃分子中卤素原子的数目,可分为一卤代烃和多卤代烃。
依据烃基的结构不同,卤代烃又分为饱和卤代烃(卤代烷烃)、不饱和卤代烃(如卤代烯烃、卤代炔烃)和芳香族卤代烃。
二、卤代烃的物理性质1、状态常温下,一氯甲烷、氯乙烷、氯乙烯等是气体,其余的卤代烃大多为液体或固体。
2、溶解性卤代烃不溶于水,可溶于大多数有机溶剂。
3、沸点卤代烃的沸点比相应的烃高。
这是因为卤素原子的引入增加了分子的极性,使得分子间的作用力增强。
卤代烃的同分异构体中,支链越多,沸点越低。
三、卤代烃的化学性质1、取代反应卤代烃中的卤素原子可以被其他原子或原子团取代。
例如,溴乙烷与氢氧化钠水溶液共热时发生取代反应,生成乙醇:CH₃CH₂Br +NaOH → CH₃CH₂OH + NaBr2、消去反应在一定条件下,卤代烃可以从分子中脱去卤化氢等小分子,生成不饱和烃。
例如,溴乙烷与氢氧化钠的醇溶液共热时发生消去反应,生成乙烯:CH₃CH₂Br +NaOH → CH₂=CH₂↑ + NaBr + H₂O消去反应的发生条件是与卤素原子相连的碳原子的邻位碳原子上必须有氢原子。
3、与金属反应卤代烃能与某些金属发生反应,生成有机金属化合物。
例如,氯乙烯与金属钠反应生成氯乙钠。
四、卤代烃的制备1、烷烃的卤代在光照或加热条件下,烷烃可以与卤素单质发生取代反应生成卤代烃。
但这种方法得到的卤代烃往往是混合物,不易分离提纯。
2、不饱和烃的加成烯烃或炔烃可以与卤素单质或卤化氢发生加成反应生成卤代烃。
例如,乙烯与溴水反应生成 1,2 二溴乙烷:CH₂=CH₂+ Br₂ → CH₂BrCH₂Br五、卤代烃对环境和人类健康的影响1、对环境的影响一些卤代烃是大气臭氧层破坏的“元凶”,例如氟氯烃。

2025年高考化学一轮复习基础知识讲义—卤代烃(新高考通用)【必备知识】1、卤代烃的概念(1)卤代烃可以看作烃分子中一个或多个氢原子被卤素原子取代后所生成的化合物。
(2)官能团是碳卤键。
2、卤代烃的物理性质(1)沸点:比同碳原子数的烃沸点要高。
常温常压下,除CH 3Cl 、CH 3Br 、CH 3CH 2Cl 、CH 2=CHCl 等少数为气体外,其余为液体或固体。
(2)溶解性:不溶于水,可溶于有机溶剂。
(3)密度:一般一氟代烃、一氯代烃比水小,其余比水大。
3、卤代烃的化学性质(1)水解反应和消去反应反应类型水解反应(取代反应)消去反应反应条件强碱的水溶液加热强碱的醇溶液加热断键方式C 2H 5Br 化学方程式CH 3CH 2X +NaOH――→水△CH 3CH 2OH +NaX CH 3CH 2X +NaOH――→醇△CH 2==CH 2+NaX +H 2O 产物特征引入—OH 消去H 、X ,生成物中含有碳碳双键或碳碳三键结构要求无邻位有氢才消去(苯环上的卤素原子不能消去。
)例1、下列卤代烃在KOH 醇溶液中加热不反应的是()A .①③⑥B .②③⑤C .全部D .②④【答案】A 例2、写出以下方程式①溴乙酸与NaOH 溶液水解方程式:②1,2-二溴乙烷消去方程式:4、卤代烃中卤素原子的检验(1)检验流程(2)加入稀硝酸酸化是为了中和过量的NaOH ,防止NaOH 与AgNO 3反应。
5、卤代烃的获取(1)不饱和烃与卤素单质、卤化氢等的加成反应①苯与Br 2反应的化学方程式:+Br 2――→Fe +HBr ;②C 2H 5OH 与HBr 反应的化学方程式:C 2H 5OH +HBr ――→△C 2H 5Br +H 2O 。
③甲苯与氯气光照的化学方程式:(2)不饱和烃的加成反应①丙烯与Br 2反应的化学方程式:CH 3—CH==CH 2+Br 2―→CH 3CHBrCH 2Br ;②乙炔与HCl 制氯乙烯的化学方程式:CH≡CH +HCl ――→催化剂△CH 2==CHCl 。
三、卤代烷的化学性质C-X键是极性键,C-X键发生异裂并与亲核试剂结合生成一系列化合物,是功能团转变的重要方法之一。
(一)取代反应在一定条件下(通常为碱性条件),卤代烃的卤原子可被一些亲核试剂取代。
是典型的亲核取代反应,是强的亲核基团Nu-取代了弱的亲核基团X-。
四、亲核取代反应卤代烷发生亲核取代反应,主要是通过两种机理(或称历程)进行。
1.单分子亲核取代(S1)N2.双分子亲核取代(S2)。
N1)(一)单分子亲核取代反应(SN1反应是分两步进行的SN以叔丁基溴的水解反应为例:动力学上表现为一级反应(只涉及叔丁基溴分子,决定整个反应的速度也只与叔丁基溴卤代烷的浓度有关,而与试剂浓度无关)[(C H3)3C B r]ν=κ各类卤代烷的S N1反应速度超共轭效应,中间体碳正离子越稳定,生成碳正离子的活化能就越小,进行SN1反应的速度就越快叔卤代烷> 仲卤代烷> 伯卤代烷> 卤代甲烷(二)双分子亲核取代反应(S N2)S N2反应是一种只有过渡态而无中间体的一步反应,以溴甲烷的水解反应为例:(三)亲核取代反应与消除反应的竞争取代反应和消除反应是一组竞争反应。
由卤代烷的结构、试剂性质、反应条件等因素来决定。
1. 卤代烷结构z叔卤代烷较易发生消除反应z伯卤代烷较易发生取代反应z仲卤代烷间于两者之间2. 试剂的影响z试剂亲核性强有利于取代反应z试剂碱性强有利于消除反应。
3.反应条件z温度提高有利于消除反应z溶剂极性强有利于取代反应,极性弱有利于消除反应。
六、亲核取代反应中的立体化学2反应机理中,亲核试剂Nu是从背面向α-碳原子在SN进攻,离去基团X从另一侧离去。
这种翻转称为构型翻转瓦尔登转化是S2反应的立体化学特征。
当我们知道N2反应,那末就可从反应物的构型来预了某一反应是SN测产物的构型。
但瓦尔登转化后的产物构型属R型还是S型,还得由确定绝对构型的方法来定,产物的旋光性是否变化也还得由实验测知。
第十四讲典型有机物的性质Part 3 卤代烃【知识网络】25ONO2+ AgX(活性:3o > 2o > 1o )-RX RX- R'R2NH R3R4N+X-消除反应R-CH2CHR'-CH=CH2R-RRHC C R'RKOH,C2H5OH25(活性:3o > 2o > 1o )R-CH=CH R'Et OR'-RLiAlH4卤代烷烃(R-X)【知识概要】一、卤代烃的分类和命名1. 分类(1)按分子中所含卤原子的数目,分为一卤代烃和多卤代烃。
(2)按分子中卤原子所连烃基类型,分为:卤代烷烃R-CH2-X卤代烯烃R-CH=CH-X 乙烯式R-CH=CH-CH2-X 烯丙式R-CH=CH(CH2)n-X ≥2 孤立式卤代芳烃X CH2X(乙烯式)(苄式)(3)按卤素所连的碳原子的类型,分为:RCH2-X 伯卤代烃一级卤代烃(1°)R2CH-X 仲卤代烃二级卤代烃(2°)R3C-X 叔卤代烃三级卤代烃(3°)2. 命名Ex1 用普通命名法命名下列化合物(i)(CH3)3CCl (ii)CHCl3(iii)Br Ex2 用IUPAC法命名下列有机物(i)CH3Cl(ii)CH3Cl(iii)Cl CH3(iv)BrClEx3 写出下列化合物的结构式(i)(4R)-2-甲基-4-氯辛烷(ii)(2S,3S)-2-氯-3-溴丁烷(iii)(4S)-4-甲基-5-乙基-1-溴庚烷(iv)(1R,3R)-1,3-二溴环己烷二、卤代烷的性质卤代烃分子结构中C—X键为极性共价键,由于卤素的电负性比碳大,碳卤键中电子云偏向卤素,使碳原子带部分正电荷。
表1 卤乙烷分子的偶极矩故C-X键比C-H键容易断裂而发生各种化学反应卤素易以X -的形式被取代,这种取代称为亲核取代反应(简写为S N )。
活泼金属也可以与卤代烃反应,生成金属有机化合物。
第五章卤代烃
1、(1) 3-氯甲基-2-溴己烷(2) 1,1-二甲基-3氯-5溴环己烷
(3) 4-氯甲基环己烯(4) (Z)-1-溴-2-丁烯
(5) 2-(3-氯苯基)-3-氯丁烷(6) 1-(3-硝基苯基)-1-氯乙烷2、(1)CH2CH CH2Br
(2)CH2CH
2CH CH CH CH3
33Cl
(3)CH3C C CH CH
2
3
(4)CH2CH2
(5)CBr2I2(6) CHI3
3、(1)CH3CH2OCH3 S N2 (2)s—BuOH SN1
(3) MeCN S N2 (4) H2NCH2CH2NH2S N2
(5)n—PrSCN S N2 (6)CH2=CH—CH2OOCCH3 S N1
(7)CH C CH3
CH3
CH3
SH
S N1 (8)i—BuC≡CH S N2(9)CH3C≡CH S N2 (10)t—BuOH S N1
4、(1)
C
H3CH CH2I
3
比
C
H3CH CH2Cl
3
反应快,因为碘离子比氯离子是更好的离去基团。
(2) (CH3)3CBr比CH3CH2CH(CH3)CH2Br反应快,S N1反应,前者形成的碳正离子中间体更稳定。
(3) CH 3CH 2CH 2CH 2Br 比CH 3CH 2CH(CH 3)CH 2Br,S N 2反之,亲核试剂进攻
时前者受到的空间阻力更小。
(4) NaOH(OH -)是比CH 3COO -更好的亲核试剂,其亲核性更强。
5、(1) CH CN
(2) (CH 3CH 2)2C==CHCH 3 (3)
CH 2CH
CH C Br
N
(4)
N +
CH 3
C
H 3Br -
(5) (CH 3)2CHCH 2N 3 (6) (CH 3)2CHCH 2CH 2NO 2
(7)
CH 3
CH 3
很难进行 (8) CH 3CH 2C
CH
6、 (1)
CH 2CH CH 2
>
CH 3CH 2CH 2
>CH 3CH 2Br (2)
Br
>
Br
>
Br
(3)
a)
CH 2Br
>
CH CH 3
>
C CH 3
CH 3
b)
I > Br > Cl
(4) a) CH 3CH 2CBr(CH 3)2 > CH 3CHBrCH 2CH 2CH 3 >BrCH 2CH 2CH 3
b) (CH 3)3CBr > Br > Br
7、 (1) 在进行S N 1反应时,生成的反应活性中间体碳正离子为
F 3C C
+
CF 3
F 3C
由于-CF 3是一个强的吸电子基团,是碳正离子非常不稳定,在进行S N 2反应时,三个-CF 3产生很大的空间阻力,使亲核试剂很难接近α-C 原子
(2) E2消除时要求反式共平面消除,而
3-溴戊烷的优势构象为
2H 5CH
其
E2消除后得到顺式产物,而要得到顺式产物则必须以下列构象消除:
H
2H 5
此构象不是优势构象。
(3)C
H 2CH CH 2Br 制备的格氏试剂C H 2CH CH 2Mg Br
为亲核试剂可以和C
H 2CH
CH 2Br 发生亲核取代反应生成
C
H 2CH
CH 2CH 2
CH
CH 2。
(4)
C C C
H 3H
C
H
Br
3
H
C
H 3H
CH 3
CH
+
CH 3
Br
消旋化
(5)
Br CH 3
CH 3
Br CH 3
CH 3
(A ) ( B ) 亲核试剂进攻(B)时遇到处于反式位的CH 3的空间阻碍(SN 2)
8、 H
H t-Bu
S
O O
CH 3
O 有与
S O
C O 处于
反式共平面的β-H 原子,按E2历程发生消除。
C(CH 3)3
-
CH 3
S O
O
O
优势构象,没有处于反式共平
面的β-H 原子,要顺利进行E 2消除,只能以其非优势构象进行,故其消除和取代只能以E1和S N 1历程进行。
9、(1)反应物选用1—溴己烷,因其消除反应虽然没有2—溴己烷速度快,但其消除产物只有一种,易于分离。
(2)碱选OH -,因其碱性比H 2O 强,相对来讲可增加消除反应,减少取代反应的发生.
(3)55℃,因为高温更有利于消除反应 (4)碱大大过量有利于消除反应 10、
11、(1)CH 3CH 2
CH 2CH 2
CH
CH 2
(2)
CH3CH CH CH2CH3
CH3
(3) CH2C CH2CH2CH3
3
(4) CH3C CH CH2CH3
3
(5) CH3C CH CH2CH3
3
(6) CH3CH CH CH CH3
3
(7)
CH2CH CH2CH3
CH3
(8)
CH3C CH2CH3
3
CH3
12、A. CH2CH CH3 B.
2CH3
Cl Cl
C. CH2CH CH2Cl
D. CH2CH CH2CH2CH3
E.
CH2CH H CH2CH
3
Br
F. CH2CH CH CH CH3。