有机化学增长和缩短碳链的反应
- 格式:doc
- 大小:338.00 KB
- 文档页数:5

增长碳链的反应碳链是有机化合物的基本结构之一,它在生物体内起着重要的作用。
而增长碳链的反应是一种可以在有机化学中实现碳链延长的重要反应。
本文将介绍增长碳链的反应原理、常见的反应类型以及应用领域。
一、增长碳链的反应原理增长碳链的反应是指通过在已有碳链上添加新的碳原子,使碳链长度增加的化学反应。
在有机化学中,常用的增长碳链的方法主要有碳碳键形成反应和碳碳键断裂反应。
碳碳键形成反应是指通过碳原子与碳原子之间的化学键形成,使碳链长度增加。
常见的碳碳键形成反应有卤代烃的分子间或分子内的偶联反应,以及烯烃的加成反应等。
例如,卤代烃可以与有机锂试剂反应,生成新的碳碳键,从而实现碳链的延长。
碳碳键断裂反应是指通过碳原子与碳原子之间的化学键断裂,从而在碳链上形成自由基或离子,然后通过其他反应形成新的碳碳键,实现碳链的延长。
常见的碳碳键断裂反应有氢化、卤化、氧化等反应。
例如,烷烃可以与卤素反应,生成卤代烃,然后通过卤代烃的偶联反应形成新的碳碳键。
二、常见的增长碳链反应类型1. 碳碳键形成反应(1)卤代烃的偶联反应:卤代烃与有机锂试剂反应,生成新的碳碳键。
(2)烯烃的加成反应:烯烃与电子亲和性较强的物质反应,生成新的碳碳键。
2. 碳碳键断裂反应(1)氢化反应:烯烃与氢气反应,断裂碳碳双键,生成新的碳碳单键。
(2)卤化反应:烷烃与卤素反应,生成卤代烃,然后通过卤代烃的偶联反应形成新的碳碳键。
(3)氧化反应:醇与氧气反应,生成酮或醛,然后通过酮或醛的加成反应形成新的碳碳键。
三、增长碳链反应的应用领域增长碳链的反应在有机合成中具有广泛的应用。
它可以用于合成复杂的有机分子,如药物、天然产物等。
例如,通过控制不同反应条件,可以实现对具有特定生物活性的天然产物的合成,从而为药物研发提供了重要的手段。
增长碳链的反应还可以用于材料科学领域。
通过合成具有特定碳链结构的聚合物或杂化材料,可以获得具有特殊性能的材料,如高分子电子材料、光学材料等。

有机化学增长碳链,减短碳链,成环,开环,引入,消除的反应方程式,分类有机化学的增长碳链反应是有机分子变换的重要步骤,也是有机分子催化反应的基本过程,对实现有机分子的转化及合成具有重要意义。
总体上可以将有机化学增长碳链反应分为减短碳链、成环、开环、引入和消除五大类。
减短碳链是指有机分子由较长的碳链变为短碳链,通常采用加氢或氧化反应实现,如:CH3—CH2—CH2—CH3+H2→CH3—CH2—H2+CH3—CH3。
成环反应即通过两个有机分子反应而形成环状有机化合物的反应,如:丙烯醛和氯乙烯的开环合成环氧乙烯,反应方程式为:C3H4O + CH2=CHCl → CH2=CH—O—CH2—CH2—Cl。
开环反应是指环状化合物由环路断裂变为直链有机物,通常采用溶剂、氧化剂、活性催化剂所起作用的氧化还原反应实现,如:CH2=CH—O—CH2—CH2—Cl → C3H4O + CH2=CHCl。
引入反应就是把特定的基团加入到分子内的反应,它一般通过氧化还原反应实现,如:CH3—CH2—CH2—CH3 + CH3—OH → CH3—CH2—CH(OH)CH3 + H2。
消除反应,消除反应也称为脱水缩合反应,是指在活性催化剂的作用下,两个原子中的水分子被溶剂所取代,两个分子发生缩合反应,两个分子原子之间的精细键断裂,同时生成新的键,如:2 CH3CH2—OH → CH3CH2—CH2—CH3 + H2O。
有机化学增长碳链反应不仅在有机合成中扮演着重要角色,而且也在生物系统中也起到了重要作用。
为解决有机合成反应的效率问题,研究人员近几年重点研究,对生物有机合成及其相关催化动力学机制也进行了有益的研究,其中有机化学增长碳链反应是值得深入研究的一个环节。
从宏观和微观方面来看,催化反应有机分子的转化及合成都是一个有趣而复杂、丰富又有价值的研究领域,其发展前景崭露,发展前景广阔,对于实现有机分子的转化和合成具有重要意义。
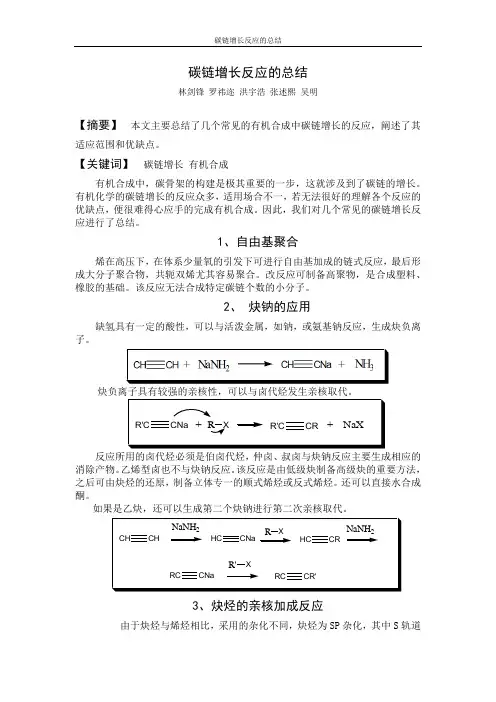
碳链增长反应的总结林剑锋罗祎迩洪宇浩张述熙吴明【摘要】本文主要总结了几个常见的有机合成中碳链增长的反应,阐述了其适应范围和优缺点。
【关键词】碳链增长有机合成有机合成中,碳骨架的构建是极其重要的一步,这就涉及到了碳链的增长。
有机化学的碳链增长的反应众多,适用场合不一,若无法很好的理解各个反应的优缺点,便很难得心应手的完成有机合成。
因此,我们对几个常见的碳链增长反应进行了总结。
1、自由基聚合烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。
改反应可制备高聚物,是合成塑料、橡胶的基础。
该反应无法合成特定碳链个数的小分子。
2、炔钠的应用缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。
炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。
反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。
乙烯型卤也不与炔钠反应。
该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃。
还可以直接水合成酮。
如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。
3、炔烃的亲核加成反应由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP杂化,其中S轨道占有的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链这里以乙炔为例。
Nu 为带有碳链的亲核基团利用炔烃可以进行亲核加成的特性可以让炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯。
还可是让炔与氢氰酸生成烯腈,烯腈再水解就可以得到α,&不饱和酸,以此衍生制备各种α,&不饱和不饱和化合物。
4、狄-阿(Diels –Alder )反应共轭双烯与亲双烯体生成环己烯的反应。
狄尔斯-阿尔德反应可以合成带有不饱和键六元环和桥环化合物,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
该反应条件所需条件不严格,只需加热便可进行。

有机化学中碳链增长的反应姓名:应化10(本1)汪吉伟100712024摘要:在对有机化学反应的研究过程中,有机合成是必不可少的一个重要环节,然而碳骨架的构建是极其关键的一步,碳链的增长是形成分子骨架的主要手段之一。
在有机化学反应中碳链增长的反应有很多,不同的方法都有其不同的特点及适用范围,因此熟悉并掌握有机反应中各种增加碳链方法的机理和优缺点将有助于我们对有机合成反应的研究,以下是对几种常见的碳链增长反应的总结。
关键词:碳链增长有机金属烃基化亲核加成正文:一、利用有机金属化合物增长碳链卤代烷能和某些金属发生反应,生成有机金属化合物。
有机金属化合物是指金属原子直接与碳原子相连的一类化合物。
有机反应中利用有机金属化合物增长碳链是重要的手段之一。
1.与格氏试剂的反应“格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一类亲核试剂,在有机合成中应用十分广泛。
(1)格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:R MgX R''R'(H)ORCR'(H)OMgXR''H3O+RCR'(H)OHR''反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。
(2)格氏试剂和CO2进行亲核加成后经水解可以可制备多一个碳的羧酸,反应可以从卤代烃出发,得到碳链增长的羧酸,适合伯、仲、叔卤代烃以及烯丙基和苯基卤代烃。
2.与二烃基铜锂的反应二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。
二烃基铜锂也是一个反应适用范围很广的试剂。
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi二烃基铜锂的烃基可以是甲基,一级烷基,二级烷基,也可以是烯丙基、苄基、乙烯基、芳基等烃基,故可称为二烃基铜锂或有机锂试剂。

末端烯燃与co 和压在八默基二钻催化下,主要生成比原料烯煌多一个碳原子 的醛。
RCH =CH 2 + CO + H 2 玲 RCH 2 CH2CHO CH3CH =CH 2 + CO + H 2 玲 CH3cH2 CH2CHO4.与CN -的反应:有机化学中碳链增长与减少增加一个碳:1 .格氏试剂格氏试剂与二氧化碳作用可制备多一个碳的竣酸: RC1 + HCHO Mg + 干醴 co 2H 3O--------- R MaBr -------------------- A RCOOMgBr ------------- ► RCOOH干酸干醛 H 3o +RMgBf ------------------► RCH 2OMgBf -------------------- ► RCH 20H RCHO , 干酸 H 3O +4RMgBf ------------------- ► R2cHOMgBi ------------------- ► R 2CHOH2. Gattermann-Koch 反应环上带有活化集团(如甲基甲氧基等)的芳燃在无水三氯化铝和氯化亚铜 催化下与一氧化碳和氯化氢得到相应的芳醛即一Gattermann-Koch 反应。
3.末端球煌碳傩增长反应75%Ni------ ► RCH 2NH 2CH 2 =C7f 2 +CO + H 2O t CH 3CH 2COOH CH 三 CH + CO + HQ -»=CH - COOH增加2个碳:1 .铭氏试剂7,干醛 H 3O +3 + WgBi' ---------------------- » RCH 2CH 2OMgBr ———► RCH 2CH 2OH2.聚合反应2c2H 2 - CH2二 CHCCHH3。
=H3c、OH.H 2O H 2C^C /COOHI CH 3RC1 + NaCNH 3OH 3O+---------- ► RCOOHRCNOHOHH 3O +OH► RCHCN► RCHCOOHCOOH /CN、RCHO + HCN5.氢粉基化C U 2CN 2KCN2 •傅克烷基化增加多个碳:1 X 自由基聚合烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形 成大分子聚合物,共筑双烯尤其容易聚合。


增长碳链的反应碳链是有机化合物中碳原子按照一定的顺序连接形成的链状结构。
增长碳链的反应是指在有机化学中,通过一系列化学反应使碳链长度增加的过程。
这种反应在有机合成中具有重要的意义,可以合成更复杂的有机分子,拓展有机化合物的结构。
增长碳链的反应可以通过不同的方法实现,下面将介绍几种常见的反应途径。
1. 烷基化反应烷基化反应是指通过添加烷基基团来增长碳链长度。
常见的烷基化试剂有卤代烷、醇和烷基锂等。
例如,可以使用溴代烷与有机金属试剂(如烷基锂)反应,生成更长的碳链。
2. 烯烃合成反应烯烃合成反应是指通过烯烃类化合物进行反应来增长碳链长度。
常见的烯烃合成反应有烯烃的加成反应、烯烃的重排反应等。
例如,可以通过烯烃的重排反应将一个碳原子的烯烃转化为两个碳原子的烯烃,从而增长碳链长度。
3. 碳碳键形成反应碳碳键形成反应是指通过在有机分子中形成新的碳碳键来增长碳链长度。
常见的碳碳键形成反应有羟基化反应、烯烃的环化反应等。
例如,可以通过羟基化反应将一个碳原子的化合物转化为两个碳原子的化合物,从而增长碳链长度。
4. 碳氢键活化反应碳氢键活化反应是指通过活化碳氢键来增长碳链长度。
常见的碳氢键活化反应有烃烃偶联反应、烃的氧化反应等。
例如,可以通过烃烃偶联反应将两个烃分子连接在一起,从而增长碳链长度。
增长碳链的反应在有机合成中具有广泛的应用。
通过增长碳链长度,可以合成更复杂的有机分子,拓展有机化合物的结构。
这对于药物合成、材料科学等领域具有重要的意义。
增长碳链的反应也面临着一些挑战。
有机化合物的合成通常需要考虑反应的选择性、收率和副反应等因素。
在设计和优化反应条件时,需要综合考虑这些因素,以实现高效、高选择性的反应。
增长碳链的反应是有机化学中一类重要的反应。
通过烷基化反应、烯烃合成反应、碳碳键形成反应和碳氢键活化反应等途径,可以增加碳链长度,合成更复杂的有机分子。
这对于有机合成和材料科学等领域具有重要的意义,为人类的科学研究和技术发展提供了重要的支持。

浅谈有机合成碳链增长与减少的反应作者:晏雄来源:《化学教学》2017年第07期摘要:有机物碳链增长与减少知识在中学化学教材中没有涉及,在考试大纲中也无具体要求。
高考有机合成题中常以信息形式提示,但学生总感到陌生与困惑。
通过对近几年高考题分析,整理出有机合成题中五种常见的碳链增长反应与一种常见的碳链减少反应。
教师以信息形式让学生阅读并仿写有机合成方程式,从而提高复习效率。
关键词:碳链增长;碳链减少;有机合成;高考试题;活泼α-H文章编号:1005–6629(2017)7–0084–03 中图分类号:G633.8 文献标识码:B有机合成题是高考试题中的常见题型,同时也是高考的热点与难点。
有机合成工业有两条主线:一条是碳骨架的构建,包括碳链的增长、减少、异构、成环、开环等反应;另一条是官能团的形成与转化。
在教学中往往以官能团为中心,对官能团的引入、转变、增减和消除复习总结较多,而对有机物碳链的增长与减少涉及较少。
尽管在这类题中会有信息提示,但学生遇到时依然很陌生总感到不是那么得心应手。
故而,对高考有机合成题中常见的碳链增长与减少反应进行整理、归纳,以提高复习效率。
1 有机合成题中常见的碳链增长反应1.1 与格氏试剂的反应“格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一類亲核试剂,在有机合成中应用十分广泛。
一般先加成后水解是制备醇的一种方法。
近四年部分高考试题中有机物与格氏试剂的反应统计见表1。
格氏试剂与醛、酮发生亲核加成反应再水解成相应的醇:1.2 醛或酮与有活泼α-H的醛、酮或酯的加成利用醛酮的加成反应来增长碳链。
醛酮的C=O双键中,氧原子的电负性大于碳原子,因此碳氧双键是极性共价键,C=O中的π键很容易断裂,与有活泼α-H的分子的加成反应,用于醛酮碳链的增长。
如:在稀碱的作用下,两分子含有α-H的醛或酮可以相互加成,生成β-羟基醛或酮的反应,称为羟醛(或醇醛)缩合。

常用的增长碳链的反应有以下几个:
1.金属有机化合物的反应:
在做题目上,这个反应用的最多的是格氏试剂,有时也用有机锂试剂,包括如与卤化物的偶联反应:
与羰基,氰基的加成反应:
和环氧化合物的开环反应:
这些反应应用很广泛而且相当方便,我个人的感觉是,如果一个合成题能用格氏试剂, 那这个题目一定非常好做.
2.各类缩合反应,这是碳链增长一个很重要的方法,不过也最难掌握,因为反应种类实在太多了,而且应用是技巧性很强,重要的缩合反应有羟醛缩合:
克莱森缩合:
还有各种缩合比如曼尼希反应,麦克尔加成,瑞福马斯基反应等.
3.炔烃,芳环,酮,酯,β-二羰基化合物,β-羰基腈的烷基化和酰基化.在题目上很多
时候这些反应通常和上面的缩合反应共同使用以构建复杂的碳架.如:
当然也可以单独用,比如付氏反应:
炔化物的烃化:
4.环加成反应.
考试中如果用这个反应的话一般也只涉及这个反应,或者和它的逆反应一起出,所以也比较简单.
5.加HCN.
这个反应只加一个碳原子,不过有时没有它是真是无路可走.
与碳链的增长反应相比,常用的缩短碳链的反应就少了些,题目中应用也不及碳链的增长广泛,常用的缩短碳链的反应有以下几个:
1.脱羧反应.我觉得做题目中碰得最多的就是它.
2.烯,炔,芳环侧链,α-二醇,α-羟基醛,酮的氧化断裂反应.
3.环加成逆反应.
4.甲基酮的卤仿反应.
5.酰胺的霍夫曼降解反应
6.β-二羰基化合物的分解.
7.酯,黄原酸酯和四级铵盐的热裂.
由上面可以看到,碳架的建造虽然是一件高度技巧性的工作,但也有规律可循,以上就是总结的一些常用的方式,当然,还要反复练习,认真总结,才能把这些方法融会贯通,这也是有机化学学习中一条必备的准则.。

有机化学中碳链增长的反应姓名:应化10(本1)汪吉伟100712024摘要:在对有机化学反应的研究过程中,有机合成是必不可少的一个重要环节,然而碳骨架的构建是极其关键的一步,碳链的增长是形成分子骨架的主要手段之一。
在有机化学反应中碳链增长的反应有很多,不同的方法都有其不同的特点及适用范围,因此熟悉并掌握有机反应中各种增加碳链方法的机理和优缺点将有助于我们对有机合成反应的研究,以下是对几种常见的碳链增长反应的总结。
关键词:碳链增长有机金属烃基化亲核加成正文:一、利用有机金属化合物增长碳链卤代烷能和某些金属发生反应,生成有机金属化合物。
有机金属化合物是指金属原子直接与碳原子相连的一类化合物。
有机反应中利用有机金属化合物增长碳链是重要的手段之一。
1.与格氏试剂的反应“格氏试剂”是含卤化镁的有机金属化合物(在常温下把镁屑放在无水乙醚中,滴加卤代烷,卤代烷与镁作用生成的有机镁化合物,该化合物不需分离即可直接用于有机合成反应),是一类亲核试剂,在有机合成中应用十分广泛。
(1)格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:R MgX R''R'(H)ORCR'(H)OMgXR''H3O+RCR'(H)OHR''反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。
(2)格氏试剂和CO2进行亲核加成后经水解可以可制备多一个碳的羧酸,反应可以从卤代烃出发,得到碳链增长的羧酸,适合伯、仲、叔卤代烃以及烯丙基和苯基卤代烃。
2.与二烃基铜锂的反应二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。
二烃基铜锂也是一个反应适用范围很广的试剂。
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi二烃基铜锂的烃基可以是甲基,一级烷基,二级烷基,也可以是烯丙基、苄基、乙烯基、芳基等烃基,故可称为二烃基铜锂或有机锂试剂。
有机物中增减碳链的常用方法一、增加碳链的反应:1.1-烯烃与CO、H2(催化剂)反应增加一个碳2.格氏试剂与酮、醛、CO2、环氧乙烷的反应3.卤代物与KCN的反应4.缩醛、醛酮与胺衍生物的加成5.羟醛缩反应等二、减碳链的反应1、增长:a、双烯合成:在无水AlCl3的作用下,两个分子的烯结合成一新的分子;b、羟醛缩合:如聚乙烯醇缩丁醛;c、成酯:聚酯;d、成酰胺:尼龙;e、格列亚反应:与烷基卤化镁反应;f、亲和取代:卤代烷与烷基铜锂的反应;2、缩短:a、高锰酸钾氧化;与酸性或碱性高锰酸钾反应;b、臭氧化;臭氧化后水解;c、脱羧基:d、霍夫曼重排:酰胺转变成胺;e、二醇的氧化:脱羧反应脂肪酸这个反应对一般的脂肪酸,特别是长链的脂肪酸,由于反应温度太高,产率低,加之不易分离,所以一般不用来制备烷烃。
但是若脂肪酸的α-碳原子上带有吸电子基团如硝基、卤素、羰基、氰基等时,则使得脱羧容易而且产率也高,但是它们的反应历程不完全一样。
例如三氯乙酸的钠盐在水中50℃就可脱羧生成氯仿。
羧酸分子中失去羧基放出二氧化碳的反应叫做脱羧反应(decarboxylation)。
一般情况下,羧酸中的羧基较为稳定,不易发生脱羧反应,但在特殊条件下,羧酸能脱去羧基(失去二氧化碳)而生成烃。
最常用的脱羧方法是将羧酸的钠盐与碱石灰(CaO+NaOH)或固体氢氧化钠强热。
脱羧反应化学方程式示意图三氯乙酸盐三氯乙酸的钠盐在水中完全离解成负离子,由于三个氯原子具有强的吸电子作用,就使得碳碳之间的电子云偏向于有氯取代的碳一边,这样形成的负碳离子就更加稳定,然后和质子结合形成氯仿,而羧基负离子上的电子转移到碳氧之间而形成二氧化碳。
此反应是通过负离子进行的脱羧反应。
β-酮酸β-酮酸很易脱羧,其反应过程与上述不同,而是通过一个六元环进行的协同反应,首先生成烯醇,然后经重排得到酮。
由于反应的过渡态是一个六元环,能量低,因而反应很易进行。
此反应在合成上很重要,丙二酸型化合物以及α,β-不饱和酸等的脱羧,一般都属于这一类型的反应。
有机化学中的增碳反应发展史羧酸的结构决定了其高氧化态,因而在其中进行碳链延长相当困难,只有利用重排反应得到相应的亚甲基羧酸。
最常用的亚甲基等价物就是重氮甲烷了,重金属离子可以促进重氮化合物的分解,并结合氯离子。
氯甲酸乙酯是一种常用的羧酸活化试剂,类似的化合物还有氯化亚矾和五氯化磷。
首先利用氯甲酸乙酯将羧酸活化为酰氯,用来提高炭基的亲核性。
第一步是羧酸对氯甲酸乙酯进行亲核加成消除,得到酸酐结构。
第二步是酸酐被氯离子进攻,得到酰氯,二氧化碳以气体形式离开反应体系。
重氮甲烷由于具有负的形式电荷,由碳原子亲核,得到酰基重氮化合物。
重氮化合物很容易分解,脱去氮气,产生卡宾。
卡宾和羧基作用发生重排,得到烯酮。
有机化学是研究有机化合物的化学,更科学的说法是研究碳化合物的化学,因为所有有机化合物中都含有碳元素。
有机化合物简称为有机物,英文是“organic matter”。
最初,有机物是指由动物和植物有机体中得到的物质,如糖、醋、酒精等。
人类很早以前就开始利用有机物了,如古代西方人用柳树皮泡水来止痛,当时他们并不知道这样做的科学道理,不知道柳树皮中含有乙酰水当然,那时候的有机物都不是纯物质,比如酒并非是纯乙醇,醋也并非是纯醋酸。
对纯有机物质的认识和获得是从16世纪开始的。
最早获得的是纯有机酸,如从葡萄汁中提取了纯酒石酸,从柠檬汁中提取了纯柠檬酸,从酸牛奶中提取了纯乳酸等。
到了16世纪末和17世纪初,当时的科学家从尿液中分离了尿素,从罂粟(鸦片)中分离出第一个生物碱--吗啡。
当时只有“化学”,并没有“有机化学”的说法。
但有了如此丰富的成果后,科学家们发现有机物和无机物在组成和性质上都有很大的不同,因此产生了把有机物和无机物区分开的需求。
瑞典科学家贝采里乌斯(Jons Jacob Berzelius)在当时是享有盛誉的科学家,他在1806年率先引用了“有机化学Organic Chemistry”这个名称,从此有机化学成为一个相对独立的学科并在后来的岁月中得到了快速的发展。
能使碳链缩短的反应碳链缩短反应是指分子中的碳链长度被缩短的化学反应。
这种反应在有机合成中非常常见,因为它可以将较长的碳链转化为更加简洁的分子结构,从而提高化合物的效率和可控性。
碳链缩短反应的方法多种多样,下面介绍其中一些常见的反应方法。
1.烷基化反应(Alkylation)烷基化反应是一种将一个烷基基团添加到有机分子中的反应。
在这个反应中,烷基化试剂通常被使用,例如甲基化试剂(MeI,CH3I)、亚甲基化试剂(CH2I2)、乙烯烷、苯乙烯等。
这种反应通常是通过亲核替换反应实现的,其中亲核试剂攻击电子云丰富的原子(如碳或氧)上,将烷基基团添加到原始分子中。
例如,苯甲酸和甲基化试剂反应时,产生苯甲基酸甲酯,即烷基化反应。
2.羰基还原反应(Carbonyl Reduction)羰基还原反应是一类将羰基还原为了碳醇或脱氧化合物的反应。
供氢试剂如锂铝氢化剂(LiAlH4)和金属催化剂(如铂、铑和钯)可以被使用,以降低有机分子中碳链数量,从而使其更加紧凑。
例如,丙酮经过氢化还原反应得到丙醇,即羰基还原反应。
3.核苷化反应(Nucleosylation)核苷化反应是将碳链拉长或者缩短的反应。
在这种反应中,核糖或脱氧核糖被使用,添加到有机分子中间,从而扩大或者缩小其碳链。
在核苷化反应中,催化剂在增加碳链长度的方面起到重要的作用。
例如,在DNA的合成过程中,脱氧核糖核苷(dNTPs)被添加到DNA链中,从而增加新的碳链。
4.亲核取代反应(Nucleophilic Substitution)亲核取代反应是将一个官能团被换成另一个官能团。
在这种反应中,一个亲核试剂被用于替换某个原始官能团。
例如,卤代烷(如氯代甲烷)可以被亲核取代反应替换为醇或胺。
这个反应不仅可以缩短碳链,还可以在有机化合物中引入新的官能团。
5.消除反应(Elimination)消除反应是碳链缩短反应中的重要反应。
这种反应通常是针对不饱和化合物和含有卤素的化合物。
有机化学中碳链增长的反应有机化学中的碳链生长反应姓名:华英10(本1)王记伟100712024在有机化学反应的研究过程中,有机合成是一个必不可少的重要环节。
然而,碳骨架的构建是至关重要的一步。
碳链的生长是形成分子骨架的主要手段之一。
有机化学反应中有许多碳链生长反应。
不同的方法有不同的特点和适用范围。
因此,熟悉和掌握有机反应中各种碳链生长方法的机理、优缺点将有助于我们研究有机合成反应。
以下是几种常见碳链生长反应的总结。
关键词:碳链增长有机金属烃化亲核加成文本:首先,使用有机金属化合物来生长碳链哈龙可以与一些金属反应形成有机金属化合物。
有机金属化合物是指一类金属原子直接与碳原子相连的化合物。
使用有机金属化合物在有机反应中生长碳链是重要的手段之一。
1.与格氏试剂的反应“格氏试剂”是一种含卤化镁的有机金属化合物(常温下将镁废料置于无水乙醚中,滴加卤代烷烃,卤代烷烃与镁作用生成的有机镁化合物可直接用于有机合成反应,无需分离)。
它是一种亲核试剂,广泛用于有机合成。
(1)格氏试剂与醛、酮、酯和烯化氧发生亲核加成反应形成相应的醇;奥格XR’(H)RCR’’R’(H)高级驻地协调员’ ‘ R’(H)RMgXR’’H3O+如果在反应中生成仲醇,它也可以被氧化成酮,然后继续与格氏试剂反应生成叔醇。
(2)在格氏试剂和CO2的亲核加成后,通过水解可以制备多一个碳的羧酸。
具有碳链延伸的羧酸可以从卤代烃中获得,其适用于伯、仲和叔卤代烃、烯丙基和苯基卤代烃。
2.与二烃基铜锂的反应二烃基锂可以通过卤化亚铜分子与氮气和氩气在乙醚中低温反应而形成。
二烃基铜锂也是一种应用广泛的试剂。
RLi+CuX→RCu+LiX RCu+RLi→R2CuLi二烷基铜锂的烃基可以是甲基、伯烷基、仲烷基或烃基如烯丙基、苄基、乙烯基、芳基等,因此它可以被称为二烷基铜锂或有机锂试剂。
二烃基铜锂可以与卤代烃偶联,反应如下:卤代烃中的烃基可以是伯或仲烷基,或乙基烯烃、芳香烃、烯丙基和苄基。
有机合成基础知识点总结一、有机合成的概念。
有机合成是指利用简单、易得的原料,通过有机化学反应,生成具有特定结构和功能的有机化合物的过程。
其目的包括合成天然产物、制备具有特殊性能的有机材料等。
二、有机合成的任务。
1. 构建碳骨架。
- 增长碳链的反应。
- 卤代烃与氰化钠(NaCN)反应:R - X+NaCN→R - CN + NaX,然后R - CN水解可得到羧酸R - COOH,实现了碳链的增长。
- 醛、酮与格氏试剂(RMgX)反应:R - CHO+R'MgX→R - CH(OH)R'(产物为醇,增长了碳链);R - CO - R'+R''MgX→R - C(OH)(R'')R'。
- 羟醛缩合反应:在稀碱作用下,含有α - H的醛发生自身加成反应。
例如2CH_3CHO→(稀碱)CH_3CH(OH)CH_2CHO,产物加热失水可得到CH_3CH = CHCHO,实现碳链增长。
- 缩短碳链的反应。
- 烷烃的裂化反应:如C_16H_34→(高温)C_8H_18+C_8H_16。
- 烯烃、炔烃的氧化反应:例如R - CH = CH - R'→(KM nO_4/H^+)R - COOH+R' - COOH,碳碳双键断裂,碳链缩短。
- 脱羧反应:R - COOH→(碱石灰)R - H+CO_2↑,常用于制备少一个碳原子的烃类。
2. 引入官能团。
- 引入卤素原子(-X)- 烷烃的卤代反应:CH_4+Cl_2→(光照)CH_3Cl+HCl,反应逐步进行,可得到多卤代物。
- 烯烃、炔烃与卤素单质或卤化氢的加成反应:CH_2 =CH_2+Br_2→CH_2Br - CH_2Br;CH≡ CH+HCl→CH_2 = C HCl。
- 芳香烃的卤代反应:在催化剂作用下,苯与液溴反应C_6H_6+Br_2→(FeBr_3)C_6H_5Br+HBr。
碳链增长和减短反应的总结
有机合成中,碳骨架的构建是极其重要的一步,这就涉及到了碳链的增长。
有机化学的碳链增长的反应众多,适用场合不一,若无法很好的理解各个反应的优缺点,便很难得心应手的完成有机合成。
因此,我们对几个常见的碳链增长反应进行了总结。
1、自由基聚合
烯在高压下,在体系少量氧的引发下可进行自由基加成的链式反应,最后形成大分子聚合物,共轭双烯尤其容易聚合。
改反应可制备高聚物,是合成塑料、橡胶的基础。
该反应无法合成特定碳链个数的小分子。
2、炔钠的应用
缺氢具有一定的酸性,可以与活泼金属,如钠,或氨基钠反应,生成炔负离子。
炔负离子具有较强的亲核性,可以与卤代烃发生亲核取代。
反应所用的卤代烃必须是伯卤代烃,仲卤、叔卤与炔钠反应主要生成相应的消除产物。
乙烯型卤也不与炔钠反应。
该反应是由低级炔制备高级炔的重要方法,之后可由炔烃的还原,制备立体专一的顺式烯烃或反式烯烃。
还可以直接水合成酮。
如果是乙炔,还可以生成第二个炔钠进行第二次亲核取代。
3、炔烃的亲核加成反应
由于炔烃与烯烃相比,采用的杂化不同,炔烃为SP杂化,其中S轨道占有的成分高,对电子的吸引能力强,所以炔烃可一发生亲核加成而烯烃不能,利用这个性质,可以用来延长碳链
这里以乙炔为例。
Nu为带有碳链的亲核基团
C C H H H Nu C CH H
H Nu C CH H H Nu
利用炔烃可以进行亲核加成的特性可以让炔与羧酸反应制备无法用烯醇直接酯化制得的酸烯酯。
还可是让炔与氢氰酸生成烯腈,烯腈再水解就可以得到α,&不饱和酸,以此衍生制备各种α,&不饱和不饱和化合物。
4、狄-阿(Diels –Alder )反应
共轭双烯与亲双烯体生成环己烯的反应。
狄尔斯-阿尔德反应可以合成带有不饱和键六元环和桥环化合物,是有机化学合成反应中非常重要的碳碳键形成的手段之一,也是现代有机合成里常用的反应之一。
该反应条件所需条件不严格,只需加热便可进行。
亲双烯体上带有吸电子基可以更好的进行D-A 反应。
CHO +
CHO
以此制备含侧链官能团的六元环,侧链上的官能团还可以进行其他碳链增长的反应。
5、傅-克(Friedel-Crafts )烷基化和傅克酰基化
在路易斯酸存在下芳烃与烷基卤和酰卤的反应叫傅克反应。
可分为烷基化和酰基化两类。
5.1傅-克(Friedel-Crafts )烷基化
氯乙烷在三氯化铝催化下与苯发生取代反应,生成乙苯,放出氯化氢。
+CH 3CH 2Cl AlCl 3
CH 2CH 3
+HCl
反应历程经过碳正离子中间体,以碳正离子为亲电试剂进攻苯环,故可能发生重排。
+CH3CH2CH2Cl AlCl3
CH3CHCH3
+
CH2CH2CH3
30~35%
65~69%
三氯化铝是傅-克反应的催化剂,起的是路易斯酸的作用,FeCl3、BF3、HF 等也可作为催化剂,同时,可以产生碳正离子其他物质也可作为烷基化试剂,如醇和烯。
烷基是个活化基团,因此,傅-克烷基化经常会得到多取代产物,且伴随着碳正离子的重排,因此反应很难得到单一的产物,故应用并不是很广泛。
而傅-克酰基化刚好可以克服烷基化的以上缺点,因此应用得较为广泛。
5.2傅-克酰基化
苯与酰卤或酸酐在三氯化铝的催化下反应成芳酮:
+H
3C C
O
Cl
AlCl3
C CH3
O
+HCl
该反应不发生重排,且酰基是个钝化基团,也防止了多取代的发生。
是个苯环侧链延长碳链的好方法。
反应生成的羰基可以通过克莱门森(Clemmensen)还原成亚甲基,也可以由氢化试剂还原成羟基再进行其他官能团的反应。
最后仍需注意的是,苯环侧链上有钝化基团的是无法进行傅-克反应的。
6、Williamson合成法
Williamson(威廉森)合成法(synthesis)是用醇钠和卤代烷在无水条件下的反应:
RONa + R'X → ROR' +NaX
这个方法即可合成对称醚,有可合成不对称醚。
该反应是SN2反应,两个试剂中的烷基结构对反应很有影响。
若烷基是三级烷基,不利于进行SN2反应,而有利于E2消除反应,得到烯烃。
因此如欲得醚,最好用一级卤代烃。
(CH3)3CO-Na+ + CH3I →(CH3)3COCH3 + NaI
S N2反应中间体
(CH3)3CBr + CH3ONa → (CH3)2C=CH2 + CH3OH + NaBr 除用卤代烷以外,磺酸酯、硫酸酯也可用于合成醚:
芳香醚可用苯酚与卤代烷或硫酸酯在氢氧化钠的水溶液中制备:
苯甲醚(茴香醚)
7、武兹反应(Wurtz Reaction)
武兹反应使两个烃基互相相连为长链,用来合成高级烷烃。
2RX+2Na R-R+2NaX
武兹反应仅限于合成对称烷烃。
如果将两种不同的卤代烃放在一起反应会产生两种不同的烷烃,分离十分困难。
反应含有自由基还会产生烯烃的副产物,当卤代烃的无卤连接碳太大时,这个副反应便显得更为突出。
8、二烃基铜锂
二分子烃基锂与一分子卤化亚铜在醚中、低温下与氮气流和氩气流中进行反应,可以形成二烃基铜锂。
二烃基铜锂也是一个反应适用范围很广的试剂。
RLi+CuX→RCu+LiX
RCu+RLi→R2CuLi
二烃基铜锂可与卤代烃发生偶联反应,反应如下:
卤代烃中的烃基可以是一级、二级烷基,也可以是乙烯烃、芳烃、烯丙基和苯甲基,二烃基铜锂中的烃基可以是一级烷基,也可以是其它烃基如乙烯基、芳基和稀丙基等,因此这个偶联反应选用范围很广。
9、格氏试剂
“格氏试剂”是含卤化镁的有机金属化合物,是一类亲核试剂,在有机合成中应用十分广泛。
格氏试剂可以合成氘代烃:
R MgX D2O
R D
RCH C R ,R KMnO , H O RCOOH RCR ,
O H 2O RCH C R ,R RCH C R ,R O O O Zn RCR ,O RCH
O
KMnO , H O RCOOH RC CR R COOH
,R
COOH CN
CN RCCH 3O NaOH I RCOONa CHI
3RCOONa RH Na 2CO
3RCNH 2O Br 2NaOH RNH 2NaBr Na 2CO 3格氏试剂与醛、酮、酯、环氧烷发生亲核加成反应成相应的醇:
反应若生成二级醇,还可以氧化成酮,再继续与格氏试剂反应生成三级醇。
格氏试剂与二氧化碳作用可制备多一个碳的羧酸:
二、缩短碳链的反应 1. 2.
3.
4.
5.
6.
7.
8.。